HIFU-гемиабляция у пациентов с локализованными формами рака предстательной железы
Автор: Абоян И.А., Галстян А.М., Бадьян К.И., Пакус С.М.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2018 года.
Бесплатный доступ
Цель исследования. оценка онкологических и функциональных результатов HIFU-гемиаблации у пациентов с локализованными формами рака предстательной железы (РПЖ). Материалы и методы. Исследовательская работа основана на сравнительной оценке результатов лечения больных локализованным РПЖ методом HIFU в объеме тотальной аблации и гемиаблации. В период с 2011 по 2017 гг. в условиях хирургического отделения №1 МБУЗ КДЦ «Здоровье» г. Ростова-на-Дону проводилось лечение пациентов локализованным РПЖ высокоинтенсивным сфокусированным ультразвуком с использованием аппарата SONOBLATE 500 V5 TCM. Лечение проведено 250 пациентам. Все пациенты были разделены на две группы в зависимости от объема проведенной аблации. Пациентам 1-й группы (200 человек) выполнено лечение методом HIFU в объеме тотальной аблации предстательной железы (ПЖ), пациентам 2-й группы (50 человек) оперативное вмешательство проведено в объеме гемиаблации. Результаты. По данным наблюдения надир ПСА пациентов в исследуемых группах отмечен к 3 месяцам наблюдения и составил в первой группе-0,8нг\мл, во второй группе - 1,4нг/мл. В группе пациентов после тотальной аблации биохимический рецидив диагностирован у 28 %, в группе гемиаблации - у 20%. Гистологический рецидив заболевания выявлен у 12 % пациентов первой группы, в 10% случаев у пациентов второй группы. По данным исследования, функциональные результаты (индекс МИЭФ-5, IPSS, VAS, QOL) были достаточно высокими в группе пациентов после HIFU-гемиаблации. Заключение. HIFU-гемиаблация у пациентов с локализованными формами РПЖ при соблюдении строгих критериев отбора является высокоэффективным методом лечения, позволяющим добиться высоких функциональных и онкологических результатов.
Локализованный рак предстательной железы, высокоинтенсивный сфокусированный ультразвук, гемиаблация
Короткий адрес: https://sciup.org/142213142
IDR: 142213142
Текст научной статьи HIFU-гемиабляция у пациентов с локализованными формами рака предстательной железы
ак предстательной железы (РПЖ) является наиболее часто выявляемым злокачественным новообразованием (ЗНО) в мире среди мужского населения и находится на третьем месте по распространенности среди всех ЗНО в целом. По данным мировой статистики в 2012 году самые высокие показатели заболеваемости РПЖ отмечены в Австралии и Новой Зеландии, самые низкие – в Южной и Центральной Азии, в Европе наиболее высокая частота РПЖ отмечена в Норвегии, самая низкая – в Албании [1,2].
По данным А.Д. Каприна и соавт. распространенность РПЖ в России за период с 2005 – 2015 гг. увеличилась в 3 раза. Из зарегистрированных в 2016 году 38 042 пациентов с диагнозом РПЖ доля больных с опухолевым процессом I стадии составила 11,4%, II стадии – 43,8%; III стадии – 27,4%; IV стадии – 15,9%. В 1,6% случаев стадия заболевания не была установлена. Летальность на первом году с момента установления диагноза составила 8%. Отношение показателей одногодичной летальности и запущенности онкологического процесса при РПЖ в 24 регионах России в 2015 г. равнялось или превышало 0,7 (среднероссийский показатель в
2014 г. 0,53). Индекс накопления контингента больных с РПЖ в России в 2015 г. составил 5,3% в сравнении с 3,8% в 2005 г. [3].
Благодаря широкому внедрению скрининга РПЖ в мире большая часть обнаруживаемых ЗНО предстательной железы (ПЖ) на сегодняшний день являются локальными [4].
В последние годы возросло количество публикаций, подтверждающих, что новые малоинвазивные методы лечения РПЖ позволяют предотвращать прогрессирование заболевания ПЖ и дают меньшее количество осложнений [5-8].
Следует отметить, что цель малоинвазивных стратегий лечения РПЖ, принимая во внимание биологические свойства злокачественных новообразований данной локализации, состоит в предотвращении прогрессирования заболевания, его лечении и контроле, сводя к минимуму побочные эффекты лечения [7,8].
Ультразвуковая аблация (HIFU) ПЖ является методом выбора лечения пациентов локализованным РПЖ и может быть использована также у пациентов, имеющих противопоказания для выполнения радикальной простатэктомии и у пациентов с доказанным местным рецидивом после проведенного ранее лечения. В настоящее время метод HIFU-гемиаблации может быть использован в качестве фокального лечения РПЖ. При этом онкологические результаты в отдаленном периоде сопоставимы с результатами тотальной аблации, а за счет сохранения ткани ПЖ, не подвергшейся ультразвуковой аблации, отмечены лучшие функциональные результаты [9,10].
Фокальная HIFU-гемиаблация РПЖ предполагает локальное прицельное энергетическое воздействие на опухолевый очаг с целью сохранения части ПЖ, не вовлеченной в опухолевый процесс [9]. Целью фокальной терапии РПЖ является выборочное разрушение очага злокачественного новообразования ПЖ с сохранением интактной ткани. Критерии и методы отбора кандидатов для фокальной терапии РПЖ могут варьировать в зависимости от объема образования, подлежащего разрушению, а также группы риска, к которой относится пациент [10, 11].
Группой ученых, учитывая гетерогенность характера РПЖ, объем поражения ПЖ, а также сопоставление уровня ПСА и объема ПЖ, разработано понятие «index lesion», которое является основополагающим при диагностике унифокального и унилатерального поражения, позво- ляя отобрать больных для выполнения фокального лечения установленного опухолевого очага [12,13].
Метод гемиаблации ПЖ был разработан для воздействия на одну из долей ПЖ при подтвержденном унифокальном, либо унилатеральном поражении с учетом верифицированного «index lesion» [14].
Основным условием эффективности фокальной терапии является обнаружение клинически значимого очага опухоли. Для этого необходимо применение комплекса высокоточных современных методов обнаружения РПЖ как в пораженной, так и в противоположной доле ПЖ, в частности мультипара-метрической магнитно-резонансной томографии (МпМРТ) (PIRADS-V2), новых схем выполнения промежностной биопсии ПЖ, гистосканирования и т.д. [15-17].
Таким образом, необходимо отметить, что в настоящее время ультразвуковая гемиаблация ПЖ имеет все возможности внедрения в клиническую практику, однако требуется проведение исследований, направленных на стандартизацию методики проведения данной процедуры, а также последующей оценки онкологических и функциональных результатов, с целью определения места данного метода в стратегии органосохраняющего лечения рака предстательной железы.
Целью работы явилась оценка онкологических и функциональных результатов HIFU-гемиаблации у пациентов с локализованными формами рака предстательной железы.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В период с 2011 по 2017 годы в условиях хирургического отделения №1 МБУЗ КДЦ "Здоровье" г. Ростова-на-Дону проводилась HIFU-аблация у пациентов с локализованным РПЖ. Лечение проведено 250 пациентам, из них 200 больным выполнено лечение методом HIFU в режиме тотальной аблации (группа тотальной аблации), 50 пациентам лечение проведено в объеме HIFU-гемиаблации (группа гемиаблации).
Отбор пациентов для проведения фокальной гемиаблации проводился на основании Руководства Европейской ассоциации урологов 2013 г., согласно которому оптимальным кандидатом для данного вида лечения является пациент с локализованным РПЖ низкого и среднего риска с изолированным уни-фокальным или унилатеральным поражением. Предпочтение отдается пациентам с ПСА <10 нг/мл, суммой баллов по Глисону <7, клинической стадией РПЖ <Т2b, количеством положительных биоптатов <4 и процентным распространением опухоли <50% в одном био-птате. К потенциальным кандидатам могут быть отнесены пациенты с РПЖ низкого риска, которым показано активное наблюдение.
Диагноз РПЖ у всех пациентов был подтвержден морфологически после выполнения полифокальной биопсии ПЖ. Пациентам из группы гемиаблации выполнялась промежностная 24-точечная биопсия, при необходимости количество биопта-тов ПЖ увеличивалось.
Сравнение медиан в группах проводилось с помощью теста Манна-Уитни и теста Фишера. Различия признавались статистическими значимыми при p <0,05. Расчеты выполнялись в статистической программе R (версия 3,2 R Foundation for Statistical Computing, Vienna, Austria).
Лечение РПЖ с использованием высокоинтенсивного сфокусированного ультразвука проводилось на аппарате для HIFU терапии Sona-blate® 500 V5 ТСМ. Нами применялась разработанная в клинике методика гемиаблации РПЖ [18]. Этап планирования проводился с учетом данных предоперационной биопсии ПЖ, результатов Мп-МРТ и заключался в маркировке плана лечения. Диапазон планируемого лечения находился в границах от латерального контура пораженной доли до транзиторной зоны с отступлением от верхушки не менее 5 мм до базальных отделов. Производился интраоперационный контроль состояния капсулы ПЖ с целью оценки динамических изменений ее структуры при проведении лечения. Время аблации зависело от объема пораженной доли ПЖ. При проведении разметки зоны аблации латеральными границами являлись зона простатического отдела уретры и латеральная поверхность предстательной железы. Результат воздействия в каждой точке оценивался с помощью уровня температурной реакции тканей при этом в ходе лечения для достижения максимальной температуры тканей (между 65°C и 100°C) в зоне целевой аблации проводилась коррекция мощности акустического сигнала. Для визуальной оценки эффективности проведенной аблации тканей выполнялись сравнительные контрольные ультразвуковые сканирования ПЖ интактной и «пролеченной» долей ПЖ. При проведении гемиаблации нами использовались только стандартные циклы лечения. Важным моментом в процессе лечения являлась необходимость контроля за расстоянием от трансдьюсера ультразвукового проба до стенки прямой кишки.
При проведении процедуры гемиаблации использовалось программное обеспечение аппарата Sonablate – TCM (tissue control monitoring), созданное для получения обратной связи и контроля хирургом не только уровня поглощенной энергии, но и определения эффективности аблации. В зависимости от динамики изменяемых параметров производился подбор интервалов аблации. В связи с вариабельностью анатомии ПЖ, риском интраоперационного отека и изменением контура ПЖ в ходе операции нами производился промежуточный контроль положения ПЖ после аблации не более 25% заданного объема ткани.
В связи с отсутствием необходимости выполнения цистостомии, а также быстрой реабилитации пациентов после гемиаблации, выписку больных из стационара производили на 4 день после операции. Основным критерием оценки эффективности операции при послеоперационном мониторинге являлась динамика уровня ПСА. Контроль уровня ПСА осуществлялся каждые 3 месяца после лечения в течение первого года наблюдения, затем один раз в течение 6 месяцев наблюдения.
После проведенного лечения осуществлялся мониторинг функциональных результатов с использованием валидизированных шкал. Использовались следующие шкалы: визуальная аналоговая шкала (VAS), шкала оценки симптомов заболеваний предстательной железы с индексом качества жизни (IIPSS+QL) международный индекс эректильной функции (МИЭФ), а также шкала оценки удовлетворенности пациента перенесенным оперативным вмешательством (EPIC).
Биохимическая прогрессия оценивалась согласно критериям ASTROPhoenix (надир ПСА+2 нг/мл). При этом необходимо отметить, что в случае HIFU- гемиаблации, при наличии интактной ткани в доле предстательной железы, не подвергающейся воздействию, уровень ПСА не всегда может прогностически свидетельствовать о рецидиве заболевания. В связи с указанным выше, рекомендуем выполнение контрольной промежностной биопсии ПЖ пациенту после гемиаблации при динамическом увеличении уровня ПСА.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При проведении сравнительной возрастной характеристики пациентов значительных расхождений между группами не выявлено. Так, в группе тотальной аблации средний возраст пациентов составил 71,7 лет, в группе гемиаблации – 72,2 года, наибольшее количество больных в обеих группах были в возрасте 7074 лет (рис. 1).
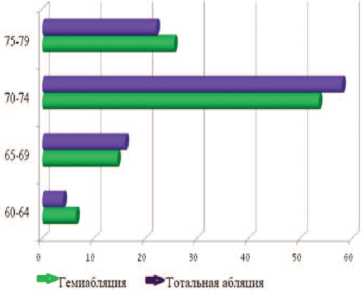
Рис. 1. Распределение пациентов в группах исследования по возрасту в %
При анализе зональной локализации РПЖ нами выявлено, что в обеих группах преобладали пациенты с новообразованиями в периферической зоне органа: 68,5% в группе тотальной аблации и 72% – в группе гемиаблации. Около 20% процентов опухолей у пациентов обеих групп локализовалось в пере-
Таблица 1. Распределение пациентов в группах исследования по стадиям заболевания согласно классификации TNM
|
TNM |
Группа тотальной аблации |
Группа фокальной гемиабла- |
||
|
Абс. число |
% |
Абс. число |
% |
|
|
T2аNх-M0 |
59 |
29,5 |
27 |
54 |
|
T2bNx-M0 |
43 |
21,5 |
23 |
46 |
|
T2cNx-M0 |
98 |
49 |
0 |
0 |
|
Всего |
200 |
100 |
50 |
100 |
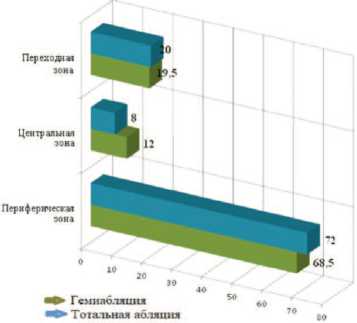
Рис. 2. Распределение пациентов (%) в группах исследования по локализации патологического процесса в различных зонах предстательной железы ходной зоне ПЖ. У меньшего количества пациентов очаг поражения диагностирован в центральной зоне ПЖ: у двух (12%) пациентов –в группе тотальной аблации ПЖ и у 4 (8%) – в группе гемиаблации (p>0,05) (рис. 2). Локализация опухоли не являлась критерием для выбора способа лечения.
Нами также проанализировано распределение пациентов, вошедших в группу тотальной абляции ПЖ, по стадиям заболевания согласно классификации TNM: стадия T2сNХM0 диагностирована у 98 (49%) пациентов, стадия T2аNХM0 – у 59 (29,5%), стадия T2bNХM0 у 43 (21,5%) пациентов. В группе пациентов, перенесших фокальную гемиаблацию ПЖ, у 27 (54%) человек диагностирована T2аNХM0 стадия заболевания, у 23 (46%) пациентов – T2bNХ-M0. (табл. 1)
Основные результаты доопера-ционного обследования пациентов обеих групп представлены в таблице 2. Группы пациентов имели сопоставимые показатели уровня ПСА, индекса Глисона, G опухоли. Имели место отличия объема ПЖ, очаговости поражения, а также результатов гистосканирования.
Проведена сравнительная оценка онкологических и функциональных результатов, полученных в 2-х группах. Медиана наблюдения составила 3 года. Мониторинг пациентов в исследуемых группах проводился с учетом динамики уровня ПСА, а именно nadir (отмеченного минимального его уровня в динамике). Данный показатель в группе с тотальной аблацией в среднем со- ставил 0,8 нг/мл, в группе гемиаблации – 1,48 нг/мл (p<0,001). Гистологический и биохимический рецидив отмечен у 12% и 28% группе тотальной аблации и 10% и 20% – в группе гемиаблации, соответственно.
Повторная биопсия выполнена всем пациентам в группе гемиаблации, а в группе тотальной аблации пациентам с биохимическим рецидивом согласно критериям Феникс, таких пациентов в группе тотальной аблации было 32 (16%).
В группе гемиаблации проведена оценка функциональных результатов лечения с использованием валидизированных шкал, являющихся субъективными шкалами оценки пациентом удовлетворенности проведенным лечением, ком-плаэнтности к лечению и адаптации пациента к дооперационным показателям жизни, выраженная в баллах у больных.
В группе пациентов после гемиаблации основные последствия лечения, связанные с неудовлетворенностью оперативным лечением, болевыми ощущениями, дизуриче-скими явлениями и другими ощущениями дискомфорта стабилизируются к 4 неделе послеоперационного наблюдения (рис. 3).
На рисунке 4 представлены показатели в динамике Международного индекса эректильной функции.
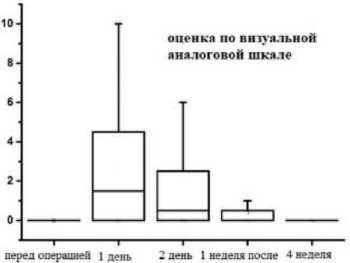
Рис. 3. Показатели шкалы VAS – Международной аналоговой шкалы адаптации пациента после перенесенного оперативного лечения в группе гемиаблации
В группе пациентов с гемиаблацией полученные данные показывают, что к 4-й неделе наблюдения показатели, связанные с эректильной функцией, могут достигать доопера-ционных параметров.
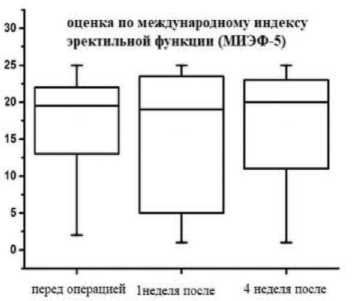
Рис. 4. Оценка в динамике показателей Международного Индекса Эректильной дисфункции (МИЭФ-5), выраженная в баллах в группе гемиаблации
На рисунках 5,6 представлены показатели качества мочеиспуска- ния пациентов в группе гемиаблации в динамике. Согласно оцениваемым шкалам в динамике через 4 недели расстройства мочеиспускания (IPSS), качество жизни (QоL), половой и мочевой функции по шкале (EPIC) у пациентов данной группы стабилизируются на дооперацион-ных показателях.
Таблица 2. Предоперационные показатели пациентов исследуемых групп
|
Показатель |
Группа тотальной аблации |
Группа фокальной гемиаблации |
|
|
Объем предстательной железы (см3) |
28,6 см3 |
42 см3 |
|
|
Очаговости поражения по данным Мп-МРТ |
Унифокальное |
84% |
85% |
|
Мультифокальное |
16% |
15% |
|
|
Индекс Глисона 6 (3+3) |
100% |
100% |
|
|
Grade 1 (ISUP 2014) |
100% |
100% |
|
|
Процент поражения в пределах биоптата |
50-80% |
0-50% |
|
|
Поражение одной доли по данным биопсии |
12% |
100% |
|
|
Перинеальная инвазия (процент пациентов) |
3% |
0% |
|
|
Уровень ПСА 0-10 нг/мл |
100% |
100% |
|
|
Гистосканирование |
2 и менее очагов в пределах каждой доли |
19% |
0% |
|
ПЖ |
2 и более очагов в пределах одной доли |
81% |
100% |
Оценка функциональных результатов также проводилась по Шкале EPIC, которая характеризует состояние половой функции, проявления дисфункции мочевой системы, выраженные в процентах. Оценка основных показателей функционирования мочевой и половой системы пациентов в группе гемиаблации согласно представленной шкале показывает относительно высокие показатели (80-100%) к 1 году наблюдения (рис. 7).
По данным комплексной оценки представленных ранее функциональных результатов лечения пациентов в группе гемиаблации можно говорить о том, что все пациенты
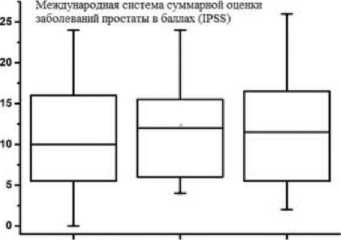
Рис.5. Оценка в динамике показателей, связанных с мочеиспусканием согласно опросника IPSS в группе пациентов с гемиаблацией перед операцией ] неделя после 4 неделя после
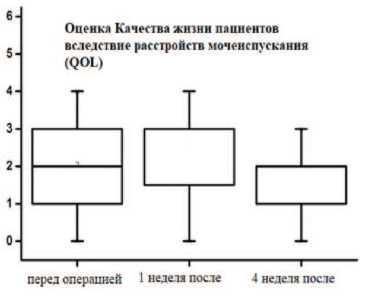
Рис. 6. Оценка в динамике показателей качества жизни пациентов QоL в группе гемиаблации

Рис.7. Оценка показателей половой функции в динамике у пациентов в группе гемиаблации (%)
остались удовлетворены проведенным вмешательством. Пациенты группы гемиаблации испытывали в послеоперационном периоде минимальные болевые ощущения, симптомы дизурии и умеренный болевой синдром. При этом эректильная функция у пациентов указанной группы соответствовала доопера-ционным показателям уже к году после лечения.
Представленные данные оценки функциональных результатов гемиаблации ПЖ и удовлетворенности проведенной операцией, говорят о высоких показателях данного вида вмешательства (рис. 8).
По данным наблюдения надир ПСА пациентов в исследуемых группах отмечен к 3 месяцам наблюде-
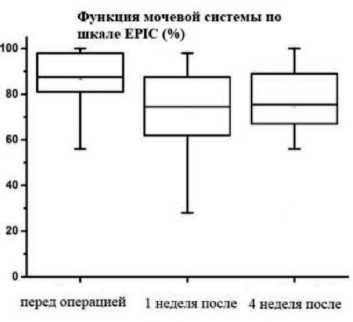
Рис. 8. Оценка в динамике функции мочевой системы у пациентов в группе гемиаблации (%)
ния и составил в первой группе – 0,8 нг/мл, во второй группе – 1,4 нг/мл. В группе пациентов после тотальной аблации биохимический рецидив диагностирован у 28%, в группе гемиаблации – у 20%. Гистологический рецидив заболевания выявлен у 12 % пациентов первой группы, в 10% случаев у пациентов второй группы. Сопоставление он-кологичес-ких показателей в обеих группах, HIFU-гемиаблация продемонстрировало сопоставимые результаты.
Таким образом, HIFU-гемиаблация у пациентов с локализованным РПЖ показывает высокие функциональные результаты, снижая сроки реабилитации после оперативного лечения.
ЗАКЛЮЧЕНИЕ
Резюме:
Цель исследования. оценка онкологических и функциональных результатов HIFU-гемиаблации у пациентов с локализованными формами рака предстательной железы (РПЖ).
Материалы и методы. Исследовательская работа основана на сравнительной оценке результатов лечения больных локализованным РПЖ методом HIFU в объеме тотальной аблации и гемиаблации. В период с 2011 по 2017 гг. в условиях хирургического отделения №1 МБУЗ КДЦ «Здоровье» г. Ростова-на-Дону проводилось лечение пациентов локализованным РПЖ высокоинтенсивным сфокусированным ультразвуком с использованием аппарата SONOBLATE 500 V5 TCM. Лечение проведено
Список литературы HIFU-гемиабляция у пациентов с локализованными формами рака предстательной железы
- Ferlay J, Soerjomataram I, Ervik M, et al. GLOBOCAN 2012 v1.0, Cancer Incidence and Mortality Worldwide: IARC CancerBase No. 11 . Lyon, France: International Agency for Research on Cancer; 2013. URL: http://globocan.iarc.fr(link is external), accessed December 2013.
- Ferlay J, Steliarova-Foucher E, Lortet-Tieulent J, Rosso S, Coebergh JW, Comber H, et al. Cancer incidence and mortality patterns in Europe: Estimates for 40 countries in 2012. Eur J Cancer 2013;49(6):1374-403 DOI: 10.1016/j.ejca.2012.12.027
- Каприн А.Д., Старинский В.В., Петрова Г.В. Состояние онкологической помощи населению России в 2016 году. М., 2017. 236 c.
- Patel MP, Schulman A, Shah KP, Anderson JB, Polascik TJ. Engaging the primary care community to encourage appropriate prostate cancer. Ther Adv Urol 2017;10(1):11-16 DOI: 10.1177/1756287217735799
- Ganzer R., Fritsche H.M., Brandtner A. Fourteen-year oncological and functional outcomes of high-intensity focused ultrasound in localized prostate cancer. BJU Int 2013;112:322-329 DOI: 10.1111/j.1464-410X.2012.11715.x
- Lukka H, Waldron T, Chin J. High-intensity focused ultrasound for prostate cancer: a systematic review. Clin Oncol R Coll Radiol 2011;23:117-127 DOI: 10.1016/j.clon.2010.09.002
- Ahmed HU, Hindley RG, Dickinson L, Freeman A, Kirkham AP, Sahu M, et al. Focal therapy for localised unifocal and multifocal prostate cancer: a prospective development study. Lancet Oncol 2012;13(6):622-32. doi: 10.1016/S1470-2045(12)70121-3
- Durand M, Barret E, Galiano M, Rozet F, Sanchez-Salas R, Ahallal Y, et al. Focal cryoablation: a treatment option for unilateral low-risk prostate cancer. BJU Int 2014 Jan;113(1):56-64 DOI: 10.1111/bju.12370
- Van Velthoven R, Aoun F, Marcelis Q, Albisinni S, Zanaty M, Lemort M, et al. A prospective clinical trial of HIFU hemiablation for clinically localized prostate cancer. Prostate Cancer Prostatic Dis. 2016;19(1):79-83 DOI: 10.1038/pcan.2015.55
- Taneja SS, Mason M. Candidate selection for prostate cancer focal therapy. J Endourol 2010;24(5):835-41 DOI: 10.1089/end.2010.0006
- Лумпов И.С., Амосов А.В., Крупинов Г.Е., Чиненов Д.В., Ганжа Т.М., Воробьев А.А. Гемиаблация локализованного рака простаты высокоинтенсивным фокусированным ультразвуком. Медицинский вестник Башкортостана 2017;12(3):97-99
- Ahmed H.U. The index lesion and the origin of prostate cancer.N Engl J Med 2009;361(17):1704-6 DOI: 10.1056/NEJMcibr0905562
- Huang CC, Deng FM, Kong MX, Ren Q, Melamed J, Zhou M. Re-evaluating the concept of "dominant/index tumor nodule" in multifocal prostate cancer. Virchows Arch 2014;464(5):589-94 DOI: 10.1007/s00428-014-1557-y
- Eggener S, Salomon G, Scardino PT, De la Rosette J, Polascik TJ, Brewster S.Focal therapy for prostate cancer: possibilities and limitations. Eur Urol 2010;58(1):57-64 DOI: 10.1016/j.eururo.2010.03.034
- Turpen R, Rosser CJ. Focal therapy for prostate cancer: revolution or evolution. BMC Urol 2009 Apr 23;9:2 DOI: 10.1186/1471-2490-9-2
- Hale Z, Miyake M, Palacios DA, Rosser CJ. Focal cryosurgical ablation of the prostate: a single institute’s perspective. BMC Urol. 2013;13:2 DOI: 10.1186/1471-2490-13-2
- Karavitakis M, Ahmed HU, Abel PD, Hazell S, Winkler MH. Tumor focality inprostate cancer: implications for focal therapy. Nat Rev Clin Oncol 2011;8(1):48-55 DOI: 10.1038/nrclinonc.2010.190
- Абоян И.А., Галстян А.М., Бадьян К.И., Пакус С.М. Способ лечения локализованного рака предстательной железы. Заявка на изобретение №2017146552/14(079560) от 27.12.2017. URL: http://www1.fips.ru/fips_servl/fips_ servlet?DB=RUPAT&DocNumber=2017146552&TypeFile=html


