Химическая модификация хлоранилинов при определении в воде методом газовой хроматографии
Автор: Груздев И.В., Алферова М.В., Кондратенок Б.М.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Химические науки
Статья в выпуске: 4, 2010 года.
Бесплатный доступ
Для одновременного определения анилина и его хлорзамещенных (2- и 4- хлоранилины, 2,4- и 2,6-дихлоранилины, 2,4,5- и 2,4,6-трихлоранилины) в водных средах применен метод химической модификации, предполагающий получение их бромпроизводных, жидкостную экстракцию и газохроматогра- фическое определение с детектором электронного захвата. Изучены условия реакции бромирования в водной среде в присутствии бромид-ионов, определе- ны экстракционные и газохроматографические характеристики хлоранилинов и их бромпроизводных. Проведена оценка эффективности химической моди- фикации при определении хлоранилинов в воде в виде их бромпроизводных.
Хлоранилины, химическая модификация, бромпроизводные хлоранилинов, газохроматографический анализ
Короткий адрес: https://sciup.org/14992415
IDR: 14992415 | УДК: 543.544.43
Текст научной статьи Химическая модификация хлоранилинов при определении в воде методом газовой хроматографии
Актуальность исследований в области аналитической химии азотсодержащих ароматических соединений обусловлена тем, что в настоящее время в питьевой воде нормируется содержание 79 таких веществ. В особую группу распространенных и высокотоксичных веществ выделяют анилины. Их широкая распространенность связана с хорошей растворимостью в воде и активным промышленным применением. Так, ароматические амины всегда присутствуют в сточных водах предприятий по производству красителей, пестицидов и фармацевтических препаратов [1].
В почвах и природных водах хлоранилины могут образовываться при гидролитической или биохимической деструкции широко применяемых пестицидов и антисептиков [2, 3].
При попадании анилина в водоисточники, используемые для подготовки питьевой воды на стадии ее обеззараживания активным хлором, может происходить образование более токсичных хлор-замещенных анилинов [4].
Хлоранилины оказывают прямое токсическое действие на организм, поэтому их содержание в питьевой воде нормируется [5]. В питьевых водоисточниках концентрация хлоранилинов не должна превышать 50 мкг/дм3, а для водоемов, имеющих рыбохозяйственное значение, предельно-допустимые концентрации (ПДК) еще ниже – 0.1 мкг/дм3 [6].
Хроматографическое определение хлорани-линов непосредственно в воде осложнено их высокой гидрофильностью и полярностью. Поэтому для выделения анилинов из водной матрицы и их концентрирования используют различные варианты жидкостной [7-8] и твердофазной экстракции [9-13].
Для хроматографического анализа полученных экстрактов применяется высокоэффективная жидкостная хроматография с электрохимическим [14], амперометрическим [11] или фотометрическим детектированием [3, 7, 8]. При анализе экстрактов методом капиллярной газовой хроматографии используют пламенно-ионизационный [13], термоион- ный [9], а также масс-спектрометрический детекторы [10, 12]. Чувствительность прямых хроматографических определений анилинов составляет 0.55 мкг/дм3, что недостаточно, учитывая ПДК анилина – 0.1 мкг/дм3.
Наличие в молекулах хлоранилинов реакционно-способной аминогруппы, атомы водорода которой достаточно легко замещаются, позволяет получать их различные производные и достигать более высокой чувствительности определения. Наибольшее применение находят азот- [15], фосфор- [16] и галогенсодержащие [17-21] производные анилинов, получаемые для определения на селективных термоионном, пламенно-фотометрическом и электронозахватном детекторах соответственно.
Кроме того, аминогруппа анилинов характеризуется выраженным положительным мезомер-ным эффектом, поэтому производные хлоранили-нов можно получать не только по функциональной группе, но и по реакции электрофильного замещения атомов водорода бензольного ядра.
В данном исследовании в качестве реагента для получения производных хлоранилинов рассматривается молекулярный бром. Применение этого модифицирующего реагента имеет следующие преимущества:
-
1. Бромирование хлоранилинов в водной фазе протекает легко, поскольку вода проявляет свойства катализатора, поляризуя молекулы брома и генерируя электрофильные частицы [22].
-
2. Введение в молекулы атомов брома значительно повысит гидрофобность хлоранилинов, что обеспечит при жидкостной экстракции более полное их извлечение из воды в органическую фазу [23].
-
3. Применение для детектирования бром-производных хлоранилинов галогенселективного детектора электронного захвата (ДЭЗ) обеспечит максимально возможное по чувствительности их газохроматографическое определение [24].
Экспериментальная часть
Для приготовления стандартных растворов использовали образцы анилина, 2-хлоранилина, 3-хлоранилина, 4-хлоранилина, 2,4-дихлоранилина, 2,6-дихлоранилина, 2,4,5-трихлоранилина, 2,4,6-трихлоранилина (Riedel-de-Haen, PESTANAL®) с содержанием основного вещества ≥ 99 %. Остальные реактивы и растворители квалификации ч.д.а. или х.ч.
Газохроматографический анализ проводили на газовом хроматографе “Кристалл 5000” (Хрома-тэк) с электронозахватным детектором, совмещенным с системой сбора и обработки хроматографической информации “Хроматэк Аналитик 2.5”. Условия газохроматографического определения: кварцевая капиллярная колонка 30 м x 0.25 мм x 0.25 мкм (ZB-5, Phenomenex), газ-носитель – азот (ос.ч.), программирование давления газа-носителя: 80 кПа (7 мин) – 25 кПа/мин – 200 кПа, поддув детектора – 20 см3/мин, деление потока – 1:30. Температура детектора 320 0С, испарителя 320 0С, термостата колонок 180 0С.
Идентификацию бромпроизводных хлорани-линов и определение логарифмических индексов удерживания проводили на хромато-масс-спектро-метре TRACE DSQ (Thermo) в режиме полного ионного тока (энергия электронов 70 эВ). Условия определения: программирование температуры термостата колонок 50 °С – 5 °С/мин – 300 °С, кварцевая капиллярная колонка 30 м x 0.32 мм x 0.25 мкм (TR-1, Thermo). Газ-носитель – гелий, чистота 99.99 %, скорость потока через колонку – 1 см3/мин, деление потока – 1:50, температура испарителя 320 °С, интерфейса 250 °С, детектора 200 °С.
Значения рН и окислительно-восстановительного потенциала водных растворов брома определяли на приборе HI 8519N (Hanna Instruments) с использованием рН-электрода HI 1043 и ОВР-электрода HI 3220.
Обсуждение результатов
Получение бромпроизводных хлоранилинов. Молекулы хлоранилинов содержат заместители, по-разному взаимодействующие с электронным облаком ароматического ядра. Так, NН 2 -группа характеризуется положительным мезомерным эффектом (+М) и отрицательным индукционным (–I), причем определяющее влияние на поведение анилинов в реакциях электрофильного замещения оказывает именно +М-эффект. Взаимодействие аминогруппы с ароматической системой облегчает замещение атомов водорода в положениях 2, 4 и 6 ( орто - и пара -замещение). Атомы хлора, наоборот, характеризуются слабо выраженным +М-эффектом и значительным отрицательным индукционным эффектом (–I), но направляют заместители также в орто- и пара- положения [22].
Таким образом, анилин и 3-хлоранилин при бромировании образуют трибромпроизводные, 2- и 4-хлоранилин – дибромпроизводные, 2,4-, 2,6-дихлоранилин и 2,4,5-трихлоранилин – монобромпро-изводные. Одновременно с указанными хлоранили-нами определяется и 2,4,6-трихлоранилин, но поскольку положения 2, 4, и 6 уже заняты атомами хлора, это соединение бромпроизводного не образует.
Для проведения химической модификации следовых количеств органических соединений традиционно применяют большие молярные избытки модифицирующих агентов, что связано с отсутствием предварительной информации о качественном и количественном составе анализируемых проб и необходимостью поддержания высокой скорости реакции дериватизации [25]. При бромировании хлоранилинов (10 мкг/дм3) концентрация брома в воде составляла 0.0005 моль/дм3, что соответствует ~103-кратному избытку от расчетного стехиометрического соотношения.
При бромировании хлоранилинов в нейтральных и кислых водных растворах удается получить очень слабый аналитический сигнал, составляющий 5-10 % от теоретически возможного (рис. 1). Этот факт можно объяснить тем, что одновременно с бромированием хлоранилинов идет их окисление молекулярным бромом, редокс-потенциал которого достигает значений 0.9-1.1 В, и этот процесс является доминирующим.
Таким образом, для получения бромпроиз-водных хлоранилинов в воде окислительно-восстановительный потенциал брома необходимо сни- жать. Введение бромид-анионов позволяет значительно снизить редокс-потенциала водных растворов брома (рис. 1, зависимость 4), что связано с образованием в растворе ионов Br3- [26]:
Br 2 + Br - о Br 3 .
С увеличением концентрации бромид-анионов в растворе возрастает и устойчивость образующихся бромпроизводных (рис. 1, зависимости 1-3). При концентрации бромид-анионов 0.1-0.15 моль/дм3 редокс-потенциал раствора снижается до ~0.85 В, что позволяет получать бромпроизводные всех анализируемых хлоранилинов с количественным выходом. Важно также, что 2,4,6-трихлор-анилин, который без бромид-анионов полностью окислялся, при их введении сохраняется в водном растворе количественно (рис. 1, зависимость 5).
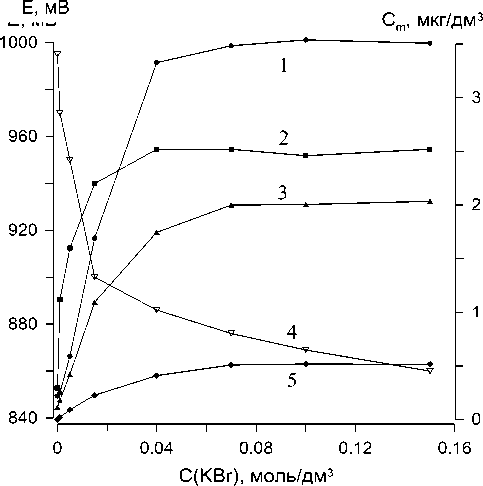
Рис. 1. Зависимость окислительно-восстановительного потенциала водного раствора брома (4) и концентрации бромпроизводных хлоранилинов в водном растворе (1-3) от концентрации бромида калия: 1 – 4,6-дибром-2-хлоранилин, 2 – 6-бром-2,4,5-три-хлоранилин, 3 – 4-бром-2,6-дихлоранилин, 5 – 2,4,6-трихлоранилин; С(Br 2 ) = 0.0005 моль/дм 3 , время бромирования 1 мин; исходная концентрация 2,4,6-трихлоранилина, 2,6-дихлоранилина, 2,4,5-трихлоранилина и 2-хлоранилина в воде – 0.5, 2.0, 2.5 и 3.5 мкг/дм 3 , соответственно.
Следует отметить, что получаемые аналитические формы хлоранилинов устойчивы как в воде, так и в органических растворителях (толуол), и концентрации бромпроизводных при температуре 20-25 ° С не изменяются, по крайней мере, в течение 24 час.
Экстракционное концентрирование бром-производных хлоранилинов. Метод газовой хроматографии, применяемый для разделения и детектирования бромпроизводных хлоранилинов, предполагает обязательную замену водной матрицы на менее активный органический растворитель. Одновременно с этим пытаются достичь селективного извлечения и максимальной степени концентрирования анализируемых соединений, поэтому от эффективности проведения жидкостной экстракции, в целом, зависит чувствительность определения анализируемых соединений [27].
Химическая модификация хлоранилинов в бромпроизводные значительно изменяет их экстракционные характеристики. Как и следовало ожидать, введение атомов брома, оказывающих гидрофобное действие, приводит к значительному увеличению коэффициентов распределения бромпроизводных, которые в системе толуол-вода характеризуются значениями в диапазоне от 3000 до 6000 (табл. 1).
Таблица 1
Коэффициенты распределения (D) и степень извлечения (R) хлоранилинов и их бромпроизводных
-
в экстракционной системе толуол/вода
Соединение
D
R, % (r = 25)
Хлоранилины
2-хлоранилин
53
14.7
3-хлоранилин
21
6.4
4-хлоранилин
8
2.4
2,4-дихлоранилин
423
58.0
2,6-дихлоранилин
1013
76.8
2,4,6-трихлоранилин
3951
95.4
2,4,5-трихлоранилин
2137
87.5
анилин
6
1.9
Бромпроизводные хлоранилинов
2-хлор-4,6-диброманилин
5334
99.5
3-хлор-2,4,6-триброманилин
5877
99.5
4-хлор-2,6-диброманилин
5051
99.4
2,4-дихлор-6-броманилин
3965
99.4
2,6-дихлор-4-броманилин
4081
99.3
2,4,5-трихлор-6-броманилин
5855
99.5
2,4,6-триброманилин
5470
99.4
Высокие значения коэффициентов распределения бромпроизводных хлоранилинов обеспечивают практически количественное извлечение анализируемых веществ из водной фазы в органическую, что значительно повышает чувствительность аналитических измерений. Степень извлечения вещества в органическую фазу (R, %) связана с D выражением [23]:
R = ——100% , D + r где r = Vв/Vo, Vo и Vв – равновесные объемы органической и водной фаз, см3.
Следует отметить, что введение атомов брома в хлоранилины приводит и к выравниванию их коэффициентов распределения, что позволяет с одинаковой эффективностью концентрировать все определяемые соединения. Экстракционное концентрирование самих же хлоранилинов сильно осложнено зависимостью их степени извлечения от числа атомов хлора в молекуле (табл. 1).
Газохроматографические свойства хлор-анилинов и их бромпроизводных. В табл. 2 приведены газохроматографические характеристики хло-ранилинов и их бромпроизводных: логарифмические индексы удерживания (RI) на стандартной неполярной полидиметилсилоксановой неподвижной фазе и относительные мольные отклики ДЭЗ [27]:
RMR an
MRi
MRan ,
где MR i и MR an – мольные отклики детектора электронного захвата на i- е соединение и анилин соответственно.
Введение атомов брома в молекулы хлор-анилинов не только значительно увеличивает (на 24 порядка), но и выравнивает значения RMR an . (табл. 2). Так, отношения RMR an 2,4,6-трибромани-лина, 4-хлор-2,6-диброманилина, 2,6-дихлор-4-бро-манилина и 2,4,5-трихлор-6-броманилина близки и составляют 1 : 0.83 : 1.06 : 1.09. Это принципиально важно для одновременного определения анилина и его моно-, ди- и трихлорзамещенных с применением ДЭЗ, поскольку при сходных концентрациях хлорани-линов их бромпроизводные будут иметь сравнимый по интенсивности аналитический сигнал (рис. 2).
Одновременное определение анилина и его хлорпроизводных в исходной форме с детектором электронного захвата невозможно, поскольку RMR an , например, анилина, 4-хлоранилина, 2,6-дихлоранилина и 2,4,5-трихлоранилина различаются более чем на четыре порядка: 1 : 9 : 545 : 12130.
Определение хлоранилинов в виде их бром-производных не вызывает значительного увеличе-
Таблица 2
Газохроматографические характеристики хлоранилинов и их бромпроизводных
Соединение RMR an RI
Хлоранилины анилин 1 946
|
2-хлоранилин |
12 |
1093 |
|
3-хлоранилин |
15 |
1157 |
|
4-хлоранилин |
9 |
1160 |
|
2,4-дихлоранилин |
416 |
1286 |
|
2,6-дихлоранилин |
545 |
1202 |
|
2,4,5-трихлоранилин |
12130 |
1488 |
|
2,4,6-трихлоранилин |
22730 |
1367 |
|
Бромпроизводные |
хлоранилинов |
|
|
2,4,6-триброманилин |
217870 |
1646 |
|
2-хлор-4,6-диброманилин |
177530 |
1552 |
|
3-хлор-2,4,6-триброманилин |
237120 |
1872 |
|
4-хлор-2,6-диброманилин |
180360 |
1546 |
|
2,4-дихлор-6-броманилин |
151740 |
1455 |
|
2,6-дихлор-4-броманилин |
231860 |
1461 |
|
2,4,5-трихлор-6-броманилин |
238660 |
1671 |
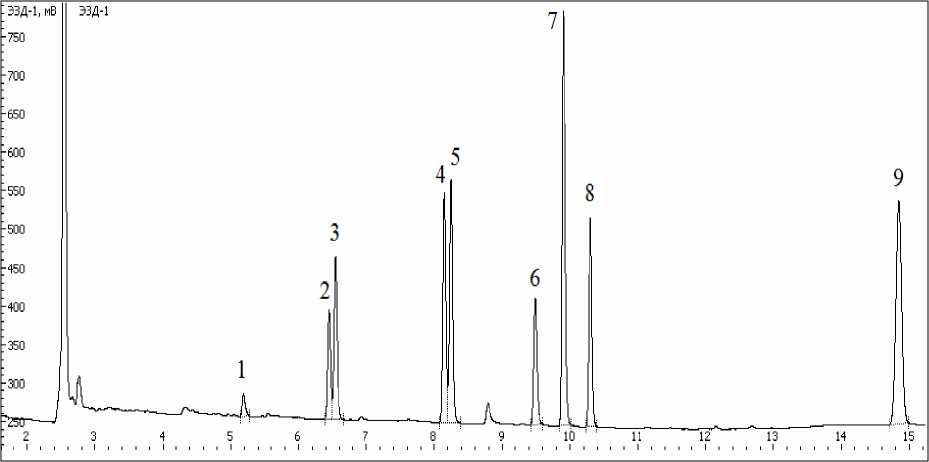
Рис. 2. Хроматограмма экстракта бромпроизводных хлоранилинов; исходная концентрация всех компонентов в водном растворе – 10 мкг/дм 3 : 1 – 2,4,6-трихлоранилин, 2 – 2,4-дихлор-6-броманилин, 3 – 2,6-дихлор-4-броманилин, 4 – 4-хлор-2,6-диброманилин, 5 – 2-хлор-4,6-диброманилин, 6 – внутренний стандарт, 7 – 2,4,6-триброманилин, 8 – 2,4,5-трихлор-6-броманилин, 9 – 3-хлор-2,4,6-триброманилин.
ния времени газохроматографического анализа – индексы удерживания (RI) возрастают только в 1.11.8 раза (табл. 2). Наибольший индекс удерживания имеет самый тяжелый компонент 3-хлор-2,4,6-триброманилин, который и определяет общее время анализа – 15 мин.
Оценка эффективности химической модификации хлоранилинов. Чувствительность определения хлоранилинов в воде возрастает в результате дополнительного введения в их молекулы атомов брома. Введение этих заместителей обеспечивает более эффективное экстракционное концен- трирование и детектирование ДЭЗ. Поэтому в качестве критерия оценки эффективности дериватиза-ции хлоранилинов нами предлагается обобщенный параметр Кхм, учитывающий как увеличение степени извлечения при экстракции, так и относительных мольных откликов ДЭЗ:
RMRan*R* К —-----------, хм RMR an R где RMRan и RMRan* – относительные мольные отклики хлоранилина и его бромпроизводного; R и R* – степень извлечения в экстракт хлоранилина и его бромпроизводного.
Параметр К хм характеризует возрастание чувствительности определения соответствующего хлоранилина при определении его в виде бромпро-изводного (табл. 3). Максимальный эффект получен для анилина – в виде бромпроизводного он определяется в миллион раз чувствительнее по сравнению с немодифицированной формой. Чувствительность определения монохлоранилинов возрастает более чем на пять порядков, дихлоранилинов – на два, 2,4,5-трихлоранилина – на порядок.
Высокая эффективность предлагаемой химической модификации позволяет снизить пределы обнаружения хлоранилинов до 0.005 мкг/дм3, что на порядок ниже минимального значения ПДК, установленных для этих соединений.
Разработанный способ был опробован для определения хлоранилинов в питьевой воде г. Сыктывкара (рис. 3). Обнаружены анилин и его моно-хлорпроизводные в концентрациях, не превышающих ПДК: Ст(2-хлоранилин) = 0.04 ± 0,01 мкг/дм3, Ст(4-хлоранилин) = 0.03 ± 0,01 мкг/дм3 и Ст(анилин) = 0.07 ± 0,03 мкг/дм3.
Таблица 3
Эффективность химической модификации хлоранилинов
|
Соединение |
К хм |
|
2-хлоранилин |
21000 |
|
3- хлоранилин |
35000 |
|
4- хлоранилин |
86000 |
|
2,4-дихлоранилин |
380 |
|
2,6-дихлоранилин |
430 |
|
2,4,5-трихлоранилин |
20 |
|
анилин |
1100000 |
Выводы
Для определения анилина и его хлорзаме-щенных (2- и 4-хлоранилины, 2,4- и 2,6-дихлорани-лины, 2,4,5- и 2,4,6-трихлоранилины) в водных средах применен метод химической модификации, предполагающий получение их бромпроизводных, жидкостную экстракцию и газохроматографическое определение с детектором электронного захвата. Бромирование хлоранилинов проводится в присутствии бромид-ионов, что позволяет получать бром-производные с количественным выходом и исключить их окисление. Изучены экстракционные и газохроматографические характеристики хлоранилинов и их бромпроизводных. Высокая эффективность предлагаемой химической модификации позволяет снизить пределы обнаружения хлоранилинов до 0.005 мкг/дм3, что на порядок ниже минимального значения ПДК, установленных для этих соединений.
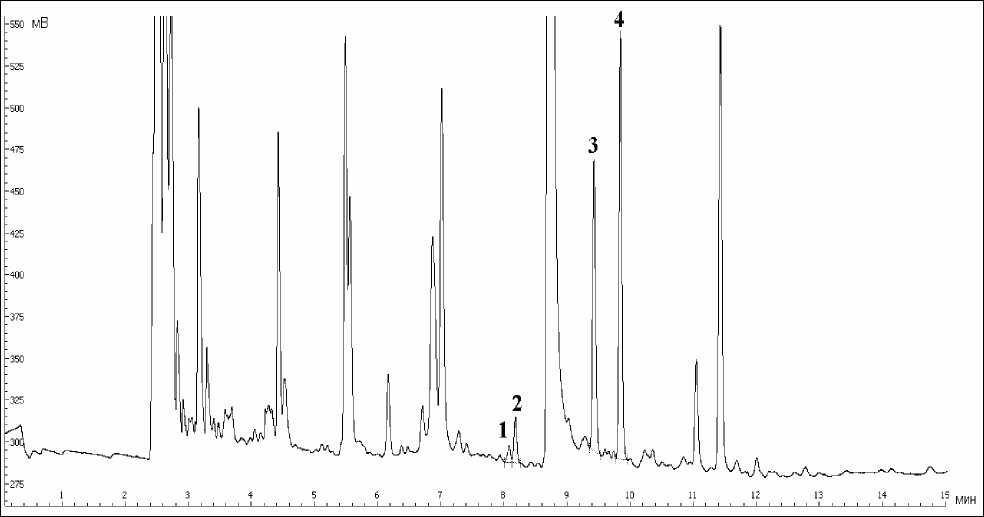
Рис. 3. Хроматограмма экстракта питьевой воды г. Сыктывкара. Пронумерованные пики соответствуют бромпроизводным: 1 – 4-хлоранилина, 2 – 2-хлоранилина, 4 – анилина; 3 – внутренний стандарт (4,6-дибром-1,2-диметоксибензол).
Список литературы Химическая модификация хлоранилинов при определении в воде методом газовой хроматографии
- Козубова Л.И., Морозов С.В. Органические загрязнители питьевой воды. Новосибирск: Изд-во СО РАН, 1993. Вып. 26. 167 с.
- Barcelo D., Hennion M. Trace determination of pesticides and their degradation products in water. Amsterdam: Elsevier, 1997. 434 p.
- Rasmussen H.; Omelczenko N.; Friedman S. Determination of chloroanilines in antibacterial soaps using cation-exchange chromatography with UV-detection//J. Chromatogr. A, 1996. Vol. 719. P. 434-437.
- Славинская Г.В. Влияние хлорирования на качество питьевой воды//Химия и технология воды, 1991. Т. 13. № 11. С. 1013-1022.
- СанПиН 2.1.4.1074-01. Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества. М.: Госкомсанэпиднадзор России, 2001. 111 с.
- Перечень рыбохозяйственных нормативов. М.: Изд-во ВНИРО, 1999. 304 с.
- Zapf A., Heyer R., Stan H. Rapid liquid-liquid extraction method for trace analysis of organic contaminants in drinking water//J. Chromatogr. A, 1995. Vol. 694. P. 453-461.
- Zhu L., Tay C., Lee H. Liquid-liquid-liquid microextraction of aromatic amines from water samples combined with high performance liquid chromatography//J. Chromatogr. A, 2002. Vol. 963. P. 231-237.
- Сониясси Р., Сандра П., Шлетт К. Анализ воды: Органические микропримеси. СПб: Теза, 1999. 248 с.
- Muller L., Fattore E., Benfenati E. Determination of aromatic amines by solid-phase microextraction and gas chromatography massspectrometry in water samples.//J. Chromatogr. A, 1997. Vol. 791. P. 221-230.
- Piangerelli V., Nerini F., Cavalli S. Determination of aromatic amines and phenols in environmental samples by selective SPE elution and HPLC with amperometric detection//Ann. Chim, 1997. Vol. 87. P. 571-582.
- Solid-phase microextraction of aromatic amines with an amide bridged calix[4]arene coated fiber/W.Wang, S.L.Gong, Q.H.Cao, Y.Y.Chen, X.J.Li, Z.R.Zeng//Chromatographia, 2005. Vol. 61. P. 75-80.
- Yan C.T., Jen J.F. Determination of aniline in water by microwave-assisted headspace solidphase microextraction and gas chromatography//Chromatographia, 2004. Vol. 59. P. 517-520.
- Lewin U., Efer J., Engewald W. High-performance liquid chromatographic analysis with electrochemical detection for residues of explosives in water samples around a former ammunition plant//J. Chromatogr. A, 1996. Vol. 730. P. 161-167.
- Skarping G., Renman L., Dalene M. Determination of aromatic amines as perfluorofatty acidamides using nitrogenselective detection//J. Chromatogr, 1983. Vol. 270. P. 207-218.
- Kijima K., Kataoka H., Makita M. Determination of aromatic amines as their N-dimethylthiophosphoryl derivatives by gas chromatography with flame-photometric detection.//J. Chromatogr. A, 1996. Vol. 738. P. 83-90.
- Dasgupta A. Gas chromatographic mass spectrometric identication and quantication of anilines after extraction from serum and derivatization with 2,2,2-trichloroethyl chloroformate, a novel derivative//J. Chromatogr. B, 1998. Vol.716. P. 354-358.
- Longo M., Cavallaro A. Determination of aromatic amines at trace levels by derivatization with heptafluorobutyric anhydride and gas chromatography electron-capture negative-ion chemical ionization mass spectrometry//J. Chromatogr. A, 1996. Vol. 753. P. 91-100.
- Mishra S., Singh V., Jain A., Verma K. K. Simultaneous determination of ammonia, aliphatic amines, aromatic amines and phenols at μgL-1 levels in environmental waters by solidphase extraction of their benzoyl derivatives and gas chromatography-mass spectrometry//Analyst, 2001. Vol. 126. P. 1663-1668.
- Schmidt T., Haas R., Steinbach K. Gas chromatographic determination of aromatic amines in water samples after solid-phase extraction and derivatization with iodine//J. Chromatogr. A, 1998. Vol. 810. P. 161-172.
- Weiss T., Angerer J. Simultaneous determination of various aromatic amines and metabolites of aromatic nitro compounds in urine for low level exposure using gas chromatography-mass spectrometry//J. Chromatogr. B, 2002. Vol. 778. P. 179-192.
- Агрономов А.Е. Избранные главы органической химии. М.: Химия, 1990. 560 с.
- Коренман И.М. Экстракция органических веществ. Горький: Изд-во Горьков. гос. ун-та, 1973. 158 с.
- Poole C. F., Zlatkis A. Sensitive derivatives for determination of organic compounds by electroncapture gas chromatography. Amsterdam: Elsevier, 1981. 151 p.
- Демьянов П.И. Химические методы получения производных при хроматографическом определении фенолов//Журн. аналит. химии, 1992. Т. 47. № 12. С. 1942-1962.
- Ксензенко В.И., Стасиневич Д.С. Химия и технология брома, йода и их соединений. М.: Химия, 1995. 379 с.
- Новак Й. Количественный анализ методом газовой хроматографии. М.: Мир, 1978. 179 с.


