Химические аспекты карбонатного выщелачивания скандия из красных шламов
Автор: Степанов С.И., Аунг М.М., Аунг Х. йЕ., Бояринцев А.В.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Химическая технология
Статья в выпуске: 4 (78), 2018 года.
Бесплатный доступ
Красные шламы (КШ) - отходы гидрохимической переработки бокситов по способу Байера, содержат целый ряд редких элементов, таких как галлий, титан, цирконий, редкоземельные элементы и скандий, содержание которого в КШ достигает 130 г/т. В решении проблемы извлечения скандия из КШ выделяют два направления: непосредственное извлечение скандия из КШ, как наиболее ценного и дорогостоящего его компонента, и попутное извлечение при комплексной переработке этого техногенного отхода. Предложенный в Институте химии твердого тела УрО РАН способ карбонатного выщелачивания скандия из КШ в процессе карбонизации щелочного раствора, образующегося при обработке КШ водой, позволяет извлекать не более 20% скандия, что недостаточно для разработки эффективной технологической схемы переработки этого сырья. В настоящей работе рассмотрены особенности химии карбонатного выщелачивания скандия из КШ в гетерогенных системах твердое - жидкость -углекислый газ для разработки условий, способствующих повышению извлечения скандия в растворы выщелачивания...
Красные шламы, скандий, извлечение, карбонатные растворы, гидролитическая полимеризация
Короткий адрес: https://sciup.org/140244288
IDR: 140244288 | DOI: 10.20914/2310-1202-2018-4-349-355
Текст научной статьи Химические аспекты карбонатного выщелачивания скандия из красных шламов
Известно [1], что красные шламы (КШ) – отходы гидрохимической переработки бокситов по способу Байера, содержат целый ряд редких элементов, таких, как галлий, титан, цирконий, редкоземельные элементы (РЗЭ) и в том числе скандий, содержание которого в КШ достигает 130 г/т. Такое высокое содержание скандия позволяет рассматривать КШ как техногенное
сырье для производства оксида скандия требуемой степени чистоты. С учетом значительного объема накопленных к настоящему времени КШ, порядка 1 млрд 200 млн тонн [2], и ежегодного прироста в ~ 45 млн т запасы скандия в этом сырье оцениваются в значительную величину.
Проблеме извлечения скандия из КШ посвящено большое число научных работ [3–7], патентов [8–9], обсуждений на конференциях
различного уровня [10–11]. Среди значительного потока литературы по этому вопросу необходимо выделить два направления, одно из которых ограничивается непосредственным извлечением скандия из КШ как наиболее ценного и дорогостоящего его компонента. Второе направление рассматривает попутное извлечение скандия из КШ при комплексной переработке этого техногенного отхода. С экономической точки зрения извлечение скандия из КШ может быть очень привлекательным, т. к. конечный продукт – оксид скандия высокой степени чистоты, является ликвидным и дорогостоящим товаром, способным окупить значительные затраты на его производство из КШ и принести прибыль. С экологической точки зрения извлечение (как правило, гидрометаллургическими способами) 100–130 г скандия из 1 т КШ с последующим размещением полученного «нового» отхода в виде КШ, не содержащих скандия, но увеличившихся в объеме до 1,1–1,2 т (за счет перевода компонентов шлама в другие анионные формы и обводнения при переработке) нецелесообразно, т. к. потребует расширения площадей шламовых прудов под эти «новые» КШ. Поэтому комплексная переработка КШ с вовлечением всего количества этих отходов для получения разнообразных ликвидных продуктов, в том числе и оксида скандия, является насущной необходимостью при разработке методов обращения с КШ.
При комплексной переработке КШ большое значение имеет использование для извлечения ценных компонентов тех составляющих шламов, которые остаются в них от основного производства. Речь, прежде всего, идет об остаточной щелочи (NаОН, КОН), содержание которой достигает 5% от исходной массы КШ и которая может быть вовлечена в процессы его переработки. Поэтому предложенный в ИХТТ УрО РАН [8] способ карбонатного выщелачивания скандия из КШ в процессе карбонизации щелочного раствора, образующегося при обработке КШ водой, является примером эффективного ресурсосбережения при переработке техногенных отходов. Дополнительным преимуществом такого карбонатного выщелачивания скандия является использование для карбонизации отходящих топочных газов, представленных преимущественно углекислым газом.
Попутно при карбонатном выщелачивании скандия из КШ удается извлечь до 30% титана и до 50% циркония, которые могут быть выделены в отдельные концентраты и переработаны с получением своих ликвидных продуктов.
Таким образом, карбонатное выщелачивание скандия из КШ при карбонизации пульпы отходящими топочными газами представляет собой часть комплексной переработки этого отхода с получением различных товарных продуктов.
Химия карбонатного выщелачивания скандия из КШ обусловлена образованием водорастворимых карбонатных анионных комплексов общей формулы [Sc(СО 3 ) n ](2n-3)–, среди которых в литературе описаны комплексы состава: [Sc(СО 3 ) 2 ]–, [Sc(СО 3 ) 3 ]3– и [Sc(СО 3 ) 4 ]5– [12]. Растворимость комплексных карбонатов скандия с щелочными металлами, натрием, калием, литием в карбонатных растворах достаточно высока [12], чтобы степень извлечения скандия из КШ в этом процессе достигала более 95%.
Однако приведенные значения степени извлечения скандия из КШ в процессе, предложенном в ИХТТ УрО РАН, невысоки и не превышают 20%, что, конечно, недостаточно для разработки эффективной технологической схемы переработки этого сырья. Очевидно, что причины такого поведения скандия в карбонатных растворах при сатурации пульпы углекислым газом обусловлены особенностями протекания химических реакций в многокомпонентных карбонатных гетерогенных системах жидкость – твердое – углекислый газ.
Цель работы – изучение химических особенностей процесса карбонатного выщелачивания скандия из КШ в гетерогенных системах с углекислым газом для разработки условий, способствующих повышению извлечения скандия в растворы выщелачивания.
Материалы и методы
В качестве исходных КШ использовали шламы «Богословского алюминиевого завода» филиала ОАО «Сибирско-Уральской алюминиевой компании» («БАЗ» филиал ОАО «СУАЛ») следующего состава, в % масс.: Аl 2 О 3 – 14,21, Fе 2 О 3 – 41,5, СаО – 12,14, МgО – 1,6, SiО 2 – 9,75, Nа 2 O – 4,52, К 2 O – 0,19, ТiО 2 – 3,78, Р 2 О 5 – 0,76, S – 1,45 СО 2 – 11,1, Sc – 0,012, ∑Ln – 0,122. Фракционный состав КШ следующий, в % масс.: ˃180 мкм – 36,6; 125–180 мкм – 29,2; 90–125 мкм – 17,0; 63–90 мкм – 14,5; 45–63 мкм – 2,6; ˂45 мкм – 0,2. В работе использовали Nа 2 СО 3 и NаОН и баллонный углекислый газ квалификации «ч». Выщелачивание скандия из КШ водными растворами Nа 2 СО 3 проводили следующим образом. Навеску КШ помещали в термостатируемую ячейку, температура которой была задана условиями эксперимента.
Затем в ячейку приливали определенное количество раствора Nа 2 СО 3 , в зависимости от условий эксперимента помещали в ультразвуковой излучатель и барботер СО 2 . Для определения содержания скандия в растворе при заданном времени выщелачивания проводили отбор пульпы, ее фильтрование и анализировали методом эмиссионной спектроскопии с индукционно связанной плазмой на приборе JobniYvon Emission-JY 38 (Франция) в аналитической лаборатории «Институт «ГИНЦВЕТМЕТ». Для интенсификации процессов выщелачивания использовали ультразвуковой проточный аппарат, Булава-П модель УЗАП-3/22-ОП производства ОАО «Центр ультразвуковых технологии» г. Бийск.
Результаты и обсуждение
Данные РФА указывают на нахождение скандия в КШ в форме оксида Sс 2 О 3 . Для его перевода в водорастворимые анионные карбонатные комплексы необходимо сначала провести реакцию образования карбоната скандия, которая может быть записана следующим образом:
Sс 2 О 3 + 3Н 2 СО 3 = Sс 2 (СО 3 ) 3 + 3Н 2 O, (1) например, с Nа 2 СО 3 :
Sс 2 (СО 3 ) 3 + (n-3) Nа 2 СО 3 =
= 2Nа (2n-3) [Sc(СО 3 ) n ]. (2)
Результатом протекания этих двух реакций и будет образование растворимых в карбонатных растворах комплексов скандия. Прямая реакция между оксидом скандия и карбонатом натрия в карбонатно-щелочных растворах не протекает. Для проведения реакции (1) необходим небольшой избыток угольной кислоты в системе, который может быть обеспечен при сатурации пульпы СО 2 или при растворении СО 2 в карбонатно-щелочном растворе под давлением. Очевидно, что в обоих случаях введения СО 2 в систему будет протекать реакция нейтрализации избытка щелочи с образованием карбоната и далее бикарбоната щелочного металла. При проведении процесса с КШ, в которых избыток щелочи обусловлен в основном гидроксидом натрия, сатурация приводит к образованию карбоната и бикарбоната натрия. В такой системе образование карбоната скандия может быть записано следующим образом:
Sс 2 О 3 +6NаНСО 3 =
= Sс 2 (СО 3 ) 3 +3Nа 2 СО 3 +3Н 2 O. (3)
Рассмотренные реакции указывают на отсутствие термодинамических запретов на выщелачивание скандия в карбонатные растворы при сатурации пульпы.
В таблице 1 представлены результаты по извлечению скандия из КШ в растворы карбоната натрия различной концентрации без корректировки растворов углекислым газом.
С ростом концентрации Nа 2 СО 3 степень извлечения скандия в выщелачивающий раствор проходит через максимум при концентрации Nа 2 СО 3 ~ 1 моль/л. Наличие максимума может быть объяснено повышением растворимости карбонатных комплексов скандия с ростом карбонатности раствора и вторичным осадкообразованием скандия в виде его оксикарбонатов с ростом рН исходного карбонатного раствора, обусловленного повышением концентрации карбоната натрия. В то же время степень извлечения скандия в растворы карбоната натрия не превышает 6–6,5%, что обусловлено, по-видимому, низким содержанием НСО 3 – групп, необходимых для протекания реакций (1) или (3).
При введении углекислого газа в процесс выщелачивания путем его барботажа через пульпу степень извлечения скандия в карбонатно-бикарбонатный раствор закономерно возрастает до 17,5% за 10 мин, что почти в 3 раза выше, чем при выщелачивании без барботажа СО 2 (таблица 2).
В отобранных для анализа пробах при стоянии наблюдали образование вторичного осадка, что отражено в примечании в таблице 2. Как показали дальнейшие исследования, содержание скандия в образующихся осадках не превышало 0,2%, а сам осадок по преимуществу содержал соединения алюминия.
Таблица 1. Зависимость Р Sс от концентрации Nа 2 СО 3 при карбонатном выщелачивании КШ: время – 4 ч, Т : Ж = 1:5, Т = 50±5 °С; исходная концентрация Sc в КШ – 100 г/т
Table 1.
The dependence of the Р Sс vs Nа 2 СО 3 concentration under carbonate leaching from the R.M.: time – 4 hour, S : L = 1:5, T = 50±5 °C, initial Sc concentration – 100 g/t
|
№ п/п |
m(КШ), г, g |
V(Nа 2 СО 3 ), мл, ml |
С(Nа 2 СО 3 ), М |
С Sс , мг/л mg/l |
Р Sс , % |
|
1 |
20,05 |
100 |
0,25 |
0,14 |
0,77 |
|
2 |
20,07 |
100 |
0,40 |
0,34 |
2,04 |
|
3 |
20,02 |
100 |
0,75 |
0,62 |
3,41 |
|
4 |
20,03 |
100 |
1,10 |
0,97 |
6,06 |
|
5 |
20,0 |
100 |
1,50 |
0,96 |
6,05 |
|
6 |
100,0 |
500 |
2,10 |
0,081 |
0,04 |
Таблица 2.
Зависимость Р Sс от времени при выщелачивании из КШ водным 1,0 М раствором Nа 2 СО 3 и барботаже СО 2 1,5 л/мин: Т : Ж = 1:5, Т = 70±5 °С, С Sс исх. – 100 г/т
Table 2.
The dependence of the Р Аl vs time under leaching from the R.M. by 1,0 M aqueous solution of Nа 2 СО 3 , and СО 2 bubbling 1,5 l/min: S : L = 1 : 5, T = 70±5 °C, С Sс init. – 100 g/t
|
Время, мин | Time, min |
С Sс , мг/л | С Sс , mg/l |
Р Sс , % |
Примечание | Comment |
|
1 |
0,76 |
3,8 |
Нет осадка | No sediment |
|
2 |
0,76 |
3,8 |
Мало осадка | Small sediment |
|
3 |
0,76 |
3,8 |
Увеличение объема осадка | Rise of sediment’s volume |
|
4 |
1,10 |
5,5 |
|
|
5 |
1,40 |
7,0 |
Снижение объема осадка | Reduction of sediment’s volume |
|
7 |
1,90 |
9,5 |
|
|
10 |
3,50 |
17,5 |
Мало осадка | Small sediment |
Условия малого времени выщелачивания скандия из КШ при одновременной сатурации пульпы СО2 были исследованы более подробно. Выщелачивание проводили в течение более длительного периода времени, а одну и ту же порцию шлама после промежуточной отмывки на фильтре от маточного раствора двумя порциями дистиллированной воды при Т : Ж = 1:1 и комнатной температуре выщелачивали дважды. В таблице 3 представлены полученные результаты, которые, с одной стороны, подтверждают данные таблицы 2 по повышению извлечения скандия в карбонатные растворы при сатурации пульпы, а с другой стороны, показывают наличие максимумов на кинетических кривых в области 20–35 мин проведения процесса на каждой ступени.
Таблица 3.
Зависимость Р Sс от времени при выщелачивании из КШ водным 1,2 M раствором Nа 2 СО 3 и барботаже СО 2 . Условия выщелачивания: Т : Ж = 1:5, расход СО 2 -1,5 л/мин, Т = 70±5 °С, исходная концентрация скандия в КШ – 100 г/т
Table 3.
The dependence of the Р Sс vs the time under leaching from R.M. by aqueous 1,2 M solution of Nа 2 СО 3 and СО 2 bubbling. Conditions of leaching: S : L = 1 : 5, СО 2 flow rate – 1,5 l/min, T = 70±5 °С, initial Sc concentration in R.M. – 100 g/t
|
№ п/п. |
1-я ступень |
2-я ступень |
||||
|
Время, мин Time, min |
С Sс , мг/л С Sс , mg/l |
Р Sс , % |
Время, мин Time, min |
С Sс , мг/л С Sс , mg/l |
Р Sс , % |
|
|
1 |
3 |
0,56 |
2,8 |
3 |
1,20 |
6,0 |
|
2 |
5 |
0,74 |
3,7 |
5 |
0,72 |
3,6 |
|
3 |
15 |
2,40 |
12,0 |
10 |
0,92 |
4,6 |
|
4 |
20 |
2,70 |
13,5 |
15 |
1,40 |
7,0 |
|
5 |
25 |
3,30 |
16,5 |
20 |
1,30 |
6,5 |
|
6 |
30 |
3,40 |
17,0 |
25 |
1,20 |
6,0 |
|
7 |
35 |
3,40 |
17,0 |
30 |
0,90 |
4,5 |
|
8 |
50 |
2,00 |
10,0 |
45 |
1,10 |
5,5 |
|
9 |
65 |
0,75 |
3,75 |
60 |
1,40 |
7,0 |
Снижение концентрации скандия в растворе в процессе выщелачивания при сатурации пульпы обусловлено, по-видимому, вторичным осадкообразованием, которое уже не может быть причиной щелочного гидролиза, как это наблюдается в случае с концентрированными растворами карбоната натрия.
Для объяснения наблюдаемого эффекта было высказано предположение о протекании процесса гидролитической полимеризации соединений скандия в карбонатных растворах в присутствии протона угольной кислоты. Учитывая низкую концентрацию скандия в растворах при выщелачивании из КШ в описанных выше условиях, трудно предполагать гомополимеризацию только скандия.
Однако данные таблицы 2, указывающие на переход в растворы наряду со скандием алюминия в значительно больших количествах, позволяют предположить образование смешанных гидролитических полимеров между алюминием и скандием в процессе более длительного выщелачивания при сатурации пульпы КШ.
Реакцию гидролитической полимеризации скандия в карбонатных растворах в присутствии протона угольной кислоты можно представить следующей упрощенной схемой:
[Sc(СО 3 ) 2 ]– + H+ → [(СО 3 )SсСО 3 H] (4)
[(СО з^ сСО з H] + [HO 3 CSc(CO 3 )] ^
- [ (CO 3 )ScCO 2 - O - О 2 CSc(CO 3 )] + H 2 O (5) [(СО 3 )SсСО 2 – O – О 2 СSс(СО 3 )] →
^ [(CO 3 )Sc - O - Sc(CO 3 )] + 2СО 2 t (6) а реакцию образования смешанных полимеров скандия и алюминия следующим образом:
[Sc(СО3)2]– + H+ → [(СО3)SсСО3H](7)
[Al(СО3)2]– + H+ → [(СО3)АlСО3H](8)
[(СО з^ сСО з Н] + [НО з СА1(СО з )] ^
- [(CO3)ScCO2 - O - О2САЦСО3)] + H2O(9)
[(СО 3 )SсСО 2 – O – О 2 САl(СО 3 )] →
^ [(CO 3 )Sc - O - А(СО з )] + 2СО 2 t (10) Необходимо отметить, что это одна из возможных схем полимеризационных превращений, в которой в ходе поликонденсации выделяются как молекулы воды, так и молекулы углекислого газа. В пользу такой схемы свидетельствует описанное в литературе [13, с. 80] соединение основного карбоната скандия состава Sс 2 O(СО 3 ) 2 . Однако эта схема достаточно наглядно демонстрирует, как может осуществляться в карбонатных растворах переход от растворимого карбонатного комплекса к нерастворимому полиядерному соединению в присутствии СО 2 или, если быть точнее, в присутствии протона угольной кислоты Н 2 СО 3 .
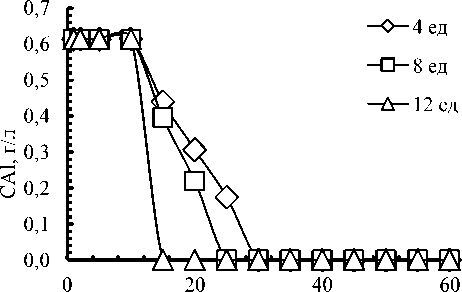
Для подтверждения высказанных предположений были проведены исследования по устойчивости щелочного раствора алюминия, полученного при выщелачивании КШ 4,0 М водным раствором NаОН, содержащим 0,61 г/л Al, при барботаже через него СО 2 (рисунок 1).
Время, мин time, min
Рисунок 1. Кинетика осадкообразования Al при барботаже СО 2 через раствор выщелачивания КШ 4,0 М водным раствором NаОН, содержащим 0,61 г/л Al, при расходе СО 2 , л/мин: 0,5 – 4 ед.; 1,0 – 8 ед.; 1,5 – 12 ед.
Figure 1. Kinetic of Aluminum precipitation under СО 2 bubbling through 4,0 M NаОН aqueous solution, containing 0,61 g/l Al. Flow rate СО 2 , l/min: 0,5 – 4 unit; 1,0 – 8 unit; 1,5 – 12 unit
При расходе СО 2 1,5 л/мин уже через 10 мин алюминий в равновесном водном растворе не обнаружен. На всех представленных кинетических зависимостях выделяется начальный участок, на котором в течение 10 мин не наблюдается никакого изменения концентрации Al в растворе. Этот период связан с нейтрализацией избытка щелочи угольной кислотой. В таблице 4 представлены данные по изменению концентрации гидроксида, карбоната и бикарбоната натрия во времени для кривой 12 ед. на рисунке 1.
Таблица 4.
Изменение концентрации NаОН, Nа 2 СО 3 и NаНСО 3 при барботаже 1,5 л/мин СО 2 через алюминатный раствор выщелачивания КШ
Table 4.
The variation of NаОН, Nа 2 СО 3 and NаНСО 3 concentrations under 1,5 l/min СО 2 bubbling through aluminate solution of R.M. leaching
|
Время, мин Time, min |
Концентрация, М Concentration, M |
||
|
NаОН |
Nа 2 СО 3 |
NаНСО 3 |
|
|
0 |
2,6 |
0,5 |
0,0 |
|
1 |
1,4 |
1,1 |
0,0 |
|
2 |
1,2 |
1,2 |
0,0 |
|
5 |
0,8 |
1,2 |
0,4 |
|
10 |
0,0 |
1,4 |
0,8 |
|
15 |
0,0 |
1,2 |
1,2 |
|
20 |
0,0 |
1,0 |
1,6 |
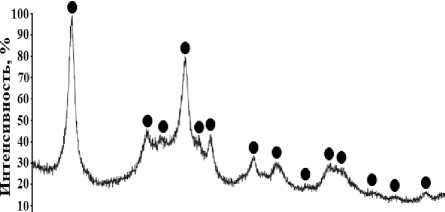
После нейтрализации щелочи и появления избытка протонов угольной кислоты начинает протекать процесс гидролитической полимеризации с выделением осадка алюминия. Для определения химической формы нахождения алюминия в осадках был получен спектр РФА, представленный на рисунке 2.
ol----.----.—,----.—,----.—.----.—,----,----.----,----,----,----,----,----,----,----^
10 13 16 19 21 15 28 31 34 37 40 43 46 49 52 5 5 58 61 64 67
Угол 29. гр.
Рисунок 2. Спектр РФА осадка, полученного при осаждении Al из 4,0 M водного раствора NаОН при барботаже 1,5 л/мин СО 2 : • – Давсонит NаАlСО 3 (OH) 2 , карта JCPDS № 45-1359
Figure 2. RFA-spectra of sediment, obtaining during Al precipitation from 4,0 M aqueous solution of NаОН under 1,5 l/min СО 2 bubbling: • – Dawsonite NаАlСО 3 (OH) 2 , card JCPDS № 45-1359
Значительное уширение всех сигналов спектра свидетельствует о высокой доле аморфных частиц осадка. Результаты РФА указывают на наличие только одной рентгеноаморфной фазы в составе осадка, соответствующей согласно данным кристаллографической базы JCPDS № 45-1359 гидроалюмокарбонату натрия – NаАlСО 3 (OH) 2 . В то же время фазы, относящиеся к Al(OH) 3 и Аl 2 O(СО 3 ) 2 , не обнаружены. В литературе [14] приводится несколько иной механизм осаждения гидроалюмокарбоната натрия, заключающийся во взаимодействии гидроксида алюминия с бикарбонатом натрия с образованием NаАlСО 3 (OH) 2 при рН водной фазы ниже 10 и увеличении в ней концентрации ионов НСО 3 -. При гидролитическом разложении NаАlСО 3 (OH) 2 получается псевдобемит (АlООН • Н 2 O) и аморфный Al(OH) 3 .
Однако в отсутствие второго компонента соединений скандия для полимеризационных превращений, описанных уравнениями (7)–(10) не наблюдается образования смешанного полимера алюминия и скандия. В то же время наличие
Список литературы Химические аспекты карбонатного выщелачивания скандия из красных шламов
- Сабирзянов Н.А., Яценко С.П. Гидрохимические способы комплексной переработки боксита. Екатеринбург: УрО РАН, 2006. 385 с.
- Трушко В.Л., Утков В.А., Бажин В.Ю. Актуальность и возможности полной переработки красных шламов глиноземного производства//Записки Горного института. 2017. Т. 227. С. 547-553.
- Пягай И.Н., Кожевников В.Л., Пасечник Л.А., Скачков В.М. Переработка отвального шлама глиноземного производства с извлечением скандиевого концентрата//Записки горного института. 2016. Т. 218. С. 225-232.
- Deelwal K. Evaluation of characteristic properties of red mud for possible use as a geotechnical material in civil construction//International Journal of Advances in Engineering & Technology. 2014. V. 7. № 3. P. 1053-1059.
- Raghavan P.K.N. Recovery of metal values from red mud//Light metals. 2011. P. 23-26.
- Кожевников В.Л., Водопьянов А.Г., Паньков В.А., Кузьмин Б.П. Совместная комплексная переработка бокситов и красных шламов//Цветные металлы. 2013. № 12. С. 36-38.
- Иванов А.И., Кожевников Г.Н., Ситдиков Ф.Г., Иванова Л.П. Комплексная переработка бокситов. Екатеринбург: УрО РАН, 2003. 180 с.
- Пат. № 2483131, RU, C22B 59/00, 3/04, 3/20, C01F 17/00. Способ получения оксида скандия из красного шлама/Пягай И.Н., Яценко С.П., Пасечник Л.А. и др. № 2011153456/02; Заявл. 2011153456; Опубл. 27.05.2013, Бюлл. № 15.
- Пат. № 2245371, RU, C21B 3/04, 13/00, 34/12, 59/00. Способ переработки красного шлама глиноземного производства/Е.А. Коршунов, С.П. Буркин, Ю.Н. Логинов, и др. № 2003103262/02; Заявл. 2003103262; Опубл. 12.04.2005, Бюлл. № 32.
- Анашкин В.С., Фомин Э.С., Яценко С.П. Разработка технологических схем безотходной и комплексной переработки низкокачественных бокситов и красных шламов//Металлургия легких металлов, проблемы и перспективы: тезисы докладов II Международной Научно-практической Конференции, Москва, 22-23 ноября 2006 г. М., 2006. С. 41-45.
- Степанов С.И., Маунг Маунг Аунг, Бояринцев А.В., Гозиян А.В. и др. О комплексной переработке красных шламов//Актуальные вопросы получения и применения РЗМ и РМ2017: сборник материалов международной научно-практической конференции 21-22 июня 2017 г. М.: ОАО «Институт «ГИНЦВЕТМЕТ», 2017. С. 278-281.
- Комиссарова Л.Н., Шацкий В.М., Пушкина Г.Я. и др. Соединения редкоземельных элементов. Карбонаты, оксалаты, нитраты, титанаты. М.: Наука, 1984. 235 с.
- Комиссарова Л.Н. Неорганическая и анали-тическая химия скандия. М.: Эдиториал УРСС. 2001. 512 с.
- Томилов Н.П., Бергер А.С., Бойкова А.И. Об условиях образования гидроалюмокарбонатов при взаимодействии алюминия с растворами карбонатов щелочных металлов//Журнал неорганической химии. 1969. Т. 14. № 3. С. 674-680.


