Химиолучевая терапия регионарного рецидива рака желудка
Автор: Скоропад В.Ю., Титова Л.Н., Силантьева Н.К., Агабабян Т.А., Бердов Б.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Опыт работы онкологических учреждений
Статья в выпуске: 6 (54), 2012 года.
Бесплатный доступ
Представлены результаты клинической апробации оригинальной методики химиолучевой терапии нерезекетабельных регионарных рецидивов рака желудка, которая разработана в Медицинском радиологическом научном центре, лечение получили 5 больных. Показано, что лечение переносится удовлетворительно, преобладают лучевые реакции I–II степени. Лечение сопровождается выраженным паллиативным эффектом (уменьшение и купирование болевого синдрома, восстановление прохождения пищи по желудочнокишечному тракту) и способствует увеличению продолжительности жизни больных. Компьютерно-томографическое исследование имеет определяющее значение в установлении показаний к данному методу лечения, а также оценке его эффективности.
Регионарный рецидив рака желудка, химиолучевая терапия, компьютерная томография
Короткий адрес: https://sciup.org/14056286
IDR: 14056286 | УДК: 616.33-006.6-036.65:615.28:615.849.1
Текст научной статьи Химиолучевая терапия регионарного рецидива рака желудка
Перед началом лучевой терапии проводили топографо-анатомическую подготовку с применением современных методов диагностики. На симуляторе определяли положение и размеры полей облучения с контрастированием зоны мишени; изоцентры помечались маркерами. Очаговую дозу рассчитывали по 90–95 % изодозе как в статическом, так и в ротационном режиме облучения. Лучевую терапию в статическом режиме проводили изоцентрически, тремя противолежащими полями с клиновидными фильтрами для выравнивания
Таблица 1
|
№ |
Пол, возраст |
Стадия РЖ |
Методика лечения, тип операции |
Время до рецидива |
Методика ХЛТ |
Лучевые реакции |
Клинические эффекты |
Срок наблюдения, статус |
|
1 |
Ж., 62 |
Ia ст. (T 1b N 0 M 0 G 2 ) |
Предоперационная лучевая терапия 25 Гр, ДСРЖ D2 |
1,8 года |
45 Гр (1 + 1,5 Гр за фр.), кселода, элоксатин → 4-нед перерыв → 28 Гр/ 2Гр за фр. |
Тошнота II ст. |
Без жалоб |
32 мес, жива, состояние удовлетворительное |
|
2 |
М., 55 |
Ib ст. (T2N0M0G4) |
ДСРЖ D1 |
8 лет |
45 Гр (1 + 1,5 Гр за фр.), кселода, элоксатин → 4-нед перерыв → 28 Гр/ 2Гр за фр. |
Лейкопения II ст. |
Значительное уменьшение болевого синдрома |
24 мес, умер от прогрессирования по брюшине |
|
3 |
Ж., 60 |
IIb ст. (T3N1M0G3) |
ДСРЖ |
3,5 года |
50 Гр/ 2 Гр за фр. (ротация), ксело-да, элоксатин |
Лейкопения II ст. |
Уменьшение болевого синдрома и дисфагии |
12 мес, жива, состояние удовлетворительное |
|
4 |
Ж., 75 |
IIb ст. (T2N2M0G3) |
ДСРЖ |
5,5 лет |
50 Гр/ 2 Гр за фр. (ротация), ксело-да, элоксатин |
Тошнота, рвота II ст., слабость II ст., лейкопения I ст. |
Купирование болевого синдрома |
22 мес, жива, состояние удовлетворительное |
|
5 |
М., 62 |
IIa ст. (T2N1M0G3) |
Предоперационная лучевая терапия 25 Гр, Гастрэктомия D1 |
1,6 года |
48 Гр/ 2 Гр за фр., кселода, элокса-тин → перерыв 5 нед → 20 Гр/2 Гр за фр. |
Тошнота, рвота II ст., лейкопения III ст., ТП II ст. |
Без жалоб |
6 мес, жив, состояние удовлетворительное |
Характеристика больных, методов и результатов лечения
оптимальных изодоз. Ротационное облучение применяли в режиме одноосевой или двухсекторной ротации. Все больные были пролечены на линейном ускорителе PHILIPS SL-20 тормозным излучением с энергией 6 МэВ. У 2 пациентов курс лучевой терапии состоял из одного этапа, СОД составила 50 Гр по 2 Гр за фракцию. Остальным больным химиолучевая терапия проводилась в два этапа. В двух случаях на первом этапе дневная очаговая доза составила 2,5 Гр, с дроблением на две фракции (1 + 1,5 Гр) и интервалом между ними 4–5 ч. Параллельно пациенты получали химиотерапию по следующей схеме: кселода в суммарной дозе 1850 мг/м2 за два приема, ежедневно и элок-сатин в дозе 85–100 мг/м2 в виде внутривенных инфузий один раз в 3 нед. По окончании первого этапа лечения следовал 4–5-недельный перерыв, необходимый для реализации результатов лучевой терапии и нивелирования лучевых реакций. После перерыва проводили контрольное обследование с оценкой результатов лечения, и трем больным лучевая терапия была продолжена после повторной топометрической подготовки с учетом степени регрессии первичного очага. При этом СОД составила 20–28 Гр при классическом режиме фракционирования.
Мультиспиральную компьютерную томографию выполняли до начала химиолучевой терапии и через 4–8 нед после ее завершения. Далее КТ-исследование производили по показаниям или в рамках стандартного обследования один раз в год. Исследование выполняли на мультиспиральном компьютерном томографе SOMATOM Emotion 6 (Siemens). Подготовка больных включала в себя пероральное контрастирование кишечника водорастворимым рентгеноконтрастным веществом и прием непосредственно перед исследованием 500– 600 мл обычной воды. КТ-сканирование проводили в положении больного на спине на специальной подставке (для планирования лучевой терапии), при необходимости выполняли полипозиционное исследование, от уровня верхнего края печени до уровня подвздошного гребня с толщиной томографического слоя 5 мм при задержке дыхания на вдохе. Выполняли исследование до и после внутривенного болюсного введения 100–120 мл контрастного вещества (Ультравист 370) со скоростью 3,5 мл/сек в артериальную, портальную и венозную фазы контрастирования (с задержкой соответственно 25–30 сек, 45–50 сек и 77–80 сек). На этапе постпроцессорной обработки данных изображение реконструировали с толщиной среза 2,5 мм и выполняли мультипланарные и трехмерные реконструкции. КТ-оценку рецидивной опухоли проводили по следующим рентгенологическим симптомам: локализация рецидивной опухоли, ее форма, размеры, контуры, структура, денситометрическая плотность (измеренная в условных единицах Хаунсфилда), наличие отдаленных метастазов.
Все количественные измерения опухоли выполняли на центральном срезе КТ-изображения в зоне ее наибольшей площади. При измерении образования указывали два взаимно перпендикулярных размера в аксиальной плоскости. Для этого измерялся максимальный диаметр образования, после чего на этом же срезе измерялся второй размер, перпендикулярный первому. Площадь опухоли подсчитывали путем умножения двух размеров (согласно критериям ВОЗ).
Для оценки степени регрессии опухоли применяли следующие критерии: полная регрессия – полное исчезновение опухоли; частичная – уменьшение максимального размера опухоли более чем на 30 %; стабилизация – уменьшение максимального размера менее чем на 30 % или увеличение до 20 %; прогрессирование – увеличение максимального размера более чем на 20 % или появление новых очагов (критерии RECIST).
Для измерения денситометрической плотности опухолей использовали инструмент ROI (region of interest – зона интереса) произвольной формы. По периферии рецидивной опухоли вычерчивали ее границы, исключая соседние органы или неоднородности в структуре опухоли, например сосуды или обызвествления. Далее измерялась плотность в пределах очерченной области. Результатом являлась автоматическая статистическая оценка разброса денситометрической плотности опухоли в пределах серой шкалы: площадь зоны интереса в см2; максимальное и минимальное значения плотностей вок-селей в зоне интереса; среднее значение плотностей всех вокселей и стандартное (среднеквадратичное) отклонение значений плотностей вокселей в зоне интереса. При оценке изменения денситометриче-ской плотности рецидивных опухолей до и после химиолучевой терапии наибольшее значение имели среднее значение плотности и стандартное отклоне- ние, характеризующее степень разброса плотностей или неоднородность структуры.
Результаты и обсуждение
Таблица 2
|
КТ-симптомы |
Больная 1. |
Больной 2. |
Больная 3. |
Больная 4. |
Больной 5. |
|||||||||||
|
До лечения |
1 мес |
9 мес |
15 мес |
23 мес |
29 мес |
До лечения |
2 мес |
12 мес |
До лечения |
2 мес |
До лечения |
3 мес |
11 мес |
До лечения |
2 мес |
|
|
Размер опухоли, мм |
59х51 |
34х29 |
18х19 |
Без динамики |
74х53 |
46х44 |
31х28 |
37х24 |
37х20 |
40х31 |
34х22 |
б/д |
64х37 |
66х37 |
||
|
Изменение площади, % |
↓ 67,2 |
↓ 88,6 |
Без динамики |
↓ 48,4 |
↓ 77,9 |
↓ 16,7 |
↓ 39,7 |
б/д |
↑ 3,1 |
|||||||
|
Нативное исследование, денсито-метрическая плотность, ед. Н. |
34,9 ± 16 |
32 ± 23 |
44,9 ± 16 |
46,8 ± 20 |
30,7 ± 20 |
30,3 ± 15 |
37,9 ± 17 |
30,3 ± 20 |
32,3 ± 16 |
36,2 ± 18 |
43,2 ± 13 |
35,1 ± 16 |
31,3 ± 13 |
36,5 ± 17 |
30,2 ± 19 |
21,8 ± 17 |
|
После в/в контрастного усиления (венозная фаза) |
55,8 ± 22 |
52,9 ± 22 |
115,2 ± 22 |
114,8 ± 25 |
105,6 ± 24 |
95,1 ± 20 |
73,2 ± 18 |
52,5 ± 20 |
48,5 ± 20 |
121,5 ± 23 |
120,1 ± 26 |
75,4 ± 15 |
61,8 ± 17 |
89,6 ± 17 |
33,1 ± 19 |
33,0 ± 21 |
|
Вовлечение окружающих структур и тканей |
Культя ДПК-левая доля печени |
Уменьшение степени выраженности вовлечения |
Без динамики |
Печеночная артерия Перешеек ПЖ |
Без динамики |
Прилежание к культе ДПК |
Без динамики |
Печеночная артерия Чревный ствол |
Без динамики |
Чревный ствол Плотное прилежание к ПЖ |
Без динамики |
|||||
|
Клинико-диагностическая регрессия |
Частичная |
Частичная |
Стабилизация |
Стабилизация |
Прогрессирование |
|||||||||||
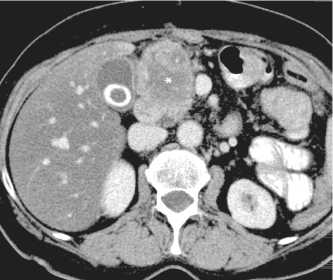
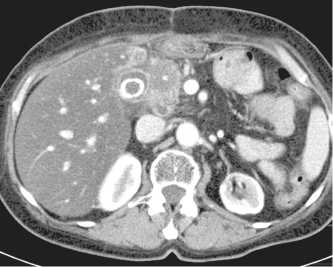
Рис. 2. КТ органов брюшной полости больной Л. через 1 мес после лечения. Выраженное уменьшение размеров рецидивной опухоли (*) до 34×29мм
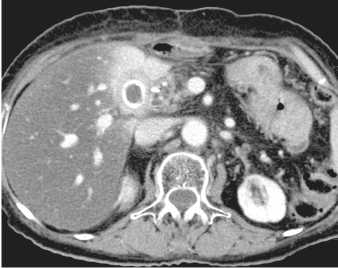
Рис. 3. КТ органов брюшной полости больной Л. через 9 мес после лечения. Дальнейшее уменьшение размеров рецидивной опухоли (*) до 18×19мм
В доступной литературе представлено очень незначительное число исследований, посвященных компьютерно-томографической диагностике изме-
В.Ю. СКОРОПАД, Л.Н. ТИТОВА, Н.К. СИЛАНТЬЕВА И ДР.
нений злокачественных опухолей ряда локализаций при проведении неоадъювантной терапии [1, 2]. Мы разделяем мнение многих авторов о необходимости совершенствования методических подходов КТ для оценки регрессии опухоли [6, 12]. Известны общемировые подходы к оценке регрессии опухолей, основополагающим правилом которых является утверждение о том, что размер солидной опухоли прямо пропорционален количеству опухолевых клеток [4, 9]. Конечно, использование критериев ВОЗ и RECIST позволяет унифицировать подход к оценке эффективности проводимого лечения, объективизировать ответ опухоли.
Под воздействием современных противораковых препаратов, лучевой терапии в опухоли происходят сложные процессы: дистрофические и некротические изменения, лучевые повреждения и т.д., что не всегда проявляется изменением размеров очага. Поэтому мы, как и J.E. Husband (1996), считаем, что оценка эффектов лечения должна проводиться с учетом как изменения размеров опухоли, так и изменения ее структуры [5].
При КТ-оценке структуры рецидивной опухоли мы рассматривали данные, полученные в нативную фазу исследования и после контрастного усиления. У всех больных до и после лечения структура опухолей была неоднородная, а накопление контрастного вещества неравномерным, что наиболее четко было видно в венозную фазу исследования. Для более детального анализа мы провели количественный анализ, измерив денситометрическую плотность ткани рецидивной опухоли (КА). Денси-тометрическая плотность опухоли колебалась: до лечения от 30,2 ± 19 до 37,9 ± 17 ед. Н (натив), от 33,1 ± 19 до 121,5 ± 23 ед. Н (венозная фаза); после лечения от 21,8 ± 17 до 43,2 ± 13 ед. Н (натив), от 33,0 ± 21 до 120,1 ± 26 ед. Н (венозная фаза). Такой разброс показателей плотности не удивителен, так как он отражает сложные морфологические процессы в опухолевой ткани (сопутствующие воспалительные, дистрофические и некротические изменения). Анализ средних значений плотностей и их стандартных (среднеквадратичных) отклонений показал, что денситометрическая плотность имела некоторую тенденцию к снижению после окончания лечения, но это не может являться той характеристикой, которая лежит в основе диагностики. Интереснее оказался анализ диагностической плотности у больных с частичной регрессией и стабилизацией процесса. При КТ, выполненной до лечения, отмечалось выраженное (p<0,05) увеличение денситометрической плотности (от 59,9 до 235,6 %), в то время как у больного с прогрессированием процесса такое увеличение составило 9,6 %. Наш материал слишком мал, чтобы делать какие-либо окончательные выводы, однако этот факт требует дальнейшего изучения по мере накопления клинического материала. Об исключительной важности и нерешенности данной проблемы свидетельствуют продолжающиеся исследования [11, 12].
Сроки наблюдения за больными и их статус приведены в табл. 1. Один больной умер через 24 мес при явлениях канцероматоза брюшины и асцита. Четверо больных живы в течение 6–32 мес, их состояние расценивается как удовлетворительное, жалоб на болевой синдром и нарушение проходимости пищи они не предъявляют.


