Химиолучевое лечение злокачественных глиом головного мозга с применением препарата пемодал
Автор: Осинов Иван Константинович, Мусабаева Людмила Ивановна, Нечитайло Максим Николаевич, Чойнзонов Евгений Лхамацыренович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 6 (36), 2009 года.
Бесплатный доступ
Представлены первые результаты применения лучевой терапии с препаратом Темодал в двух режимах у больных зло- качественными глиомами головного мозга после условно-радикального оперативного лечения. В I группе (n=35) Темодал назначался в разовой дозе 200 мг/м2 по схеме 5 дней, каждые 28 дней; во II группе (n=12) - в разовой дозе 75 мг/м2 еже- дневно, за час до проведения лучевой терапии в течение 42 дней. Всем больным проводилась дистанционная гамма-терапия по стандартной методике РОД 2,0 Гр, 5 дней в неделю до СОД 56-60 Гр. Результаты проведенного исследования показали удовлетворительную переносимость избранных режимов химиотерапии препаратом Темодал. Непосредственная эффек- тивность лечения у больных анапластической астроцитомой и мультиформной глиобластомой головного мозга в сроки 6 и 12 мес после лучевой терапии с препаратом Темодал была в 2-3 раза выше по сравнению с больными, получавшими лучевую терапию в монорежиме в СОД 56-60 Гр. Показатели общей трехлетней выживаемости у больных с анапластиче- ской астроцитомой и мультиформной глиобластомой головного мозга после проведенного лечения были в 3-4 раза выше, чем в контрольной группе.
Анапластическая астроцитома, мультиформная глиобластома, лучевая терапия, темодал
Короткий адрес: https://sciup.org/14055200
IDR: 14055200 | УДК: 616.831-006.484+615.28+615.849
Текст научной статьи Химиолучевое лечение злокачественных глиом головного мозга с применением препарата пемодал
Лечение злокачественных глиом (анапластическая астроцитома, мультиформная глиобластома, анапластическая олигодендроглиома) остается одной из наиболее сложных проблем в онкологии. Заболеваемость злокачественной глиомой, по данным Европейского общества медицинской онкологии (ESMO), в 2007 г. составила 5–7 случаев на 100 тыс. человек [3].
Ведущим в лечении злокачественных глиом остается хирургический метод, который преследует две основные цели: установление гистологического диагноза и уменьшение внутричерепного давления путем удаления максимально возможного объема опухоли. При глиомах высокой степени злокачественности объем операции является независимым фактором прогноза. Существенное улучшение выживаемости связано с резекцией 98 % или большего объема опухоли (медиана выживаемости 13 мес, по сравнению с 8,8 мес при резекции менее чем 98 %, р<0,0001) [9]. В рандомизированных исследованиях в начале 1990-х годов была доказана эффективность послеоперационной лучевой терапии при злокачественных глиомах. Использование лучевой терапии по стандартной методике (разовая очаговая доза 1,8–2,0 Гр, до СОД – 56–60 Гр) приводило к увеличению общей выживаемости с 5,2 до 10,2 мес [2]. Следует отметить, что глиомы головного мозга относятся к радиорезистентным новообразованиям. Р. Bouchard [4] на материале 63 аутопсий не зарегистрировал ни одного случая полного исчезновения клеток глиальной опухоли после облучения. Предпринимались попытки улучшить результаты местного контроля путем увеличения суммарной дозы облучения, применением нестандартных методик фракционирования (гипер- или мультифракционирование), когда облучение разовой очаговой дозой 1,2– 1,6 Гр осуществлялось 2–3 раза в день до СОД 82 Гр [11]. И хотя в I/II фазах клинического исследования были получены данные, указывающие на небольшое преимущество лучевой терапии в СОД 72 Гр, последующее рандомизированное исследование (Radiation Therapy Oncology Group RTOG 90–06; III фаза) результаты не подтвердило, не получено достоверных различий в выживаемости между группами, получавшими 72 Гр (60 фракций по 1,2 Гр × 2 раза в день) и 60 Гр (30 фракций по 2 Гр × 1 раз в день) [12, 16]. По данным J.L. Chan et al. [5], увеличение СОД с 70 до 90 Гр приводит к снижению как одногодичной, так и двухгодичной выживаемости. Несмотря на применение различных методик лучевого лечения злокачественных глиом, продолжительность жизни больных исчисляется 10–12 мес, при этом рецидивы заболевания встречаются в 70–80 % случаев [2]. Таким образом, стандартным подходом в лучевой терапии злокачественных глиом является подведение 60 Гр по 2 Гр за фракцию, 5 дней в нед, курс – 6 нед.
Неудовлетворительные итоги лечения глиом высокой степени злокачественности заставляют искать новые варианты лечения. Последние 5 лет в комплексном лечении глиом активно ис- пользуется Темодал (темозоломид), который был синтезирован в 1984 г. в Великобритании группой ученых, возглавляемых M. Stevens [13]. Темодал (темозоломид) – это новый цитостатический алкилирующий препарат второго поколения, принадлежащий к классу имидазотетразинов. Основным механизмом действия Темодала является метилирование дезоксирибонуклеиновой кислоты (ДНК), обеспечивающее противоопухолевый повреждающий эффект. Темодал хорошо проникает через гематоэнцефалический барьер в ткань опухоли головного мозга. Достоинством препарата является возможность проведения химиотерапии Темодалом per os в амбулаторных условиях.
В сравнительных рандомизированных многоцентровых клинических исследованиях у больных с рецидивами мультиформной глиобластомы в сравнении с прокарбазином приём Темодала в дозе 200 мг/м2/день в течение 5 дней каждые 4 нед дает более высокую частоту объективных ответов. Объективный ответ у больных, получавших Темодал, составил 21 %, прокарабазин – 8 % [17]. В своем исследовании C. Cypro et al. [6] убедительно демонстрирует преимущество радиосенсибилизирующего эффекта Темодала, применяемого дозой 75 мг/м2 ежедневно в случае сочетания со стандартной лучевой терапией в суммарной очаговой дозе 60 Гр. Комбинированная химиолучевая терапия с Темодалом в режиме 75 мг/м2 в 2 раза снизила риск прогрессирования болезни по сравнению с монотерапией этим препаратом. По данным Университетской клиники Лозанны, в III фазе клинических исследований (лучевая терапия и Темодал в дозе 75 мг/м2) 5-летняя выживаемость была в 4 раза выше в группе ЛТ с Темодалом по сравнению с одной ЛТ (p=0,012), при этом возраст больных злокачественной глиомой был менее 50 лет и соматический статус по ECOG – 0–1 [13, 14].
Выделяют следующие прогностические факторы, от которых зависит непосредственная эффективность лечения злокачественных глиом: гистологическая степень злокачественности опухоли, возраст пациентов, тяжесть состояния больных при поступлении в клинику и после операции, объём удаленной опухоли на операции, повторные операции [8]. Однако многие аспекты химиолучевой терапии с Темодалом у больных злокачественными глиомами головного мозга исследованы еще недостаточно, в частности, окончательно не определена оптимальная доза препарата при лучевой терапии анапластической астроцитомы и мультиформной глиобластомы. В НИИ онкологии СО РАМН с 2005 г. проводится сравнительное изучение клинической эффективности двух режимов химиотерапии Темодалом из расчета разовой дозы 200 мг/м2 и 75 мг/м2 в сочетании с лучевой терапией после различных по объему хирургических вмешательств у больных со злокачественными глиомами головного мозга, результаты исследования представлены в данном сообщении.
Материал и методы
В исследование включено 82 больных с мультиформной глиобластомой (ГБ) и анапластической астроцитомой (АА) головного мозга, которым выполнено оперативное лечение в объеме тотального, субтотального и парциального удаления опухоли, из них – 49 мужчин и 33 женщины. Средний возраст больных 48 ± 1,6 года. В зависимости от морфологического диагноза и методики химиотерапии препаратом Темодал больные были разделены на следующие сравниваемые две группы:
I группа – 35 больных злокачественной глиомой головного мозга, из них у 18 – анапластическая астроцитома, у 17 – мультиформная глиобластома. Медиана возраста 51 год. Статус по шкале Карновского 70 баллов, по ECOG – 1–2. Средний срок наблюдения составил – 18 ± 2,1 мес.
Вторая группа – 12 больных злокачественной глиомой головного мозга: у 5 – анапластическая астроцитома, у 7 – мультиформная глиобластома. Медиана возраста 44,5 года. Статус по шкале Карновского 80 баллов, по ECOG – 0–1. Средний срок наблюдения – 11±2,0 мес.
Третья группа исторического контроля – 35 больных злокачественной глиомой головного мозга: анапластическая астроцитома – 17 человек, мультиформная глиобластома – 18, получавших лучевое лечение в отделении радиологии НИИ онкологии с 1996 по 2006 г. Медиана возраста 48,5 года. Средний срок наблюдения – 16 ± 2,3 мес.
На первом этапе больным основных групп проводилось оперативное лечение в объеме тотального удаления опухоли у 15,8 % больных, субтотального удаления у 63,4 % и парциального удаления у 20,7 % больных. Во всех когортах больных преобладающим объемом оперативного вмешательства было субтотальное удаление опухоли: I группа – в 54,2 %, II группа – в 41,6 %, III группа – в 80 % случаев. После оперативного лечения в среднем на 14–21-й день назначалась дистанционная лучевая терапия.
Планирование лучевой терапии осуществлялось с помощью КТ/МРТ с учетом рекомендаций ICRU-50 и 62 (Inetrnational Commission on Radiology Units). При этом вся зона интереса охвачена 95 %, а при больших объемах – 80 % изодозой. Лучевую терапию проводили на аппарате Рокус-М – 1,25 МэВ в режиме стандартного фракционирования разовой очаговой дозой РОД 2,0 Гр, 5 раз в нед до СОД 56–60 Гр, размеры полей 8х10 и 10х10 см, преимущественно ротационным способом и статическим методом в исследуемых и контрольной группах.
Химиотерапию (ХТ) Темодалом начинали с первого дня лучевой терапии, в первой группе все больные получали препарат в дозе 200 мг/ м2 (280–400 мг) по схеме 5 дней через каждые 23 дня, суммарная доза на курс составляла 1400–2000 мг. Всего за курс лучевой терапии проводили 2 курса ХТ Темодалом. В постлучевом периоде прием Темодала продолжали по той же схеме (медиана – 6 курсов).
Во второй группе больные получали препарат Темодал в разовой дозе 75 мг/м2 (120–140 мг) ежедневно за час до проведения ДГТ в течение 42 дней (5040–5880 мг). Далее в постлучевом периоде проводили 6 курсов ХТ Темодалом по схеме 200 мг/м2 (280–400 мг) 5 дней через каждые 23 дня, суммарная доза за курс составляла 1400–2000 мг (медиана – 6 курсов).
В группе контроля проводилась дистанционная гамма-терапия на аппарате Рокус-М – 1,25 МэВ или тормозным излучением на отечественном Бетатроне 22 МэВ, преимущественно статическим способом, РОД 2,0 Гр, 5 фракций в неделю, до СОД 54–60 Гр.
В контрольные сроки после ХЛТ через 1, 3, 6 и 12 мес проводилось МРТ/КТ исследование головного мозга с контрастированием. Данные исследования дополнялись ОЭКТ с 99mТс-Технетрилом в дозе 600 МБк через 1 мес после химиолучевой терапии (ХЛТ) и далее каждые 6 мес. Для оценки переносимости химиолучевой терапии использовались критерии токсичности CTC-NCIC (Clinical Trial Center National Institute Canada). Эффективность комплексного лечения больных злокачественной глиомой головного мозга с применением Темодала оценивалась по частоте объективного эффекта – полная регрессия + частичная регрессия (ПР + ЧР) – на проводимое лечение, достижению контроля роста опухоли – полная регрессия + частичная регрессия + стабилизация болезни (ПР + ЧР + СБ) – и медиане выживаемости до прогрессирования заболевания [6]. Статистическая обработка показателей проводилась с использованием программы Statistica v. 6.0.
Результаты и обсуждение
Наиболее значимыми показателями переносимости химиолучевого лечения были следующие клинические симптомы: головная боль, общая слабость, тошнота, рвота, боли в эпигастрии, признаки нарастающего отека головного мозга у отдельных пациентов – выбухание ткани мозга через трепанационное отверстие, заторможенность, ухудшение неврологического статуса.
Общие токсические эффекты (головная боль, общая слабость, кратковременная гипертермия) встречались одинаково часто у пациентов исследуемых групп. Диспепсия (тошнота, рвота, боли в эпигастрии) достоверно чаще наблюдалась у пациентов I и II группы по сравнению с контролем. Переносимость химиолучевого лечения в исследуемых группах была удовлетворительной: частота общих токсических эффектов по критериям CTC-NCIC у пациентов, получавших ХЛТ, была сопоставима в двух группах с различными режимами приема препарата Темодал. Гематологическая токсичность не превышала I степени. Снижение на 25 % от исходного числа тромбоцитов и на 15 % лейкоцитов отмечалось на 21–28-й день после начала курса химиотерапии, но в течение последующих двух недель показатели периферической крови нормализовались. Признаков органной и кумулятивной токсичности химиопрепарата не отмечалось.
Для оценки непосредственной эффективности лечения больные исследуемых групп были разделены в подгруппы в соответствии с морфологическим диагнозом (рис. 1). В срок через 6 мес после химиолучевого лечения объективный эффект в I группе наблюдался в 33 %, во II группе – в 80 % случаев, что статистически значимо выше, чем в группе контроля, где объективный эффект получен у 11 % больных
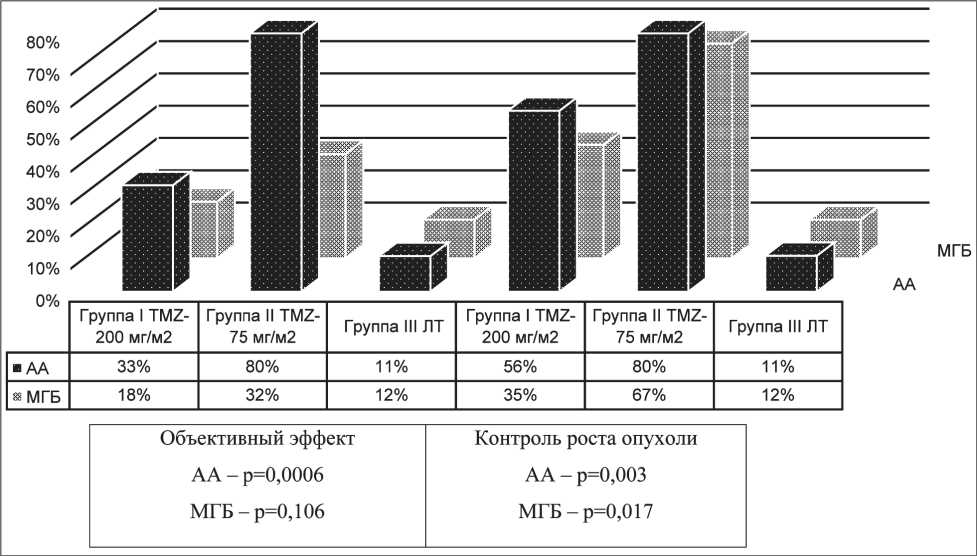
Рис. 1. Эффективность лечения злокачественных глиом головного мозга через 6 мес СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2009. №6 (36)
Таблица
Результаты одногодичного наблюдения больных злокачественными глиомами головного мозга по окончании лечения
|
Группа больных |
АА |
МГБ |
||||
|
ОВ (%) |
Медиана (мес) |
Медиана ВДП (мес) |
ОВ (%) |
Медиана (мес) |
Медиана ВДП (мес) |
|
|
TMZ |
56,4 ± 11,5 |
16 |
9,5 |
64,7 ± 11,5 |
13 |
6 |
|
200 мг/м2 |
(12,4–26,3) |
(8,3–23) |
(10,3–22,6) |
(5,4-17,2) |
||
|
ЛТ |
27,7 ± 10,5 |
7 (5,6–21,7) |
5 (4–17) |
23,5 ± 10,2 |
6 (4,2–15,1) |
3 (1,7-11,5) |
Примечание: ОВ – общая выживаемость; ВДП – выживаемость до прогрессирования.
(р=0,0006). Наибольшая частота объективного эффекта (80 %) наблюдалась у больных II группы с АА, получавших курс химиолучевой терапии с Темодалом в режиме 75мг/м2 ежедневно в течение всего курса лучевой терапии. У больных с МГБ в группе II через 6 мес в том же режиме приема Темодала объективный эффект был выше, чем в первой и третьей группе, и составил 32 %, однако статистически значимых различий между показателями исследуемых групп получено не было (р=0,106).
Контроль роста опухоли через 6 мес у больных с АА в I группе достигнут в 56 %, у больных с МГБ – в 35 % случаев, во II группе – в 80 % и 67 % соответственно (р=0,003 и р=0,017). В контрольной группе больных, получавших ЛТ, контроль роста опухоли был достигнут у 11 % пациентов при АА и у 11,7 % – при МГБ. Объективный эффект и контроль роста опухоли в группах больных, которые получали ХЛТ с Темодалом, статистически значимо отличался от показателей контрольной группы больных с лучевой терапией при АА и МГБ (p<0,05). Статистически значимых различий в эффективности применяемых двух режимов химиотерапии Темодалом у больных получено не было.
Ввиду того, что средний срок наблюдения во II группе не превышал одного года, непосредственную эффективность и общую выживаемость в срок 12 мес оценить не представлялось возможным. Объективный эффект в первой группе больных, которые принимали Темодал в режиме 200 мг/м2, после окончания ХЛТ и 6 курсов химиотерапии Темодалом при АА составил 38,8 %, при МГБ – 17,6 %. Контроль роста опухоли при АА достигнут у 50 %, при
МГБ – у 23 % больных. Оценка эффективности основывалась на объективных данных МРТ и КТ исследований с контрастированием. В группе лучевой терапии объективного эффекта через год не было установлено ни у одного больного, у трёх больных с АА отмечалась стабилизация процесса. Общая одногодичная выживаемость и медиана выживаемости до прогрессирования у больных с АА и МГБ, получающих ХЛТ с Темодалом по 200 мг/м2, в 2–3 раза превышала таковую по сравнению с контрольной группой больных, получавших лучевую терапию (таблица). Различия статистически значимы для каждой гистологической формы опухоли: АА – р<0,017; МГБ – р<0,018.
При анализе трехлетних результатов лечения в группе I и контроле установлено, что у больных с АА, получавших ХЛТ, общая трехлетняя выживаемость составила 54,1 ± 12 %, у больных с МГБ – 23,5 ± 10,2 %. В контрольной – 14,8 ± 8,9 % при АА и 5,8 ± 5,7 % при МГБ соответственно (рис. 2,3). Различия между группами статистически значимы (р<0,05).
Таким образом, сравнительный анализ эффективности применения препарата Темодал и стандартного курса лучевой терапии подтвердил литературные данные о преимуществе химиолучевой терапии с Темодалом в лечении злокачественных глиом головного мозга. При сравнении двух режимов применения препарата Темодал по критериям непосредственной эффективности лечения через 6 мес получены данные о том, что в группе больных с АА, принимавших Темодал в режиме 75 мг/м2 ежедневно в течение всего курса ЛТ, отмечалась выраженная регрессия опухоли. Объективный эффект
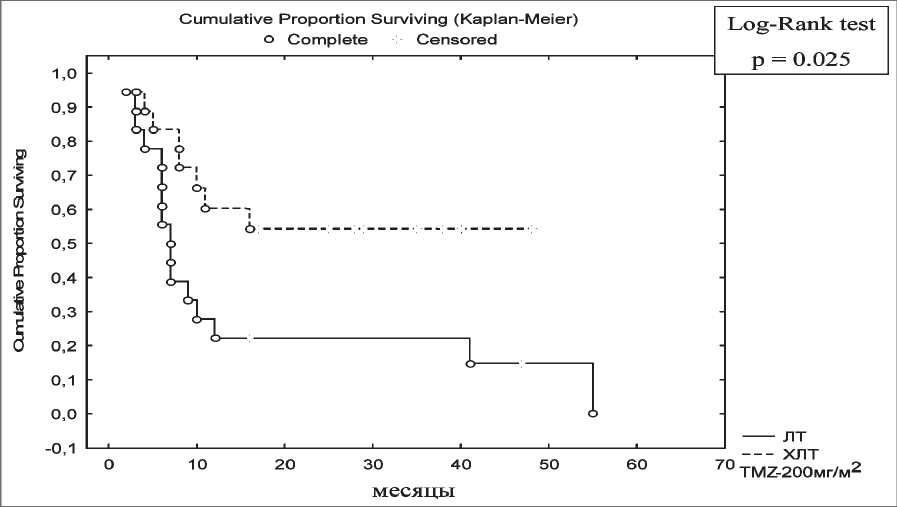
Рис. 2. Общая трехлетняя выживаемость у больных с АА в зависимости от метода лечения
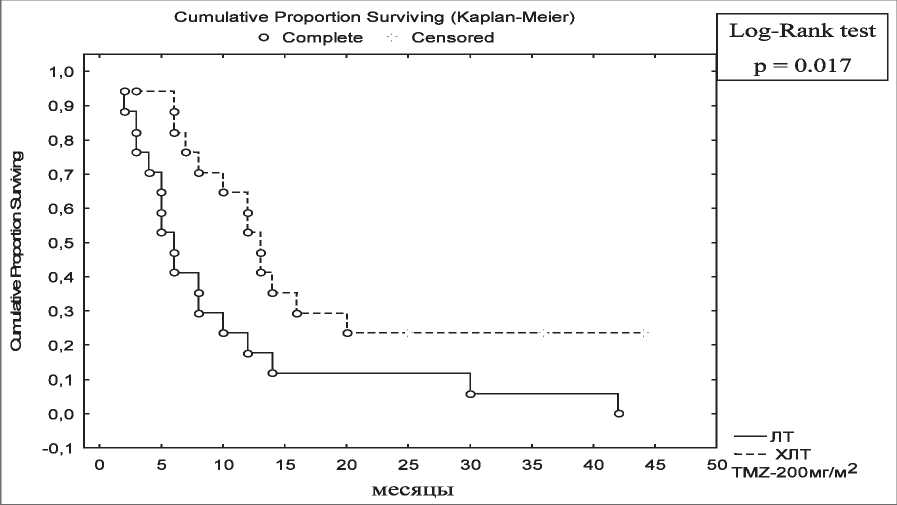
Рис. 3. Общая трехлетняя выживаемость у больных с МГБ в зависимости от метода лечения от лечения и контроль над опухолевым ростом отмечен в 80 % случаев, что, вероятнее всего, связано не с увеличением суммарной курсовой дозы препарата, а с его радиосенсибилизирующим эффектом. В случае с МГБ этот эффект был выражен в меньшей степени, чем у больных с АА, но имел тенденцию к повышению в сравнении с результатами больных МГБ после лучевой терапии в контрольной группе.
Показатели трехлетней общей выживаемости у больных с АА и МГБ в первой группе статистически значимо превышали показатели контроля в 3–4 раза. Полученные первые результаты собственных клинических испытаний применения с лучевой терапией препарата Темодал в двух режимах у больных злокачественными глиомами (анапластической астроцитомой и мультиформной глиобластомой) являются обнадеживающими, что дает основание для продолжения научного исследования в данном направлении.


