Хиральный эффект адсорбции атомарного кислорода на поверхности углеродных нанотрубок
Автор: Шамина Елена Николаевна, Лебедев Николай Геннадьевич
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Химическая физика
Статья в выпуске: 1 (18), 2013 года.
Бесплатный доступ
Представлены результаты квантово-химических исследований адсорбционных свойств хиральных и ахиральных однослойных углеродных нанотрубок относительно двухвалентного атома кислорода. Определены энергетические характеристики процессов хемосорбции атомарного кислорода на поверхности нанотрубок. Обнаружен адсорбционный хиральный эффект для двухвалентного атома кислорода.
Углеродные нанотрубки, сarbon nanotubes, кислород, адсорбция, хиральный эффект, энергетические и геометрические характеристики
Короткий адрес: https://sciup.org/14968720
IDR: 14968720 | УДК: 541.138
Текст научной статьи Хиральный эффект адсорбции атомарного кислорода на поверхности углеродных нанотрубок
ã Шамина Е.Н., Лебедев Н.Г., 2013
В работах [4; 5; 9; 10] на основе теоретических исследований авторами был предсказан хиральный адсорбционный эффект, а также представлены результаты компьютерного моделирования процессов адсорбции атомов водорода и фтора на однослойных углеродных нанотрубках (УНТ) разного диаметра и хиральности в рамках квантово-химических полуэмпирических методов. В результате расчета электронного строения и геометрических характеристик образовавшихся одноатомных гидридов и фторидов показана осциллирующая зависимость энергий адсорбции и активации процессов гидрогенизации и фторирования от диаметра и хиральности нанотрубки. Причем наблюдалась корреляция между рассчитанными энергиями: хиральные УНТ, обладающие наиболее выгодной адсорбционной энергией, присоединяют атомы с наименьшей энергией активации и наоборот. Были определены оптимальные диаметры хиральных УНТ, на которых адсорбция протекает наиболее эффективно. Такими оказались нанотрубки, проявляющие проводящие свойства. Основные носители зарядов (электроны) в этих УНТ оказываются нело-кализованными, поэтому p-AO атомов углерода, принимающих участие в формировании химических p -связей, являются ненасыщенными и создают повышенную реакционную способность.
Для нанотрубок, которые проявляют полупроводниковые свойства, процесс атомарной адсорбции оказывается энергетически менее выгодным.
Последующие экспериментальные исследования [8] углеродных нанотрубок показали возможность их гравировки водородной плазмой. С помощью Рамановской спектроскопии и сканирующей туннельной микроскопии исследователи обнаружили, что водородная плазма предпочитает проводящие однослойные углеродные нанотрубки полупроводниковым, что соответствует выводам теоретических работ [4; 5; 9; 10].
Кроме того, хиральный адсорбционный эффект также экспериментально обнаружен при взаимодействии УНТ с кислородом [1; 7]. Была выполнена серия экспериментов, в которых исследовались электронные и проводящие свойства нанотрубок, выдержанных в газе О2. Выяснено, что узкощелевые полупроводящие УНТ обнаруживают металлическое поведение после взаимодействия с кислородом. И, как оказалось, окисление металлических однослойных нанотрубок происходит эффективнее, чем полупроводниковых. Последний вывод косвенно указывает на хиральный адсорбционный эффект окисления УНТ.
В данной работе представлены результаты расчета энергетических характеристик процессов адсорбции атома кислорода на однослойных углеродных нанотрубках. Расчеты электронного строения данных структур выполнены в рамках модели молекулярного кластера с граничными псевдоатомами с использованием квантово-химических полуэмпирических методов MNDO и PM 3 [3].
1. Выбор модели
Рассмотрены однослойные углеродные ахиральные нанотрубки ( n , n ) типа ( n = 3, 4, 5, 6, 7), у которых хиральный угол составляет q = 30°, и хиральные нанотрубки ( n , m ) типа ( n = 5, 6, 7; m = 2, ..., 6), у которых угол q лежит в диапазоне 16° £ q £ 27°. В качестве геометрических моделей изучаемых нанотрубок выбраны кластеры, содержащие n шестиатомных циклов (гексагонов) по периметру трубки и 10 элементарных ячеек вдоль оси трубки. По окружности все трубки геометрически замкнуты. Граничные разорванные химические связи замыкались атомами водорода, которые выбирались в качестве граничных. Начальные расстояния между ближайшими атомами углерода принимались равными 1,44 Å, полученные в процессе предварительной оптимизации геометрии с помощью метода молекулярной механики [2].
Положение адсорбированного атома (адатома) кислорода выбрано над центром С-С-связи, так как он является двухвалентным при формировании ионно-ковалентных связей. Кроме того, адсорбирующийся атом помещался в центральной части кластера, чтобы уменьшить влияние границы (см. рис. 1).
Исследование адсорбции атомарного кислорода на поверхности УНТ проводилось с учетом двух возможных спиновых состояний атома: синглетного и триплетного. Результаты квантово-химических расчетов представлены в таблицах 1–4.
2. Обсуждение результатов
Как следует из таблиц 1 и 2, для большинства ахиральных УНТ с адатомом кислорода энергии граничных, то есть верхней занятой и нижней вакантной, молекулярных орбиталей Е ВЗМО и Е НВМО оказываются приблизительно одинаковыми, что свидетельствует о подобии их физико-химических свойств. Величины энергий верхней занятой и нижней вакантной МО зависят от геометрических размеров УНТ, а именно Е ВЗМО монотонно уменьшается с ростом диаметра, а Е НВМО – увеличивается.
Анализируя энергии граничных орбиталей хиральных УНТ (см. табл. 3 и 4), можно сделать вывод, что величины Е ВЗМО и Е НВМО для большинства хиральных УНТ с адатомом кислорода в синглетном и триплетном состояниях немонотонно зависят от диаметра НТ. Они осциллируют в противофазе относительно некоторых средних значений: величина Е ВЗМО » -6,70 эВ, Е НВМО » -3,25 эВ ( MNDO ) и Е ВЗМО » -6,77 эВ, Е НВМО » -3,50 эВ ( PM 3) – для синглетного состояния; Е ВЗМО » -8,30 эВ, Е НВМО » -2,12 эВ ( MNDO ) и Е ВЗМО » -7,79 эВ, Е НВМО » -2,92 эВ ( PM 3) – для триплетного состояния.
Изменение величин граничных энергий Е ВЗМО и Е НВМО свидетельствует об изменении свойств нанотрубок в результате адсорбции, в частности, об увеличении реакционной способности данных систем. То есть адсорбированные на поверхности трубки частицы увеличивают сродство УНТ к другим частицам.
Согласно проведенным расчетам величина энергии запрещенной щели Еg у УНТ с адатомом кислорода в синглетном состоянии составляет ~1,5–1,7 эВ у ахиральных нанотрубок (см. табл. 1 и 2) и ~0,6–1,9 эВ – у хиральных (см. табл. 3 и 4), что свидетельствует о полупроводниковых свойствах изучаемых УНТ.
Как видно из приведенного рисунка (рис. 1), адсорбция атомарного кислорода, как и следовало ожидать, протекает с образованием двух химических связей атома с соседними поверхностными атомами углерода. То есть атом О располагается практически над центром С-С-связи, деформируя поверхность нанотрубки так, что атомы углерода смещаются с положений равновесия наружу трубки. В результате такой деформации С-С-связь углеродного гексагона, над которым происходило присоединение атома О, удлинилась по сравнению с невозмущенными значениями. У нанотрубок (3, 3) и (4, 4), (5, 2), (5, 3), (5, 4), (6, 3), (6, 5) и (7, 4) длина С-С-связи составила 2,1 Å, что, на наш взгляд, соответствует некоторому переходному состоянию, после которого дальнейшее удлинение приводит к разрыву С-С-связи. Причиной такой сильной деформации химических связей является высокая кривизна поверхности УНТ. Образование химических связей с адатомами сопровождается перестройкой электронных оболочек обоих атомов и изменением степени гибридизации атомных орбиталей углерода. Отталкивание электронов гибридизованных атомных орбиталей приводит к описанной деформации химических связей. С ростом диаметра и соответственно уменьшением кривизны поверхности УНТ удлинение С-С-связи составляет: у нанотрубки (5, 5) – 1,66 Å, у (6, 6) и (7, 7), (7, 5) и (7, 6) нанотрубок ~1,6 Å. То есть с уменьшением кривизны поверхности УНТ деформация связей, вызванная адсорбцией атома кислорода, становится менее выражена.
Рис. 1. Фрагмент углеродной нанотрубки (4, 4) с адатомом кислорода
Длина образовавшейся С-О-связи остается почти без изменения с ростом диаметра УНТ (см. табл. 1–4). Удлинение С-О-связи составило приблизительно 1–2 % в MNDO- и PM 3-мето-дах во всем диапазоне рассмотренных диаметров.
Анализируя заряды на адатоме кислорода (см. табл. 1–4), можно сделать вывод, что в результате адсорбции произошел перенос заряда с УНТ на адатом кислорода. Причем величина заряда зависит от геометрических размеров УНТ, а именно монотонно увеличивается с ростом диаметра трубки. У ахиральных нанотрубок (см. табл. 1–2) увеличение составило приблизительно 5 % в MNDO- методе и 50 % в PM 3-методе. У хиральных нанотрубок (см. табл. 2–4) увеличение составило приблизительно 15 % в MNDO -методе и 50 % в PM 3-методе. Это связано, на наш взгляд, с тем, что с уменьшением кривизны УНТ увеличивается степень перекрывания атомных p -орбиталей кислорода и углерода при формировании химических связей между ними.
Энергия адсорбции атомов и молекул рассчитывалась как разность полных энергий продуктов реакции и реагентов. Оценивая результаты, полученные при расчете величины E адс и представленные в таблице 1, можно сделать вывод, что абсолютное значение энергии адсорбции синглетного атома кислорода на поверхности ахиральных УНТ монотонно уменьшается (по абсолютной величине) с ростом диаметра трубки (рис. 2, а ). То есть с уменьшением кривизны поверхности усиливается отталкивание атомов примеси от атомов 2-й координационной сферы. Отрицательные значения энергии химической С-О-связи (адсорбции) указывают на то, что система находится в устойчивом состоянии.
Таблица 1
Электронно-энергетические и геометрические характеристики ахиральных нанотрубок с адатомом кислорода ( S = 0)
|
Трубки |
Метод |
R A-TUB , Å |
Q A * |
E A Д , эВ |
E g , эВ |
Δ Eg , эВ |
Е ВЗМО, эВ |
Е НВМО, эВ |
D , нм |
|
3, 3 + О |
MNDO |
1,40 |
-0,19 |
-7,57 |
1,71 |
-0,05 |
-7,62 |
-2,44 |
0,40 |
|
PM 3 |
1,42 |
-0,12 |
-6,77 |
1,70 |
-0,04 |
-7,65 |
-2,70 |
||
|
4, 4 + O |
MNDO |
1,40 |
-0,19 |
-6,65 |
1,48 |
-0,08 |
-7,19 |
-2,86 |
0,54 |
|
PM 3 |
1,42 |
-0,15 |
-4,76 |
1,41 |
-0,09 |
-7,32 |
-3,08 |
||
|
5, 5 + О |
MNDO |
1,40 |
-0,19 |
-5,27 |
1,69 |
-0,05 |
-7,09 |
-2,86 |
0,68 |
|
PM 3 |
1,43 |
-0,16 |
-4,49 |
1,64 |
-0,13 |
-7,18 |
-3,14 |
||
|
6, 6 + О |
MNDO |
1,41 |
-0,19 |
-5,07 |
1,78 |
-0,11 |
-6,93 |
-2,98 |
0,81 |
|
PM 3 |
1,43 |
-0,17 |
-4,31 |
1,69 |
-0,20 |
-7,00 |
-3,29 |
||
|
7, 7 + O |
MNDO |
1,41 |
-0,19 |
-5,00 |
1,56 |
-0,03 |
-6,76 |
-3,10 |
0,95 |
|
PM 3 |
1,44 |
-0,18 |
-4,19 |
1,52 |
-0,08 |
-6,88 |
-3,39 |
Примечание. * В единицах элементарного заряда.
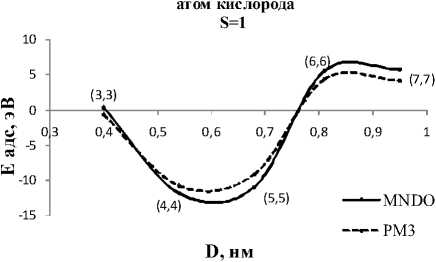
Зависимость энергии адсорбции атома кислорода в триплетном спиновом состоянии от диаметра D (см. табл. 2, рис. 2, б ) имеет осциллирующий характер. При этом для большинства диаметров энергия адсорбции является положительной. Это свидетельствует о том, что неспаренные электроны локализованы на атоме примеси и поэтому создают дополнительное отталкивание электронов примеси с электронами УНТ. Это отталкивание усиливается с уменьшением кривизны трубки.
Таблица 2
Электронно-энергетические и геометрические характеристики ахиральных нанотрубок с адатомом кислорода ( S = 1)
|
Трубки |
Метод |
R A-TUB , Å |
Q A * |
E A Д , эВ |
Е ВЗМО , эВ |
Е НВМ О , эВ |
D , нм |
|
3, 3 + О |
MNDO |
1,40 |
-0,19 |
0,36 |
-8,81 |
-1,54 |
0,40 |
|
PM 3 |
1,43 |
-0,12 |
-0,63 |
-8,61 |
-2,64 |
||
|
4, 4 + O |
MNDO |
1,41 |
-0,19 |
-14,78 |
-8,26 |
-2,21 |
0,54 |
|
PM 3 |
1,44 |
-0,12 |
-10,73 |
-8,46 |
-2,69 |
||
|
5, 5 + О |
MNDO |
1,42 |
-0,19 |
-11,91 |
-8,07 |
-2,16 |
0,68 |
|
PM 3 |
1,44 |
-0,17 |
-9,12 |
-7,57 |
-3,12 |
||
|
6, 6 + О |
MNDO |
1,42 |
-0,20 |
5,59 |
-8,02 |
-2,11 |
0,81 |
|
PM 3 |
1,44 |
-0,18 |
4,4 |
-7,35 |
-3,09 |
||
|
7, 7 + O |
MNDO |
1,42 |
-0,20 |
5,78 |
-7,94 |
-2,11 |
0,95 |
|
PM 3 |
1,44 |
-0,18 |
4,2 |
-7,30 |
-3,08 |
Примечание. * В единицах элементарного заряда.
Рассчитанные зависимости энергий адсорбции процесса оксидирования хиральных УНТ от их диаметра, представленные в таблицах 3 и 4, демонстрируют хиральный эффект процесса окисления. Эффект заключается в осциллирующей (периодической) зависимости энергий адсорбции от диаметра трубок. Чередование минимальных и максимальных значений энергий с ростом диаметра трубок позволило определить оптимальные диаметры хиральных УНТ, на которых адсорбция атомарного кислорода реализуется наиболее эффективно в том смысле, что формируется энергетически более устойчивая система. Следует подчеркнуть, что эффект наблюдается как для синглетного, так и для триплетного спиновых состояний атома кислорода. Оптимальные диаметры хиральных нанотрубок, на которые атом кислорода в синглетном состоянии адсорбируется наиболее эффективно, имеют такие же УНТ, как и для случаев гидрогенизации и фториро- вания [4; 5; 9; 10], – (5, 2), (5, 3), (6, 3), (7, 4) и (7, 5). Для этих нанотрубок энергии адсорбции располагаются в окрестности энергетического минимума кривой. Для УНТ (5, 4), (6, 5) и (7, 6) процессы оксидирования энергетически менее выгодны (рис. 3, а).
Таблица 3
Электронно-энергетические и геометрические характеристики хиральных нанотрубок с адатомом кислорода ( S = 0)
|
Трубки |
Метод |
R A-TU B , Å |
Q A * |
E A Д , эВ |
E g , эВ |
Δ E g , эВ |
Е ВЗМО , эВ |
Е НВМО , эВ |
D , нм/ θ, град. |
|
5, 2 + О |
MNDO |
1,39 |
-0,18 |
-6,52 |
0,60 |
-0,21 |
-6,52 |
-3,29 |
0,487/ |
|
PM 3 |
1,41 |
-0,11 |
-5,73 |
0,60 |
-0,21 |
-6,71 |
-3,54 |
16 |
|
|
5, 3 + O |
MNDO |
1,39 |
-0,19 |
-6,49 |
0,60 |
0,16 |
-6,60 |
-3,18 |
0,546/ |
|
PM 3 |
1,41 |
-0,12 |
-5,68 |
0,57 |
1,12 |
-6,58 |
-3,55 |
22 |
|
|
5, 4 + О |
MNDO |
1,39 |
-0,19 |
-5,96 |
1,83 |
-0,13 |
-7,19 |
-2,85 |
0,612/ |
|
PM 3 |
1,41 |
-0,12 |
-5,44 |
1,91 |
-0,02 |
-7,18 |
-2,87 |
26 |
|
|
6, 3 + О |
MNDO |
1,39 |
-0,19 |
-6,06 |
0,62 |
-0,22 |
-6,33 |
-3,57 |
0,619/ |
|
PM 3 |
1,41 |
-0,12 |
-5,59 |
0,60 |
-0,24 |
-6,52 |
-3,83 |
19 |
|
|
6, 5 + O |
MNDO |
1,39 |
-0,19 |
-5,11 |
1,92 |
0,08 |
-7,07 |
-2,99 |
0,744/ |
|
PM 3 |
1,41 |
-0,15 |
-5,10 |
1,83 |
-0,01 |
-7,19 |
-3,28 |
27 |
|
|
7, 4 + O |
MNDO |
1,39 |
-0,19 |
-5,81 |
0,92 |
-0,12 |
-6,43 |
-3,49 |
0,752/ |
|
PM 3 |
1,41 |
-0,16 |
-5,17 |
0,84 |
-0,18 |
-6,55 |
-3,81 |
21 |
|
|
7, 5 + O |
MNDO |
1,41 |
-0,19 |
-5,01 |
1,05 |
0,10 |
-6,46 |
-3,46 |
0,814/ |
|
PM 3 |
1,43 |
-0,17 |
-4,24 |
0,72 |
-0,21 |
-6,45 |
-3,66 |
25 |
|
|
7, 6 + O |
MNDO |
1,42 |
-0,20 |
-4,85 |
1,80 |
-0,08 |
-6,88 |
-3,18 |
0,879/ |
|
PM 3 |
1,44 |
-0,18 |
-4,17 |
1,64 |
-0,23 |
-6,99 |
-3,50 |
27 |
Примечание. * В единицах элементарного заряда.
Таблица 4
Электронно-энергетические и геометрические характеристики хиральных нанотрубок с адатомом кислорода (S = 1)
|
Трубки |
Метод |
R A-TUB , Å |
Q A * |
E A Д , эВ |
Е ВЗМО , эВ |
Е НВМО , эВ |
D , нм/ θ, град. |
|
5, 2 + О |
MNDO |
1,42 |
-0,17 |
-6,26 |
-8,71 |
-1,82 |
0,487/ |
|
PM 3 |
1,44 |
-0,15 |
-3,36 |
-8,27 |
-2,20 |
16 |
|
|
5, 3 + O |
MNDO |
1,42 |
-0,18 |
-0,37 |
-8,61 |
-1,79 |
0,546/ |
|
PM 3 |
1,44 |
-0,16 |
-0,40 |
-8,11 |
-2,62 |
22 |
|
|
5, 4 + О |
MNDO |
1,42 |
-0,18 |
-1,33 |
-8,20 |
-2,28 |
0,612/ |
|
PM 3 |
1,44 |
-0,16 |
0,09 |
-7,66 |
-3,14 |
26 |
|
|
6, 3 + О |
MNDO |
1,42 |
-0,18 |
-3,24 |
-8,48 |
-2,02 |
0,619/ |
|
PM 3 |
1,44 |
-0,16 |
-3,16 |
-7,82 |
-2,79 |
19 |
|
|
6, 5 + O |
MNDO |
1,42 |
-0,19 |
-2,09 |
-8,15 |
-2,28 |
0,744/ |
|
PM 3 |
1,44 |
-0,17 |
-2,55 |
-7,55 |
-3,26 |
27 |
|
|
7, 4 + O |
MNDO |
1,42 |
-0,19 |
-3,00 |
-8,08 |
-2,38 |
0,752/ |
|
PM 3 |
1,44 |
-0,17 |
-3,03 |
-7,74 |
-3,02 |
21 |
|
|
7, 5 + O |
MNDO |
1,42 |
-0,19 |
-3,63 |
-8,25 |
-2,09 |
0,814/ |
|
PM 3 |
1,44 |
-0,17 |
0,96 |
-7,69 |
-3,00 |
25 |
|
|
7, 6 + O |
MNDO |
1,42 |
-0,20 |
-2,69 |
-8,09 |
-2,29 |
0,879/ |
|
PM 3 |
1,44 |
-0,18 |
1,37 |
-7,46 |
-3,32 |
27 |
Примечание. * В единицах элементарного заряда.
Случай адсорбции триплетного атома кислорода отличается от синглетного численным значением энергии адсорбции. Характер кривой зависимости энергии образовавшейся связи от диаметра УНТ аналогичен случаю синглетного кислорода. Оптимальные диаметры хиральных на- нотрубок, на которые атом кислорода адсорбируется наиболее эффективно, те же, что для случая синглетного кислорода – (5, 2), (5, 3), (6, 3), (7, 4) и (7, 5), а для УНТ (5, 4), (6, 5) и (7, 6) процессы оксидирования также энергетически менее выгодны (рис. 3, б).
Исследованный хиральный адсорбционный эффект можно использовать для повышения эффективности существующих химических сенсоров [6] на базе углеродных нанотрубок, направленных на регистрацию рассмотренных в работе частиц и соединений на их основе.
-10 3
-2
-3
-4
-5
-6
-7
-8
атом кислорода S=0
0,5 0,7 0,9 1,1
б)
Рис. 2. Зависимость энергии адсорбции (эВ) ахиральной УНТ с адатомом кислорода от диаметра (нм):
-
а) синглетное состояние; б) триплетное состояние
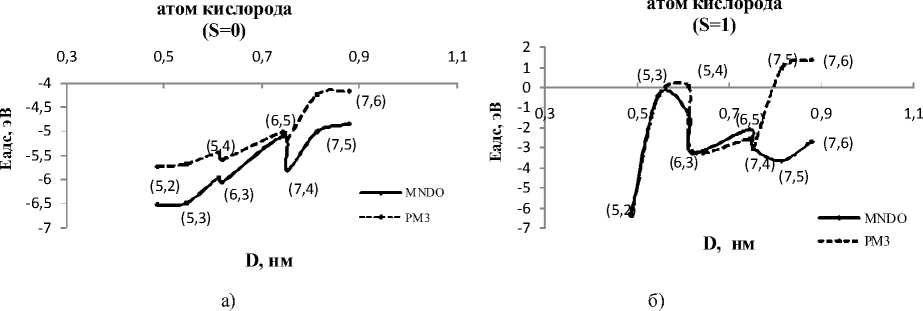
Рис. 3. Зависимость энергии адсорбции (эВ) хиральной УНТ с адатомом кислорода от диаметра (нм): а) синглетное состояние; б) триплетное состояние
Заключение
В заключении сформулируем основные выводы по данной работе:
-
1. Изучен эффект адсорбции двухвалентного атома кислорода на поверхности последовательного ряда углеродных нанотрубок. Показана зависимость энергетических характеристик процесса адсорбции от геометрической структуры УНТ.
-
2. Предсказан хиральный эффект адсорбции двухвалентных атомов кислорода на поверхности УНТ.
-
3. Адсорбционные свойства углеродных нанотрубок, хиральный адсорбционный эффект позволяют прогнозировать применение проводящих углеродных нанотрубок в качестве наиболее эффективных адсорбентов в устройствах химических сенсоров.
Список литературы Хиральный эффект адсорбции атомарного кислорода на поверхности углеродных нанотрубок
- Гевко, П.Н. Влияние отжига на оптические спектры поглощения одностенных углеродных нанотрубок/П.Н. Гевко, А.В. Окотруб, Л.Г. Булушева//ФТТ. -2006. -Т. 48. -С. 755-759.
- Кларк, Т. Компьютерная химия/Т. Кларк. -М.: Мир, 1990. -383 с.
- Степанов, Н.Ф. Квантовая механика и квантовая химия/Н.Ф. Степанов. -М.: Мир, 2001. -519 с.
- Шамина, Е.Н. Изменение физических свойств углеродных нанотрубок, обусловленное поверхностной адсорбцией атомов и простых молекул/Е.Н. Шамина, Н.Г. Лебедев//Научно-технические ведомости СПбГПУ Серия «Физико-математические науки». -2009. -№ 2 (77). -С. 99-104.
- Шамина, Е.Н. Хиральный эффект адсорбции одновалентных атомов и двухатомных молекул на поверхности углеродных нанотрубок/Е.Н. Шамина, Н.Г. Лебедев//Журн. хим. физ. -2012. -Т. 31, № 5. -С. 73-80.
- Эггинс, Б. Химические и биологические сенсоры/Б. Эггинс. -М.: Техносфера, 2005. -336 с.
- Collins, P.G. Extreme oxygen sensitivity of electronic properties of carbon nanotubes/P.G. Collins, K. Bradley, M. Ishigami, A. Zettl//Science. -2000. -№ 287. -P. 1801-1804.
- Hassanien, A. Selective etching of metallic single-wall carbon nanotubes with hyrogen plasma/A. Hassanien, M. Tokumoto, P. Umek [et al.]//Nanotechnology. -2005. -V. 16. -P. 278-281.
- Lebedev, N.G. Hiral effects of single wall carbon nanotube fluorination and hydrogenation/N.G. Lebedev, I.V. Zaporotskova, L.A. Chernozatonskii//Fullerenes, nanotubes and carbon nanostructures. -2004. -V. 12, № 1. -P. 443-448.
- Lebedev, N.G. Hiral effects of single-wall carbon nanotube fluorination and hydrogenation/N.G. Lebedev, I.V. Zaporotskova, L.A. Chernozatonskii//Int. Journ. Quant. Chem. -2004. -V. 100, № 4. -P. 548-558.


