Хирургические аспекты лапароскопической резекции почки при новообразованиях в области ее ворот
Автор: Сергеев В.П., Галлямов Э.А., Мартов А.Г., Кочкин А.Д., Кызласов П.С.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Онкоурология
Статья в выпуске: 2 т.18, 2025 года.
Бесплатный доступ
Резекция почки (РП) как хирургическая технология получила особенно широкое распространение в 2000 годы, когда многочисленными исследованиями была показана онкологическая адекватность вмешательства [1-3]. В лечении новообразований почек РП постепенно стала доминирующим вмешательством, потеснив радикальную нефрэктомию (РН) в сегменте опухолевых изменений радиологически и клинически определяемых как Т1-2. В Российских клинических рекомендациях (КР) наличие опухолевого очага (новообразования), размер и локализация которого позволяют выполнить органосохраняющую операцию, рассматривается как показание к РП [4, 5]. Для остальных случаев методом выбора лечения клинически локализованного почечно-клеточного рака (ПКР) является РН [1, 6, 7]. Таким образом, в случаях сложного для резекции расположения опухоли может быть принято решение о РН. Одной из таких локализаций является расположение опухоли в воротах почки с интимным прилежанием к ветвям почечной артерии и притокам почечной вены, лоханке и чашечкам почки. Для оценки сложности предстоящей РП и риска развития осложнений валидировано множество нефрометрических шкал [8, 9]. Одной из наиболее востребованных в клинической практике является шкала R.E.N.A.L., основой которой как раз служат размер и локализация опухолевого узла. Вместе с тем значимая часть новообразований в почках имеет доброкачественную природу, что нередко верифицируется патоморфологом при изучении удаленного органа, а не его фрагмента с опухолью [10]. В актуальных КР допустимые методики выполнения операции по виду доступа определены как открытые и эндоскопические. Лапароскопический доступ также, как и сама РП, получил все большее распространение. Публикации о лапароскопических резекциях при такой локализации чаще представлены описанием либо клинических случаев, либо сравнением серий открытых и роботических операций [11, 12]. Представляет интерес адаптация приемов и возможностей классической малоинвазивной хирургии для решения непростого вопроса выполнения «сложной» РП при опухоли в области ее ворот. Цель: оценить эффективность предложенного технического регламента выполнения лапароскопической резекции почки (ЛРП) при новообразованиях в области ее ворот.
Лапароскопическая резекция почки, опухоль ворот почки, рак почки, ворота почки
Короткий адрес: https://sciup.org/142245359
IDR: 142245359 | DOI: 10.29188/2222-8543-2025-18-2-46-53
Текст научной статьи Хирургические аспекты лапароскопической резекции почки при новообразованиях в области ее ворот
экспериментальная и клиническая урология № 2 2025
Резекция почки (РП) как хирургическая технология получила особенно широкое распространение в 2000 годы, когда многочисленными исследованиями была показана онкологическая адекватность вмешательства [1-3]. В лечении новообразований почек РП постепенно стала доминирующим вмешательством, потеснив радикальную нефрэктомию (РН) в сегменте опухолевых изменений радиологически и клинически определяемых как Т1-2. В Российских клинических рекомендациях (КР) наличие опухолевого очага (новообразования), размер и локализация которого позволяют выполнить органосохраняющую операцию, рассматривается как показание к РП [4, 5]. Для остальных случаев методом выбора лечения клинически локализованного почечно-клеточного рака (ПКР) является РН [1, 6, 7]. Таким образом, в случаях сложного для резекции расположения опухоли может быть принято решение о РН. Одной из таких локализаций является расположение опухоли в воротах почки с интимным прилежанием к ветвям почечной артерии и притокам почечной вены, лоханке и чашеч кам почки. Для оценки сложности предстоящей РП и риска развития осложнений валидировано множество нефрометрических шкал [8, 9]. Одной из наиболее вос требованных в клинической практике является шкала R.E.N.A.L., основой которой как раз служат размер и локализация опухолевого узла.
Вместе с тем значимая часть новообразований в почках имеет доброкачественную природу, что нередко верифицируется патоморфологом при изучении удаленного органа, а не его фрагмента с опухолью [10]. В актуальных КР допустимые методики выполнения операции по виду доступа определены как открытые и эндоскопические. Лапароскопический доступ также, как и сама РП, получил все большее распространение. Публикации о лапароскопических резекциях при такой локализации чаще представлены описанием либо клинических случаев, либо сравнением серий открытых и роботических операций [11, 12]. Представляет интерес адаптация приемов и возможностей классической малоинвазивной хирургии для решения непростого вопроса выполнения «сложной» РП при опухоли в области ее ворот.
Цель: оценить эффективность предложенного технического регламента выполнения лапароскопиче ской резекции почки (ЛРП) при новообразованиях в области ее ворот.
МАТЕРИАЛЫ И МЕТОДЫ
За период с ноября 2015 по август 2021 гг. в ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России было проведено 638 лапароскопических операций при обра зованиях почки, из них 358 (56,1%) ЛРП.
Критерии включения: пациенты с новообразова ниями ворот почки (все значения R.E.N.A.L.) или па ренхимы почки с экзофитным кортикальным компонентом и значениями R.E.N.A.L.>7.
Критерии исключения: интраренальные или мно жественные новообразования; резекция аномальной или единственной почки; выполнение ЛРП в рамках сочетанной операции.
Основную группу исследования («ГИ») составили пациенты с новообразованиями в области ворот почки, а группу сравнения («ГС») – все остальные па циенты. Резекция почки с опухолью, имеющей экзо фитную часть,проводилась с использованием общепринятой техники. Резекция почки с опухолью в обла сти ее ворот выполнялась по определенному алго ритму – «Техническому регламенту резекции почки в ее воротах». Хирургический регламент выполнения операции состоял из девяти этапов (рис. 1):
-
1. Хирургический доступ в забрюшинное про странство.
-
2. Обеспечение сосудистого контроля в воротах почки.
-
3. Мобилизация почки, создание экспозиции для выполнения резекции.
-
4. Диссекция сосудистых структур и лоханки почки от экзофитной части патологического образования.
-
5. Размещение в брюшной полости обеспечитель ных материалов для выполнения аблативного и гемо статического этапа.
-
6. Выключение почечного кровотока.
-
7. Этап резекции паренхимы почки с опухолевым узлом.
-
8. Окончательный гемостаз и герметизация ча шечно-лоханочной системы (ЧЛС).
-
9. Дренирование области операции.
-
1-3: Использование субмодальности доступа – внебрюшинного или трансмезентериального (при опухоли левой почки), позволяет избежать полной мобилизации и необходимости ротации органа, а также сократить время до экспозиции сосудов ворот почки и опухолевого узла.
-
2-4: Мобилизация почечной артерии и притоков почечной вены – облигатная процедура, которая имеет своей целью не только подготовку к ишемии, но и выделение экзофитной части опухоли, прилежащей к трубчатым структурам ворот почки.
6-8: Ишемия почки, как правило, проводится «по требованию»,что позволяет часть операций провести без почечной аноксии и ушивания пострезекционной раны. Лигатурный гемостаз выполняется с использо трансперитонеальный
Технический
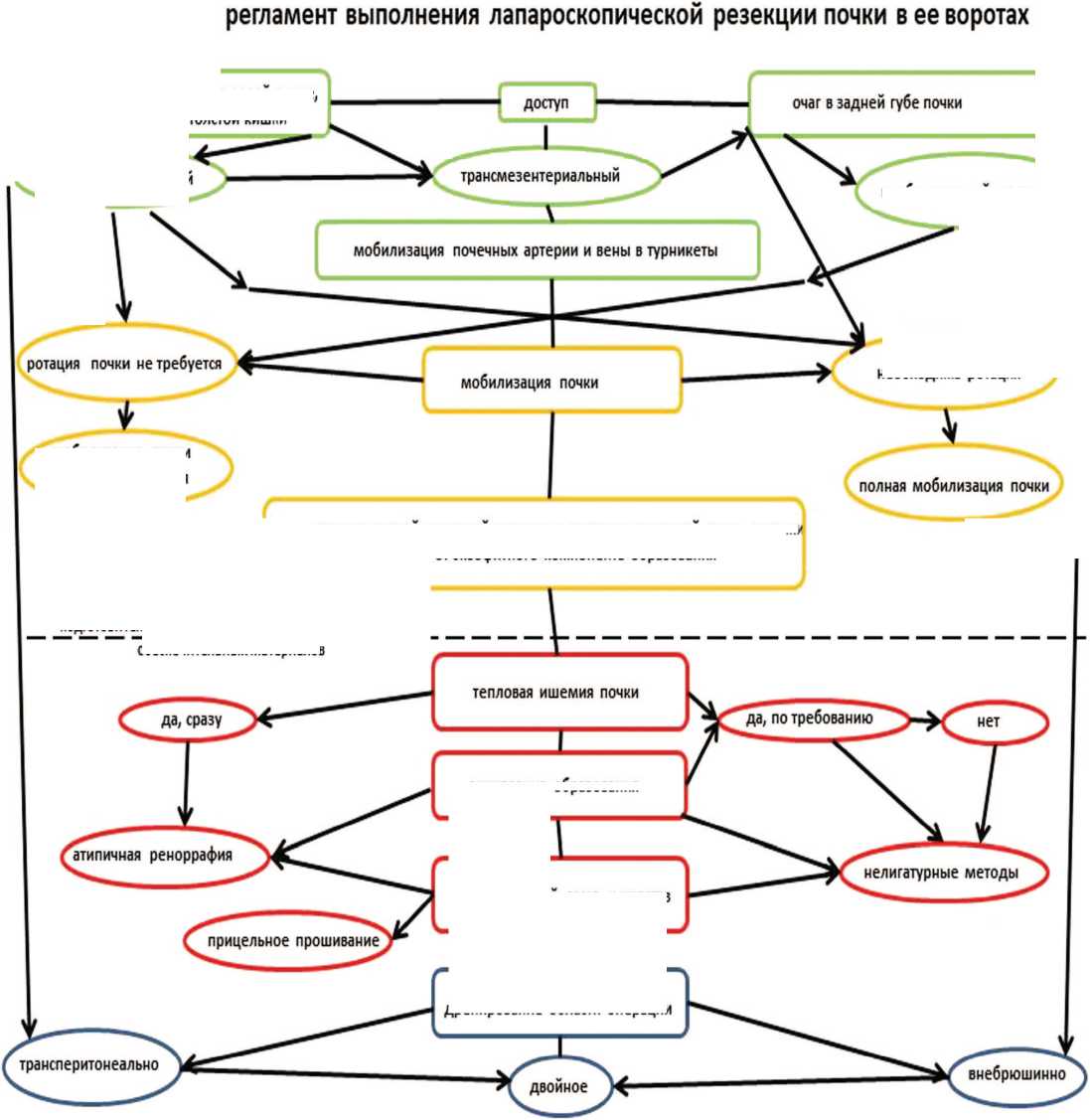
подготовительный этап; введение в брюшную полость обеспечительных материалов
Рис. 1. Технический регламент лапароскопической резекции почки в ее воротах
Fig. 1. Technical regulations of laparoscopic partial nephrectomy at the renal hilum
очаг в передней губе почки, в левой почке, «высокий» левый изгиб толстой кишки
внебрюшинный доступ
необходима ротация
мобилизация почки вокруг образования
диссекция ветвей почечной артерии и притоков почечной вены, лоханки почки от экзофитного компонента образования
энуклеация образования
окончательный гемо- и уростаз
дренирование области операции
ванием приемов прицельного прошивания,коагуля ции или клипирования питающих опухоль сосудов и атипичной ренораффии.
-
9: Решение о необходимости дренирования послеоперационной области.
Критериям включения соответствовали 166 человек. Общая характеристика групп исследования и сравнения приведена в таблице 1.
«ГИ» составили 44 пациента,группа сравнения «ГС» сформирована из 122 пациентов. «ГС» сопоставимы с «ГИ» по всем критериям, кроме двух (табл. 1). Индекс R.E.N.A.L. в «ГИ» был достоверно выше: 9,4 против 8,6, а индекс массы тела – ниже ( р <0,05 для всех). Расположение опухоли в воротах почки при нефрометрии по шкале R.E.N.A.L. дает максимальное количество баллов,поэтому различие по первому параметру с одной стороны закономерно, с другой – явилось основой для сравнительного анализа. Индекс массы тела пациентов не повлиял на полученные результаты. Производили сравнение результатов по времени операции, ишемии, доступу к почке, характеру гемостаза, объему кровопотери, доле осложнений, продолжительности госпитализации, патоморфологи-ческому статусу опухоли. Статистическая обработка данных производилась при помощи программы IBM SPSS (США), версии 26.0.
РЕЗУЛЬТАТЫ
Конверсии доступа, перехода ЛРП в нефрэкто мию,интраоперационных осложнений и гемотранс фузий в обеих группах не было. В большинстве случаев ЛРП была проведена на фоне тепловой ише мии, время которой составило около 17 минут. Хирур гический край резекции был негативным во всех случаях. Послеоперационные осложнения отмечены в 6,0% у 10 пациентов. При морфологическом исследо вании у 15 (9,0%) пациентов верифицировано добро качественное новообразование (ДНО). Медианное значение послеоперационного койко-дня – пять. Дан ные межгруппового сравнительного анализа пред ставлены в таблице 2.
Статистически значимые отличия между груп пами отмечены по трем категориям. Первое: у паци ентов «ГИ» внебрюшинный и трансмезентериальный доступ использовались чаще: 6,8% против 3,3% и 31,6% против 6,8%, соответственно ( р =0,025). Второе отличие:практически каждую третью резекцию в во ротах ложе удаленной опухоли не ушивали: приме нялся нелигатурный способ гемостаза (клипирование или электрокоагуляция таргетных сосудов и (или) ап пликация гемостатических материалов). В «ГС» рана почки закрывалась лигатурными швами в 91,8%
Таблица 1. Общая характеристика больных
Table 1. General characteristics of patients
|
Признак Sign |
ГИ SG |
ГС CG |
p |
|
Количество пациентов, n Number of patients, n |
44 |
122 |
– |
|
Мужчины, n (%) Male, n (%) |
25 (56,8%) |
86 (70,5%) |
0,099 |
|
Женщины, n (%) Female, n (%) |
19 (43,2%) |
36 (29,5%) |
0,09911 |
|
Возраст, годы* Age, years* |
57,5±12,2 () |
57,1±11,6 () |
0,889 |
|
Индекс массы тела, кг/м2* Body mass index, kg/m2* |
28,1±5,2 () |
30,2±5,1 () |
0,008 |
|
Локализация опухоли справа, n (%) Tumor localization on the right, n (%) |
25 (56,8%) |
63 (51,6) |
0,555 |
|
Локализация опухоли слева, n (%) Tumor localization on the left, n (%) |
19 (43,2%) |
59 (48,4%) |
|
|
Диаметр опухоли, мм** Tumor diameter, mm** |
42,0 [29,3; 50,8] (7-80) |
38,0 [31,0; 48] (12-90) |
0,853 |
|
Индекс R.E.N.A.L. R.E.N.A.L. score index |
9,4±1,31 |
8,6±1,2 |
<0,001 |
Таблица 2. Межгрупповой сравнительный анализ периоперационных результатов
Table 2. Intergroup comparative analysis of perioperative outcomes
|
Признак Sign |
ГИ SG |
ГС CG |
p |
|
Длительность операции, мин** Operation time, min** |
137,5 [105; 175] |
142,5 [110; 171,3] |
0,668 |
|
ꜛ Трансперитонеально, n (%) Transperitoneal, n (%) |
35 (79,5%) |
114 (93,4%) |
0,025 |
|
ꜛ Экстраперитонеально, n (%) Extraperitoneally, n (%) |
3 (6,8%) |
4 (3,3%) |
|
|
ꜛ Слева трансмезентериально, n (%) Transmesocolic left, n (%) |
6 (31,6%) |
4 (6,8%) |
|
|
Объем кровопотери, мл** Volume of blood loss, ml** |
100 [100; 200] |
100,0 [100; 200] |
0,656 |
|
Гемоглобин до операции, г/л* Hemoglobin before surgery,g/l* |
141,7±15,3 |
145,7±14,3 |
0,554 |
|
Гемоглобин после операции, г/л* Hemoglobin after surgery, g/l* |
127,1±12,6 |
127,7±14,0 |
|
|
Тепловая ишемия, n (%) Warm ischemia, n (%) |
34 (77,3,8%) |
98 (80,3%) |
0,667 |
|
Время ишемии, мин* Ischemia time, min* |
17,0 [10; 23,8] |
15,5 [10; 22,0] |
0,532 |
|
Без ишемии, n (%) Zero ischemia, n (%) |
10 (22,7%) |
24 (19,7%) |
0,667 |
|
Нефроррафия, n (%) Nephrorrhea, n (%) |
32 (72,7%) |
112 (91,8%) |
0,001 |
|
Без нефроррафии, n (%) Without nephrorrhea, n (%) |
12 (27,3%) |
10 (8,2%) |
|
|
Послеоперационные осложнения, n (%) Postoperative complications, n (%) |
3 (6,8%) |
7 (5,7%) |
0,796 |
|
Сроки лечения после операции, дни ** Postoperative hospital stay, day** |
5,0 [4,0; 5,8] |
5,0 [4,0; 7,0] |
0,186 |
|
Морфология «ДНО», n (%) Вenign neoplasms, n (%) |
9 (20,5%) |
6 (4,9%) |
0,002 |
|
Морфология «ЗНО», n (%) Мalignant neoplasms, n (%) |
35 (79,5%) |
116 (95,1%) |
( р =0,001). Третий признак значимого различия – у 20,5% пациентов, которым проведена лапароскопическая резекция в воротах почки, морфологически было подтверждено наличие ДНО,тогда как в «ГС» этот показатель составил 4,9% ( р =0,002). Иллюстрацией использования технического регламента служит клинический пример.
Клинический случай
Пациент С. 46 лет , ИМТ 26,31 кг/м2. В левой почке выявлено солидное васкуляризованное образование размером 42 мм. Опухоль расположена по передней поверхности почки в области ворот, в непосредственной близости от лоханки, почечной вены, артерии и ее ветвей и хорошо контурирует через мезоколон (рис. 2).
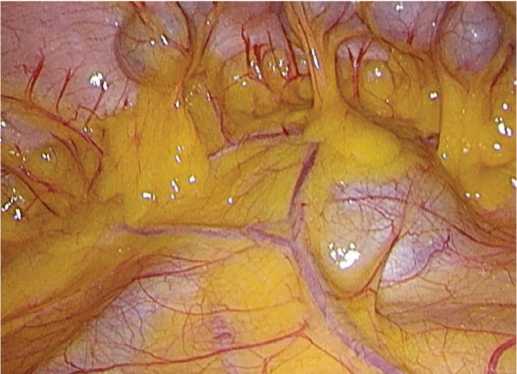
Рис. 2. Опухоль в области ворот левой почки пролабирует через мезоколон
Fig. 2. Tumor of the left renal hilum prolapses through the mesocolon
Персонифицированный план операции: трансме зентериальный доступ к почке, энуклеация опухоле вого узла,проведение тепловой ишемии «по требованию» и вероятное использование техники гемостаза без ушивания раны почки. Операция проведена через «окно» в брыжейке толстой кишки (рис. 3), с прицель ной коагуляцией сосудов (рис. 4), без ишемии почки и ушивания ее раны и завершена тампонадой раневой поверхности гемостатиком (рис. 5).
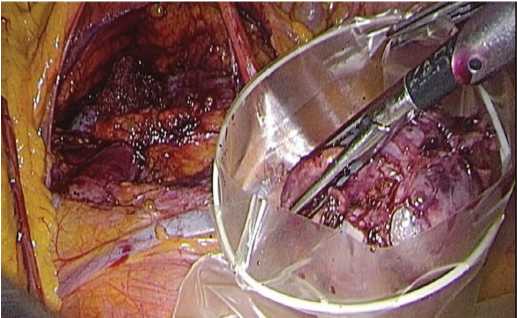
Рис. 3. Опухоль удалена через окно в брыжейке толстой кишки и помещена в контейнер
Fig. 3. The tumor was removed through a window in the mesentery of the colon and placed in an endobag
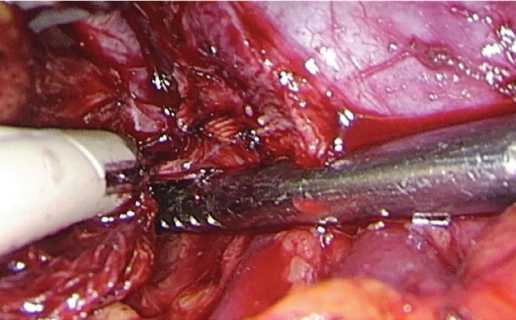
Рис. 4. Прицельная биполярная коагуляция таргетного сосуда в глубине раны почки
Fig. 4. Targeted bipolar coagulation of the target vessel in the depth of the kidney wound
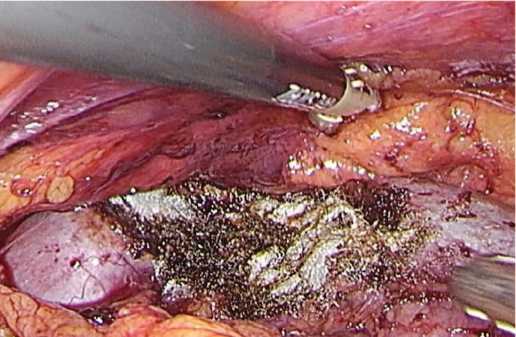
Рис. 5. Окончательный гемостаз завершен тампонадой раны почки гемостатиком
Fig. 5. Final hemostasis is completed by tamponade of the kidney wound with a hemostatic agent
Кровопотеря составила 30 мл. Продолжитель ность операции – 170 минут. Выписка на 2 сутки после операции. Патоморфология: светлоклеточная по чечно-клеточная карцинома, в крае резекции без опу холевого роста.
ОБСУЖДЕНИЕ
Результаты применения ЛРП как хирургической процедуры активно изучаются в последнее десятилетие. Проводится оценка периоперационных данных, мор-бидности вмешательства, использования разнообразных технологий оперативного доступа (диссекции, ишемии почки, гемостаза), онкологических результатов. Продолжительность операции, уровень кровопотери, доля осложнений, степень нарушения почечной функции несколько разнятся от серии к серии, но все говорит о приемлемости малоинвазивного доступа для решения онкологической и функциональных задач операции.
Для оценки сложности предстоящей РП и риска развития осложнений валидировано множество неф рометрических шкал [8, 9]. Сама по себе нефрометрия не является сугубо онкологическим инструментом, а оценивает сложность и риск резекции любого ново образования почки. Например, по шкале R.E.N.A.L. опухоли ворот почки при одинаковом размере имеют более высокую степень сложности резекции.Основой этому служит расположение очага внутри полярных линий и предельная близость к структурам синуса почки. Именно эти особенности в ряде случаев служат поводом для уролога принять решение об органоуно сящем лечении – нефрэктомии.С этим отчасти свя зано то,что к оперативному лечению опухоли ворот почки,тем более с использованием приемов классиче ской лапароскопии, сохраняется настороженное отно шение. В некоторых исследованиях было показано, что опухоль ворот почки есть фактор риска повышения стадии cT1 → pT3a, что служит ограничением для РП [13, 14]. Например, в исследовании Andres F Correa и соавт. при оценке результатов лечения 1324 пациентов с опухолями почки нефронсберегающие процедуры проводились достоверно реже при опухоли ворот почки (73,0% против 85,3%, p<0,01). При этом следует отметить, что доля доброкачественных образований в области ворот достигала 13,9% в когорте пациентов, которым выполнена не только резекция почки,но и радикальная нефрэктомия.При обзоре факторов по вышения стадии инвазия в околопочечный жир была значительно выше в опухолях вне ворот почки, тогда как инвазия в клетчатку синуса была сопоставима между двумя локализациями [10]. Таким образом, дан ные о большей злокачественности опухоли централь ной локализации не получают достаточного подтверждения. В нашем исследовании в «ГИ» у 20,5% пациен тов по результатам патоморфологии операционного материала верифицированы доброкачественные обра-зования.Субъективная оценка хирургом такой клинической ситуации и опухоли как нерезектабельной могла быть дополнена объективно высоким баллом нефрометрической шкалы.Это прямой путь к радикальной нефрэктомии.Если вернуться к периоперационным показателям, то при сложном расположении опухоли, большем размере и времени операции риск интраоперационных осложнений во время резекции не был выше для опухолей ворот, чем для другого расположения в почке [15].
С 2015 г. мы применяем приемы конвенциональной лапароскопии как взаимно обусловленную последовательность действий на линии от доступа к почке до установки дренажа. Эта последовательность составляет своеобразный регламент, следуя которому можно рассчитывать на достижение оптимального результата у этой категории больных хирургами не только экспертного центра. Так, возможность выполнения подобной сложной ЛРП начинается с умения обеспечить адекватное удаление опухоли и достижение гемо- и уростаза в ране почки в приемлемом диапазоне времени операции, ишемии и осложнений. Применение вариантов доступа – внебрюшинного или трансмезентериального (при опухоли левой почки), позволило у части пациентов избежать обширной или полной мобилизации органа и сократить время до начала аблативного этапа [16]. Это параметр, по которому достигнуто достоверное различие между группами. Пациенты «ГИ» с новообразованиями левой почки оперированы трансмезентериально чаще, чем в «ГС» (31,6% против 6,8%), при этом время операции было сопоставимым при более сложном уровне ЛРП по R.E.N.A.L.
Контроль гемостаза напрямую связан с выбором метода ишемии. Если в вопросе длительности ишемии имеется консенсус, то в ее обязательности и способах выполнения единства не достигнуто [9]. В нашей серии операций в «ГИ» ишемия почки,как правило, проводилась «по требованию»,что позволило почти в четверти случаев (22,7%) провести операцию без по чечной аноксии и ушивания пострезекционной раны. Эффективность этого подхода подчеркивает как сравнение медианного объема кровопотери,показа тели которого были идентичны в группах, так и отсут ствие различий уровня гемоглобина после операции. Гемостаз выполнялся с использованием приемов при цельного прошивания или коагуляции/клипирования питающих опухоль сосудов и атипичной ренораффии: эти приемы использовались в 2 раза чаще в «ГИ» в сравнении с «КГ».
ЗАКЛЮЧЕНИЕ
Сравнительный анализ по базовым периопера ционным показателям, отражающими травматич ность вмешательства: времени операции, ишемии, кровопотере, осложнениям, снижения уровня гемо глобина – показал отсутствие значимых различий в группах. Тогда как «технологические» параметры (до ступ к почке и способ гемостаза) имели существен ную разницу, с которой, вероятно, и связано третье важное отличие.Каждый пятый пациент «ГИ» имел ДНО и получил возможность сохранить почку вместо нефрэктомии. Объединение последовательности хи рургических действий логикой и выбором оптималь ной экспозиции, бережной мобилизации сосудов, энуклеации основной части опухолевого узла, прие мов нелигатурного гемостаза в регламент позволяет обеспечить принципиальную возможность доста точно безопасного выполнения лапароскопической резекции при образованиях почечных ворот.
ЛНТЕРАТУРА/REFERENGES
ПТШТУРАШШПШ
Сведения об авторах:
Сергеев В.П. – ассистент кафедры урологии и андрологии МБУ ИНО ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, заведующий онкоурологическим отделением Центра урологии и андрологии ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России; Москва, Россия; РИНЦ Author ID 924911;
Галлямов Э.А. – д.м.н., профессор, заведующий кафедрой общей хирургии Первого МГМУ им. И.М. Сеченова; Москва, Россия; РИНЦ Author ID 851478;
Мартов А.Г. – д.м.н., профессор, член-корреспондент РАН, заведующий кафедрой урологии и андрологии МБУ ИНО ФГБУ ГНЦ ФМБЦ им. А.И. Бурназяна ФМБА России, ведущий научный сотрудник отдела урологии и андрологии МНОЦ МГУ им. М.В. Ломоносова, директор урологического центра ФБУ «ЦКБ Гражданской Авиации»; Москва, Россия; РИНЦ Author ID 788667;
Кочкин А.Д. – д.м.н., заведующий кафедрой урологии ФДПО ФГБОУ ВО «Приволжский медицинский исследовательский университет» Минздрава России, врач-уролог отделения урологии ЧУЗ «КБ «РЖД-Медицина»; Нижний Новгород, Россия;
РИНЦ Author ID 526782; Х
Кызласов П.С. – д.м.н, профессор, руководитель Центра урологии и андрологии ФМБЦ ГНЦ имени А.И. Бурназяна ФМБА России, Главный внештатный уролог ФМБА; Москва, Россия; РИНЦ Author ID 615093;
Вклад авторов:
Сергеев В.П. – обобщение анализа собранных данных, концепция и дизайн исследования, написание рукописи, 30%
Галлямов Э.А. – концепция и дизайн исследования, 20%
Мартов А.Г. – научное редактирование рукописи, 15%
Кочкин А.Д. – литературный обзор, написание рукописи, 20%
Кызласов П.С. – научное редактирование рукописи, 15%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Статья подготовлена без финансовой поддержки.
Статья поступила: 17.01.25
Результаты рецензирования: 24.03.25
Исправления получены: 17.04.25
Information about authors:
Sergeev V.P. – assistant at the department of urology and Andrology of the A.I. Burnazyan Federal Medico-Biological Agency of Russia, head of oncourology department of the center of urology and andrology Andrology of the A.I. Burnazyan Federal Medico-Biological Agency of Russia; Moscow, Russia; RSCI Author ID 924911;
A.I. Burnazyan Federal Medico-Biological Agency of Russia; Moscow, Russia;
RSCI Author ID 615093;


