Хирургическое лечение больных пороком аортального клапана в сочетании с расширением восходящей аорты менее 5 см (обзор литературы)
Автор: Белов Ю.В., Рыбаков К.Н., Губарев И.А., Салех А.З., Фролов К.Б., Винокуров И.А.
Журнал: Московский хирургический журнал @mossj
Статья в выпуске: 5 (69), 2019 года.
Бесплатный доступ
Аневризмы восходящей аорты относятся к тяжелым заболеваниям сердечно-сосудистой системы с неблагоприятным прогнозом при их «естественном» течении и отсутствии адекватного хирургического лечения. Изолированные аневризмы восходящей аорты встречаются довольно редко, в большинстве своем, они сочетаются с патологией клапанного аппарата сердца, чаще с патологией аортального клапана. Если при аневризме восходящей аорты и пороке аортального клапана у большинства кардиохирургов не возникает сомнений по поводу их протезирования клапансодержащим кондуитом по методике Бенталла - Де Боно или же раздельного протезирования аортального клапана и восходящей аорты, то при пограничных эктазиях аорты до 5 см до сих пор возникают многочисленные дискуссии по поводу методики хирургического лечения. Вопрос показаний к хирургическому лечению у больных с размером корня и восходящей аорты до 5 см освещен в современной литературе недостаточно и требует дальнейшего изучения.
Стеноз аортального клапана, аневризма восходящей аорты, хирургия, протезирование восходящей аорты и аортального клапана
Короткий адрес: https://sciup.org/142224449
IDR: 142224449 | УДК: 617-089.844 | DOI: 10.17238/issn2072-3180.2019.5.38-45
Текст обзорной статьи Хирургическое лечение больных пороком аортального клапана в сочетании с расширением восходящей аорты менее 5 см (обзор литературы)
Аневризмы восходящей аорты (АВА) относятся к тяжелым заболеваниям сердечно-сосудистой системы с неблагоприятным прогнозом при их «естественном» течении и отсутствии адекватного хирургического лечения [1-4]. Зачастую, у больных АВА диагностируется сопутствующее поражение аортального клапана (АК) в виде его недостаточности, что, в свою очередь, значительно усугубляет тяжесть основного заболевания, и, как следствие, увеличивает риск развития различных осложнений, вплоть до фатальных [5-10].
Первые сообщения об аневризмах грудной части аорты датированы XVI веком нашей эры. Так, фламандский хирург Vesalius в 1555 году впервые диагностировал абдоминальную аневризму и описал грудную и брюшную аневризмы аорты, а в 1557 году сообщил о мешковидной посттравматической аневризме грудной аорты [11]. В 1581 году Фернель описал сифилитическую аневризму грудной аорты [12]. В 30-50-х годах 20 века появились научные работы, свидетельствующие о связи аневризм аорты (АА) с врожденными заболеваниями сердечно-сосудистой системы. Так, Абботт в 1927 году впервые в своей работе обратил внимание на более высокую частоту встречаемости АА у пациентов с двустворчатым аортальным клапаном. Первое упоминание о расслаивающей АА у больного с синдромом Марфана было сделано Хелен Тоссиг, хотя до 1943 года синдром Марфана не связывали с аневризмами или расслоением аорты [13]. Данные о влиянии соединительнотканных дисплазий у больных с врожденными заболеваниями сердечно-сосудистой системы на развитие АА в значительной мере облегчили диагностику и лечение этой группы пациентов. Впервые в мире успешная резекция аневризмы грудного отдела аорты с протезированием была выполнена в 1953 г. М. DeBakey, D. Cooley. Успешную операцию раздельного протезирования АК и восходящей части аорты впервые в мире выполнил R. Wheat в 1964 году [14]. В дальнейшем М. Bentall (1968), J. Edwards (1974) и С. Cabrol (1981) в случаях вовлечения в патологический процесс фиброзного кольца, синусов Вальсальвы и устьев коронарных артерий, предложили различные модификации одновременного протезирования аортального клапана (ПАК) и восходящей аорты (ВА) клапаносодержащим «кондуитом» с реимплантацией коронарных артерий [15, 16]. Родоначальником резидуальной аортопластики и экзопротезирования аорты признан Francis Robicsek. Суть ее заключалась в иссечении расширенной части ВА с последующим экзопротезированием дакроновым протезом [17-21]. Также большой вклад в развитии резидуальной аортопластики и хирургии ВА внес Bauer M, который работал над проблемой пластики ВА при двухстворчатом аортальном клапане [22, 23]. В России первую успешную операцию резекции посттравматической аневризмы грудной части аорты в условиях искусственного кровообращения (ИК) выполнил М.И. Аничков 17 апреля 1962 года. 28 декабря того же года А.В. Покровский выполнил успешную резекцию мешковидной аневризмы восходящей аорты (АВА) с наложением краевого шва в условиях ИК. Первую успешную операцию при расслоении ВА в России выполнил Б.В. Петровский в 1964 г. Первые в России успешные операции супракоронарной резекции АВА с раздельным ее протезированием и протезированием АК при синдроме Марфана выполнил Г. И. Цукерман в 1973 году, а операции по методике Бентала и Каброля в 1978 и 1983 гг [24]. На сегодняшний день в России наибольшим опытом в хирургии АВА обладает академик РАН Белов Ю.В.
Современная классификация АВА Ю.В. Белова (1998) включает в себя (Рисунок 1):
-
1. Анулоаортальные аневризмы, проявляющиеся аневризматическим расширением фиброзного кольца АК, корня аорты и большей части ВА. Чаще всего данные аневризмы раз-
- виваются при соединительно-тканных дисплазиях, таких как синдром Марфана, кистомедионекроз Эрдгейма и др. Данный тип аневризм сочетается тяжелой аортальной недостаточностью (АН);
-
2. Супраанулярные аневризмы, характеризующиеся нормальными размерами фиброзного кольца и расширением остальных структур ВА. Этот тип аневризм может сопровождаться АН;.
-
3. Супракомиссуральные аневризмы, с расширением тубулярного отдела ВА и нормальными размерами корня аорты. Как правило, такие аневризмы возникают при атеросклерозе и стенозе АК. Этот тип аневризм также может сопровождаться АН.
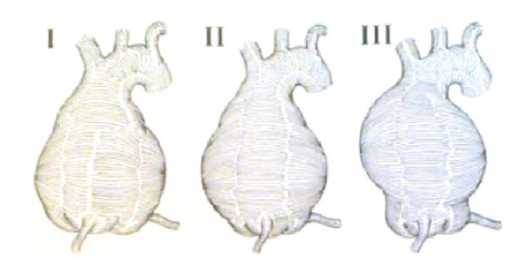
Рис 1 Классификация АВА по Ю.В. Белову (1998)
На сегодняшний день на генетическом уровне выявлено более пятидесяти различных аномалий развития соединительной ткани, которые могут приводить к появлению АВА. Синдром Марфана является наиболее изученным и часто встречающимся синдромом, который может приводить к формированию АА. У 9 из 10 пациентов с синдромом Марфана происходит патологический синтез белка фибриллина. Это приводит к формированию неполноценных микрофибрилл и нарушению связи между пластинами. Эти дефекты заполняются межклеточным веществом, состоящим из мукополисахаридов [25] Синдром Элерса-Данло и другие подобные синдромальные дисплазии проявляются нарушением образования эластина и коллагена, а также деструкции и фрагментации внутренней эластической мембраны. Чаще всего такие заболевания про- являются в молодом возрасте. Идиопатический кистозный медианекроз, наоборот, является наиболее частой причиной аневризматического поражения аорты у людей пожилого возраста. Это дегенеративное заболевание проявляется дегенерацией эластических волокон, повреждением гладкомышечных элементов и появлением мукоидных кист [24].
Изолированные АВА встречаются довольно редко. В большинстве своем, они сочетаются с патологией клапанного аппарата сердца, чаще с патологией АК. В 90% случаев причиной патологии АК является ревматизм, кальциноз и врожденные пороки. Все остальные причины занимают не более 10%. При этом частота развития не ревматических пороков АК в разы превышает частоту ревматических [26].
Так, по мнению Goldstein J.A. (1994), изолированное обызвествление АК – это самая частая причина стеноза АК, которая является показанием к его протезированию у 40% больных в возрасте до 65 лет и у 90% больных в возрасте от 65 до 80 лет [27]. Поэтому немаловажное значение в хирургии АК имеет определение степени его обызвествления. Наиболее распространенной является классификация кальциноза АК, разработанная в НЦССХ им. академика Бакулева А.Н. (Бураковский В.И. 1989) [24]:
-
I – степень: незначительное очаговое обызвествление в толще комиссур или теле створок АК;
-
II – степень: грубое обызвествление створок и комиссур АК без распространения на область прикрепления створок;
-
III – степень: массивное обызвествление АК с переходом на фиброзное кольцо, стенку аорты, выходной отдел левого желудочка, переднюю створку митрального клапана.
В последние годы в отечественной и мировой литературе описывается множество факторов, которые приводят к дегенерации и кальцинозу АК. Среди них нарушение реологических свойств крови, апоптоз эпителиальной выстилки аортальной поверхности клапана, повышенное содержание холестерина в крови, мужской пол, курение, сопутствующие заболевания, такие как артериальная гипертензия и сахарный диабет, нарушения кальций - фосфорного обмена и др. [28-30].
Для определения степени аортальной недостаточности М.А. Иваницкая (1971) разработала классификацию, основанную на введении контрастного препарата в корень аорты [31]:
-
1. 1 степень – небольшое количество контрастного препарата попадает из аорты в левый желудочек в диастолу и выбрасывается обратно в аорту с первой же систолой;
-
2. 2 степень – небольшое количество контрастного препарата попадает из аорты в левый желудочек и сохраняется в нем в течение нескольких сердечных циклов;
-
3. 3 степень – контрастный препарат из аорты попадает в левый желудочек, достигает митрального клапана, скапливается в желудочке и задерживается в нем;
-
4. 4 степень – большое количество контрастного препарата попадает из аорты в левый желудочек, одномоментно заполняя всю его полость и длительно задерживаясь в ней.
Выраженность аортальной недостаточности регистрируется с помощью эхокардиографического метода исследования. Наиболее распространенной в повседневной клинической практике является классификация аортальной регургитации по S. Teague (1990) [32]:
-
1. 1 степень (незначительная) – регургитация регистрируется под створками клапана;
-
2. 2 степень (умеренная) – регургитация регистрируется в пределах выходного тракта левого желудочка;
-
3. 3 степень (средняя) – регургитация выходит за пределы выходного тракта левого желудочка, но не достигает папиллярных мышц;
-
4. 4 степень (выраженная) – регургитация выходит за пределы папиллярных мышц.
Среди классификаций степеней аортального стеноза, в клинической практике часто применяется классификация Белоусова Ю.В., (2003) [33]:
-
1. 1 степень – незначительный стеноз (градиент давления на аортальном клапане до 30 мм рт.ст.);
-
2. 2 степень – умеренный стеноз (градиент давления на аортальном клапане от 30 до 50 мм рт.ст.);
-
3. 3 степень – выраженный стеноз (градиент давления на аортальном клапане от 51 до 80 мм рт.ст.);
-
4. 4 степень – резкий стеноз (градиент давления на аортальном клапане более 80 мм рт.ст.).
Эхокардиография, как метод диагностики недостаточности или стеноза АК, позволяет определить анатомию порока и степень его выраженности, а также выявить сопутствующую кардиальную патологию [34]
Чреспищеводная эхокардиография является незаменимым методом обследования для интраоперационной диагностики. Чувствительность данного метода составляет 95-100%, специфичность 98% [35].
Компьютерная томография с внутривенным введением контрастного вещества является наиболее информативным и точным методом исследования при аневризмах аорты и патологиях АК, однако значимыми недостатками этого метода является невозможность провести одномоментное динамическое исследование, возникновение аллергических реакций на введение контрастного препарата и немалые дозы облучения. Этих недостатков лишен метод магнитно-резонансной томографии, при котором не вводятся контрастные вещества, нет лучевого облучения, есть возможность провести одномоментное динамическое обследование с оценкой функции левого желудочка АК и ВА [36].
В соответствии с современными рекомендациями по ведению пациентов с аневризмой корня и ВА, хирургическое вмешательство рекомендуется проводить пациентам с:
-
• Расширением ВА более 50 мм при наличии семейной формы аневризмы или синдрома дисплазии соединительной ткани;
-
• Расширением ВА более 50 мм при наличии определен-
- ных факторов риска, таких как маленький рост, двустворчатый аортальный клапан, сопутствующие заболевания АК;
-
• Расширением ВА более 55 мм у пациентов без сопутствующих рисков.
Постепенное расширение ВА и изменение размеров корня аорты приводят к возникновению аортальной недостаточности при наличии сохранных створок. В основе формирования АА лежит патология среднего слоя стенки сосуда, однако вопрос патогенеза изменений стенки аорты, лежащий в основе прогрессирования дилатации у больных с АВА, остается нерешенным. Гистологические исследования подтверждают высокий уровень изменений в стенке аорты у больных с большими размерами АВА, но вопрос показаний к хирургическому лечению, степень гистологических изменений стенки аорты у больных с размером корня и ВА до 5 см изучен и освещен в современной литературе недостаточно. Данную когорту пациентов с пограничной дилатацией ВА не выделяют в отдельную группу, что несет в себе высокий риск возникновения осложнений (разрыва или расслоения аорты).
По данным литературы, дилатация проксимального отдела ВА встречается у 30 - 80% больных с пороками АК [37, 38]. Данный факт ставит перед хирургом вопрос о выборе хирургической тактики. С одной стороны, у такой категории больных возможно выполнение изолированного протезирования АК, но с другой, такой подход подвергает больного риску повторных хирургических вмешательств в отдаленном периоде, связанному с аневризматическим расширением или расслоением ВА.
При АА в сочетании с аортальной недостаточностью основной причиной заболевания, по мнению ряда авторов, являются системные заболевания соединительной ткани. В таких случаях, с целью профилактики роста аневризмы и возникновения осложнений, таких как расслоение аорты, протезирование АК необходимо дополнять вмешательством на ВА [39].
По данным мировой литературы, частота развития осложнений со стороны ВА (увеличение диаметра аорты, расслоение, разрыв) после изолированного протезирования аортального клапана (ПАК) достигает 30%, а распространенность расслоений ВА после протезирования АК составляет от 22 до 27% по сравнению с 0,6% случаев при нормальном диаметре ВА [40-44]. Все это диктует необходимость превентивного вмешательства на ВА при ее постстенотическом расширении у пациентов с пороками АК.
В выборе методики хирургического лечения данной патологии учитывается множество факторов: возраст больного и наличие сопутствующей патологии, в том числе патология других клапанов сердца, коарктация аорты, ишемическая болезнь сердца, состояние корня аорты, опыт хирурга и др.
Если при АВА и пороке АК у большинства кардиохирургов не возникает сомнений по поводу их протезирования клапан-содержащим кондуитом по методике Бенталла – Де Боно или же раздельного протезирования АК и ВА, то при пограничных эктазиях аорты до 5 см до сих пор возникают многочисленные дискуссии по поводу методики хирургического лечения. И в качестве альтернативы рассматриваются различные варианты: одни отдают предпочтение ПАК в сочетании с аорторафией, другие предлагают дополнять это вмешательство окутыванием аорты, третьи ограничиваются окутыванием ВА без ее редукции, а четвертые предлагают изолированное ПАК без каких-либо вмешательств на ВА.
Впервые о сочетанной методике хирургического лечения АВА, осложненной патологией АК сообщил Wheat M. в 19641965 гг. До внедрения в клиническую практику методик Bentall H. и DeBono A. (1968), методом выбора хирургического лечения таких пациентов оставалось раздельное ПАК и ВА.
Техника Wheat M. включала три основных этапа [14]:
-
1. Резекция аневризмы с последующим протезированием ВА синтетическим протезом от фиброзного кольца АК до дуги аорты;
-
2. ПАК;
-
3. Имплантация венечных артерий в бок сосудистого протеза.
Успех таких вмешательств достигался четырьмя основными факторами: состоянием АК, коронарных артерий, аневризмы и аорты дистальнее аневризмы, а операция была показана пациентам с аневризмой корня аорты и АН 3-4 степени [45].
По мнению McCready R.A. (1979), методика раздельного протезирования ВА и АК наиболее применима у пациентов с аневризмами корня аорты в отсутствии у них системных заболеваний соединительной ткани [46].
В 1980 году в своей работе Miller D.C. считает раздельное протезирование методом выбора хирургического лечения больных с АВА и сопутствующей АН [47].
По мнению Antunes M.J. (1984), раздельное протезирование возможно при умеренных (до 5 см) размерах синусов Вальсальвы [48].
Karck M. считает, что метод раздельного протезирования обеспечивает низкий операционный риск, меньший процент осложнений со стороны коронарных артерий, однако при наличии системных заболеваний соединительной ткани отдает предпочтение клапаносодержащим кондуитам с целью предотвращения возможных рецидивов [49].
По мнению Sioris T., раздельное протезирование ВА и АК является приемлемым у больных с патологией АК, АВА и нормальными или умеренно увеличенными размерами синусов Вальсальвы [50].
Болдырев С.Ю. и соавт. (2018) считают, что, пограничная дилатация ВА в сочетании со значимой патологией АК требует особого подхода и тактики ведения пациента, в особенности при наличии клиники сердечной недостаточности и признаков увеличения размеров корня и восходящего отдела аорты. Учитывая наличие данных об осложненных АВА (расслоения и разрывы) у пациентов с расширением корня и ВА, не достигающего критериев, подходящих под диагноз аневризма, группа пациентов с пограничной эктазией ВА требует более
агрессивной тактики – оперативного вмешательства на клапане и ВА [51].
Список литературы Хирургическое лечение больных пороком аортального клапана в сочетании с расширением восходящей аорты менее 5 см (обзор литературы)
- Гаприндашвили Т.В. Некоторые особенности хирургической техники при расслаивающих аневризмах восходящей аорты // В сб.: Современные проблемы реконструктивной хирургии. М., 1992. С. 136.
- Семеновский М. J.I., Мякишев В.Б., Соколов В.В., Бирюков В.Б. Непосредственные и отдаленные результаты операции Бентала-Де Боно // Ангиология и сосудистая хирургия. 1997. №1. С. 45 - 56.
- Birks E., Webb C., Child A. et al. Early and long-term results of a valve-sparing operation for Marfan syndrome. Circulation, 1999 Nov 9, 100(19 Suppl), pp. 1129-35.
- Svensson L., Nadolny E., Kimmel W. Minimal access aortic surgery including reoperations. Eur-J-Cardiothorac-Surg, 2001 Jan, 19(1), pp. 30-33.
- Белов Ю.В., Степаненко А.Б., Гене А.П. и др. Острая недостаточность аортального клапана в ближайшем послеоперационном периоде у больного с синдромом Марфана после протезирования // Грудная и сердечно-сосудистая хирургия. 1999. № 4. С. 76-80.
- Бокерия Л.А., Малашенков А.И., Русанов Н.И., и др. Выбор метода хирургического лечения расслаивающей аневризмы восходящей аорты и дуги // Анналы хирургии. 2001. № 4. С. 39-44.
- Мовсесян Р.А. Хирургия аневризмы восходящей аорты // Анналы хирургии. 1998. № 3. С. 7-13.
- Мякишев В.Б., Гиоргадзе О.А. Хирургическое лечение аневризм восходящего отдела аорты в сочетании с недостаточностью аортального клапана // В сб.: Диагностика и хирургическое лечение заболеваний сердца и сосудов. Киев. 1990. С. 40-41.
- David Т., Armstrong S., Ivanov J. et al. Results of aortic valve-sparing operations. J-Thorac-Cardiovasc-Surg, 2001 Jul, 122(1), pp. 39-46.
- Morris A., Perez D., McNoe B. The use of quality life in clinical practice. Qual life research, 1999, Vol.7, pp. 85 - 91.
- O'Malley C.D. Andreas Vesalius of Brussels: 1514-1564. Berkeley CA: University of California Press; 1964.
- Reemtsma K., Bregman D. Aneurysms of the thoracic aorta. In Vascular surgery. Ed.1. Najarian, J. Delaney. Stuttgart. 1978. pp. 415-420.
- Edwards J.E., Kerr A.R. A safes technique for replacement of the entire ascending aorta and aortic valve. J. Thorac. cardiovasc. Surg, 1970, Vol. 59, pp. 837-839.
- Wheat M.W., Wilson J.R., Bartley T.D. Successful replacement of the entire ascending aorta and aortic valve. J.A.M.A, 1964, 188, p. 717.
- Benall H.H., DeBono A. A technique for complete replacement of the ascending aorta. Thorax, 1968, 23, pp. 338-339.
- Cabrol C., Pavie A., Gandjbakhek J. et al. Complete replacement of the ascending aorta with reimplantation of the coronary arteries. J. thorac. cardiovasc. Surg, 1981, Vol. 81, pp. 309-315.
- Robicsek F. A new method to treat fusiform aneurysms of the ascending aorta associated with aortic valve disease: an altemative to radical resection. Ann. Thorac. Surg, 1982, 34, pp. 92-94.
- Robichek F. Conservative in the management of aortic aneurysm. J. Cardiovasc. Surg, 1984, 25, pp. 81-85.
- Robicsek F., Daugherty H.K., Mullen D.C. Extemal grafting of aortic aneurysms. J. Thorac. Cardiovasc. Surg, 1971, 61, pp. 131-134.
- Robicsek F., Daugherty K, Mullen D.C. et al. Is there a place for wall reinforcement in modem aortic surgery? Arch. Surg, 1972, 105, pp. 827-829.
- Robicsek F., Cook J.W., Reames M.K., Skipper ER Size reduction ascending aortoplasty: Is it dead or alive? J. Thorac. Cardiovasc. Surg, 2004, 128, pp. 562-570.
- Bauer M., Pasic M., Meyer R. et. Al. Morphometric analysis of aortic media in patients with bicuspid and tricuspid aortic valve. Ann. Thorac. Sug, 2002, 74, pp. 58-62.
- Bauer M., Grauhan O., Hetzer R. How to avoid problems with reduction aortoplasty: Reply. Ann. Thorac. Surg, 2004, 78, p. 387.
- Сердечно-сосудистая хирургия. / под ред. В.И. Бураковского, Л.А. Бокерия. М.: Медицина, 1989. 384 с.
- Dietz H.C., Loeys B., Carta L., Ramirez F. Recent progress towards a molecular understanding of Marfan syndrome. Am. J.Med. Genet. C. Se- min. Med. Genet, 2005, 139, pp. 4-9.
- Дземешкевич С.Л., Стивенсон Л.У., Алекси-Месхишвили В.В. Болезни аортального клапана. М.: ГЭОТАР-МЕД, 2004. 325 с.
- Goldstein J.A., Aortic stenosis. Essential of cardiovascular medicine. Ed. M. Freed and C.Grines. Birmingham. 1994.
- Mohler E.R. Aortic valve calcificacation: How and Why? ACC current J. review. 2001 May/Jun, pp. 84-85.
- Pohle K., Moffert R., Robert D., et al. Progression of aortic valve calcification assaciotion with coronary atherosclerosis and cardiovascular risk factors. Circulation, 2001, 104, pp. 1927-1932.
- Шумаков В.И., Семеновский В.В., Соколов В.В., и др. Протезирование клапанав сердца при инфекционном эндокардите у пациентов, находящихся на хроническом гемодиализе // Грудная и сердечно-сосудистая хирургия. 1999. № 6. С. 45-49.
- Иваницкая М.А., Петросян Ю.С., Хомутова М.Г. Рентгенкинематография в диагностике заболеваний сердца. М.: Медицина, 1971. С. 66-67.
- Teague S.M. Doppler echocardiographic evalution of aortic regurgitation. In: Doppler Echocardiography, ad. Schiller N.B. Cardiology Clinics, 1990, 8, p. 2.
- Белоусов Ю.В. Охотин И.К. Выбор метода хирургической коррекции врожденного аортального стеноза в зависимости от анатомического варианта. Восстановительная и реконструктивная хирургия. Горький, 1980. С. 49-59.
- Espinal M., Fuisz A.R., et al. Sensivity and specificity of transesophageal echocardiography for determination of aortic valve morphology. Am. Heart J, 2000, 139(6), pp. 1071-1076.
- Ковалевская О.А., Чреспищеводная эхокардиография в хирургии аневризм и расслоений восходящего отдела аорты. Дисс. К.м.н. - Москва. 2000.
- Sitsir R.M., Sayre К., Flacke S. et al. Assessment of ventricular contractility during cardiac magnetic resonance imaging examinations using normalized maximal ventricular power. Ann. Biomed. Eng, 2001, 29, pp. 974-978.
- Pachulski R.T., Weinberg A.L., Chan L. Aortic aneurysm in patients with functionally normal or minimally stenotic bicuspid aortic valve. Am. J. Cardiol, 1991, 67, pp. 781-782.
- Keane M.G., Wiegers S.E., Plappert T. Et al. Bicuspid aortic valves are associated with aortic dilatation out of coexisten valvular lesions. Circulation, 2000, 102, pp. 35-39.
- Mueller X., Tevaearai H., Genton C. et. al. Drawback of aortoplasty for aneurysm of the ascending aorta associated with aortic valve diseae. Ann Thorac Surg, 1997, 63, pp. 762-767.
- Ali A., Patel A., Ali Z. A. et al. Stentless aortic valve replacement in patients with bicuspid aortic valve disease: clinical outcome and aortic diameter changes during follow-up. Eur. J. Cardiothorac. Surg, 2010, Vol. 38, pp. 134-140.
- Ali A., Patel A., Ali Z.A. et al. Stentless aortic valve replacement in patients with bicuspid aortic valve disease: clinical outcome and aortic diameter changes during follow-up. Eur. J. Cardiothorac. Surg, 2010, Vol. 38, pp. 134-140.
- Andrus B.W., O'Rourke D.J., Dacey L.J., Palac R.T. Stability of ascending aortic dilatation following aortic valve replacement. Circulation, 2003, Vol. 108, pp. 295 - 299.
- Borger M.A., Preston M., Ivanov J. et al. Should the ascending aorta be replaced more frequently in patients with bicuspid aortic valve disease? J. Thorac. Cardiovasc. Surg, 2004, Vol. 128, pp. 677 -683.
- Kuralay E., Demirkilic U., Arslan M., Tatar H. Surgical approach to ascending aorta in patients with bicuspid aortic valve. Ann. Thorac. Surg, 2004, Vol. 78, No. 2, pp. 757 - 757.
- McKellar S.H.,. Tester D.J, Yagubyan M. et al. Novel NOTCH1 mutations in patients with bicuspid aortic valve disease and thoracic aortic aneurysms. J. Thorac. Cardiovasc. Surg, 2007, Vol. 134, No. 2, pp. 290-296.
- Wheat M.W., Boruchow I.B., Ramsey H.W. Surgical Treatment of Aneurysms of the Aortic Root. Ann. Thorac. Surg, 1971, 12, pp. 593-607.
- McCready R.A., Pluth J.R. Surgical treatment of ascending aortic aneurysms associated with aortic valve insufficiency. Ann. Thorac. Surg, 1979, 28(4), pp. 307-316.
- Miller D.C., Stinson E.B., Oyer P.E. et al. Concomitant resection of ascending aortic aneurysm and replacement of the aortic valve. J. Thorac. Cardiovasc. Surg, 1980, 79, pp. 388-401.
- Antunes M.J., Baptista A.L., Colsen P.R., Kinsley R.H. Surgical treatment of aneurysms of the ascending aorta associated with severe aortic regurgitation. Thorax, 1984, 39, pp. 305-310.
- Karck M., Laas J., Heinemann M., Borst H.G. Long-term follow - up after separate replacement of the aortic valve and ascending aorta. Herz, 1992, 17(6), pp. 394-397.
- Sioris T., David T., Ivanov J. et al. Clinical outcomes after separate and composite replacement of the aortic valve and ascending aorta. The Journal of Thoracic and Cardiovascular Surgery, 2004, 128 (2), pp. 260-265.
- Болдырев С.Ю. Современные аспекты диагностики и хирургического лечения аневризм и расслоений восходящего отдела и дуги аорты: дис. … д.м.н. М., 2018.


