Хирургическое лечение колоректальных метастазов в печень: современное состояние и перспективы развития
Автор: Забелин М.В., Мельников П.В., Савенков С.В., Каннер Д.Ю.
Журнал: Хирургическая практика @spractice
Рубрика: Современное состояние проблемы: обзоры, лекции
Статья в выпуске: 1, 2015 года.
Бесплатный доступ
Хирургический метод является единственным радикальным методом лечения метастазов рака прямой и ободочной кишки в печень. Был произведен обзор публикаций по современным методам хирургического лечения в сети PubMed, eLibrary, Google. Выяснено, что современные методики способствуют минимизации послеоперационных осложнений, а летальность не превышает 5%. При этом отдаленная 5-летняя выживаемость достигает 40-58%. Методика резекций активно развивается и в лапароскопической хирургии, где результаты сопоставимы с аналогичными при традиционных подходах. Оптимистичными выглядят результаты трансплантации печени, достигая 60% общей 5-летней выживаемости.
Метастазы в печень, резекции печени, рак прямой кишки, рак толстой кишки, колоректальный рак, лапароскопические резекции печени, роботизированные резекции печени, трансплантация печени
Короткий адрес: https://sciup.org/142211613
IDR: 142211613 | УДК: 616-089;
Текст научной статьи Хирургическое лечение колоректальных метастазов в печень: современное состояние и перспективы развития
Рак прямой и ободочной кишки по-прежнему остается одной из наиболее распространенных форм опухолей, прогрессируя до IV стадии у 70% больных. Синхронное метастатическое поражение печени диагностируется у 25% больных, еще у 35 - 45% вторичные опухоли выявляются в последующие годы (преимущественно в первые 3 года, даже на фоне противоопухолевой терапии) [2, 3, 21, 26, 46]. Лечение больных с метастатическим поражением печени колоректального рака является сложным и высокотехнологичным процессом. Считается, что ключевыми в терапии таких больных должны быть использование мультидисциплинарного подхода, а также индивидуализация алгоритмов лечения. Несмотря на актуальность представленной проблемы, анализ литературных данных свидетельствует о дефиците доказательной базы, в особенности рандомизированных исследований, посвященных хирургическому лечению этой группы больных [16, 26, 31, 35, 45, 48].
История хирургии печени
Первое анатомическое описание печени появилось в IV веке до нашей эры в трудах древнегреческого врача Alexandrian Herophilus. И вплоть до XV в. в медицинской литературе вся анатомия давалась по Галену, который в свою очередь основывался на работах Herophilus [1]. Однако операции на печени сопровождались высокой летальностью и до XIX века проводились только по жизненным показаниям в связи с огнестрельными или колото-резанными ранениями печени (табл. 1) [1, 21].
Коренной поворот печеночная хирургия получила в 1887 году, когда Carl Langenbuch при выполнении лапаротомии 30-летней женщине выявил присутствие плотной массы ткани в левой доле печени и удалил 370 г ткани. При этом в воротах предварительно была перевязана левая сосудисто-секреторная ножка. Таким образом, Langenbuch был первым, кто успешно выполнил операцию избирательной резекции печени. За год до этого, в 1886 году, Luis также выполнил подобную резекцию печени, однако через 6 часов у больной возникло фатальное кровотечение [21]. Революционный переворот в представлениях о сегментарном строении печени был связан с классическими работами, опубликованными в 1954 г. Claude Couinaud (рис. 1), который выделил восемь сегментов печени. Именно принцип анатомических резекций был реализован при выполнении право- и левосторонних гемигепатэктомиях к середине ХХ века (табл. 1). Новая эра в хирургии печени была открыта американским хирургом Thomas E. Starzl (рис. 2), впервые осуществившим трансплантацию печени [1].
Современное состояние хирургии печеночных метастазов
Одни из первых ретроспективных исследований (Wilson, 1976 [49] и Wanebo [48], 1978) показали, что 5-летняя выжи-
Таблица 1
Основные исторические вехи операции на печени
|
Год |
Описание операции |
|
Первая половина 17 в |
Hildanus произвел первую резекцию печени по поводу травмы |
|
1716 |
Berta удалил участок печени после ранения ножом |
|
1846 |
MacPherson удалил и зашил участок раненой ножом печени |
|
1870 |
Victor von Brun удалил участок печени в связи с огнестрельным ранением |
|
1887 |
Carl Langenbuch выполнил первую успешную резекцию печени по поводу опухоли с перевязкой сосудистосекреторной ножки |
|
1891 |
Lucke впервые успешно удалил опухоль печени |
|
1899 |
Keen выполнил первую истинную левую латеральную сегментэктомию |
|
1943 |
Cattell выполнил первую резекцию печени по поводу КРР метастаза в Lahey Clinic (г. Бостон) |
|
1952 |
Lortat-Jacob и Robert выполнил первую анатомическую правостороннюю гемигепатэктомию |
|
1967 |
Thomas E. Starzl выполнил первую ортотопическую трансплантацию печени |
|
1992 |
Gagner выполнил первую лапароскопическую резекцию печени по поводу фокальной нодулярной гиперплазии |
Рис. 1. Надгробная доска Клода Куино на кладбище в Париже ваемость у больных с потенциально резектабельными печеночными метастазами без хирургического лечения составила 0% (медиана выживаемости 19 месяцев) в сравнении с 25-28% в аналогичной временной перспективе у пациентов, у которых были выполнены резекции печени. На данный момент, по данным крупных популяционных исследований, около 25% больных первичным раком прямой и ободочной кишки представлены с синхронными метастазами в печени [26]. Чуть более 50% больных после удаления первичной опухоли толстой кишки в конечном итоге получат метахронные метастазы в печень [46, 16]. Однако резектабельные метастазы выявляют только у 15-20% больных. Поэтому не удивительно, что количество операций по поводу колоректальных метастазов в печень уве- личивается. Так, при анализе национальной базы данных онкологических больных с 1998 по 2004 годы количество резекций печени увеличилось в 2 раза — с 1,7% до 3,4% (от всех операций по поводу рака прямой и ободочной кишки) [33].
При этом, несмотря на существенный прогресс в химио- и таргетной терапии, хирургическое лечение имеет лучшие ре-
Рис. 2. Томас Старзл (1922 - 2008)
зультаты выживаемости в срав нении с симптоматической или химиотерапией и достигает 25–58% в 5-летней перспективе, что сравнимо с результатами лечения III стадии КРР (рис. 3).
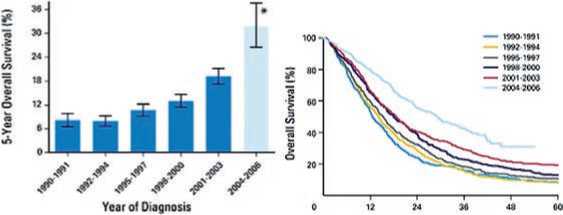
Рис. 3. Общая выживаемость у больных раком прямой и ободочной кишки, перенесших резекцию печени с метастазами. (A) Кривая Kaplan-Meier.
(B) Средняя общая выживаемость [28]
Если мы посмотрим на публикации разных лет (табл. 2), то увидим, что с конца 70-х годов отмечаются отчетливые тенденции — уменьшение послеоперационной летальности и увеличение отдаленных показателей выживаемости. С одной стороны, это стало возможным благодаря широкому внедрению применения системных цитостатиков фторпиримидинового ряда. С другой, благодаря систематизации знаний топографической анатомии и достижениям хирургии печени, с революционными открытиями в области высоких технологий, медицинского обеспечения и оборудования, которые могли влиять на различные аспекты, такие как гемостаз, контроль крупных сосудов и пересечение паренхимы [28].
Контроль гемостаза был одной из важнейших проблем, исторически стоявшей перед хирургами. Важным этапом в ее решении стал прием сосудистой изоляции, предложенный в 1908 г. James Hogarth Pringle, заключавшийся в наложении сосудистых клемм или пережатии турникетом гепатодуоденальной связки для временной остановки кровотечения из ран печени. Данная методика не была лишена недостатков. В работе Smyrniotis V. с соавт. (2005) было продемонстрировано, что, с одной стороны, кровопотеря увеличивает летальность и осложнения, а гемотрансфузия увеличивает риск рецидива опухоли. Но с другой стороны, после полной сосудистой изоляции риск осложнений также увеличивался не менее чем на 10 - 20% [47]. Поэтому,
Непосредственные и отдаленные результаты резекций печени по поводу метастазов колоректального рака
|
Авторы, год публикации |
Число наблюдений |
Послеоперационная летальность, % |
5-летняя выживаемость, % |
|
Iwatsuki, 1988 [25] |
90 |
0 |
30 |
|
Nordlinger, 1987 [35] |
80 |
5 |
25 |
|
Scheele, 1995 [46] |
469 |
4,4 |
39 |
|
Fong, 1999 [16] |
1001 |
2,8 |
37 |
|
Minigawa, 2000 [32] |
235 |
0 |
38 |
|
Ercolani, 2002 [14] |
257 |
0,8 |
34 |
|
Adam, 2003 [4] |
615 |
1 |
41 |
|
Abdalla, 2004 [1] |
190 |
- |
58 |
|
Патютко, 2010 [2] |
527 |
1,2 |
37,4 |
вместе с развитием медицинского оборудования и технологий были предложены усовершенствованные методы пересечения печеночной паренхимы.
Основным приемом исторически являлся раздавливающий метод, при котором происходит размозжение печеночной паренхимы и выявление кровеносных сосудов и желчных протоков. Он может быть выполнен как пальцами хирурга — дигитоклазия, так и простым хирургическим зажимом — «crush-clamp» техника. Однако в профессиональной среде до сих пор отсутствует единое мнение о наиболее эффективном методе пересечения печеночной паренхимы. Мы проанализировали серию РКИ и метаанализов, чтобы оценить эффективность этого и более нового метода.
Исследование авторов из Швейцарии [29], в котором рандомизировано 100 пациентов без явлений цирроза и холестаза, с целью сравнения методики «crush-clamp» + Pringle-прием и применения без сосудистой изоляции водоструйного диссектора (HydroJet), ультразвукового (УЗ) диссектора-аспиратора (CUSA) и электрохирургического (ЭХ) диссектора. У раздавливающего метода была большая скорость транссекции (3,9± ±0,3 см2/мин) и меньше кровопотеря (1,5±0,3 мл/см2), в то время как у CUSA (2,3±0,2 см2/мин и 4±0,7 мл/см2), Hydrojet (2,4± ±0,3 см2/мин и 3,5±0,5 мл/см2), ЭХ-диссектор (2,5±0,3 см2/мин и 3,4±0,4 мл/см2) (скорость: P= 0,001; кровопотеря: P= 0,003). Также гемотрансфузий при раздавливающем методе требовалось в меньшем числе наблюдений, и он был наиболее экономически целесообразным, экономя от 600 до 2400 € за случай. Это подтверждается в обзоре Cochrane 2009 года [37], включающем 7 РКИ на когорте из 556 больных и метаанализе 7 РКИ, проведенном английскими коллегами [40], и 500 больных немецких авторов, которые не смогли выявить достоверную разницу в показателях смертности, осложнений, маркеров травмы паренхимы печени, или продолжительности госпитализации в РАО/ общей госпитализации в сравнении раздавливающего и альтернативных методов.
Таблица 2
В последние два десятилетия отмечается развитие хирургических технологий с использованием методов физического воздействия на паренхиму печени, включающие диссекцию, коагуляцию, дегидратацию и карбонизацию.
The Cavitron Ultrasonic Surgical Aspirator (CUSA) — ультразвуковой диссектор-аспиратор — генерирует УЗ-энергию и аспирирует разрушенную печеночную паренхиму, для скелетизации сосудистых и желчных структур диаметром более 2 мм, которые разделяются любым способом. Раннее нерандомизированное исследование применения CUSA и традиционного раздавливающего метода выявило уменьшение средней кровопотери (2,4 л и 3,4 л, р=0,02), объема переливаемых гемокомпонентов (1,2 и 2,2, р=0,001), и большее число пациентов, которым гемотрансфузия не требовалась (32% и 8%, р=0,0001). При этом достоверно меньше определялась частота осложнений (28% и 47%, р=0,012) и летальности (0 и 17%, р=0,0004) [15]. Однако эти оптимистичные данные не подтвердились в более поздних рандомизированных исследованиях, тем более время пересечения при CUSA оказалось больше, чем при традиционных методах [29].
Гармонический скальпель — использует схожие принципы УЗ-энергии в разделении и заваривании кровеносных сосудов. При использовании ультразвуковой диссекции Harmonic-генератор вырабатывает механическую волну с частотой 55–500 Гц, которая достигает максимальной амплитуды на кончике лезвия. При этом важно отметить, что через тело пациента электричество не проходит. Таким образом, УЗ-инструменты элиминируют риски электрохирургического оборудования: стенки сосудов запаиваются друг к другу без эрозии, позволяя коагулировать сосуды до 5 мм с использованием ножниц. Традиционно наиболее часто используется при лапароскопических резекциях печени. В нерандомизированном исследовании [27] на когорте из 149 больных использование Harmonic Scalpel было ассоциировано с уменьшением времени операции (357±15,0 против 404±19,1 мин., p = 0,05) и тенденцией к уменьшению кровопотери (1211±125,5 против 1411±180,7 мл, р = не достоверно) и показаний к гемотрансфузии (2,6±0,5 против 1,7±0,3 доз, р = 0,10).
В исследовании авторов из Турции гармонический скальпель продемонстрировал лучшую эффективность при пересечении вен 2 мм и менее, из которых наиболее часто наблюдается кровотечение при традиционном лигатурном лигировании [36]. А в ретроспективном когортном исследовании комбинации TissueLink с гармоническим скальпелем или CUSA Harmonic был эффективнее в оценке средней кровопотери (250 и 1035 мл соответственно (p < 0,05). Среднего времени операции (185 и 290 мин.) и меньшей частоте осложнений (20% и 26% осложнений) [6].
Новый уровень использования энергии в хирургии реализовался в комбинации компрессии и приложения тепловой энергии. Наиболее современный из них Enseal — современный биполяр, способный лигировать сосуды до 7 мм с минимальным (до 1 мм) латеральным термическим поражением, что крайне важно при резекциях печени, учитывая опасную близость расположения крупным сосудов. Однако в связи относительно недавним запуском международных продаж в конце 2009 года крупных работ не опубликовано. Интерес представляет проспективное исследование [31], сравнивающее когорту из 35 больных, у которых лапароскопическую резекцию печени проводили Enseal, и 19 пациентов, у которых при аналогичных операциях применяли Harmonic Scalpel. Средняя кровопотеря была одинакова 100 мл (20–1000 мл) и 175 мл (50–700 мл) соответственно (р = 0,580), однако было быстрее время пересечение паренхимы 35 мин. (20–65 мин.) и 55 мин. (29–75 мин.) (р < 0,001) и общее время операции 130 мин. (70–180 мин.) и 180 мин. (80–240 мин.) соответственно при использовании Enseal нежели в группе УЗ-устройства (р = 0,050). При этом разницы в осложнениях у пациентов разных групп не было.
Эллектрохирургический диссектор Ligasure Vessel Sealing System — широкоизвестный биполяр для заваривания сосудов до 7 мм в диаметре, сочетающий элементы давления и энергии, расплавляющую коллагеновый матрикс в сосудистой стенке. В небольшом РКИ из одного центра в Японии в сравнении с раздавливающим методом [45] было выявлено, что при использовании Ligasure разницы между средней кровопотерей в ходе пересечения паренхимы достоверно не было (200 против 322 мл, р = 0,185), однако при малых гепатэктомиях кровопотеря была достоверно меньше, чем при традиционном методе (186 против 412 мл, р = 0,012). Также применение Ligasure было ассоциировано с существенной большей скоростью пересечения паренхимы (2,3 против 1,6 см2/мин, р < 0,001). По всей видимости, это произошло за счет меньшего вязания лигатурных узлов (6 vs 69 узлов, р < 0,001). Однако также имелась тенденция к увеличению частоты желчеистечения (3% против 9% (р = 0,301)). В более позднем РКИ группа авторов под руководством Ikeda [24], также из Японии, не смогла доказать достоверное уменьшение времени операции или кровопотери при применении Ligasure. Так, среднее время трансекции было 57 минут (от 11 до 127 мин.), что близко к традиционному методу — 56 мин. (от 9 до 269), р = 0,64). В то время как не было разницы в скорости пересечения между двумя методами — 1,16 (0,15 - 2,26) см/мин и 1,10 (0,15 - 2,66) см/мин, р = 0,95). Общая кровопотеря и кровопотеря при транссекции также была одинакова (средняя: 315 (25 - 2415) мл и 315 (10 - 1700) мл, р = 0,80) и 5,04 (1,01 - 44,2) мл/см2 и 4,36 (0,15 - 50,5) мл/см2, р = 0,14) соответственно.
The Salient Dissecting Sealer (TissueLink) — аппарат, который использует радиочастотную энергию для рассечения паренхимы печени, попутно заваривая мелкие сосуды. В работе Geller [17] с соавторами анализирован 3-летний опыт применения данного устройства при 170 резекциях печени. Выявлен низкий уровень осложнений (лишь у 1 больного произошла ТЭЛА), низкий уровень гемотрансфузий (только 3,5% (у 6 па- циентов), желчеистечение в послеоперационном периоде (2,3% — у 4 больных).
Резекция печени с радиочастотной ассистенцией — методика, включающая радиочастотную термокоагуляцию участка печеночной паренхимы перед рассечением. Итальянское РКИ [30] выявило высокий уровень послеоперационных осложнений — 33% (абсцесс — 6, желчный свищ — 3, стеноз желчного древа — 1) при подобных типах резекции печени, в то время как при раздавливающем методе осложнений не было (р < 0,001). Однако переливание крови требовалось меньше — в 33% наблюдений, в то время как при краш-методе — в 50%, однако разница была недостоверна (р = 0,079).
Водоструйный диссектор (HydroJet) — техника основана на размывание печеночной паренхимы струей воды под высоким давлением и скелетизации небольших сосудистых и желчных структур, которые потом разделяются любым способом. Rau [42] в работе представил серию из 950 резекций печени, выполненных исключительно HydroJet. Применение данного метода снизило кровопотерю, гемотрансфузию, применение Прингл-маневра (с 48% до 6%) и время резекции. Однако эти результаты не были подтверждены в РКИ, описанных выше [29, 37, 40].
Степлерный метод первоначально применялся для пересечения главных сосудов, но со временем сфера применения расширилась до рассечения паренхимы. Ретроспективный анализ [43] более чем 200 пациентов за 10 лет показал, что в сравнении с «crush-clamp»-методом использование степлеров снижает время операции, кровопотерю и гемотрансфузию. Однако РКИ CRUNSH [41] выявило, что достоверной разницы между интраоперационной кровопотерей при применении этих методов нет: 1050 (525 - 1650) против 925 (450 - 1425) мл соответственно (р = 0,279). Различия в соотношении общей интраоперационной кровопотери к поверхности рассеченной паренхимы было также статистически недостоверным (р = 0,092). Кровопотеря в ходе рассечения паренхимы была существенно ниже при степлерном методе (р = 0,002), так же, как и время рассечения паренхимы (среднее 30 (21) против 9 (7) мин. у раздавливающего и степлерного метода соответственно, р < 0,001), и общая продолжительность операции (средняя 221 (86) против190 (85) мин., р = 0,047). Так же не было существенной разницы в послеоперационной летальности (р = 0,863) и частоте осложнений (р = 0,684) между группами.
Стоит отметить, что в конце 2014 года закончится набор пациентов в 3 фазе клинических исследований CRUNSH II (NCT01858987), сравнивающих Ligasure и степлерный метод.
Перспективы развития
Лапароскопическая хирургия является большой развивающейся областью в онкохирургии. В 1992 году Gagner выполнил первую лапароскопическую резекцию печени по поводу фокальной нодулярной гиперплазии. А уже к концу 2000-х Nguen [34] в анализе 127 публикаций насчитал 2804 лапароскопических резекции печени по поводу различных заболеваний. Из них 50% — злокачественные заболевания печени, 45% — доброкачественные, 1,7% — донорские гепатэктомии, остальные — не определенные. Преобладали тотальные лапароскопические операции — 75%, мануально-ассистированными были — 17%, лапароскопически-ассистированные, открытые гепатэктомии (гибридные) — 2%. Оставшиеся операции (6%) носили характер неклассифицируемых методик. Частота конверсий от лапароскопических к лапаротомным или от лапароскопических к мануально-ассистированным операциям встречались в 4,1% и 0,7% сообщенных случаев соответственно. Общая летальность составила 0,3% (умерло 9/2804), осложнения выявили в 10,5%. В крупном метаанализе китайские авторы (2014) продемонстрировали анализ 14 исследований на когорте 975 больных. Было установлено, что лапароскопический метод эквивалентен открытому традиционному как по отдаленным, так и по непосредственным результатам (табл. 3).
Достаточное количество выполненных лапароскопических резекций печени позволило в 2008 году на согласительной конференции University of Louisville рекомендовать критерии отбора для данного подхода: размер опухоли <5 см, периферическое расположение опухоли, расположение во 2 - 6 сегментах. Однако ввиду технической сложности объемные резекции должны выполняться в высокоспециализированных центрах. А кривая обучаемости минимально инвазинвых резекций составляет около 60 операций [34]. Опубликованных рандомизированных исследований по данному методу не существует. В Oslo University Hospital завершается 3 фаза РКИ NCT01516710, результаты которого будут известны в 2015 году.
Роботизированные резекции печени являются еще одним способом миниинвазивного хирургического лечения метастазов колоректального рака в печень. В системном обзоре Reggiani и соавт. [44] обобщен результат применения данной методики у 235 больных злокачественными и доброкачественными заболеваниями печени в 17 сериях (рис. 4), в том числе в 20% у пациентов с метастазами КРР в печень. Частота кон-
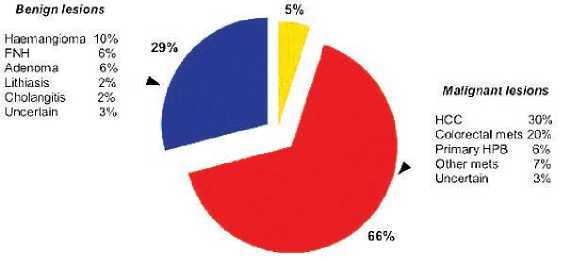
* Benign lesions ■ malignant lesions other
Рис. 4. Структура роботизированных резекций печени версий и осложнений составила 4,2% и 13,4% соответственно, а среднее время операции составило 285 мин.
Если непосредственные результаты демонстрируют, что роботизированные резекции печени сравнимы с таковыми лапароскопическими, то отдаленные онкологические результаты пока неясны. Из известных работ невозможно составить статистический тренд, дающий объективное представление о без-рецидивной и общей выживаемости (табл. 4).
Трансплантология
В последние 2 десятилетия отмечается прогресс в развитии трансплантации печени, с одной стороны. С другой стороны, большое число пациентов с множественным билобарным поражением печени и неудовлетворительные результаты паллиативного химиотерапевтического лечения толкают в поисках новых методов. В мае 2013 года в журнале Annals of Surgery Hagness и соавторы опубликовали результаты трансплантаций в лечении нерезектабельных метастазов у 21 пациента (SECA study), выполненное в Section for Transplantation Surgery, Department of Transplantation Medicine, Oslo, Norway [20]. Критериями включения служили метастазы только в печень, удаленная первич-
Таблица 3
Отдаленные результаты нерандомизированных сравнительных исследований лапароскопических и традиционных операций
|
Автор, год |
Лапароскопические Традиционные |
1-летняя ОВ/БРВ, % |
3-летняя ОВ/БРВ, % |
5-летняя ОВ/БРВ, % |
P для ОВ P для БРВ |
|
Cannon R.M., 2012 [7] |
35 140 |
Нет данных |
Нет данных |
36/15 42/22 |
Р = 0,818 |
|
P = 0,346 |
|||||
|
Castaing D., 2009 [9] |
60 60 |
97/70 97/70 |
82/47 70/40 |
64/35 56/27 |
P = 0,32 |
|
P = 0,32 |
|||||
|
Chen K.Y., 2011 [11] |
21 18 |
82,6 77,8 |
43,5 38,9 |
8,6 0 |
P > 0,05 |
|
Guerron A.D., 2013 [19] |
40 40 |
8933 8133 |
P < 0,05 |
||
|
Huh J.W., 2011 [23] |
20 20 |
Нет данных |
52,8 58,7 |
61,0 49,2 |
P = 0,713 |
1ОВ – Общая выживаемость
2БРВ – Безрецидивная выживаемость
3Общая 2-летняя выживаемость
Таблица 4
Результаты наблюдений после роботизированных резекций печени по поводу метастазов рака толстой кишки
Обсуждение
Прошло то время, когда хирургия печени ограничивалась атипичными краевыми резекциями в соответствии с расположением зоны поражения и ее размерами. Значительно расширились за последние 10-15 лет показания к резекциям печени по поводу метастатического поражения, арсенал хирургических методик и современного оборудования позволяет проводить комбинированные и многоэтапные операции. Приведенные данные показали, что невысокий уровень летальности и допустимый уровень послеоперационных осложнений у оперированных пациентов с метастатическим поражением печени, а также высокие показатели отдаленной выживаемости подтверждают тезис о необходимости комплексного подхода при лечении этих больных, применение комбинированных методик и схем лечения позволяют достичь наилучших результатов лечения. Тем не менее, лечение пациентов метастатическим поражением печени следует проводить в специализированных центрах, где возможно осуществить мультидисциплинарный подход.
Множество привнесенных медицинских инноваций и технологий, казалось, улучшат методику пересечения паренхимы печени, существенно обезопасят и снизят кровопотерю. Однако в настоящее время в проведенных рандомизированных исследованиях это не было подтверждено.
Тем не менее, до настоящего времени существенной проблемой, активное изучение которой продолжается до настоящего времени, является оценка показаний к хирургическому лечению и оценка самой целесообразности хирургического лечения больных с местно-распространенным поражением печени метастазами колоректального рака. В доступной литературе, в том числе в ежегодно обновляемых клинических рекомендациях международных сообществ онкологов (NCCN, ESMO), отсутствуют внятные указания на границы возможностей хирургической агрессии при местно-распространенном метастатическом поражении печени, в том числе при внепеченочной диссеминации метастазов.
Список литературы Хирургическое лечение колоректальных метастазов в печень: современное состояние и перспективы развития
- Ермолов А.С., Чжао А.В., Чугунов А.О. История развития хирургии печени//Бюллетень сибирской медицины. 2007. № 3. С. 8-15.
- Патютко Ю.И., Сагайдак И.В., Котельников А.Г. и др.//Анналы хирургической гепатологии. 2010. Т. 15, №2. С. 9-17.
- Abdalla E.K., Vauthey J.N., Ellis L.M. et al. Recurrence and outcomes following hepatic resection, radiofrequency ablation, and combined resection/ablation for colorectal liver metastases//Ann. Surg. 2004. Vol. 239(6). P. 818-825.
- Adam R., Pascal G., Azoulay D. Liver resection for colorectal metastases: the third hepatectomy//Ann. Surg. 2003. Vol. 238(6). P 871-883.
- Berber E. et al. Robotic versus laparoscopic resection of liver tumours.//HPB. 2010. № 12. Р. 583-586.
- Bodzin A.S., Leiby B.E., Ramirez C.G. Liver resection using cavitron ultrasonic surgical aspirator (CUSA) versus harmonic scalpel: a retrospective cohort study//Int. J. Surg. 2014. Vol. 12(5). P. 500-503.
- Cannon R.M., Scoggins C.R., Callender G.G. et al. Laparoscopic versus open resection of hepatic colorectal metastases//Surgery. 2012. Vol. 152(4). P. 567-573.
- Casciola L. et al. Robot-assisted parenchymal-sparing liver surgery including lesions located in the posterosuperior segments//Surg. Endosc. 2011. Vol. 25. Р. 3815-3824.
- Castaing D., Vibert E., Ricca L. et al. Oncologic results of laparoscopic versus open hepatectomy for colorectal liver metastases in two specialized centers//Ann. Surg. 2009. Vol. 250(5). P. 849-855.
- Chan A. Liver transplantation for unresectable colorectal liver metastasis//Hepatobiliary Surg. Nutr. 2013. Vol. 2(3). P. 162-164.
- Chen K.Y., Xiang G.A., Wang H.N. et al. Simultaneous laparoscopic excision for rectal carcinoma and synchronous hepatic metastasis//Chin. Med. J. (Engl). 2011. Vol. 124(19). P. 2990-2992.
- Choi G.H. et al. Robotic liver resection: technique and results of 30 consecutive procedures//Surg. Endosc. 2011. Vol. 26. Р. 2247-2258.
- Dueland S., Guren T.K, Hagness M, Chemotherapy or Liver Transplantation for Nonresectable Liver Metastases From Colorectal Cancer?//Ann. Surg. 2014. Epub. ahead of print.
- Ercolani G., Grazi G.L., Ravaioli M. et al. Liver resection for multiple colorectal metastases: influence of parenchymal involvement and total tumor volume, vs number or location, on long-term survival//Arch. Surg. 2002. Vol. 137(10). P. 1187-1192.
- Fan S.T., Lai E.C., Lo C.M. Hepatectomy with an ultrasonic dissector for hepatocellular carcinoma//Br. J. Surg. 996. Vol. 83(1). P. 117-120.
- Fong Y., Fortner J., Sun R.L. et al. Clinical score for predicting recurrence after hepatic resection for metastatic colorectal cancer: analysis of 1001 consecutive cases//Ann. Surg. 1999. Vol. 230(3). Р. 309-318.
- Geller D.A., Tsung A., Maheshwari V. et al. Hepatic resection in 170 patients using saline-cooled radiofrequency coagulation//HPB (Oxford). 2005. № 7. P. 208-213.
- Giulianotti PC. et al. Robotic liver Surgery: results for 70 resections//Surgery. 2011. Vol. 149. Р. 29-39.
- Guerron A.D., Aliyev S., Agcaoglu O. et al. Laparoscopic versus open resection of colorectal liver metastasis//Surg. Endosc. 2013. Vol. 27(4). P. 1138-1143.
- Hagness M., Foss A., Line P.D. et al. Liver transplantation for nonresectable liver metastases from colorectal cancer//Ann. Surg. 2013. Vol. 257. Р. 800-806.
- Hardy K.J. Liver surgery: the past 2000 years//Australian and New Zealand Journal of Surgery. 1990. Vol. 60(10). P. 811-817.
- Hu M.G., Ou-yang C.G., Zhao G.D. et al. Outcomes of open versus laparoscopic procedure for synchronous radical resection of liver metastatic colorectal cancer: a comparative study//Surg. Laparosc. Endosc. Percutan. Tech. 2012. Vol. 22(4). P. 364-369.
- Huh J.W., Koh Y.S., Kim H.R. Comparison of laparoscopic and open colorectal resections for patients undergoing simultaneous R0 resection for liver metastases//Surg. Endosc. 2011. Vol. 25(1). Р. 193-198.
- Ikeda M., Hasegawa K., Sano K. et al. The vessel sealing system (LigaSure) in hepatic resection: a randomized controlled trial//Ann. Surg. 2009. Vol. 250. Р. 199-203.
- Iwatsuki S., Starzl T.E. Personal experience with 411 hepatic resections//Ann. Surg. 1988. Vol. 208(4). P. 421-434.
- Jemal A., Murray T., Ward E. et al. Cancer statistics//CA Cancer J. Clin. 2005. Vol. 55. P. 10-30.
- Kim J., Ahmad S.A., Lowy A.M. Increased biliary fistulas after liver resection with the harmonic scalpel//Am. Surg. 2003. Vol. 69(9). Р. 815819.
- Kopetz S., Chang G.J., Overman M.J. et al. Improved survival in metastatic colorectal cancer is associated with adoption of hepatic resection and improved chemotherapy//J. Clin. Oncol. 2009. Vol. 27(22). P. 36773683.
- Lesurtel M., Selzner M., Petrowsky H. et al. How should transection of the liver be performed?: a prospective randomized study in 100 consecutive patients: comparing four different transection strategies//Ann. Surg. 2005. Vol. 242. Р. 814-822.
- Lupo L., Gallerani A., Panzera P. et al. Randomized clinical trial of radiofrequency-assisted versus clamp-crushing liver resection//Br. J. Surg. 2007. Vol. 94. P. 287-291.
- Mbah N.A., Brown R.E., Bower M.R. Differences between bipolar compression and ultrasonic devices for parenchymal transection duringlaparoscopic liver resection//HPB (Oxford). 2012. Vol. 14(2). P. 126-131.
- Minagawa M., Makuuchi M., Torzilli G. et al. Extension of the frontiers of surgical indications in the treatment of liver metastases from colorectal cancer: long-term results//Ann. Surg. 2000. Vol. 231(4). P. 487499.
- Morris E.J., Forman D., Thomas J.D. et al. Surgical management and outcomes of colorectal cancer liver metastases//Br. J. Surg. 2010. Vol. 97(7). P. 1110-1118.
- Nguyen K.T., Gamblin T.C., Geller D.A. World review of laparoscopic liver resection -2,804 patients//Ann. Surg. 2009. Vol. 250(5). Р. 831-841.
- NordlingerB., Quilichini M.A., ParcR. Hepatic resection for colorectal liver metastases. Influence on survival of preoperative factors and surgery for recurrences in 80 patients//Ann. Surg. 1987. Vol. 205(3). P. 256-263.
- Olmez A., Karabulut K., Aydin C. Comparison of harmonic scalpel versus conventional knot tying for transection of short hepatic veins at liver transplantation: prospective randomized study//Transplant. Proc. 2012. Vol. 44(6). Р. 1717-1719.
- Pamecha V., Gurusamy K.S., Sharma D. Techniques for liver parenchymal transection: a meta-analysis of randomized controlled trials//HPB (Oxford). 2009. Vol. 11(4). Р. 275-281.
- Patriti A. et al. Laparoscopic and robot-assisted one-stage resection of colorectal cancer with synchronous liver metastases: a pilot study//J. Hepatobiliary Pancreat. Surg. 2009. Vol. 16. Р. 450-457.
- Pringle J.H. Notes on the arrest of hepatic haemorrhage due to trauma//Ann. Surg. 1908. Vol. 48. P. 501.
- Rahbari N.N., Koch M., Schmidt T. et al. Meta-analysis of the clamp-crushing technique for transection of the parenchyma in elective hepatic resection: back to where we started?//Ann. Surg. Oncol. 2009. Vol. 16. Р. 630-639.
- Rahbari N.N., Elbers H., Koch M. et al. Randomized clinical trial of stapler versus clamp-crushing transection in elective liver resection//Br. J. Surg. 2014. Vol. 101(3). P. 200-207.
- Rau H.G., Duessel A.P., Wurzbacher S. The use of water-jet dissection in open and laparoscopic liver resection//HPB (Oxford). 2008. Vol. 10. Р. 275-280.
- Reddy S.K., Barbas A.S., Gan T.J. et al. Hepatic parenchymal transection with vascular staplers: a comparative analysis with the crush-clamp technique//Am. J. Surg. 2008. Vol. 196. P. 760-767.
- Reggiani P., Antonelli B., Rossi G. Robotic surgery of the liver: Italian experience and review of the literature//Cancer Medical Science. 2013. Vol. 26, № 7. P. 358.
- Saiura A., Yamamoto J., Koga R. et al. Usefulness of LigaSure for liver resection: analysis by randomized clinical trial//Am. J. Surg. 2006. Vol. 192. Р. 41-45.
- Scheele J., Stang R., Altendorf-Hofmann A. et al. Resection of colorectal liver metastases//World J. Surg. 1995. Vol. 19(1). P. 59-71.
- Smyrniotis V., Farantos C., Kostopanagiotou G. et al. Vascular control during hepatectomy: review of methods and results//World J. Surg. 2005. Vol. 29(11). Р. 1384-1396.
- Wanebo H.J., Semoglou C., Attiyeh F et al. Surgical management of patients with primary operable colorectal cancer and synchronous liver metastases//Am. J. Surg. 1978. Vol. 135(1). P. 81-85.
- Wilson S.M., Adson M.A. Surgical treatment of hepatic metastases from colorectal cancers//Arch. Surg. 1976. Vol. 111(4). Р. 330-334.


