Хирургическое лечение пациентов с умеренной и пограничной ишемической митральной недостаточностью на современном этапе
Автор: Рядинский М.Э., Филиппов А.А., Каменских М.С., Ким Г.И., Капушев Р.Ю., Провоторова Ю.Д., Асадуллин И.Ш., Шматов Д.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Одним из наиболее частых осложнений ишемической болезни сердца (ИБС) является ишемическая митральная недостаточность (ИМН). Около 20% больных ИБС страдают от возникновения и прогрессирования ИМН, чаще она наблюдается у пациентов, перенесших инфаркт миокарда нижней стенки левого желудочка (ЛЖ). Известно, что наличие митральной регургитации (МР) снижает выживаемость пациентов независимо от наличия ИБС. Накопленный опыт в области диагностики и тактики хирургического лечения ИМН на сегодняшний день неоднозначен, несмотря на множество проводимых исследований. В частности, остаются нерешенными такие важные проблемы, как определение предикторов и факторов риска возникновения рецидива ИМН после хирургического лечения, а также показания к вмешательству на митральном клапане, выбор оперативной тактики для коррекции умеренной и пограничной ИМН. Определение факторов риска неблагоприятного исхода каждого метода хирургического лечения пограничной ИМН поможет специалисту принять правильное решение в вопросе лечения вышеупомянутой патологии. В данном обзоре литературы представляется весь спектр современных хирургических методов лечения пограничной и умеренной ишемической митральной дисфункции, оцениваются результаты наиболее распространенных изолированных и сочетанных операций, анализируются факторы риска неблагоприятного исхода в отдаленном периоде после их выполнения, предлагаются оригинальные подходы к тактике хирургического лечения ИМН.
Коронарное шунтирование, митральный клапан, умеренная ишемическая митральная недостаточность, пограничная ишемическая митральная недостаточность, постинфарктное ремоделирование левого желудочка, предикторы рецидива митральной недостаточности
Короткий адрес: https://sciup.org/149145656
IDR: 149145656 | УДК: 616.12-007.61 | DOI: 10.29001/2073-8552-2024-39-2-46-57
Текст обзорной статьи Хирургическое лечение пациентов с умеренной и пограничной ишемической митральной недостаточностью на современном этапе
Ишемическая болезнь сердца (ИБС) в настоящее время остается главной причиной смертности населения в России и в мире. Ежегодно в Европе от различных форм ИБС умирают около 1,8 млн человек. Частым осложнением ИБС является ишемическая митральная недостаточность (ИМН). Примерно у 20% пациентов с ИБС имеются проявления митральной недостаточности (МН) различной степени выраженности. Чаще ИМН встречается у пациентов, перенесших инфаркт миокарда нижней стенки левого желудочка (ЛЖ), что обусловлено значительной уязвимостью задней папиллярной мышцы и частым возникновением ее дисфункции при ишемическом повреждении миокарда, кровоснабжаемого ветвями правой коронарной артерии [1]. ИМН развивается у 50% пациентов, перенесших инфаркт миокарда, причем умеренная или тяжелая ИМН встречается более чем у 10% из них [2, 3].
Распространенность ишемическая митральная регургитация (ИМР) растет, только в США она составляет от 1,6 до 2,9 млн человек [4]. Известно, что наличие митральной регургитации (МР) снижает выживаемость пациентов независимо от наличия ИБС. M.S. Hickey и соавт. в своем исследовании показали, что летальность пациентов, имеющих тяжелую МН, составляет 40%, умеренную – 17%, легкую – 10%. Летальность пациентов, не имеющих МН, составляет 6% [5]. У пациентов с ИБС ИМР повышает риски неблагоприятных сердечных событий. Так, в исследовании SAVE (Survival and Ventricular Enlargement) было продемонстрировано, что ИМР повышает риск смерти от сердечно-сосудистых событий у пациентов, перенесших трансмуральный инфаркт миокарда и имеющих проявления сердечной недостаточности (СН) – 5-летняя летальность в группе из 194 пациентов с ИМН составила 24%, без ИМН – 16% [6]. В настоящее время ИМР является одним из наиболее сложных проявлений ИБС с точки зрения выбора правильной методики лечения. Даже для опытной мультидисциплинарной команды специалистов, включающей кардиологов, врачей функциональной диагностики и кардиохирургов, ИМН зачастую не представляется легко решаемой проблемой. Накопленный опыт в области диагностики, консервативной терапии, определения показаний и тактики хирургического лечения ИМН на сегодняшний день неоднозначен, несмотря на множество проводимых исследований. В частности, остаются нерешенными такие важные проблемы, как определение предикторов рецидива ИМН после хирургического лечения, а также показания и выбор тактики оперативного лечения умеренной и пограничной ИМН.
История изучения, этиология, патогенез и место ишемической дисфункции митрального клапана в современной классификации митральной недостаточности
Впервые ИМН описал G.E. Burch в 1963 г., назвав данную патологию синдромом дисфункции папиллярных мышц, а позже ИМР [7].
Существует множество различных определений ИМН, основные аспекты которых можно изложить следующим образом: ИМН – это заболевание, возникшее в результате перенесенного инфаркта миокарда, при котором створки и хорды митрального клапана (МК) остаются интактными, но имеется дисбаланс между силами фиксации и силами закрытия створок МК [8–10]. В зависимости от выраженности МР, по данным эхокардиографии (ЭхоКГ), МН подразделяется на легкую, умеренную, пограничную и выраженную.
В нашей работе будут рассмотрены варианты лечения умеренной и пограничной МН. Согласно рекомендациям Американской Ассоциации Сердца по клапанной патологии, умеренная (прогрессирующая) МН характеризуется следующими ЭхоКГ-показателями: эффективная площадь отверстия регургитации (ERO) < 0,40 см2, объем регургитации (Rvol) < 60 мл, фракция регургитации (RF) < 50%, региональное нарушение движения стенок с ЛЖ с легким тетерингом одной из створок, дилатация фиброзного кольца МК с легким центральным нарушением коаптации створок.
Выраженной МН соответствуют следующие значения: эффективная площадь отверстия регургитации (ERO) ≥ 0,40 см2, объем регургитации (Rvol) ≥ 60 мл, фракция регургитации (RF) ≥ 50%, региональное нарушение движения стенок, сопровождающееся дилатацией ЛЖ, выраженным тетерингом одной из створок, дилатация фиброзного кольца МК с выраженным центральным нарушением коаптации створок [11].
С практической точки зрения целесообразно выделить пограничную МН, которой соответствуют следующие ЭхоКГ-критерии: эффективная площадь отверстия регургитации (ERO) = 0,30–0,45 см2, объем регургитации (Rvol) = 50–65 мл, фракция регургитации (RF) = 40–55%, региональное нарушение движения стенок с ЛЖ со значимым тетерингом одной из створок, дилатация фиброзного кольца МК с умеренным центральным нарушением коаптации створок. Стоит отметить, что данные ЭхоКГ-по-казатели пограничной ИМН не статичны, они варьируют в зависимости от физических нагрузок, системного артериального давления и других факторов.
Нарушение кровотока по коронарным артериям и, как следствие, возникновение инфаркта миокарда сегментов ЛЖ, лежащих под сосочковыми мышцами (чаще в области боковой или нижней стенки ЛЖ), приводит к ремоделированию данной области. В результате этого сосочковые мышцы смещаются апикально, латерально и кзади, а ЛЖ стремится принять сферическую форму (дилатация ЛЖ наиболее выражена в средней части задне-нижней стенки, на уровне крепления задней папиллярной мышцы). Развивается чрезмерное натяжение базальных хорд в систолу ЛЖ и уменьшение амплитуды систолического движения створок МК, уменьшается и смещается ближе к верхушке ЛЖ зона коаптации створок клапана.
При выполнении эхокардиографического исследования характерная деформация передней створки описывается как «симптом чайки» [12]. В зарубежной литературе силы, действующие на створки МК и обусловливающие их натяжение, называются «tethering», а состояние излишне натяженных створок МК – «tenting». Из-за патологического ремоделирования ЛЖ расширяется фиброзное кольцо МК (чаще в септолатеральном направлении), снижается систолическая функция ЛЖ, развивается сегментарная диастолическая дисфункция ЛЖ, обусловленная высокой жесткостью миокарда обеих папиллярных мышц и прилегающих сегментов миокарда ЛЖ, нарушается синхронная работа сосочковых мышц, развивается глобальная диссинхрония ЛЖ (особенно в базальных отделах). Патологический круг замыкается, и процесс носит самовоспроизводящийся характер, поскольку МР приводит к дилатации ЛЖ, что, в свою очередь, приводит к дальнейшему смещению папиллярных мышц, расширению фиброзного кольца МК и дальнейшему прогрессированию МР [13, 14].
Наиболее детальной и распространенной в мире классификацией МН является классификация A. Carpentier [15]. Дисфункция створок (с ограничением движения их краев в систолу), приводящая к наиболее распространенной форме ИМН, относится к типу IIIb, согласно данной классификации. ИМН, возникающая при нормальном движении створок, но обусловленная изолированной дилатацией фиброзного кольца клапана (аннулоэктазией), относится к I типу. У некоторых пациентов развивается ИМН II типа, характеризующаяся избыточной подвижностью створок МК. Такая дисфункция возникает в результате острой (разрыв сосочковой мышцы) или хронической (фиброз и удлинение сосочковой мышцы) ишемии миокарда.
Хирургическое лечение умеренной и пограничной ишемической митральной недостаточности
В настоящее время в распоряжении кардиохирургов имеется несколько стратегий коррекции нарушения запирательной функции МК ишемической природы. В случае наличия у пациента не более чем умеренной ИМН и возможности реваскуляризации (коронарного шунтирования (КШ)) коронарных артерий, кровоснабжающих участки миокарда, ответственные за возникновение МН (например, папиллярные мышцы), возможно выполнение КШ без вмешательства на МК.
Иной сценарий предполагает дополнение КШ пластическими вмешательствами на створках, фиброзном кольце клапана или папиллярных мышцах при пограничной ИМН, вызванной аннулоэктазией, удлинением папиллярных мышц или избытком тканей задней створки МК. При рестриктивных изменениях створок, вызванных рубцеванием общирных фрагментов стенки желудочка, выраженном расширении и значительном снижении сократительной функции ЛЖ, высоких прогностических рисках рецидива МН после выполнения клапаносохраняющей операции, а также в ряде других клинических ситуаций предпочтение отдается протезированию МК различными типами протезов.
Если в отношении выраженной ИМН актуальные клинические рекомендации однозначно предписывают выполнение оперативной или малоинвазивной коррекции клапанного порока, то для группы пациентов с умеренной и пограничной ИМН не существует общепринятой тактики хирургического лечения и критериев необходимости дополнения КШ сочетанным вмешательством на клапане.
Существует множество разнообразных точек зрения по данному вопросу, однако анализ нашего опыта хирургического лечения ИМН (в Клинике высоких медицинских технологий им. Н.И. Пирогова выполнено более 400 вмешательств по поводу данной патологии) показывает, что у большинства больных с умеренной ИМН и адекватным состоянием дистального коронарного русла предпочтительно воздержаться от вмешательства на клапане. В то же время в группе больных с пограничной ИМН и возможностью восстановить функцию клапана хирургическим путем предпочтительно выполнение клапаносохраняющих вмешательств. Тактика лечения наиболее часто встречаемых групп пациентов представлена на рисунке 1.
Имплантационная аннулопластика митрального клапана
Имплантация опорного кольца МК является «золотым стандартом» лечения большинства случаев умеренной / пограничной ИМН. Она может выполняться изолированно, однако при отрыве хорд первого порядка от створок МК или папиллярных мышц имплантация жесткого опорного кольца дополняет триангулярную или квадриангу-лярную (трапецевидную) резекцию створки МК.
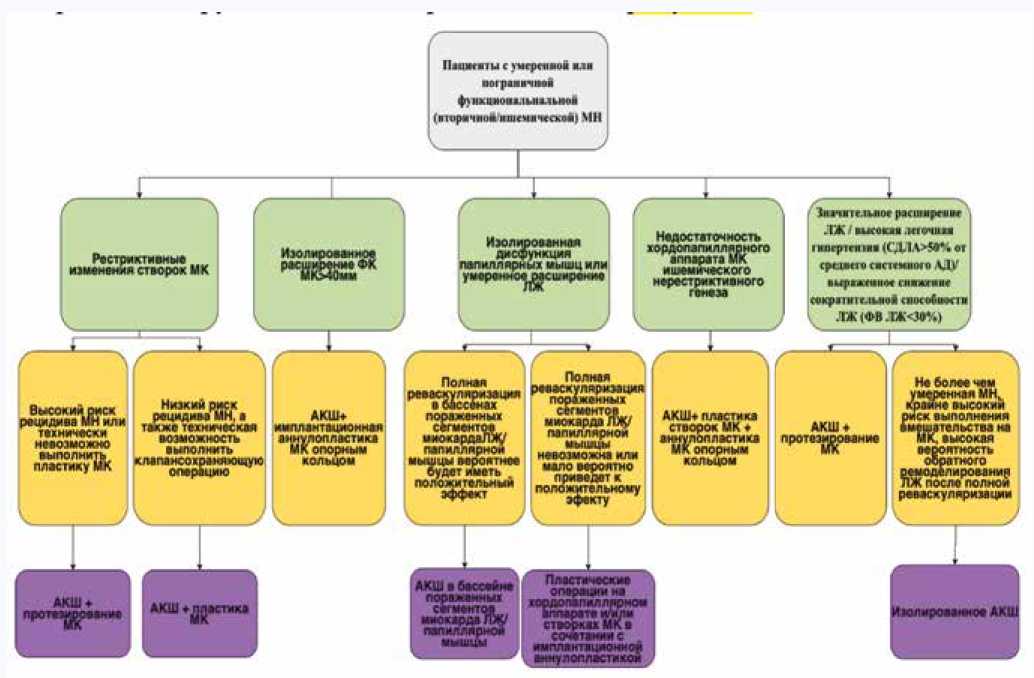
Рис. 1. Тактика лечения наиболее часто встречаемых групп пациентов с ишемической митральной недостаточностью Fig. 1. Treatment tactics for the most common groups of patients with ischemic mitral regurgitation
Возможно выполнение имплантационной аннулопла-стики совместно с продольной или поперечной пликацией скомпрометированных участков задней створки МК [16]. Опорные кольца, используемые для аннулопластики МК при ИМН, целесообразно классифицировать в зависимости от их жесткости и формы. Классификация опорных колец, а также их наиболее часто используемые российские и зарубежные модели представлены в таблице 1.
Таблица 1. Классификация опорных колец митрального клапана
Table 1. Classification of mitral valve support rings
|
Степень жесткости опорного кольца |
Форма |
Наиболее известные представители |
|
Иностранные |
||
|
Ригидные |
D-образные (замкнутые) плоские |
Carpentier-Edwards Classic |
|
Carbomedics Annuloflo |
||
|
Седловидные |
Carpentier-McCarthy-Adams IMR ETlogix |
|
|
GeoForm |
||
|
Prifile 3D |
||
|
Гибкие |
D-образные (замкнутые) |
Duran AnCore |
|
C-образные (разомкнутые) |
Cosgrove Edwards flexible band |
|
|
Полуригидные |
Седловидные |
Carpentier-Edwards Physio I |
|
Carpentier-Edwards Physio II |
||
|
D-образные (замкнутые) плоские |
Carbomedics Memo 3D |
|
|
C-образные (разомкнутые) |
Colwin Galloway Future Band |
|
|
Отечественные |
||
|
Стандартные полужесткие |
Разомкнутого контура |
МедИнж Standart |
|
Замкнутого контура без прогиба |
МедИнж D-ring 15 |
|
|
Замкнутого контура с прогибом |
МедИнж D-ring 16 НеоКор «Neo Ring» |
|
|
Жесткие |
Замкнутого контура |
МедИнж Rigid |
|
Мягкие |
Разомкнутого контура |
МедИнж C-FLEX |
|
Замкнутого контура |
МедИнж FLEX |
|
В зависимости от типа ИМН, согласно Carpentier, следует использовать то или иное опорное кольцо. Например, опорные кольца МедИнж Rigid, Carpentier-Edwards Classic, Carbomedics Annuloflo применяются при изолированной аннулодилатации (I тип). Диаметр данных колец значительно меньше, чем диаметр дилатированного фиброзного кольца МК, поэтому их имплантация демонстрирует достаточно надежную коррекцию ИМН. Кольца Ме-дИнж D-ring 16, НеоКор «Neo Ring», Carpentier-Edwards Physio, GeoForm рекомендуется использовать при симметричном смещении папиллярных мышц и формировании центральной струи регургитации (симметричный тип IIIb) [17]. Данные кольца имеют седловидную форму, что позволяет не только уменьшать переднезадний размер фиброзного кольца МК, но и подтягивать сегмент Р2 задней створки МК вверх и внутрь, к А2-сегменту передней створки. Данные типы колец имеют преимущества перед стандартными кольцами в отношении коррекции МР типа IIIb, так как при их имплантации отсутствует необходимость подбора кольца меньшего размера для достижения стойкого эффекта аннулопластики, что минимизирует риски формирования функционального митрального стеноза.
Кольцо Carpentier-McCarthy-Adams IMR Etlogix рекомендуется использовать в случае асимметричного смещения папиллярных мышц (асимметричный IIIb-тип) [18]. Данное кольцо имеет асимметричное углубление в проекции сегментов P2 и P3 задней створки МК, что позволяет увеличить коаптацию створок за счет подтягивания данных сегментов. Однако существуют исследования, сооб- щающие о формировании функционального митрального стеноза после установки кольца Carpentier – McCarthy – Adams IMR ETlogix [19].
Осложнения имплантационной аннулопластики митрального клапана
Функциональный митральный стеноз после имплантационной аннулопластики митрального клапана опорным кольцом
Постинфарктное ремоделирование ЛЖ и, как следствие, тетеринг хорд МК приводит к ограничению подвижности створок не только в систолу, но и в диастолу, что обусловливает вероятность формирования митрального стеноза даже при отсутствии сопутствующих органических поражений МК. Однако, как правило, степень рестрикции створок недостаточно велика для того, чтобы вызвать тяжелый митральный стеноз с выраженными клиническими проявлениями. Механика аннулопласти-ки МК при ИМР заключается в уменьшении фиброзного кольца МК на один или несколько размеров. Логичным результатом такого уменьшения может явиться функциональный стеноз МК. На рисунке 2 схематично представлен механизм формирования функционального митрального стеноза: до операции угол открытия створок а1 снижен, размер отверстия створок слегка уменьшен, а скорость потока наполнения увеличена. После имплантации опорного кольца размер отверстия МК еще больше уменьшается, а скорость потока наполнения значительно увеличивается [21].
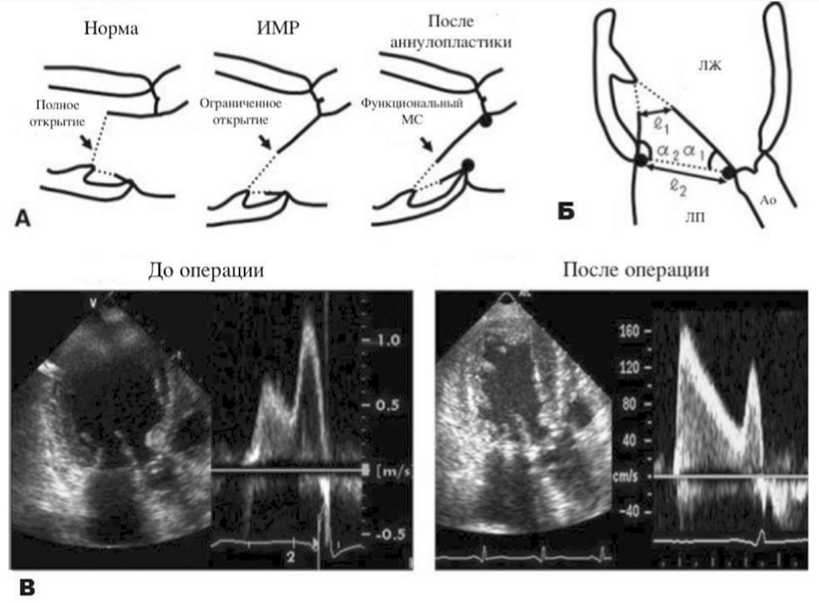
Рис. 2. Механизм формирования функционального митрального стеноза [21]
Примечание: A – схема механизма развития функционального митрального стеноза, Б – параметры количественной оценки подклапанного диастолического ограничения подвижности створок МК, В – ЭхоКГ-критерии: скорость открытия створок МК, скорость потока наполнения, размеры отверстия МК. ℓ1 – размер отверстия МК на уровне кончиков створок, ℓ2 – размер отверстия МК на уровне фиброзного кольца МК, а1, а2 – углы открытия створок, ЛЖ – левый желудочек, ЛП – левое предсердие, Ао – аорта.
Fig. 2. The mechanism of functional MS formation [21]
Note: MS – mitral stenosis.
Существует точка зрения, что развитие функционального митрального стеноза связано с величиной исходной легочной гипертензии [20]. K. Kubbota и соавт. считают, что имплантация 3D кольца меньшего размера, чем диаметр фиброзного кольца МК приводит к диастолической подклапанной фиксации створок [21]. Они предположили, что увеличение трансмитрального градиента вызывает уменьшение толерантности к физическим нагрузкам и повышение функционального класса хронической сердечной недостаточности (ХСН).
Однако P.B. Bertrand и соавт. опровергли эту точку зрения. В своем исследовании они показали, что трансмитральный градиент, развившийся после рестриктивной аннулопластики, выполняемой по поводу ИМР, не коррелирует с функциональной способностью пациентов, определяемой по максимальному поглощению кислорода во время велоэргометрии. Функциональные показатели пациентов зависят не только от трансмитрального градиента, но и от гемодинамических факторов, таких как сократительная способность ЛЖ и сердечный выброс, что говорит о том, что трансмитральный градиент не стоит интерпретировать как вредный фактор, его необходимо рассматривать в совокупности с гемодинамическими показателями [22].
В своем следующем исследовании авторы показали влияние EOAi (индексированное значение эффективной площади открытия клапана) на функциональные возможности пациентов после аннулопластики МК. Несмотря на фиксированный размер фиброзного кольца МК, размер EOA менялся у пациентов во время физической нагрузки. Это изменение (EOAi) говорит о том, что решающую роль в формировании функционального митрального стеноза у пациентов, перенесших аннулопластику фиброзного кольца, играет подклапанная диастолическая фиксация створок, а в частности диастолический тетеринг передней створки МК [23].
Рецидивирующая ишемическая митральная недостаточность после имплантационной аннулопластики митрального клапана
В ряде случаев установка некорректно подобранных гибких опорных колец или опорных колец разомкнутого контура приводит к возврату МН в послеоперационном периоде. Данное осложнение может остаться незамеченным во время основного этапа операции, а также во время интраоперационной чреспищеводной ЭхоКГ (ЧП-ЭхоКГ). Поэтому весьма важным является правильный подбор опорного кольца для аннулопластики в зависимости от этиологии и типа МН. Тем не менее рецидив МН после имплантационной аннулопласти-ки может произойти, несмотря на правильный выбор типа и размера опорного кольца. В этой связи интересно разобрать различные предикторы рецидива МН после хирургического лечения умеренной / пограничной ИМН.
Предикторы и факторы риска рецидива ИМН после выполнения изолированного КШ у пациентов с умеренной и пограничной ИМН
На сегодняшний день нет полного списка предикторов и факторов риска рецидива ИМН после выполнения аортокоронарного шунтирования (АКШ) без вмешательства на МК. Анализ немногочисленных литературных источников показал лишь некоторые наиболее очевидные пре- дикторы успеха такой операции и единичные факторы риска прогрессирования. М.Н. Penicka и соавт. в рандомизированном исследовании [24] обнаружили, что наличие жизнеспособного миокарда и отсутствие диссинхронии между сосочковыми мышцами являются благоприятными показателями уменьшения ИМР после АКШ. J. Braun и соавт. [25] продемонстрировали, что дооперационное расширение ЛЖ было в значительной степени нивелировано обратным ремоделированием и регрессированием ИМН после выполнения АКШ. D.S. Jeong и соавт. [26], а также K. Fattouch и соавт. [27] предположили, что у пациентов с умеренной ИМН и фракцией выброса (ФВ) ЛЖ менее 40% проведение АКШ без коррекции функции клапана не рекомендуется из-за высокой частоты рецидивирующей МР и смертности, связанной с последствиями ее прогрессирования. X. Sun [28] и ряд других авторов [29, 30] показали положительное влияние реваскуляризации задненижнего сегмента ЛЖ, которое характеризовалось обратным регионарным ремоделированием. Данный факт свидетельствует о том, что восстановление кровоснабжения задненижнего сегмента ЛЖ является предиктором благоприятного прогноза после АКШ у пациентов с умеренной и пограничной ИМР.
Предикторы рецидива ИМН после реконструктивных вмешательств на МК у пациентов с умеренной ИМН
Сочетанная операция коррекции порока МК и АКШ является перспективным методом устранения пограничной ИМН, однако в послеоперационном периоде также имеются значимые риски ее рецидива. Значительная часть факторов риска относятся к анатомическим (первичным и вторичным) особенностям строения клапана и подклапанных структур.
J. Magne и соавт. в своем исследовании выявили, что наиболее информативным предиктором прогрессирования МН у пациентов, перенесших рестриктивную аннуло-пластику по поводу ИМН, был угол задней створки ≥ 45°. R. Capoulade и соавт. [31] сообщили, что несоответствие размера кольца МК и систолического размера ЛЖ также связано с повышенным риском рецидива МР. Существуют и другие факторы, определяющие возврат МР у пациентов с умеренной ИМР после сочетанной пластики МК и АКШ (табл. 2) [32–42].
Таблица 2. Предикторы возврата митральной регургитации после сочетанной операции (коронарное шунтирование + аннулопластика митрального клапана)
Table 2. Predictors of MR return after combined surgery (CABG + MV annuloplasty)
|
Параметры |
Значение, указывающее на повышенный риск рецидива МН после хирургической коррекции |
|
Трансторакальное ЭхоКГ |
|
|
Площадь натяжения створок [32] |
≥ 2,5 см2 |
|
Высота натяжения створок [32] |
≥ 1 см |
|
Задний угол тетеринга [32] |
≥ 45° |
|
Угол тетеринга сегмента P3 [33] |
≥ 29,9° |
|
Передний угол тетеринга [34] |
≥ 39,5° |
|
Соотношение переднего и заднего углов тетеринга [34] |
≥ 0,76 |
|
Угол экскурсии передней створки [34] |
≤ 35° |
|
Окончание табл. 2 End of table 2 |
|
|
Параметры |
Значение, указывающее на повышенный риск рецидива МН после хирургической коррекции |
|
Дистальный угол передней створки [34] |
> 25° |
|
Межпапиллярная дистанция [35] |
> 20 мм |
|
Соотношение конечнодиастолического размера ЛЖ / площади поверхности тела [36] |
> 3,5 см/м2 |
|
Конечно-систолический объем ЛЖ [36] |
≥ 145 мл |
|
Индекс систолической сферичности [37] |
≥ 0,7 |
|
Индекс работоспособности миокарда [37] |
≥ 0,9 |
|
Индекс движения стенок [37] |
≥ 1,5 |
|
Диссинхрония папиллярных мышц [38] |
> 58 мс |
|
Кинетика базальной стенки ЛЖ [42] |
Аневризма / дискинез |
|
Диастолическая функция ЛЖ [39, 40] |
Рестриктивная ДД |
|
ЧП-ЭхоКГ |
|
|
Диаметр фиброзного кольца МК [40] |
≥ 37 мм |
|
Площадь натяжения [41] |
≥ 1,6 |
|
Note: MR – mitral regurgitation, CABG MV – mitral valve. |
– coronary artery bypass grafting, |
Сравнительные результаты сочетанной операции (коррекции порока МК и АКШ) и операцией изолированного АКШ у больных с пограничной ИМН
В настоящее время в литературе представлены различные точки зрения относительно целесообразности дополнения операции КШ вмешательством на МК при хирургической коррекции умеренной и пограничной ИМН.
Первая точка зрения представлена данными ряда исследований, показавшими, что сочетанная операция у пациентов с умеренной ИМР имеет лучшие отдаленные результаты по сравнению с изолированным АКШ [44, 45]. А.М. Чернявский и соавт. выявили статистически значимые различия в показателе отсутствия прогрессирования МН через год после операции: в группе сочетанной операции прогрессирование отсутствовало у 42% пациентов в сравнении с 3% в группе изолированного АКШ ( p < 0,001). Оба метода показали хорошие результаты в отношении улучшения клинического состояния пациентов с умеренной ИМР [43]. В.А. Чрагян и соавт. определили достоверную разницу в выживаемости между группами в ходе шестилетнего периода наблюдения: при выполнении КШ и КШ в сочетании с пластикой МК выживаемость составила 53 и 74% соответственно ( р = 0,05) [46].
После сочетанной операции АКШ и пластики МК отмечается значительно более стойкое снижение степени МР и уменьшение функционального класса ХСН по NYHA, чем при изолированном АКШ, что находит свое подтверждение в ряде работ [47, 48].
Противоположная точка зрения представлена в ряде клинических исследований, продемонстрировавших, что выполнение операции КШ, последующее обратное ремоделирование и восстановление сократительной способности ряда сегментов миокарда приводят к улучшению запирательной функции МК в долгосрочной перспективе. Например, в исследовании M.A. Narayanan и соавт. [49]
показано, что пациентам с умеренной ИМН вполне достаточно выполнение изолированного АКШ. Они представили метаанализ 11 крупных исследований со средним сроком наблюдения 35,3 мес. среди пациентов с умеренной ИМН, которым проводилось изолированное АКШ или АКШ + аннулопластика МК. Авторами были получены следующие результаты: смертность от всех причин, ранняя смертность и частота острых нарушений мозгового кровообращения были сопоставимы в обеих группах. Неблагоприятные события во время отдаленного периода наблюдения встречались реже в группе изолированного АКШ, а значимых различий в изменении ЭхоКГ-параме-тров (ФВ ЛЖ, КДО, КСО) получено не было.
-
L. Seese и соавт. [50] провели исследование, выводы которого согласуются с метаанализом M.A. Narayanan. В исследование были включены 528 пациентов с умеренным ИМН, которым было выполнено изолированное АКШ. Прогрессирование ИМН до тяжелой степени (2,2%) или повторные вмешательства на МК (0,2%) в течение 5 лет были признаны статистически незначимыми. Выживаемость через 30 дней (95,8%), 1 год (89,6%) и 5 лет (76,6%) была приемлемой. Кроме того, отсутствие повторной госпитализации по поводу прогрессирования СН составило 92,6% случаев через 30 дней после операции, 79,9% – через 1 год, 65,0% – через 5 лет. Дальнейший субанализ, сравнивающий АКШ с сочетанным КШ и аннулопластикой МК, показал сопоставимость групп по выживаемости, повторным госпитализациям, повторным вмешательствам на МК и выраженности резидуальной МР.
Из представленных данных можно сделать вывод, что выполнение АКШ без вмешательства на МК может быть достаточным и, возможно, лучшим вариантом для пациентов с умеренной ИМН и жизнеспособным миокардом, особенно в области нижне-латеральной стенки. Сочетанное восстановление запирательной функции МК может быть эффективным для пациентов с пограничной ИМР, сниженным объемом жизнеспособного миокарда, значимым расширением ЛЖ и меньшей вероятностью обратного ремоделирования ЛЖ после реваскуляризации.
Альтернативные клапаносохраняющие методики коррекции ишемической митральной недостаточности и их особенности
Установка кольца меньшего размера уменьшает латерально-перегородочный диаметр фиброзного кольца МК, но не устраняет непосредственную причину МР, а именно тетеринг створок МК (как диастолический, так и систолический), который ухудшает гемодинамические характеристики и может спровоцировать формирование функционального стеноза МК после аннулопластики МК опорным кольцом. В этой связи растет интерес к хирургическим методам, нацеленным на коррекцию функции подклапанного аппарата МК. Данные методы могут обеспечить лучшие отдаленные результаты, более стойкую коррекцию МР, в том числе и у пациентов, имеющих предикторы неудачи изолированной аннулопластики МК опорным кольцом. Мы постарались описать некоторые альтернативные процедуры, которые могут выполняться в дополнение к аннулопластике МК опорным кольцом.
-
M. Moscarelli и соавт. провели метаанализ, в который были включены 5 исследований и 404 пациента (214 имели дополнительные подклапанные процедуры и 190 изолированную аннулопластику). Первичными ко-
нечными точками были поздний рецидив умеренной МР, ремоделирование ЛЖ и глубина коаптации створок МК. Вторичными конечными точками были ранняя смертность, среднесрочная выживаемость и результаты операции. Дополнительные подклапанные процедуры были связаны со значительно меньшим количеством поздних рецидивов МР (отношение шансов (ОШ) 0,34; 95% доверительный интервал (ДИ) [0,18; 0,65], p = 0,0009), меньшим КСР ЛЖ (WMD –4,06; 95% ДИ [–6,10; –2,03], p = 0,0001) и уменьшением глубины коаптации створок (WMD –2,36; 95% ДИ [–5,01; –0,71], p = 0,009). Эти результаты были аналогичными даже в тех исследованиях,
в которых участвовали пациенты с высоким риском неудачи восстановления МК (глубина коаптации > 10 мм и площадь тентинга > 2,5 см2). Не было выявлено значимой разницы с точки зрения ранней смертности и среднесрочной выживаемости [51].
Аппроксимация сосочковых мышц
Головки передних и задних папиллярных мышц сближаются с помощью U -образного шва, усиленного двумя прокладками или расширенной трубкой из политетрафторэтилена, окружающей тела каждой папиллярной мышцы и удерживающей их вместе (рис. 3).
Имплантация опорного кольца меньшего размера
Имплантация опорного кольца меньшего размера с аппроксимацией папиллярных мышц
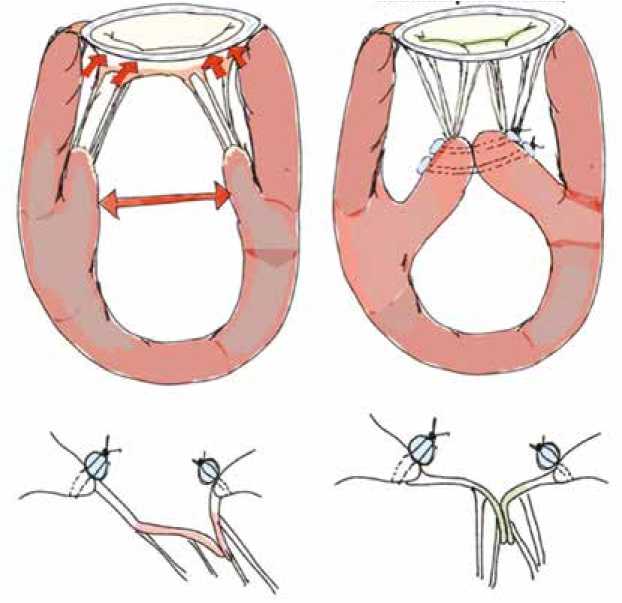
Рис. 3. Схема операции аппроксимации сосочковых мышц [59]
Fig. 3. Scheme of the papillary muscle approximation surgery [59]
В 2016 г. F. Nappi и соавт. [52] опубликовали результаты многоцентровых рандомизированных исследований по изучению влияния аппроксимации сосочковых мышц на отдаленные клинические исходы у пациентов с ИМР. Они сообщили о положительном влиянии на первичную конечную точку обратного ремоделирования ЛЖ (изменение КДР ЛЖ по сравнению с исходным уровнем) у пациентов в группе изолированной аннулопластики и группе сочетанной операции (аннулопластики и аппроксимации сосочковых мышц). Среднее уменьшение КДР по сравнению с исходным уровнем равнялось 5,8 и 0,2 мм соответственно, p < 0,001). Они также сообщили, что группа сочетанной операции имела более стойкую восстановленную конфигурацию МК и меньшую частоту рецидивов МР от умеренной до тяжелой степени через 5 лет (27% в группе сочетанной операции против 56% в группе изолированной аннулопластики, p = 0,01). Однако они не обна- ружили существенных различий в 5-летней выживаемости и качестве жизни оперированных пациентов.
C.G. Mihos и соавт. [53] в своем исследовании изучали влияние аппроксимации сосочковых мышц на обратное ремоделирование и ИМР у пациентов с вторичной МР (в том числе неишемического генеза). Исследователи сообщили о лучших показателях подклапанной геометрии и меньшем количестве рецидивов МР у пациентов, перенесших дополнительную аппроксимацию папиллярных мышц, в сравнении с пациентами, перенесшими изолированную аннулопластику опорным кольцом.
Перемещение сосочковых мышц
Перемещение (релокация) сосочковых мышц является еще одним дополнительным методом коррекции ИМН. Переднюю сосочковую мышцу перемещают кпереди или кзади в зависимости от типа поражения МК (рис. 4).
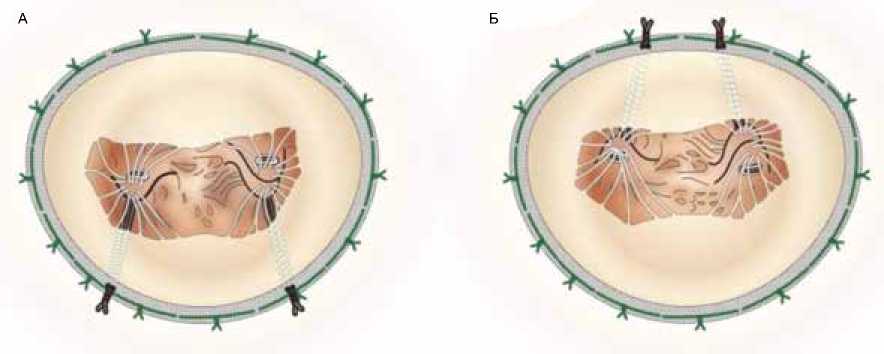
Рис. 4. Релокация передней сосочковой мышцы. A – рестриктивная аннулопластика с задней релокацией передней сосочковой мышцы, Б – рестриктивная аннулопластика с передней релокацией передней сосочковой мышцы [60]
Fig. 4. Relocation of papillary muscle. A – restrictive annuloplasty with posterior relocation of the papillary muscle, Б – restrictive annuloplasty with anterior relocation of the papillary muscle [60]
I.L. Kron и соавт. [54] сообщили о 18 случаях ИМР, осложненной нижним инфарктом миокарда, которые лечились путем перемещения задней сосочковой мышцы с сопутствующими АКШ и аннулопластикой опорным кольцом. Заднюю сосочковую мышцу перемещали сразу кзади правого фиброзного треугольника. Авторы пришли к выводу, что прямое перемещение сосочковых мышц может быть полезно для пациентов с минимально расширенным ЛЖ или региональными геометрическими изменениями ЛЖ.
K. Fattouch и соавт. [55] провели когортное исследование, в котором сравнивали 55 пациентов, перенесших двустороннюю релокацию папиллярных мышц в сочетании с митральной аннулопластикой опорным кольцом истинного размера, с пациентами, перенесшими изолированную аннулопластику с кольцом, уменьшенным на два размера. Перемещение папиллярной мышцы осуществлялось путем перемещения головки передней сосочковой мышцы и обеих головок задней сосочковой мышцы в соответствующее митральное кольцо. Их результаты показали снижение тетеринга в группе релокации передней сосочковой мышцы, что привело к значительному снижению частоты рецидивирующей МР (группа релокации передней сосочковой мышцы – 3,7%, изолированная группа аннулопластики – 11,5%).
Резекция хорд митрального клапана
В 2001 г. E. Messas и соавт. представили научному сообществу концепцию резекции хорд МК [56]. Постинфарктное ремоделирование искажает физиологию створок таким образом, что происходит ограничение их движения как в систолу, так и в диастолу. Наиболее интересной в данном контексте выступает передняя створка МК, тетеринг которой и играет существенную роль в формировании МР. Перерезание вторичных хорд передней створки МК уменьшает тетеринг и увеличивает ее подвижность, что приводит к снижению МР.
A.M. Calafiore и соавт. [57] провели анализ пациентов с ИМР, у которых глубина коаптации составляла ≤ 10 мм, угол изгиба передней створки был < 145°, которым была проведена только аннулопластика или аннулопластика в сочета- нии с процедурой рассечения вторичных хорд. Они пришли к выводу, что резекция хорд связана с более низкой частотой рецидивов МР, увеличением ФВ ЛЖ и улучшением функционального класса ХСН по NYHA в среднесрочном периоде наблюдения. Однако поскольку вторичные хорды прикрепляются к желудочковой стороне створки и усиливают систолическую функцию ЛЖ [58], ответ на вопрос, влияет ли эта процедура, разобщающая митрально-папиллярный комплекс, на долгосрочную систолическую функцию ЛЖ, в настоящее время еще не получен.
Заключение
Наиболее распространенными методами оперативного лечения ИМН в настоящее время остаются изолированное КШ, сочетанная операция АКШ и клапаносохраняющего вмешательства на МК или добавление к этим методам дополнительной процедуры на подклапанном аппарате МК. Сохраняется общемировая тенденция к минимизации объема оперативного вмешательства у пациентов с умеренной ИМН и жизнеспособным миокардом – полная реваскуляризация миокарда методом КШ позволяет эффективно восстановить запирательную функцию МК у большинства таких пациентов. В случаях, требующих прямого вмешательства на клапане, предпочтительно выполнение клапаносохраняющих вмешательств.
Важно понимать, что физиологические и анатомические механизмы возникновения и прогрессирования ИМН весьма многогранны, а многие клинические случаи выходят за рамки шаблонов и клинических рекомендаций, поэтому прямолинейных и простых подходов к ее лечению не существует. Окончательное решение о необходимости и оптимальной методике хирургической коррекции ИМН в каждом отдельном случае принимается командой специалистов с учетом всех особенностей пациента и накопленного мирового опыта.
Дальнейшее изучение и предоперационная оценка предикторов и факторов риска рецидива МН и неблагоприятного клинического исхода представляется наиболее перспективной. Понимание этого позволит кардиологам и кардиохирургам принимать более прогнозируемые и обоснованные клинические решения.
Список литературы Хирургическое лечение пациентов с умеренной и пограничной ишемической митральной недостаточностью на современном этапе
- Mil-Homens Luz F., Amorim M.J. Ischemic mitral regurgitation - to repair or replace? Looking beyond the valve. Port. J. Card. Thorac. Vasc. Surg. 2022;29(1):25-34. https://doi.org/10.48729/pjctvs.253.
- Calafiore A.M., Prapas S., Katsavrias K., Totaro A., Di Marco M., Guarracini S. et al. Ischemic mitral regurgitation: Changing rationale of reparative surgical strategy. Hellenic J. Cardiol. 2021;62(1):35-37. https://doi.org/10.1016/j.hjc.2020.12.003.
- Beeri R. Ischemic mitral regurgitation and leaflet remodeling: Another arrow hits the target. J. Am. Coll. Cardiol. 2022;80(5):511-512. https://doi.org/10.1016/j.jacc.2022.05.023.
- Servito T., Elbatarny M., Yanagawa B., Dokollari A., Bisleri G. Surgical repair of ischemic mitral regurgitation: One ring does not fit all. Curr. Opin. Cardiol. 2021;36(2):154-162. https://doi.org/10.1097/HCO.0000000000000827.
- Hickey M.S., Smith L.R., Muhlbaier L.H., Harrell F.E. Jr., Reves J.G., Hinohara T. et al. Current prognosis of ischemic mitral regurgitation. Implications for future management. Circulation. 1988;78(3_Pt_2):I51-I59.
- Nonaka D.F., Fox A.A. Ischemic mitral regurgitation: Repair, replacement or nothing. Semin. Cardiothorac. Vasc. Anesth. 2019;23(1):11-19. https://doi.org/10.1177/1089253218792921.
- Burch G.E., De Pasquale N.P., Phillips J.H. The syndrome of papillary muscle dysfunction. Am. Heart. J. 1968;75(3):399-415. https://doi.org/10.1016/0002-8703(68)90097-5.
- Vinciguerra M., Grigioni F., Romiti S., Benfari G., Rose D., Spadaccio C. et al. Ischemic mitral regurgitation: A multifaceted syndrome with evolving therapies. Biomedicines. 2021;9(5):447. https://doi.org/10.3390/biomedicines9050447.
- Vinciguerra M., Romiti S., Wretschko E., D’Abramo M., Rose D., Miraldi F. et al. Mitral plasticity: The way to prevent the burden of ischemic mitral regurgitation? Front. Cardiovasc. Med. 2022;8:794574. https://doi.org/10.3389/fcvm.2021.794574.
- Yamazaki S., Numata S., Yaku H. Surgical intervention for ischemic mitral regurgitation: How can we achieve better outcomes? Surg. Today. 2020;50(6):540-550. https://doi.org/10.1007/s00595-019-01823-8.
- Otto C.M., Nishimura R.A., Bonow R.O., Carabello B.A., Erwin J.P. 3rd, Gentile F. et al. 2020 ACC/AHA Guideline for the management of patients with valvular heart disease: Executive summary: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2021;143(5):е35- е71. https://doi.org/10.1161/CIR.000000000000932.
- Piatkowski R., Kochanowski J., Budnik M., Peller M., Grabowski M., Opolski G. Stress echocardiography protocol for deciding type of surgery in ischemic mitral regurgitation: Predictors of mitral regurgitation recurrence following CABG alone. J. Clin. Med. 2021;10(21):4816. https://doi.org/10.3390/jcm10214816.
- Hadjadj S., Marsit O., Paradis J.M., Beaudoin J. Pathophysiology, diagnosis, and new therapeutic approaches for ischemic mitral regurgitation. Can. J. Cardiol. 2021;37(7):968-979. https://doi.org/10.1016/j.cjca.2020.12.011.
- Бузиашвили Ю.И., Кокшенева И.В., Абуков С.Т., Абдуллаев А.А. Значение функции папиллярных мышц митрального клапана и прилежащих сегментов миокарда левого желудочка в прогрессировании ишемической митральной регургитации у больных ишемической болезнью сердца после хирургического лечения. Терапевтический архив. 2015;87(8):915. https://doi.org/10.17116/terarkh20158789-15.
- Carpentier A. Cardiac valve surgery - the “French correction”. J. Thorac. Cardiovasc. Surg. 1983;86(3):323-337.
- Schaff H.V., Nguyen A. Contemporary techniques for mitral valve repair - the Mayo Clinic experience. Indian J. Thorac. Cardiovasc. Surg. 2020;36(Suppl_1):18-26. https://doi.org/10.1007/s12055-019-00801-6.
- Kuralay E. Mitral ring annuloplasty by biological material. Turk. Gogus. Kalp. Damar. Cerrahisi. Derg. 2022;30(4):645-648. https://doi.org/10.5606/tgkdc.dergisi.2022.23578.
- Chotivatanapong T. Mitral annuloplasty ring design and selection: Complete semi-rigid is best. JTCVS Tech. 2021;10:55-57. https://doi.org/10.1016/j.xjtc.2021.10.036.
- Del Forno B., Castiglioni A., Sala A., Geretto A., Giacomini A., Denti P. et al. Mitral valve annuloplasty: Tutorial (video). Multimed. Man. Cardiothorac. Surg. 2017:016. https://doi.org/10.1510/mmcts.2017.016.
- Pierce E.L., Bloodworth C.H., Imai A., Begum S., Soomro M.A., Naseeb Kh. et al. Mitral annuloplasty ring flexibility preferentially reduces posterior suture forces. J. Biomech. 2018;75:58-66. https://doi.org/10.1016/j.jbiomech.2018.04.043.
- Kubota K., Otsuji Y., Ueno T. et al. Functional mitral stenosis after surgical annuloplasty for ischemic mitral regurgitation: importance of subvalvular tethering in the mechanism and dynamic deterioration during exertion. J. Thorac. Cardiovasc. Surg. 2010;140(3):617-623. https://doi.org/10.1016/j.jtcvs.2009.11.00342.
- Bertrand P.B., Gutermann H., Smeets C.J., Van Kerrebroeck C., Verhaert D., Vandervoort P. et al. Functional impact of transmitral gradients at rest and during exercise after restrictive annuloplasty for ischemic mitral regurgitation. J. Thorac. Cardiovasc. Surg. 2014;148(1):183-187. https://doi.org/10.1016/j.jtcvs.2013.10.013.
- Bertrand P.B., Verbrugge F.H., Verhaert D., Smeets C.J., Grieten L., Mullens W. et al. Mitral valve area during exercise after restrictive mitral valve annuloplasty: Importance of diastolic anterior leaflet tethering. J. Am. Coll. Cardiol. 2015;65(5):452-461. https://doi.org/10.1016/j.jacc.2014.11.037.
- Penicka M., Linkova H., Lang O. et al. Predictors of improvement of unrepaired moderate ischemic mitral regurgitation in patients undergoing elective isolated coronary artery bypass graft surgery. Circulation. 2009;120(15):1474-1481. https://doi.org/10.1161/CIRCULATIONAHA.108.842104.
- Braun J., Bax J.J., Versteegh M.I., Voigt P.G., Holman E.R., Klautz R.J. et al. Preoperative left ventricular dimensions predict reverse remodeling following restrictive mitral annuloplasty in ischemic mitral regurgitation. Eur. J. Cardiothorac. Surg. 2005;27(5):847-853. https://doi.org/10.1016/j.ejcts.2004.12.031.
- Jeong D.S., Lee H.Y., Kim W.S., Sung K., Park P.W., Lee Y.T. Off pump coronary artery bypass versus mitral annuloplasty in moderate ischemic mitral regurgitation. Ann. Thorac. Cardiovasc. Surg. 2012;18(4):322- 330. https://doi.org/10.5761/atcs.oa.11.01845.
- Fattouch K., Sampognaro R., Speziale G. et al. Impact of moderate ischemic mitral regurgitation after isolated coronary artery bypass grafting. Ann. Thorac. Surg. 2010;90(4):1187-1194. https://doi.org/10.1016/j.athoracsur.2010.03.103.
- Sun X., Huang J., Shi M., Huang G., Pang, L., Wang Y. Predictors of moderate ischemic mitral regurgitation improvement after off-pump coronary artery bypass. J. Thorac. Cardiovasc. Surgery. 2015;149(6):1606- 1612. https://doi.org/10.1016/j.jtcvs.2015.02.047.
- Poh K.K., Lee G.K., Lee L.C., Chong E., Chia B.L., Yeo T.C. Reperfusion therapies reduce ischemic mitral regurgitation following inferoposterior ST-segment elevation myocardial infarction. Coron. Artery. Dis. 2012;23(8):555-559. https://doi.org/10.1097/MCA.0b013e32835aab65.
- Hwang H.Y., Lim J.H., Oh S.J., Paeng J.C., Kim K.B. Improved functional mitral regurgitation after off-pump revascularization in acute coronary syndrome. Ann. Thorac. Surg. 2012;94(4):1157-1165. https://doi.org/10.1016/j.athoracsur.2012.04.118.
- Capoulade R., Zeng X., Overbey J.R. et al. Impact of left ventricular to mitral valve ring mismatch on recurrent ischemic mitral regurgitation after ring annuloplasty. Circulation. 2016;134(17):1247-1256. https://doi.org/10.1161/CIRCULATIONAHA.115.021014.
- Magne J., Pibarot P., Dagenais F., Hachicha Z., Dumesnil J.G., Sénéchal M. Preoperative posterior leaflet angle accurately predicts outcome after restrictive mitral valve annuloplasty for ischemic mitral regurgitation. Circulation. 2007;115(6):782-791. https://doi.org/10.1161/CIRCULATIONAHA.106.649236
- Bouma W., Lai E.K., Levack M.M. et al. Preoperative three-dimensional valve analysis predicts recurrent ischemic mitral regurgitation after mitral annuloplasty. Ann. Thorac. Surg. 2016;101(2):567-575. https://doi.org/10.1016/j.athoracsur.2015.09.076.
- Sun X., Jiang Y., Huang G., Huang J., Shi M., Pang L. et al. Threedimensional mitral valve structure in predicting moderate ischemic mitral regurgitation improvement after coronary artery bypass grafting. J. Thorac. Cardiovasc. Surg. 2019;157(5):1795-1803.e2. https://doi.org/10.1016/j.jtcvs.2018.09.018.
- Sun X., Huang G., Huang J., Shi M., Wang F., Pang L. et al. Left ventricular regional dyssynchrony predicts improvements in moderate ischaemic mitral regurgitation after off-pump coronary artery bypass. Eur. J. Cardiothorac. Surg. 2018;54(1):84-90. https://doi.org/10.1093/ejcts/ezy024.
- Teng Z., Ma X., Zhang Q., Yun Y., Ma C., Hu S. et al. Additional mitral valve procedure and coronary artery bypass grafting versus isolated coronary artery bypass grafting in the management of significant functional ischemic mitral regurgitation: a meta-analysis. J. Cardiovasc. Surg. (Torino). 2017;58(1):121-130. https://doi.org/10.23736/S0021-9509.16.08852-2.
- Gelsomino S., Lorusso R., De Cicco G., Capecchi I., Rostagno C., Caciolli S. et al. Five-year echocardiographic results of combined undersized mitral ring annuloplasty and coronary artery bypass grafting for chronic ischaemic mitral regurgitation. Eur. Heart. J. 2008;29(2):231-240. https://doi.org/10.1093/eurheartj/ehm468.
- Van Garsse L., Gelsomino S., Parise O., Lucà F., Cheriex E., Lorusso R. et al. Systolic papillary muscle dyssynchrony predicts recurrence of mitral regurgitation in patients with ischemic cardiomyopathy (ICM) undergoing mitral valve repair. Echocardiography. 2012;29(10):1191-1200. https://doi.org/10.1111/j.1540-8175.2012.01789.x.
- Gelsomino S., Lorusso R., Billè G., Rostagno C., De Cicco G., Romagnoli S. et al. Left ventricular diastolic function after restrictive mitral ring annuloplasty in chronic ischemic mitral regurgitation and its predictive value on outcome and recurrence of regurgitation. Int. J. Cardiol. 2009;132(3):419-428. https://doi.org/10.1016/j.ijcard.2007.12.058.
- Ereminiene E., Vaskelyte J., Benetis R., Stoskute N. Ischemic mitral valve repair: predictive significance of restrictive left ventricular diastolic filling. Echocardiography. 2005;22(3):217-224. https://doi.org/10.1111/j.0742-2822.2005.03108.x.
- Kongsaerepong V., Shiota M., Gillinov A.M., Song J.M., Fukuda S., Mc-Carthy P.M. et al. Echocardiographic predictors of successful versus unsuccessful mitral valve repair in ischemic mitral regurgitation. Am. J. Cardiol. 2006;98(4):504-508. https://doi.org/10.1016/j.amjcard.2006.02.056.
- Kron I.L., Hung J., Overbey J.R., Bouchard D., Gelijns A.C., Moskowitz A.J. et al. Predicting recurrent mitral regurgitation after mitral valve repair for severe ischemic mitral regurgitation. J. Thorac. Cardiovasc. Surg. 2015;149(3):752-61.e1. https://doi.org/10.1016/j.jtcvs.2014.10.120.
- Чернявский А.М., Разумахин Р.А., Эфендиев В.У., Рузматов Т.М., Подсосникова Т.Н. и др. Отдаленные результаты хирургического лечения умеренной ишемической митральной недостаточности у пациентов с сохраненной фракцией выброса левого желудочка. Патология кровообращения и кардиохирургия. 2015;19(2):63-71. https://doi.org/10.21688/1681-3472-2015-2-63-71.
- Smith P.K., Puskas J.D., Ascheim D.D., Voisine P., Gelijns A.C., Moskowitz A.J. et al. Surgical treatment of moderate ischemic mitral regurgitation. N. Engl. J. Med. 2014;371(23):2178-2188. https://doi.org/10.1056/NEJMoa1410490.
- El-Hag-Aly M.A., El Swaf Y.F., Elkassas M.H., Hagag M.G., Allam H.K. Moderate ischemic mitral incompetence: does it worth more ischemic time? Gen. Thorac. Cardiovasc. Surg. 2020;68(5):492-498. https://doi.org/10.1007/s11748-019-01212-5.
- Чрагян В.А., Арутюнян В.Б., Дьячков С.И. Результаты одномоментной коррекции ишемической митральной недостаточности и коронарного шунтирования у больных с осложненными формами ишемической болезни сердца. Пермский медицинский журнал. 2017;34(3):25-32. https://doi.org/10.17816/pmj34325-32.
- Salmasi M.Y., Harky A., Chowdhury M.F., Abdelnour A., Benjafield A., Suker F. et al. Should the mitral valve be repaired for moderate ischemic mitral regurgitation at the time of revascularization surgery? J. Card. Surg. 2018;33(7):374-384. https://doi.org/10.1111/jocs.13722.
- Khallaf A., Elzayadi M., Alkady H., El Naggar A. Results of coronary artery bypass grafting alone versus combined surgical revascularization and mitral repair in patients with moderate ischemic mitral regurgitation. Heart Surg. Forum. 2020;23(3):E270-E275. https://doi.org/10.1532/hsf.2773.
- Anantha Narayanan M., Aggarwal S., Reddy Y.N.V., Alla V.M., Baskaran J., Kanmanthareddy A. et al. Surgical repair of moderate ischemic mitral regurgitation - A systematic review and meta-analysis. Thorac. Cardiovasc. Surg. 2017;65(6):447-456. https://doi.org/10.1055/s-0036-1598012.
- Seese L., Deitz R., Dufendach K., Sultan I., Aranda-Michel E., Gleason T.G. et al. Midterm outcomes of isolated coronary artery bypass grafting in the setting of moderate ischemic mitral regurgitation. J. Surg. Res. 2022;278:317-324. https://doi.org/10.1016/j.jss.2022.04.043.
- Moscarelli M., Athanasiou T., Speziale G., Punjabi P.P., Malietzis G. Lancellotti P. et al. The value of adding sub-valvular procedures for chronic ischemic mitral regurgitation surgery: a meta-analysis. Perfusion. 2017;32(6):436-445. https://doi.org/10.1177/0267659117693683.
- Nappi F., Lusini M., Avtaar Singh S.S., Santana O., Chello M., Mihos C.G. Risk of ischemic mitral regurgitation recurrence after combined valvular and subvalvular repair. Ann. Thor. Surg. 2019;108(2):536-543. https://doi.org/10.1016/j.athoracsur.2018.12.030.
- Mihos C.G., Yucel E., Santana O. The role of papillary muscle approximation in mitral valve repair for the treatment of secondary mitral regurgitation. Eur. J. Card. Thorac. Surg. 2017;51(6):1023-1030. https://doi.org/10.1093/ejcts/ezw384.
- Kron I.L., Green G.R., Cope J.T. Surgical relocation of the posterior papillary muscle in chronic ischemic mitral regurgitation. Ann. Thorac. Surg. 2002;74(2):600-601. https://doi.org/10.1016/s0003-4975(02)03749-9.
- Fattouch K., Lancellotti P., Castrovinci S. Murana G., Sampognaro R., Corrado E. et al. Papillary muscle relocation in conjunction with valve annuloplasty improve repair results in severe ischemic mitral regurgitation. J. Thorac. Cardiovasc. Surg. 2012;143(6):1352-1355. https://doi.org/10.1016/j.jtcvs.2011.09.062.
- Messas E., Guerrero J.L., Handschumacher M.D., Conrad C., Chow C.M., Sullivan S. et al. Chordal cutting: a new therapeutic approach for ischemic mitral regurgitation. Circulation. 2001;104(16):1958-1963. https://doi.org/10.1161/hc4201.097135.
- Calafiore A.M., Refaie R., Iacò A.L., Asif M., Al Shurafa H.S., Al-Amri H. et al. Chordal cutting in ischemic mitral regurgitation: a propensity-matched study. J. Thorac. Cardiovasc. Surg. 2014;148(1):41-46. https://doi.org/10.1016/j.jtcvs.2013.07.036.
- Nielsen S.L., Timek T.A., Green R.G., Dagum P., Daughters G.T., Hasenkam M.J. et al. Influence of anterior mitral leaflet second-order chordae tendineae on left ventricular systolic function. Circulation. 2003;108(4):486-491. https://doi.org/10.1161/01.CIR.0000080504.70265.05.
- Zhan-Moodie S., Xu D., Suresh K.S., He Q., Onohara D., Kalra K. et al. Papillary muscle approximation reduces systolic tethering forces and improves mitral valve closure in the repair of functional mitral regurgitation. JTCVS open. 2021;7:91-104. https://doi.org/10.1016/j.xjon.2021.04.008.
- Oi K., Arai H., Nagaoka E., Fujiwara T., Oishi K., Takeshita M. et al. Long-term outcomes of papillary muscle relocation anteriorly for functional mitral regurgitation. Interact. Cardiovasc. Thorac. Surg. 2022;35(6):ivac245. https://doi.org/10.1093/icvts/ivac245.


