Хирургическое лечение патологии торакоабдоминального отдела аорты
Автор: Марченко А.В., Мялюк П.А., Петрищев А.А., Арутюнян В.Б., Орехова Е.Н., Кадыралиев Б.К., Мусаев О.Г., Вронский А.С., Синельников Ю.С.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.36, 2021 года.
Бесплатный доступ
Материал и методы. С января 2016 г. по декабрь 2020 г. в Федеральном центре сердечно-сосудистой хирургии имени С.Г. Суханова Министерства здравоохранения Российской Федерации были прооперированы 29 пациентов с патологией торакоабдоминальной аорты, из них 19 пациентов - с аневризмой торакоабдоминальной аорты, 6 пациентов - с расслоением аорты III типа и 4 пациента - с корригированным I типом расслоения аорты. Средний возраст пациентов составил 58 ± 12 лет и варьировал от 29 до 73 лет. В Центре разработан и внедрен в клиническую практику новый метод реконструкции торакоабдоминальной аорты, направленный на минимизацию времени ишемии висцеральных органов. Протезирование начинается с дистального шунтирования подвздошных артерий, затем без пережатия аорты при естественном кровообращении производится поэтапный дебраншинг левой почечной артерии, верхней брыжеечной артерии, чревного ствола. И только на этапе протезирования правой почечной артерии и межреберных артерий подключается обход левого желудочка - ЛЖ (легочная вена - бранша протеза), пережимается и вскрывается аорта. Последним этапом выполняется проксимальный анастомоз на уровне перешейка аорты.Результаты. Общая послеоперационная летальность составила 13,7% (4 пациента). Острая почечная недостаточность, потребовавшая почечно-заместительной терапии, была выявлена в 10,3% случаев. Спинальные осложнения в виде временной параплегии отмечались у 2 пациентов (6,9%). Дыхательная недостаточность выявлена у 4 больных (13,7%). Кровотечение, требующее повторной операции, возникло у 1 пациента (3,4%).Выводы. Предложенная новая методика хирургической реконструкции торакоабдоминальной аорты позволяет уменьшить время пережатия аорты, время искусственного кровообращения, ишемию внутренних органов и спинного мозга, что непосредственно влияет на улучшение результатов хирургического лечения этой тяжелой категории пациентов.
Торакоабдоминальная аорта, аневризма аорты, протезирование аорты
Короткий адрес: https://sciup.org/149136643
IDR: 149136643 | УДК: 616.135/.136-089.8 | DOI: 10.29001/2073-8552-2021-36-1-82-91
Текст научной статьи Хирургическое лечение патологии торакоабдоминального отдела аорты
На сегодняшний день открытая хирургия торакоабдоминальных аневризм аорты остается достаточно сложным хирургическим вмешательством. Несмотря на развитие различных методик защиты органов, протезирование торакоабдоминального отдела аорты ассоциировано с большим количеством осложнений и высоким риском смертности [1–3]. Наиболее опасными послеоперационными осложнениями после открытых вмешательств являются параплегия вследствие ишемии спинного мозга и острая почечная недостаточность, которая зачастую впоследствии требует пожизненного диализа. Подобные осложнения возникают вследствие мальперфузии органов во время протезирования аорты. Минимизация ишемического повреждения во время реконструкции торакоабдоминальной аневризмы аорты остается главной целью предупреждения вышеописанных осложнений [4–6]. Применение различных методов защиты внутренних органов и спинного мозга позитивно сказывается на результатах хирургического лечения торакоабдоминальной аорты [7, 8].
Материал и методы
С января 2016 г. по декабрь 2020 г. в Федеральном центре сердечно-сосудистой хирургии имени С.Г. Суханова Министерства здравоохранения Российской Федерации
(ФЦССХ им. С.Г. Суханова) были прооперированы 29 пациентов с патологией торакоабдоминальной аорты, из них 19 пациентов – с аневризмой торакоабдоминальной аорты, 6 пациентов с расслоением аорты III типа и 4 пациента – с корригированным I типом расслоения аорты. Средний возраст пациентов, среди которых было 20 мужчин и 9 женщин, составил 58 ± 12 лет и варьировал от 29 до 73 лет.
Оперативная техника
Традиционно операция на торакоабдоминальной аорте выполняется в условиях обхода левого желудочка (ЛЖ) путем канюляции левого предсердия и бедренной артерии или непосредственно аорты. Первым этапом пережимается аорта выше или ниже подключичной артерии, выполняется проксимальный анастомоз на уровне перешейка аорты. Затем последовательно выполняется реимплантация висцеральных артерий и межреберных артерий, заключительным этапом накладывается дистальный анастомоз на уровне бифуркации аорты.
В ФЦССХ им. С.Г. Суханова в 2016 г. разработан и внедрен в клиническую практику новый метод реконструкции торакоабдоминальной аорты, направленный на минимизацию времени ишемии висцеральных органов. Предложенная нами методика переворачивает последовательность операции «с головы на ноги». Мы начинаем операцию не с пережатия аорты и выполнения первым этапом проксимального анастомоза, а, наоборот, без пережатия аорты выполняем первым этапом дистальные анастомозы «конец в бок» с подвздошными артериями. Затем также без пережатия аорты и без искусственного кровообращения поэтапно производим протезирование левой почечной артерии, верхней брыжеечной артерии, чревного ствола (дебраншинг вперед). На этом этапе кровоснабжение внутренних органов и спинного мозга осуществляется естественным способом через аневризматическую аорту, ретроградно через подвздошные артерии заполняется многобраншевый протез и поэтапно реимплантированные висцеральные артерии. И только на этапе протезирования правой почечной артерии и реимплантации межреберных артерий мы подключаем обход ЛЖ, пережимаем и вскрываем аневризматическую аорту. При этом канюляция осуществляется через левую нижнюю легочную вену в левое предсердие без вскрытия перикарда. Артериальная линия подключается через дополнительную браншу в многобраншевом протезе. На этом этапе кровоснабжение внутренних органов осуществляется за счет обхода ЛЖ (левая нижняя легочная вена – бранша протеза). Последним этапом мы накладываем проксимальный анастомоз на уровне перешейка аорты. Схема и последовательность выполнения анастомозов при хирургическом лечении торакоабдоминальной аорты по нашей методике представлена на рисунке 1.
В качестве примера приводим клинический случай пациентки Р., 29 лет, поступившей в Центр с диагнозом: хроническое расслоение аорты III типа по DeBakey. По данным мультиспиральной компьютерной томографии (МСКТ) было выявлено, что расслоение начинается непосредственно от устья левой подключичной артерии. Проксимальная фенестрация на 5 мм дистальнее устья левой подключичной артерии, с максимальным размером аорты на уровне перешейка 73 мм. На рисунке 2 представлены данные компьютерной томографии до операции.
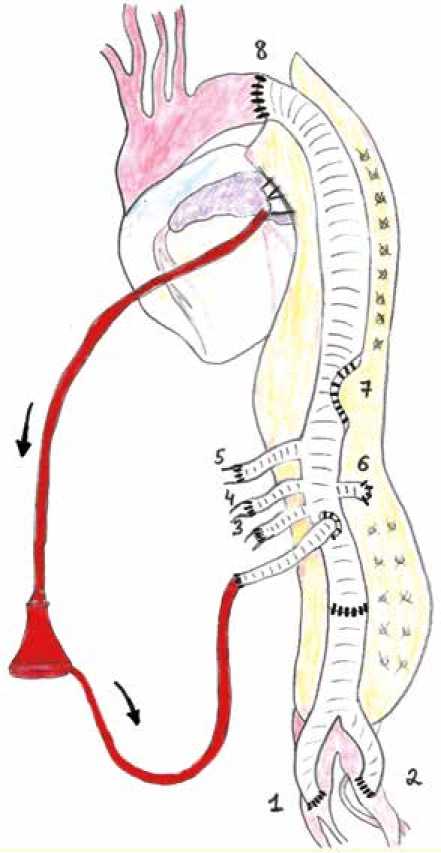
Рис. 1. Последовательность выполнения анастомозов при хирургии торакоабдоминальной аорты. Анастомозы без искусственного кровообращения: с правой подвздошной артерией № 1, левой подвздошной артерией № 2, левой почечной артерией № 3, верхней брыжеечной артерией № 4, чревным стволом № 5. Анастомозы с искусственным кровообращением: с правой почечной артерией № 6, площадкой межреберных артерий № 7, проксимальный анастомоз на уровне перешейка аорты № 8
Fig. 1. The steps of creating the anastomoses in thoracoabdominal aortic surgery. Anastomoses without cardiopulmonary bypass: right iliac artery (1), left iliac artery (2), left renal artery (3), superior mesenteric artery (4), and celiac trunk (5). Anastomoses with cardiopulmonary bypass: right renal artery (6), intercostal arteries (7), and proximal anastomosis at the level of aortic isthmus (8)
В протокол операции обязательно входит установка спинального дренажа и мониторинг давления спинномозговой жидкости. Операционный доступ через торако-френолюмботомию по 4-му межреберью. Мобилизованы: вся торакоабдоминальная аорта, висцеральные артерии и подвздошные артерии. Сформирован неопротез из сосудистого многобраншевого протеза Coselli № 22, сосудистого бифуркационного протеза № 20/10/10 с формированием дополнительной бранши протеза № 10 для перфузии во время обхода ЛЖ. На рисунке 3 представлен сформированный неопротез.
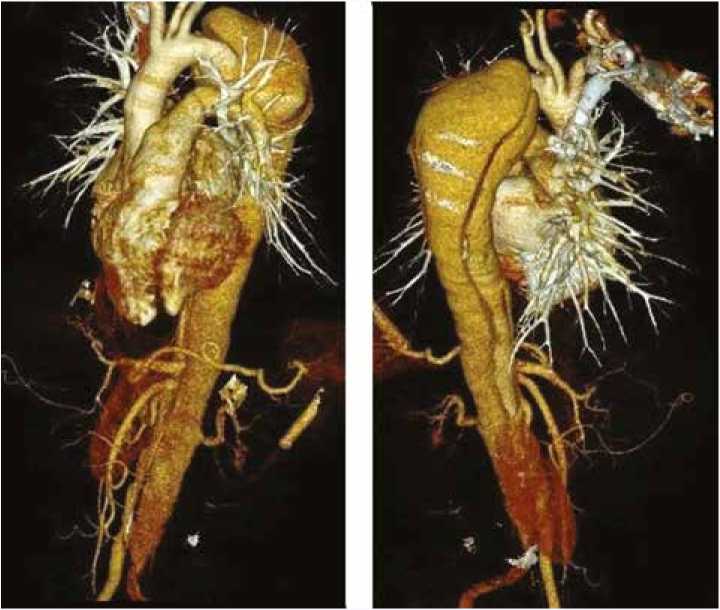
Рис. 2. Расслоение аорты III типа по DeBakey по данным компьютерной томографии Fig. 2. Computed tomography of DeBakey type III aortic dissection

Рис. 3. Сформированный неопротез (многобраншевый протез Коселли + бифуркационный протез + дополнительная бранша протеза для перфузии) Fig. 3. Created neo prosthesis (multi-branched Coselli prosthesis + bifurcation prosthesis + additional branch of the prosthesis for perfusion)
Протезирование аорты выполнялось по методике «Distal first». Первым этапом были наложены анастомозы № 1 и 2 с левой и правой общими подвздошными артериями по типу «конец в бок» (рис. 4).
Без искусственного кровообращения и без пережатия аорты поэтапно выполнен дебраншинг висцеральных артерий. Поэтапно наложены анастомозы с левой почечной артерией, верхней брыжеечной артерией и чревным стволом соответственно (рис. 5, 6).
До наложения анастомоза кровоснабжение осуществлялось по нативной аорте, после наложения анастомо- зов висцеральные артерии кровоснабжались из неопротеза ретроградным кровотоком из общих подвздошных артерий. Анастомозы были наложены поочередно, время ишемии бассейна каждой артерии составляло не более 7 мин. Таким образом, мы избегали тотальной ишемии висцеральных органов за счет попеременного выключения висцеральных артерий.
После выполнения дебраншинга висцеральных артерий подключали обход ЛЖ путем канюляции левой нижней легочной вены и дополнительной бранши неопротеза (рис. 7).
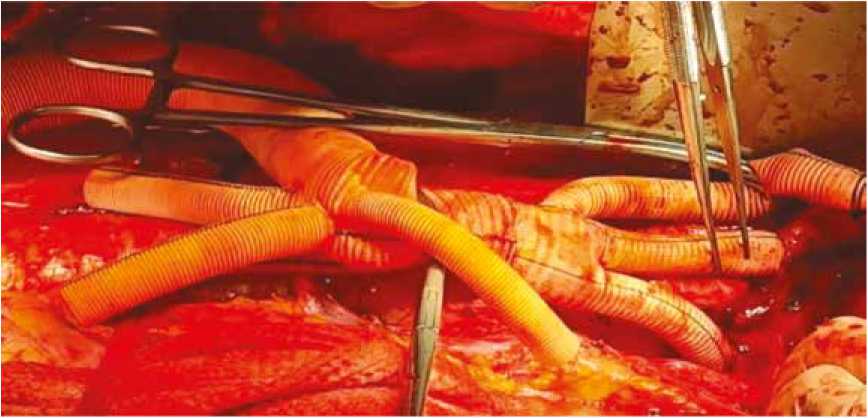
Рис. 4. Шунтирование подвздошных артерий (анастомозы № 1 и 2)
Fig. 4. Ileac artery bypass grafting (anastomoses No. 1 and 2)
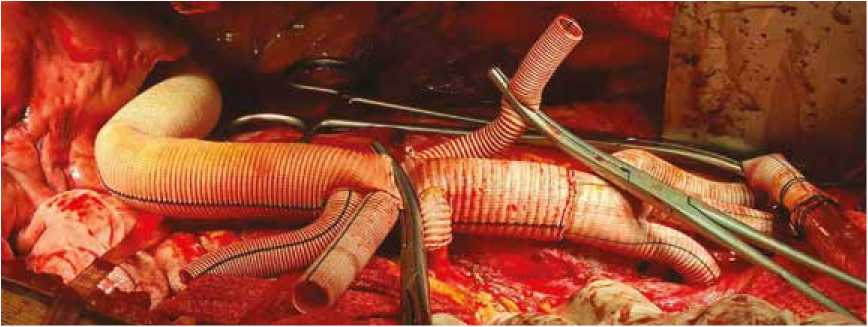
Рис. 5. Дебраншинг левой почечной артерии (анастомоз № 3)
Fig. 5. Debranching of the left renal artery (anastomosis No. 3)
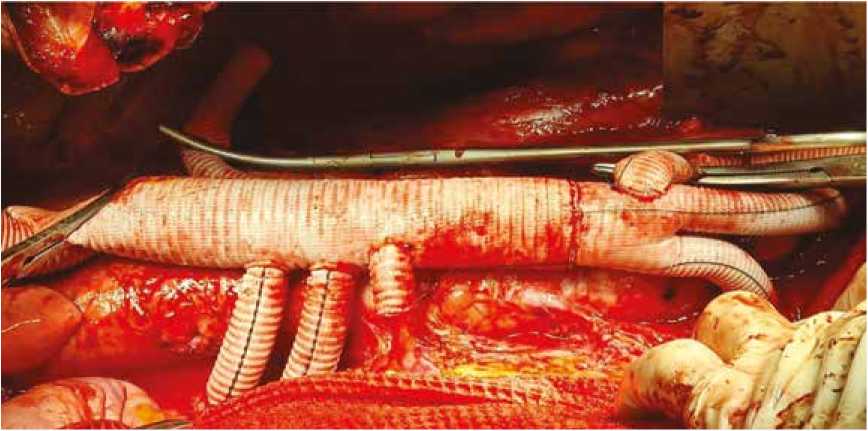
Рис. 6. Дебраншинг верхней брыжеечной артерии и чревного ствола (анастомозы № 4 и 5)
Fig. 6. Debranching of the superior mesenteric artery and the celiac trunk (anastomoses No. 4 and 5)
После начала обхода ЛЖ аорта пережата на уровне диафрагмы, подвздошные артерии лигированы выше анастомозов, вскрыт брюшной отдел аорты, наложен анастомоз № 6 с правой почечной артерией. Далее аорта пережата на уровне средней трети нисходящей грудной аорты, выполнена ревизия нижнегрудных межреберных артерий для реимплантации на площад- ке. Однако в данном случае реимплантацию межреберных артерий выполнить не удалось из-за расслоенной на несколько каналов грудной аорты. В последнюю очередь пережата аорта выше подключичной артерии, наложен проксимальный анастомоз № 7 на уровне перешейка аорты. Общий вид итога операции отображен на рисунке 8.
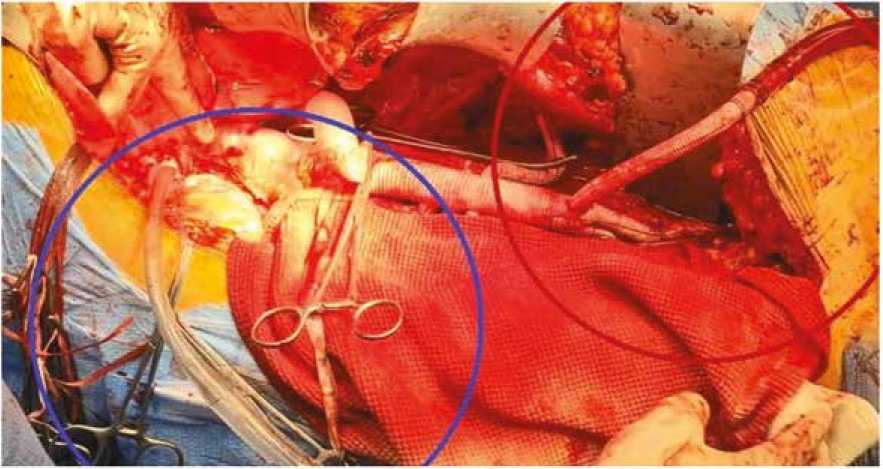
Рис. 7. Схема обхода левого желудочка (левая нижняя легочная вена – бранша протеза)
Fig. 7. Scheme of the left ventricular bypass (left inferior pulmonary vein and branch of the prosthesis)
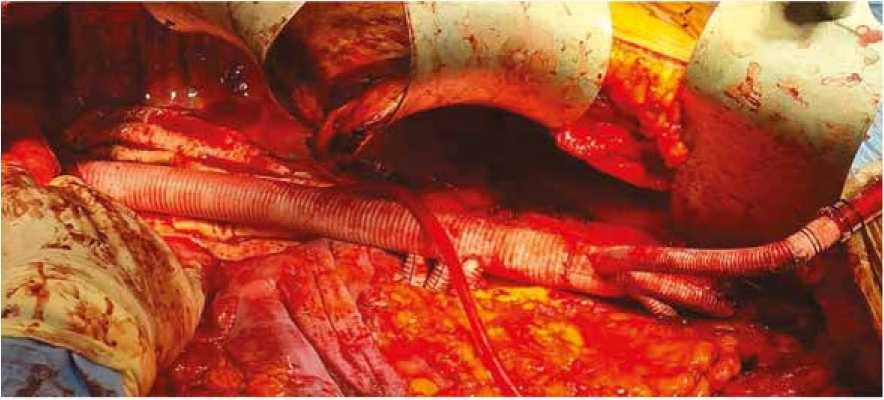
Рис. 8. Протезирование торакоабдоминального отдела аорты
Fig. 8. Prosthetic repair of the thoracoabdominal aorta
Таким образом, 5 анастомозов из 7 были выполнены при естественном кровообращении, и только анастомоз с правой почечной артерией и проксимальный анастомоз осуществлены в условиях обхода ЛЖ. Время обхода ЛЖ составило 32 мин.
Предложенная нами методика позволяет значительно сократить время искусственного кровообращения, снизить травматизацию клеток крови, а также поддер- живать гемодинамику на должном уровне на всех этапах операции.
Послеоперационный период протекал без осложнений. Дренажи были удалены на 3-и сут. На контрольной МСКТ контрастируются все бранши протеза, висцеральные и подвздошные артерии (рис. 9). Пациентка выписана из стационара в удовлетворительном состоянии на 21-е сут после операции.
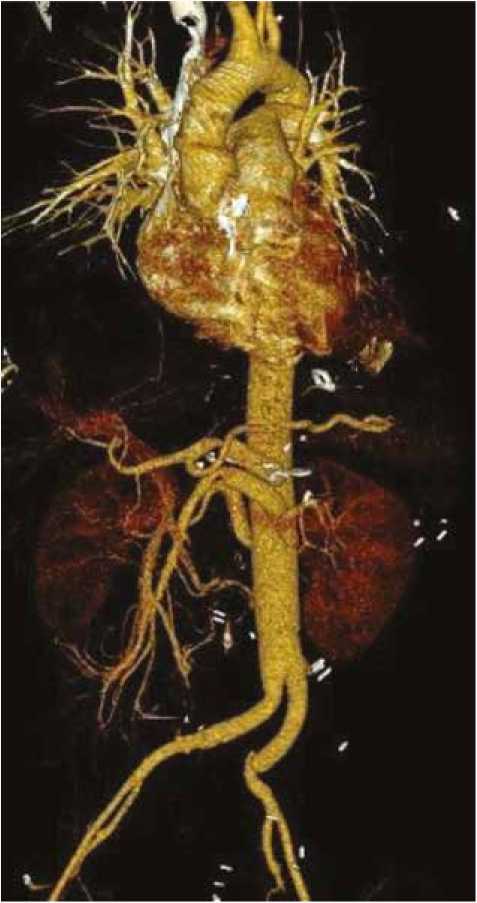
Рис.9. Компьютерная томография после протезирования торакоабдоминальной аорты
Fig. 9. Computed tomography after prosthetic repair of the thoracoabdominal aorta
Результаты
Общая послеоперационная госпитальная летальность составила 13,7% (4 пациента), из них 3 пациента погибли при хирургическом лечении аневризм торакоабдоминальной аорты (15,8%), 1 пациент – при хирургической коррекции расслоения аорты (10%). Острая почечная недостаточность, потребовавшая почечно-заместительной терапии, была выявлена у 3 пациентов (10,3%). Спинальные осложнения в виде временной параплегии отмечались у 2 пациентов (6,9%). Дыхательная недостаточность зарегистрирована у 4 больных (13,7%), в том числе 1 пациенту (3,4%) потребовалась трахеостомия. Кровотечение, требующее повторной операции, возникло у 1 пациента (3,4%). Послеоперационные осложнения при хирургическом лечении патологии торакоабдоминальной аорты представлены в таблице.
Таблица. Послеоперационные осложнения при хирургическом лечении патологии торакоабдоминальной аорты
Table. Postoperative complications following surgical treatment for pathology of thoracoabdominal aorta
|
Послеоперационные осложнения Postoperative complications |
Кол-во пациентов № patients |
% |
|
Госпитальная летальность In-hospital lethality |
||
|
Патология торакоабдоминальной аорты Pathology of thoracoabdominal aorta |
4/29 |
13,7 |
|
Аневризмы аорты Aortic aneurisms |
3/19 |
15,8 |
|
Расслоение аорты Aortic dissection |
1/10 |
10 |
|
Дыхательная недостаточность Respiratory failure |
4/29 |
13,7 |
|
Острая почечная недостаточность Acute kidney injury |
3/29 |
10,3 |
|
Временная параплегия Transient paraplegia |
2/29 |
6,9 |
|
Кровотечение, реторакотомия Bleeding, rethoracotomy |
1/29 |
3,4 |
|
Инфекция мягких тканей Soft-tissue infection |
1/29 |
3.4 |
Обсуждение
С развитием новых технологий в защите спинного мозга и внутренних органов во время обеспечения операций на торакоабдоминальной аорте старые методики «clamp and go» остаются в прошлом [9, 10]. На сегодняшний день при хирургическом лечении торакоабдоминальной аорты самым большим опытом в мире обладает Техасская школа под руководством J.S. Coselli [4]. В протокол операции обязательно входят установка спинального дренажа и мониторинг давления спинномозговой жидкости. Подключается обход ЛЖ путем канюляции легочной вены и нисходящей грудной аорты. Первым этапом выполняется проксимальный анастомоз на уровне перешейка аорты в условиях обхода ЛЖ. После этого вскрывается торакоабдоминальная аорта, поэтапно протезируются висцеральные артерии с использованием многобраншевого протеза Coselli. На этом этапе защита внутренних органов осуществляется за счет кровяной перфузии чревного ствола и верхней брыжеечной артерии с использованием специальных катетеров [11]. Для защиты почек используется холодовая кристаллоидная почечная перфузия. Последним этапом выполняется дистальный анастомоз на уровне бифуркации аорты.
Предложенная нами методика позволяет сократить время искусственного кровообращения, обхода ЛЖ за счет выполнения 5 анастомозов при естественном кровообращении. Также данная методика дает возможность сократить время ишемии внутренних органов и спинного мозга за счет поэтапного протезирования висцеральных артерий. Поддержание стабильной гемодинамики при естественном кровообращении и сокращении времени искусственного кровообращения, когда необходимо искусно поддерживать гемодинамику на двух этажах, также позитивно сказывается на профилактике ишемии спинного мозга во время операции. Еще одним неоспоримым преимуществом нашей методики является способ канюляции в браншу протеза и перфузия через многобраншевый протез, что исключает необходимость канюлировать аневризматическую, атероматозную, тромбированную или расслоенную аорту. Такие же недостатки присутствуют при бедренной канюляции и ретроградной перфузии атероматозной или расслоенной аорты. Перфузия через многобраншевый протез позволяет исключить тромбоэмболические осложнения и возможные эпизоды ишемии.
Сложность обеспечения операций на торакоабдоминальной аорте и методов защиты внутренних органов подтверждается достаточно большим количеством послеоперационных осложнений. Осложнения из-за ишемии и реперфузионного повреждения остаются «ахиллесовой пятой» открытых вмешательств. Параплегии вследствие ишемии спинного мозга в крупных центрах регистрируются у 2–20% оперированных больных [12, 13]. Острое повреждение почек, по данным авторов, встречается в 7–23% случаев, большинству из них затем требуется пожизненный диализ [14, 15]. Дыхательная недостаточность отмечается в 20–40% случаев [16, 17]. Подобные осложнения возникают вследствие ишемического, а затем и реперфузионного повреждения висцеральных органов, в подобных ситуациях время пережатия и полноценная перфузия являются ключевыми моментами.
Процент послеоперационных осложнений при хирургическом лечении торакоабдоминальных аневризм аорты остается довольно высоким, даже если ориентироваться на самый большой в мире опыт Хьюстонской группы, в исследование которой включены результаты хирургического лечения 3309 пациентов [4]. Так, при анализе 1066 операций при II типе торакоабдоминальных аневризм операционная летальность составила 15,5%, спинальные осложнения – 14%, почечная недостаточность – 16%, дыхательная недостаточность – 31%. Основными предикторами грозных осложнений авторы считают применение циркуляторного ареста, разрывы аорты, хроническую почечную недостаточность, II тип торакоабдоминальной аневризмы, экстренность операции, эндартерэктомии из висцеральных артерий, возраст пациента и время пережатия аорты [4].
Выводы
Хирургическое лечение патологии торакоабдоминальной аорты остается одной из сложных проблем в сердечно-сосудистой хирургии. Предложенная новая методика хирургической реконструкции торакоабдоминальной аорты дает возможность уменьшить время пережатия аорты, время искусственного кровообращения и ишемию внутренних органов и спинного мозга, что непосредственно влияет на улучшение результатов хирургического лечения этой тяжелой категории пациентов. Дальнейший поиск и совершенствование методов обеспечения операций, применение гибридных технологий позволит улучшить результаты хирургического лечения патологии торакоабдоминальной аорты.
Список литературы Хирургическое лечение патологии торакоабдоминального отдела аорты
- De Bakey M.E., Cooley D.A., Crawford E.S., Morris G.C. Jr. Clinical application of a new flexible knitted dacron arterial substitute. Am. Surg. 1958;24(12):862-869.
- Shine T.S., Harrison B.A., De Ruyter M.L., Crook J.U., Heckman M., Daube J.R. et al. Motor and somatosensory evoked potentials: Their role in predicting spinal cord ischemia in patients undergoing thoracoabdominal aortic aneurysm repair with regional lumbar epidural cooling. Anesthesiology. 2008;108:580-587. DOI: 10.1097/ALN.0b013e318168d921.
- Gloviczki P. Surgical repair of thoracoabdominal aneurysms: Patient selection, techniques and results. Cardiovasc. Surg. 2002;10(4):434-441. DOI: 10.1177/096721090201000426.
- Coselli J.S., LeMaire S.A., Preventza O., de la Cruz K.I., Cooley D.A., Price M.D. et al. Outcomes of 3309 thoracoabdominal aortic aneurysm repairs. J. Thorac. Cardiovasc. Surg. 2016;151(5):1323-1337. DOI: 10.1016/j.jtcvs.2015.12.050.
- Чернявский А.М., Сирота Д.А., Caus T., Хван Д.С., Альсов С.А., Ляшенко М.М. Гибридная хирургия при хроническом расслоении торакоабдоминального отдела аорты. Ангиология и сосудистая хирургия. 2017;23(2):49-52.
- Козлов Б.Н., Насрашвили Г.Г., Кузнецов М.С., Панфилов Д.С., Черных Ю.Н., Мочула А.В. и др. Непосредственные результаты реновисцерального дебранчинга у пациентов с патологией торакоабдоминальной аорты. Кардиология и сердечно-сосудистая хирургия. 2020;13(2):104-107. DOI: 10.17116/kardio202013021104.
- Coselli J.S., LeMaire S.A. Left heart bypass reduces paraplegia rates after thoracoabdominal aortic aneurysm repair. Ann. Thorac. Surg. 1999;67(6):1931-1934. DOI: 10.1016/s0003-4975(99)00390-2.
- Белов Ю.В., Гулешов В.А., Комаров Р.Н., Степаненко А.Б., Генс А.П., Чарчян Э.Р. Способ защиты висцеральных органов в хирургии торакоабдоминальных аневризм аорты. Хирургия. Журнал им. Н.И. Пирогова. 2008;(1):53-54.
- Crawford E.S. Thoraco-abdominal and abdominal aortic aneurysms involving renal, superior mesenteric, celiac arteries. Ann. Surg. 1974;179(5):763-772. DOI: 10.1097/00000658-197405000-00032.
- Murana G., Castrovinci S., Kloppenburg G., Yousif A., Kelder H., Sche-pens M. et al. Open thoracoabdominal aortic aneurysm repair in the modern era: results from a 20-year single-centre experience. Eur. J. Cardiothorac. Surg. 2016;49(5):1374-1381. DOI: 10.1093/ejcts/ezv415.
- Coselli J.S., de la Cruz K.I., Preventza O., LeMaire S.A., Weldon S.A. Extent II thoracoabdominal aortic aneurysm repair: How i do it. Semin. Thorac. Cardiovasc. Surg. 2016;28(2):221-237. DOI: 10.1053/j. semtcvs.2016.07.005.
- Conrad M.F., Crawford R.S., Davison J.K., Cambria R.P. Thoracoabdominal aneurysm repair: A 20-year perspective. Ann. Thorac. Surg. 2007;83(2):S856-861. DOI: 10.1016/j.athoracsur.2006.10.096.
- Coselli J.S., Bozinovski J., LeMaire S.A. Open surgical repair of 2286 thoracoabdominal aortic aneurysms. Ann. Thorac. Surg. 2007;83(2):S862-864;discussion S890-892. DOI: 10.1016/j.athorac-sur.2006.10.088.
- LeMaire S.A., Price M.D., Green S.Y., Zarda S., Coselli J.S. Results of open thoracoabdominal aortic aneurysm repair. Ann. Cardiothorac. Surg. 2012;1(1):286-292. DOI: 10.3978/j.issn.2225-319X.2012.08.16.
- Ballard J.L., Abou-Zamzam A.M. Jr., Teruya T.H. Type III and IV thoracoabdominal aortic aneurysm repair: Results of a tri- furcated/two graft technique. J. Wasc. Surg. 2002;36(2):211-216; discussion 216. DOI: 10.1067/mva.2002.125031.
- Hiratzka L.F., Bakris G.L., Beckman J.A., Bersin R.M., Carr V.F., Casey D.E. Jr. et al.; American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines; American Association for Thoracic Surgery; American College of Radiology; American Stroke Association; Society of Cardiovascular Anesthesiologists; Society for Cardiovascular Angiography and Interventions; Society of Interven-tional Radiology; Society of Thoracic Surgeons; Society for Vascular Medicine. 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the diagnosis and management of patients with thoracic aortic disease. A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines, American Association for Thoracic Surgery, American College of Radiology, American Stroke Association, Society of Cardiovascular Anesthesiologists, Society for Cardiovascular Angiography and Interventions, Society of Interventional Radiology, Society of Thoracic Surgeons, and Society for Vascular Medicine. J. Am. Coll. Card. 2010;55:e27-e129. DOI: 10.1016/j.jacc.2010.02.015.
- Hountis P.G., Plestis K.A. Strategies in the management of extensive descending and thoracoabdominal aortic aneurysms. Hellenic J. Cardiol. 2009;50(4):295-302.


