Хондроидная липома как псевдосаркома мягких тканей: обзор литературы и клиническое наблюдение
Автор: Васильев Н.В., Вторушин С.В., Анисеня И.И., Ситников П.К., Табакаев С.А., Фролова И.Г., Богоутдинова А.В., Жуйкова Л.Д., Байрамов П.В., Пономарева С.И., Цветухин М.О.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 4 т.20, 2021 года.
Бесплатный доступ
Актуальность. Псевдосаркомы мягких тканей всегда создавали сложности в диагностической и лечебной тактике. С одной стороны, сложно дать однозначный нозологический диагноз по биопсийному фрагменту опухоли, с другой – трудно определить наиболее целесообразную тактику лечебных мер по описательной гистологической картине. Цель исследования – обобщение литературных данных и систематизация гистологических характеристик опухоли, обусловливающих сложности верификации при хондроидной липоме и псевдосаркомах в целом. Описание клинического случая. На клиническом примере хондроидной липомы, редко встречающейся опухоли мягких тканей, и анализе литературных данных авторы показали важность детального изучения полученного материала, квалифицированного описания морфологической картины в тех случаях, когда в диагностическом заключении нельзя однозначно говорить о злокачественности опухолевого процесса. Дополнительная биопсия не всегда позволяет уточнить гистотип опухоли. Показаны сложности дифференциальной диагностики мягкотканых сарком. Заключение. При клинически агрессивном опухолевом процессе в мягких тканях, когда в биопсийном материале нет однозначных признаков злокачественности, следует предпочесть сдержанную хирургическую тактику: экономное иссечение с гистологическим и иммуногистохимическим исследованием.
Хондроидная липома, псевдосаркома мягких тканей, ИГХ, МРТ, КТ, дифференциальная диагностика.
Короткий адрес: https://sciup.org/140254545
IDR: 140254545 | УДК: 616-006.326.03-076-08 | DOI: 10.21294/1814-4861-2021-20-4-152-159
Текст научной статьи Хондроидная липома как псевдосаркома мягких тканей: обзор литературы и клиническое наблюдение
Background. Pseudosarcomas of soft tissues can cause diagnostic and treatment challenges. On the one hand, it is difficult to make a nosological diagnosis based on a biopsy specimen of a tumor; on the other hand, it is difficult to determine the most appropriate treatment strategy based on a histological pattern. the purpose of the study was to analyze available literature data and systematize the histological characteristics of the chondroid lipoma and pseudosarcoma. case description . We present the case of chondroid lipoma in a 57-year-old female patient with atypical clinical symptoms. This case shows the difficulties of differential diagnosis of soft tissue sarcomas. Using a clinical example of chondroid lipoma, a rare soft tissue tumor, and an analysis of literature data, the authors showed the importance of a detailed study of the obtained material, a qualified description of the morphological picture, in those cases when the diagnostic conclusion cannot be unambiguous about the malignancy of the tumor process. Additional biopsy is not always possible to clarify the histotype of the tumor. The presented observation shows the difficulties of differential diagnosis of soft tissue sarcomas. Minimally invasive biopsy provides no a full appreciation of histological structure; therefore, if there is a suspicion for chondroid lipoma, it is necessary to perform total surgical biopsy followed by a morphological study using the immunohistochemical method.
Хондроидная липома (ХЛ) относится к числу орфанных новообразований [1]. Однако главной причиной внимания к ХЛ является особенность ее морфологического строения, обусловливающая трудность нозологической верификации и высокий риск диагностической ошибки патолога, чаще всего направленной, как показывает практика, в сторону саркомы, что заставляет клиницистов формировать план неоправданно агрессивного лечения [2, 3].
Цель исследования – обобщение литературных данных и систематизация гистологических характеристик опухоли, обусловливающих сложности верификации при хондроидной липоме и псевдосаркомах в целом.
Клиническое наблюдение
Пациентка Д., 57 лет, с сентября 2019 г. отмечала боли в области правого коленного сустава. В октябре 2019 г. обследована по месту жительства. По данным КТ правого бедра с контрастированием и МРТ правого коленного сустава выявлено образование мягких тканей дорзальной области нижней трети правого бедра с вероят- ным вовлечением в процесс бедренной артерии и надкостницы бедренной кости (рис. 1). Выполнена тонкоигольная биопсия, при цитологическом исследовании не исключена злокачественная мягкотканая опухоль с выраженным миксоидным компонентом. В ноябре 2019 г. при консультации онколога по месту жительства поставлен диагноз: саркома мягких тканей н/3 правого бедра T2bN0M0 стадии с инвазией сосудисто-нервного пучка и рекомендовано хирургическое лечение.
Для дальнейшего лечения больная обратилась в НИИ онкологии Томского НИМЦ. При объективном осмотре движения в правом коленном суставе в полном объеме, в подколенной области пальпируется неподвижное, болезненное уплотнение эластичной консистенции, размером до 6 см. Регионарные лимфоузлы не увеличены.
В условиях НИИ онкологии выполнена трепан-биопсия с описательным гистологическим заключением: фрагмент опухоли, построенный тесно расположенными крупными овальными, умеренно полиморфными клетками, напоминающими липо-бласты. Клетки образуют солидные поля (рис. 2).
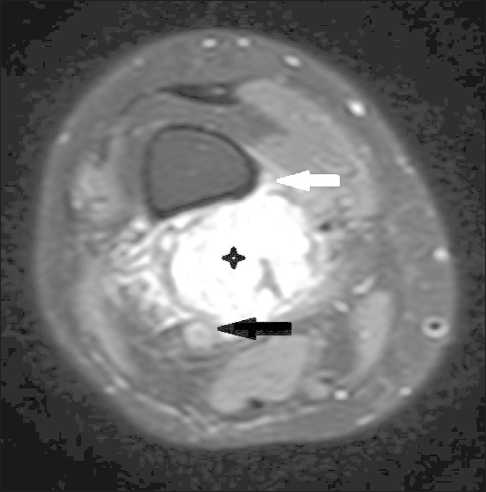
Рис. 1. МРТ правого коленного сустава. Режим Т2 с жироподавлением. Черной звездочкой отмечено образование кистозно-солидного строения с преобладанием солидного. По медиальной поверхности бедренной кости определяется линейная реакция надкостницы (белая стрелка). Образование прилежит к подколенной артерии (черная стрелка) Fig. 1. MRI scan of the right knee joint. T2 mode with fat reduction. A black asterisk marks the formation of a cystic solid structure with a predominance of a solid one. On the medial surface of the femur, the linear reaction of the periosteum is determined (white arrow). The mass is adjacent to the popliteal artery (black arrow)
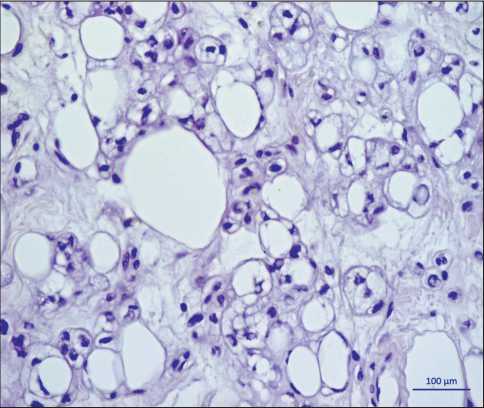
Рис. 2. Микрофото. Биопсийный материал. Поля крупных полиморфных клеток, в части напоминающих липобласты.
Окраска гематоксилином и эозином, ×400
Fig. 2. Microphoto. Biopsy specimen. Fields of large polymorphic cells, resembling lipoblasts. Staining with hematoxylin and eosin, ×400
Рекомендовано уточнение диагноза на более представительном операционном материале с ИГХ исследованием.
Третьего декабря 2019 г. под эндотрахеальным наркозом выполнено иссечение опухоли с резекцией подколенной артерии и надкостницы бедренной кости. Макропрепарат: опухолевый узел овальной формы, 7 см в диаметре, окруженный фиброзной капсулой, жировой клетчаткой, с интимно прилежащим и приращенным к капсуле фрагментом надкостницы бедренной кости размерами 1,5×1 см без истинной опухолевой инвазии. На разрезе опухоль ярко-желтого и бурого цвета, эластической консистенции. Сосуды в тканях, окружающих опухолевый узел, не дифференцируются.
При гистологическом и иммуногистохимическом исследовании выявлена опухоль, местами с четкой широкой фиброзной капсулой, с неравномерной клеточностью, построена слабо полиморфными крупными овальными клетками, напоминающими хондроциты, с нормохромным ядром, с широкой «пустой» цитоплазмой, с четкой цитолеммой. Также встречаются двумногоядерные клеточные формы (рис. 3). Клетки тесно расположены между собой и образуют кластеры, дольки, солидные структуры; струк-
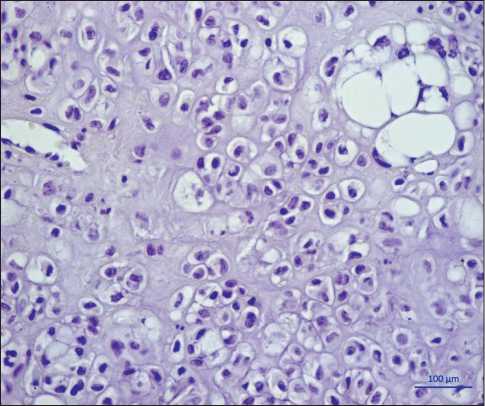
Рис. 3. Микрофото. Операционный материал. Полиморфные одно-двуядерные клетки типа хондроцита и типа липобласта лежат в умеренном «хондроидном» матриксе. Окраска гематоксилином и эозином, ×200
Fig. 3. Microphoto. Surgical specimen. Polymorphic mono-binuclear cells of the chondrocyte type and lipoblast type lie in a moderate «chondroid» matrix. Staining with hematoxylin and eosin, ×200
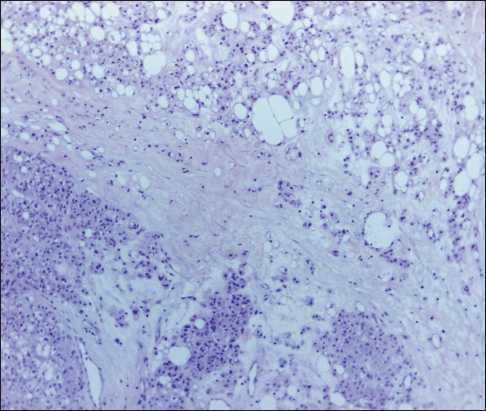
Рис. 4. Микрофото. Операционный материал. Клетки типа хондроцита и липобласта образуют кластеры, дольки, солидные структуры, лежащие в «хондроидном» и миксоидном матриксе с фиброзными тяжами, с регулярными мелкими тонкостенными широкими сосудами. Окраска гематоксилином и эозином, ×100
Fig. 4. Microphoto. Surgical specimen. Cells such as chondrocytes and lipoblasts form clusters, lobules, solid structures lying in the «chondroid» and myxoid matrix with fibrous cords, with regular small thin-walled wide vessels. Staining with hematoxylin and eosin, ×100
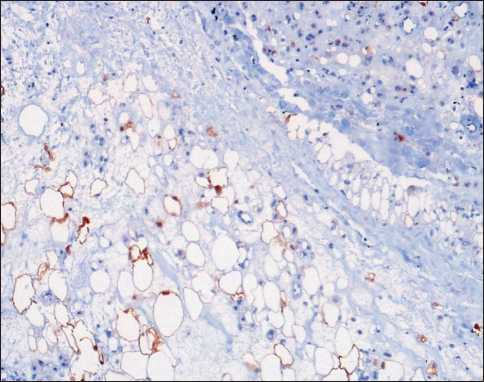
Рис. 5. Микрофото. Операционный материал. Жировые клетки и часть клеток, напоминающих липобласты, экспрессируют S100. Иммуногистохимическая реакция, ×100
Fig. 5. Microphoto. Surgical specimen. Fat cells and a portion of lipoblast-like cells express S100. Immunohistochemical reaction, ×100
туры, напоминающие клеточные изогенные группы разной величины; реже клетки расположены одиночно в скудном бледно-базофильном матриксе, напоминающем хондроидный. Указанные опухолевые структуры лежат в массивном миксоидном матриксе с фиброзными тяжами, с полями и участками атипичных липоцитов, с многочисленными тонкостенными регулярными сосудами с «зияющим» просветом (рис. 4). В удельном отношении «хондроидный» компонент превалирует над жировой и миксоидной тканью. Липоциты и часть «хондроидных» клеток экспрессируют S-100 (поликлональное, Dako) (рис. 5); в части «хондроидных» клеток – экспрессия CD68 (clone PG-M1, Dako) и MDM2 (clone 1B10). Ki 67(clone MIB-1, Dako) – экспрессия в <1 % опухолевых клеток. Отсутствует экспрессия Cytokeratine АЕ1/ АЕ3 (clone АЕ1/АЕ3, Dako). Заключение: Хондроидная липома (ICD 8862/0).
Обсуждение
В 1986 г. J.K.C. Chan et al. впервые описали случай опухоли, которую назвали «экстраскелет-ная хондрома с липобластоподобными клетками» [3, 5]. Однако официальной датой наименования данной опухоли является 1993 г., когда J.M. Meis, F.M. Enzinger опубликовали результаты исследовательской серии из 20 случаев доброкачественной жировой опухоли, возникающей в основном в мягких тканях конечностей у женщин, чаще около 35 лет, показывающей черты жировой и хрящевой ткани [6]. Авторы именовали, систематизировали и представили ХЛ как новую самостоятельную нозологическую форму, после чего она была интегрирована в классификацию ВОЗ [1, 6–9]. Дефиниция хондроидной липомы в классификации ВОЗ (2013) и сформулированные разными авторами определения хондроидной липомы как нозологической единицы создают общее представление о ней как о редкой мягкотканой доброкачественной жиросодержащей опухоли с характеристиками эмбриональной жировой и хрящевой ткани, построенной липобластами, лежащими в миксоидно-хондроидном матриксе, перемежающимися зрелыми липоцитами [1, 7, 9]. Частота встречаемости ХЛ весьма низкая: спустя почти три десятилетия после первой публикации в англоязычной литературе представлено 64 статьи, в которых общее число описанных наблюдений ХЛ составило 88 случаев [1, 7].
Теория хондрогенной дифференцировки ХЛ, базирующаяся на схожести миксогиалинового матрикса опухоли с хрящевой тканью, была опровергнута в 1995 г., когда при ультраструктурном анализе не обнаружили доказательства истинной хрящевой дифференцировки ткани опухоли [3, 5]. Клеточные элементы представляют собой спектр дифференцировки от примитивных клеток с характеристиками прелипобласта, хондробласта до липобластов, предадипоцитов и зрелых жировых клеток, содержащих цитоплазматический гликоген или жир [7, 8]. Рядом авторов описана характерная для ХЛ реципрокная транслокация t(11;16) (q13;p13), которая приводит к формированию онкогена C11orf95-MKL2 [7, 10].
Пик заболеваемости ХЛ приходится на 3–4-е десятилетия жизни, у детей моложе 10 лет ХЛ встречается очень редко, соотношение женщин и мужчин 4:1. Хондроидная липома возникает чаще в мягких тканях проксимальных отделов конечностей, редко – в дистальных отделах, в туловище и области головы и шеи. Расположение опухоли обычно глубокое; поверхностное наблюдается в 20 % случаев. Хондроидная липома безболезненна, может отмечаться медленный рост [1, 5, 7, 10, 11].
При ХЛ не описаны случаи злокачественной трансформации, развития метастазов [3, 5, 7, 12]. Зарегистрирован лишь один случай возникновения рецидива [1]. Опухолевый узел, как правило, четко отграничен и инкапсулирован; величина его варьирует от 1,5 до 11 см, в среднем около 4 см в диаметре. Ткань опухоли желеобразной консистенции; серого, белого или желтовато-коричневого цвета. Структура опухоли на разрезе солидная, гомогенная, реже – дольчатая, с фиброзными септами [1, 5, 7, 10].
Микроскопическая картина ХЛ отличается многоликим гистологическим «пейзажем» – она представлена тремя тканевыми компонентами, «мозаично» расположенными между собой и сочетающимися в различных пропорциях: зрелой жировой тканью; хондроидным/миксохондро-идным матриксом и плеоморфным клеточным компонентом. Удельное соотношение тканевых компонентов вариабельно, и обычно с преобладанием клеточного компонента, реже жирового. Клеточный компонент, вызывающий наибольшие трудности для интерпретации патологом в силу клеточного плео- и полиморфизма, построен представителями двух клеточных форм, характеризующихся вакуолизацией цитоплазмы и отличающихся между собой типом вакуоли (крупной и мелкой) [1, 3–5, 13].
Первая клеточная форма (крупновакуолизиро-ванная клетка) напоминает липобласт или псев-долипобласт и отличается наличием одной-двух крупных вакуолей, реже трех, разделенных узкими перемычками (уни-билокулярность); центральным или периферическим ядром; четкой цитолеммой [13]. При периферическом расположении ядро крупновакуолизированной клетки зачастую имеет «сдавленный» вид, характерные вдавления кариолеммы, зубчатый контур – и такая клетка неотличима от классического липобласта [4, 5, 7, 11]. Вторая клеточная форма (мелковакуолизиро-ванная клетка) – меньшая по величине, содержит множественные мелкие вакуоли, формирующие пенистый или мелкозернистый вид бледной или бледно-эозинофильной цитоплазмы (мультило-кулярность); центрально расположенное ядро, отчетливую цитолемму. Такая клетка напоминает хондробласт или клетку гиберномы [4, 5, 7, 11, 13]. В абсолютном большинстве отмечается слабый ядерный полиморфизм. Иногда наблюдаются дольчатость ядра, иррегулярная кариолемма, внутри- ядерные бороздки; мелкое, нечеткое базофильное ядрышко. Клетки обоих типов образуют гнезда, цепочки, солидные структуры. Зрелая жировая ткань диффузно или фокально распределена, вариабельна по объему, иногда может преобладать над другими тканевыми компонентами. Могут встречаться участки, напоминающие серозную дегенерацию жировой ткани. Матрикс опухоли может варьировать от миксоидного до миксохондроидного или хондроидного, но, как правило, миксоидный. При наличии участков хондроидного матрикса может создаваться впечатление о его хрящевой природе благодаря лакунарному или псевдолакунарному расположению клеток в матриксе (клетка лежит в истинной лакуне или вокруг нее наблюдается перицеллюлярный ободок просветления). Иногда в матриксе могут встречаться структуры кости, гиа-линизированные участки, кальцинаты, отложения гемосидерина, мелкие очаговые кровоизлияния, инфильтрация воспалительными клетками. Сосудистая сеть опухоли достаточно развита – мелкие сосуды с утолщенной стенкой перемежаются с тонкостенными сосудами кавернозного типа, с распространенным тромбозом, развивающимся преимущественно в сосудах мелкого калибра. Митозы в абсолютном большинстве наблюдений отсутствуют [1, 3, 7, 13].
Опухоль отличает весьма низкий пролиферативный индекс – доля клеток, экспрессирующих Ki67 (как правило, это мелковакуолизированные клетки), составляет менее 1 %. Иммунофенотип хондроидной липомы неспецифичен. Клетки диффузно экспрессируют Vimentin; большинство клеток экспрессируют S-100 (до 90 %). От 30 до 64 % опухолевых клеток фокально экспрессируют CD68. Цитокератины в опухолевых клетках могут быть как отрицательными, так и фокально позитивными (до 25 %). За исключением жировой ткани 65–90 % клеток опухоли экспрессируют PCNA. Описаны случаи положительной экспрессии cy-clin D1, коллагена IV типа (фокально), ламинина. Отсутствует экспрессия клетками хондроидной липомы ЕМА, HMB45, SMA, GFAP, CD57, рецепторов эстрогена, прогестерона и андрогена [1, 3, 5, 7, 13]. Специальные гистохимические окраски (ШИК-реакция; Судан III, жировой красный) выявляют в цитоплазме вакуолизированных клеток гликоген, жир [7, 11].
Дифференциальная диагностика ХЛ предполагает рассмотрение опухолей, составляющих довольно широкий ряд, включающий как доброкачественные (веретеноклеточная липома, хондролипома, хондрома мягких тканей, нейрофиброма), так и злокачественные образования (экстраскелетная миксоидная хондросаркома, миксоидная липосар-кома, миоэпителиальная карцинома мягких тканей, атипическая липоматозная опухоль). Морфологическая верификация большинства из этих новообразований не вызывает сложностей, поэтому внимание патолога должно быть сосредоточено на миксоидной липосаркоме и экстраскелетной миксоидной хондросаркоме [5, 7, 8, 11–13].
При миксоидной липосаркоме липобласты (в большинстве – перстневидные) приблизительно одной величины в отличие от псевдолипобластов при ХЛ, значительно варьирующих в размерах. Для миксоидной липосаркомы характерен рисунок сосудистой сети типа «crow’s feet» – тонкие капилляры разветвляются под острым углом, напоминая след вороньей лапки. В ХЛ подобный сосудистый рисунок отсутствует. Матрикс миксоидной ли-посаркомы – только миксоидного типа, обычно с наличием миксоидных «озер» [5, 7, 11].
Экстраскелетной миксоидной хондросаркоме (ЭСМХ) свойственно дольчатое строение с агрегацией клеток по периферии долек. Клетки ЭСМХ слабо полиморфны, однотипны и образуют анастомозирующие между собой цепочки, формирующие кружевной, аркадный рисунок. Отсутствуют липобласты, жировая ткань. Хондроидной липоме свойственно клеточное многообразие, отсутствие аркадной архитектуры [5, 7, 11].
Трудность диагностики ХЛ обусловлена особенностями ее строения, проявляющимися выраженной морфологической гетерогенностью, клеточным плеоморфизмом и катаплазией, которые в своей совокупности создают псевдосаркоматоз-ный вид. Гистологическая картина ХЛ находится в противоречии с ее клиническими и параклиническими характеристикам, в целом типичными для доброкачественной мягкотканой опухоли [3, 7, 12]. Данное обстоятельство заставляет коснуться феномена так называемых псевдосарком мягких тканей. Псевдосаркомы не являются официальной нозологической категорией и не входят в существующие классификации, тем не менее они привлекают к себе внимание и заставляют с осторожностью относиться к ее наиболее «заметным» представителям – пролиферативному фасцииту, оссифицирующему миозиту, декубитальной язве, болезни Нора, липобластоме, веретеноклеточной/ плеоморфной липоме, и в том числе хондроидной липоме [14–16].
Псевдосаркомы мягких тканей представляют собой большое количество мягкотканых образова- ний как опухолевой, так и неопухолевой природы, формируя «серую» зону между незлокачественными образованиями и истинными саркомами. Причиной выделения этих образований в отдельный класс является их морфология, имитирующая картину саркоматозного процесса на фоне их клинической доброкачественности [2, 14–17]. По выражению зарубежных исследователей, эти процессы часто предстают в «маске» саркомы в связи с наличием ряда гистологических признаков, отражающих «злокачественный» облик мезенхимальный опухоли – высокая клеточная плотность, инфильтративный рост, клеточный и ядерный полиморфизм, веретеновидный клеточный тип, митозы, некрозы [15, 16]. Саркоматозную «симуляцию» псевдосарком могут обусловить четыре фактора: а) морфологическая гетерогенность (пример: болезнь Нора); б) клеточно-тканевая катапла-зия (пример: декубитальная язва); в) зональность строения (пример: оссифицирующий миозит); г) инвазивность (пример: клеточная шваннома) [2–5, 9, 14–17]. Несмотря на то, что в ряде образований подозрения в пользу злокачественной опухоли, кроме гистологических, могут проявляться также клиническими (нарастание объема опухоли, болевой синдром) и рентгенологическими характеристиками (лизис смежной кости), необходимо отметить, что псевдосаркомы мягких тканей – это сугубо патоморфологический феномен, поскольку диагностические ошибки обычно обусловлены «сложной» гистологией образования [2, 14–17].
Список литературы Хондроидная липома как псевдосаркома мягких тканей: обзор литературы и клиническое наблюдение
- Huang C., Guo W., Qu W., Zhu Z., Li R. Characteristics of chondroid lipoma: A case report and literature review. Medicine (Baltimore). 2019 May; 98(19): e15587. https://doi.org/10.1097/MD.0000000000015587.
- Jo V.Y., Hornick J.L. Neoplastic mimics in soft tissue and bone pathology. DiacriTech. LLC, 2016. 363 r.
- Goldblum J.R., Folpe A.L., Weiss S.W. Enzinger and Weiss”s Soft tissue tumors. Sixth edition. MOSBY Elsevier. 2014. 1155 p.
- Folpe A.L., Inwards C.Y. Bone and soft tissue pathology (A volume in the series foundations in diagnostic pathology). By Saunders, an imprint of Elsevier, Inc. 2010. 462 r.
- Hornick J.L. Practical soft tissue pathology. A diagnostic approach. 2013. by Saunders, an imprint of Elsevier Inc. 523 r.
- Meis J.M., Enzinger F.M. Chondroid lipoma. A unique tumor simulating liposarcoma and myxoid chondrosarcoma. Am J Surg Pathol. 1993 Nov; 17(11): 1103-12.
- Thway K., Flora R.S., Fisher C. Chondroid lipoma: an update and review. Ann Diagn Pathol. 2012 Jun; 16(3): 230-4. https://doi.org/10.1016/j.anndiagpath.2012.01.002.
- Villarroel Dorrego M., Papp Y., Shelley M.J., Barrett A.W. Chondroid lipoma of the tongue: a report of two cases. Oral Maxillofac Surg. 2014 Jun; 18(2): 219-22. https://doi.org/10.1007/s10006-013-0426-1.
- Fletcher C.D.M., Bridge J.A., Hogendoorn P.C.W., Mertens F. WHO Classification of Tumours of Soft Tissue and Bone. IARC: Lyon 2013. 468 r.
- Perez-Ordonez B., Chetty R. Chondroid lipoma of the parotid gland. Diagnostic Histopathology. 2014; 20(10): 422-424.
- Guillou L., Fletcher C.D.M. Newer entities in soft tissue tumours. Current Diagnostic Pathology. 1997; 4: 210-221.
- Murphey M.D., Carroll J.F., Flemming D.J., Pope T.L., Gannon F.H., Kransdorf M.J. From the archives of the AFIP: benign musculoskeletal lipomatous lesions. Radiographics. 2004 Sep-Oct; 24(5): 1433-66. https://doi.org/10.1148/rg.245045120.
- Stanford University Medical Center. School of medicine. Surgical Pathology Criteria is focused on the presentation of useful diagnostic criteria in an accessible format. Soft tissue - tumors of adipose differentiation. 2017. [Internet]. URL: https://surgpathcriteria.stanford.edu/by_section.html#Fat. (cited 16.08.2020).
- Mills S.E. Sternberg’s diagnostic surgical pathology, 5th edition. Lippincott Williams & Wilkins. 2010. 2785.
- Forcucci J.A., Bruner E.T., Smith M.T. Benign soft tissue lesions that may mimic malignancy. Semin Diagn Pathol. 2016 Jan; 33(1): 50-9. https://doi.org/10.1053/j.semdp.2015.09.007.
- Rosenberg A.E. Pseudosarcomas of soft tissue. Arch Pathol Lab Med. 2008 Apr; 132(4): 579-86. https://doi.org/10.5858/2008-132-579-POST.
- Bishop J.A. Soft Tissue Pseudosarcomas. Surg Pathol Clin. 2011 Sep; 4(3): 699-719. https://doi.org/10.1016/j.path.2011.08.001.


