Хориокарцинома яичников: роль молекулярногенетического исследования в дифференциальной диагностике гестационных и негестационных форм
Автор: Летучих А.Н., Абляметова А.С., Зоринова А.В., Исраелян Э.Р., Царева А.С., Румянцев А.А.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Клинический случай
Статья в выпуске: 4 т.14, 2024 года.
Бесплатный доступ
Тактика лечения гестационной и негестационной хориокарциномы яичников имеет ряд различий, в связи с чем их дифференциальная диагностика требует особого внимания. Внедрение молекулярно-генетического тестирования, определяющего наличие отцовского генетического материала в опухоли, позволяет достоверно определить происхождение хориокарциномы яичников. Представленный клинический случай демонстрирует значение данного метода исследования в дифференциальной диагностике гестационных и негестационных форм хориокарциномы яичников.
Герминогенная опухоль, негестационная хориокарцинома яичников, гестационная хориокарцинома яичников, молекулярно-генетическое тестирование, определение аллелей партнера в опухолевом материале
Короткий адрес: https://sciup.org/140309798
IDR: 140309798 | DOI: 10.18027/2224-5057-2024-015
Текст научной статьи Хориокарцинома яичников: роль молекулярногенетического исследования в дифференциальной диагностике гестационных и негестационных форм
Хориокарцинома яичников (ХЯ) относится к редким злокачественным опухолям и характеризуется быстрым инвазивным ростом, гематогенным метастазированием и повышенным уровнем бета-хорионического гонадотро- пина (бета-ХГЧ) в плазме крови. Выделяют две основные формы ХЯ: наиболее частая — гестационная (связанная с настоящей или предшествовавшей беременностью) и негестационная [1].
Негестационная хориокарцинома яичников (НХЯ) — гистологический подтип недисгерминомных герминогенных опухолей (ГО). Патоморфологически НХЯ классифицируется как «чистая» хориокарцинома (не содержащая других недисгерминомных компонентов) и смешанная [2,3]. Частота встречаемости «чистой» НХЯ составляет 0,6% всех случаев злокачественных новообразований яичников [4].
Гистологически гестационная и негестационная формы хориокарциномы имеют идентичную картину: аномальную гиперплазию и анаплазию трофобласта, отсутствие ворсин хориона, высокий пролиферативный индекс, а также наличие кровоизлияний и некрозов в опухолевой ткани [5]. Стандартные методы обследования не позволяют отличить подтипы ХЯ между собой из-за их морфологических и клинических сходств [6].
В настоящее время наиболее достоверным способом дифференциальной диагностики НХЯ от гестационной хориокарциномы яичников (ГХЯ) является проведение молекулярно-генетического тестирования, в основе которого лежит определение аллелей партнера в опухолевом материале [3]. ГХЯ всегда ассоциированы с наличием отцовского генетического материала в опухоли, в отличие от НХЯ, происхождение которых связано с пороками развития первичной половой клетки в эмбриогенезе [7,8].
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка Е., 38 лет, с февраля 2022 года планировала беременность. В начале июня этого же года в связи с задержкой менструации (последний день менструации — 27.04.2022, цикл — 28 дней) было выполнено УЗИ органов малого таза, по результатам которого визуализировалось образование левого яичника. При комплексном обследовании выявлены множественное метастатическое поражение легких, единичный очаг в S4а–S3 печени. Уровень CA125 от 25.06.2022 — 87 ЕД/мл. По месту жительства установлен предварительный диагноз — рак яичников (РЯ), 15.07.2022 пациентка была прооперирована в объеме экстирпации матки с придатками. По данным гистологического исследования (ГИ) — в левом яичнике морфологическая картина опухоли соответствовала хориокарциноме.
После оперативного лечения в августе 2022 года была выполнена компьютерная томография (КТ) органов грудной клетки, брюшной полости с внутривенным контрастированием, по результатам которой все ранее определяемые очаги увеличились в размерах. Наиболее крупные из них: в S6 правого легкого до 2,4 × 2,2 см; в S4а-S3 печени до 2,7 см; по висцеральной поверхности правой доли печени выявлялось отграниченное жидкостное образование с геморрагическим содержимым размерами 9,0 × 7,0 см; также отмечена уретеропиелоэктазия слева.
По данным магнитно-резонансной томографии органов малого таза от 07.09.2022-в полости таза определялись множественные опухолевые узлы неоднородной кистозносолидной структуры, сливающиеся между собой, общими размерами до 10,7 × 9,7 × 8,9 см; вдоль общих подвздошных сосудов — опухолевые лимфатические узлы размерами до 1,5 × 1,2 × 1,9 см справа и до 3,9 × 3,8 см слева.
Пациентка обратилась в НМИЦ онкологии им. Н.Н. Блохина для определения дальнейшей тактики лечения.
Уровень онкомаркеров от 02.09.2022: бета-ХГЧ — 659238 мМЕ/мл, лактатдегидрогеназа (ЛДГ) — 1403 Ед/л, альфа-фетопротеин (АФП) в пределах референсных значений. Несмотря на распространенность заболевания, соматический статус по шкале ECOG — 0.
Учитывая результат ГИ, первичную локализацию опухоли в левом яичнике, уровень бета-ХГЧ, заболевание было расценено как распространенная ХЯ. Собрав детальный гинекологический анамнез — предшествовавшие роды в январе 2021 года, планируемая вторая беременность с февраля 2022 года, задержка менструального цикла (последний день менструации — 27.04.2022, цикл — 28 дней), был установлен предварительный диагноз: диссеминированная злокачественная трофобластическая опухоль, исходящая из левых придатков, сверхвысокий риск лекарственной резистентности (18 баллов по шкале FIGO). Для дифференциальной диагностики ХЯ и окончательного подтверждения диагноза гистологический материал был отдан на молекулярно-генетическое исследование (МГИ). Однако, учитывая распространенность заболевания, высокую курабельность опухоли, коллегиально было принято решение, не дожидаясь результатов МГИ, начать лекарственное лечение.
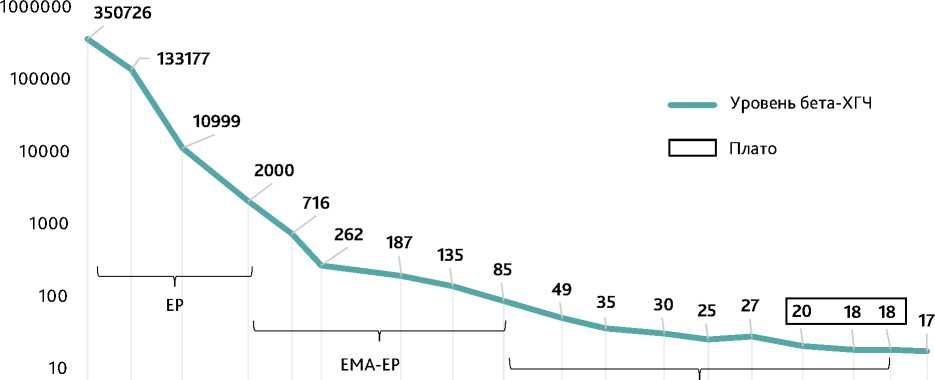
Уровень бета-ХГЧ от 13.09.2022 (до начала лечения) — 350726 мМЕ/мл. В связи с выраженной пиелоэктазией слева была установлена нефростома.
Принимая во внимание высокие риски распада опухоли и жизнеугрожающего кровотечения, первый курс химиотерапии (ХТ) был проведен в стабилизирующем режиме по схеме ЕР (этопозид, цисплатин) (табл. 1).
Таблица 1. Стабилизирующий режим ЕР
Table 1. Low-dose EP induction chemotherapy
|
Дата введения |
Препараты |
|
13.09.2022 |
Этопозид 100 мг/м 2 |
|
14.09.2022 |
Цисплатин 20 мг/м 2 (24-часовая инфузия) |
|
16.09.2022 |
Этопозид 100 мг/м 2 , цисплатин 20 мг/м 2 |
|
20.09.2022 |
Этопозид 100 мг/м 2 , цисплатин 20 мг/м 2 |
|
21.09.2022 |
Этопозид 100 мг/м 2 , цисплатин 20 мг/м 2 |
С 13.09.2022 по 21.09.2022 проведено два двухдневных блока стабилизирующего курса ХТ в режиме ЕР. В связи с развитием затяжной гематологической токсичности (тромбоцитопении 3 степени, нейтропении 4 степени, фебрильной нейтропении 3 степени) третий блок курса не проводился. После восстановления лабораторных показателей крови лечение было продолжено по схеме ЕМА-ЕР. С 05.10.2022 по 12.10.2022 проведен первый курс ХТ в данном режиме. В связи с затяжной тромбоцитопенией 4 степени и нейтропенией 4 степени начало очередного курса было задержано на 9 дней. С 28.10.2022 по 04.11.2022 проведен второй курс ХТ с редукцией дозы этопозида на 20%, в интервале после которого наблюдались анемия 2 степени, нейтропения 4 степени, тромбоцитопения 3 степени. Проведение третьего курса было задержано на 6 дней.
Учитывая гематологическую токсичность, несоблюдение дозоинтенсивности ХТ, коллегиально было принято решение о продолжении лечения в режиме ВЕР. С 17.11.2022 по 22.11.2022 проведен третий курс ХТ в модифицированном режиме ВЕР с редукцией дозы этопозида до 300 мг/м 2 суммарно, в интервале отмечена гематологическая токсичность 3–4 степени. С 13.12.2022 по 27.12.2022 проведен четвертый курс ХТ (суммарная доза этопозида — 280 мг/м 2 ) в прежнем режиме. При поступлении на пятый курс отмечено снижение уровня бета-ХГЧ менее чем на 10% в трех последовательных анализах крови (плато, график 1). Пациентка обсуждена на онкологическом консилиуме, было рекомендовано проведение второй линии терапии в режиме: пембро-лизумаб 400 мг в/в капельно в день 1, каждые 6 недель. Первый курс второй линии лекарственного лечения проведен 10.01.2023.
По данным молекулярно-генетического тестирования от 26.01.2023: в опухолевом материале не выявлено дополнительных аллелей, соответствующих генотипу партнера пациентки, также наблюдался субтотальный некроз опухоли, процент опухолевых клеток не превышал 15% на площадь среза. Длительное ожидание результата МГИ (4 месяца) было связано с отсутствием необходимых реагентов в лаборатории.
Пациентка повторно обсуждена на консилиуме, в связи с отсутствием аллелей партнера в опухолевом материла диагноз трактован как недисгерминомная ГО левого яичника. Было принято решение завершить иммунотерапию (ИТ) с дальнейшим рассмотрением вопроса о проведении циторедуктивной операции при наличии резидуальных очагов более 1 см.
По данным ПЭТ-КТ с 18F-ФДГ от 05.04.2023-в малом тазу сохранялся опухолевый конгломерат размерами 6 × 5 см, вовлекающий левый мочеточник, определялось опухолевое поражение печени (очаги до 3 см), легких (до 1 см).
Выполнена циторедуктивная операция 12.05.2023 в объеме: удаление остаточной опухоли малого таза, уре-теротомия, установка мочеточникового стента, ушивание мочеточника, атипичная резекция правой доли печени. По результатам ГИ был достигнут полный патоморфо-логический ответ, в пределах исследуемого материала признаков неопластического процесса не обнаружено. При наблюдении за пациенткой в течение 11 месяцев, данных за прогрессирование заболевания не получено.
ОБСУЖДЕНИЕ
В представленном клиническом случае пациентке с предварительным неверифицированным диагнозом РЯ на первом этапе была выполнена экстирпация матки с придатками. Важно отметить, что диагноз РЯ устанавливается на основании ГИ материала, полученного во время операции (выполняется срочное интраоперационное ГИ) или при биопсии на дооперационном этапе [9]. В случае, если результат противоречит диагнозу РЯ, тактика лечения меняется в зависимости от полученного гистологического заключения.
ВЕР
Пембролизумаб 1
График 1. Динамика уровня бета-ХГЧ
Graph 1. Dynamics of beta-hCG
По данным ГИ у пациентки была верифицирована хориокарцинома, исходящая из левых придатков. Учитывая выраженную эффективность ХТ при данной опухоли и желание пациентки сохранить репродуктивную функцию, объем выполненного хирургического вмешательства носил калечащий характер.
Высокая чувствительность ХЯ к ХТ вне зависимости от подтипа обуславливает главенствующие позиции данного метода лечения над другими, позволяя сохранить репродуктивную функцию у большинства пациенток. Принципы хирургического подхода в лечении ХЯ различны: пациенткам с НХЯ необходимо удаление всех резидуальных проявлений болезни более 1 см после завершения ХТ [10], в то время как при ГХЯ оперативное вмешательство не является стандартом лечения [11].
Основные отличия в подходах лечения распространенных форм НХЯ и ГХЯ представлены в таблице 2 [10–12].
До недавнего времени основным способом дифференциальной диагностики НХЯ и ГХЯ был детальный сбор гинекологического анамнеза [13]. Предшествующая беременность является основополагающим условием постановки диагноза гестационной хориокарциномы, однако клинические диагностические критерии ненадежны, за исключением случаев, когда на момент постановки диагноза у пациентки ранее не было половых контактов [7,13–15]. Наиболее достоверный способ идентификации происхождения ХЯ — молекулярно-генетическое тестирование, определяющее наличие аллелей партнера в опухолевом материале, однако ожидание результата этого исследования может занимать более одного месяца, что в ряде случаев приводит к отсрочке начала адекватного лечения.
В работе Fisher R.A. et al. в 1992 году представлена серия клинических наблюдений, в которой впервые гестационная хориокарцинома была верифицирована методом анализа ДНК с использованием определенных клонированных последовательностей генома (ДНК зондов) для анализа полиморфизма длин рестрикционных фрагментов путем сравнения образцов крови, полученных от пациентки и ее партнера. На основании результатов этой работы у пациентки с изначально установленным диагнозом ГХЯ по данным МГИ отсутствовал отцовский генетический материал в опухоли, что подтвердило диагноз НХЯ. Дороговизна метода и низкая доступность не позволили ему войти в широкую клиническую практику [7].
В настоящее время флуоресцентное микросателлит-ное генотипирование методом полимеразной цепной реакции (ПЦР) лежит в основе определения аллелей в опухоли, совпадающих с генотипом партнера. В 1996 году впервые было использовано профилирование на основе коротких тандемных повторов (short tandem repeat — STR), обладающих высокой специфичностью, генетической и соматической стабильностью [16]. При таком подходе ряд полиморфных STR-локусов амплифицируются методом ПЦР с дальнейшей оценкой наличия аллелей партнера в опухолевом материале с помощью анализа STR [17].
В крупном ретроспективном анализе Alifrangis C. с соавторами проведена оценка показателей общей выживаемости (ОВ) в когортах пациенток, получивших первичное лекарственное лечение в режиме ЕМА-СО в периоды с 1979 по 1995 год и с 1995 по 2010 год, и ОВ составила 86,2 % (n = 151) и 97,9 % (n = 140) соответственно. Увеличение ОВ почти на 9% связано, во-первых, с проведением
Таблица 2. Отличия в подходах лечения распространенных форм НХЯ и ГХЯ
Table 2. Differences in the treatment approaches for advanced gestational and non-gestational ovarian choriocarcinoma
|
НХЯ |
ГХЯ |
|
|
Оценка риска развития резистентности к лекарственной терапии |
– |
Прогностические критерии FIGO 2020 года |
|
I линия лекарственного лечения |
ВЕР, при противопоказаниях к назначению блеомицина — PEI, ЕР |
В зависимости от риска развития лекарственной резистентности: монохимиотерапия (метотрексат, дактиномицин), ЕМА-СО, ЕМА-ЕР |
|
Количество курсов ХТ |
При отсутствии резидуальной опухоли — 3 курса При наличии резидуальной опухоли — 4 курса |
До нормализации бета-ХГЧ + 2–3 консолидирующих курса |
|
Хирургическое лечение |
После завершения ХТ — удаление всех резидуальных проявлений болезни ≥ 1 см |
Не является стандартом лечения |
|
II линия лекарственного лечения |
TIP, VeIP |
|
|
III линия лекарственного лечения |
TGO, GemOx, при dMMR/MSI-H — пембролизумаб |
в когорте 2 (лечение с 1995 по 2010 год) низкодозовой ХТ в режиме ЕР пациенткам с факторами риска жизнеугрожающих осложнений. Такой подход привел к снижению частоты развития ранних смертей до 0,7%, в отличие от когорты 1 (с 1979 по 1995 год — 7,3%), получившей ХТ в полных дозах. Во-вторых, причина наблюдаемого улучшения ОВ также связана с применением МГИ, позволившего исключить опухоли негестационного происхождения, продуцирующие бета-ХГЧ (n = 6), летальность в данной подгруппе составила 100% [18].
Несмотря на отсутствующий результат МГИ на момент начала терапии, клинико-анамнестические данные указывали на ГХЯ сверхвысокого риска (18 баллов по FIGO), в связи с чем пациентке после проведения стабилизирующего курса продолжено лечение многокомпонентной платиносодержащей ХТ в режиме ЕМА-ЕР. Однако, учитывая выраженную гематологическую токсичность после проведения второго курса, этот режим был заменен на схему ВЕР.
Тактика ведения пациенток с ЗТО заключается в достижении нормализации концентрации бета-ХГЧ с последующим проведением 2–3 консолидирующих курсов ХТ [11]. В представленном клиническом наблюдении отмечено плато бета-ХГЧ после проведения второго курса ХТ в режиме ВЕР, что расценено как резистентность опухоли к проводимому лекарственному лечению.
В многоцентровое проспективное исследование II фазы TROPHIMMUN включались пациентки с ЗТО низкого (когорта A) и высокого (когорта B) рисков с резистентностью к одно- и многокомпонентной ХТ соответственно, которым проводили ИТ авелумабом. В когорте А была достигнута первичная конечная точка — частота нормализации бета-ХГЧ отмечена у 53% пациенток (n = 8) [19]. В когорте В лишь у 1 пациентки (14,3%) достигнута нормализация уровня бета-ХГЧ на фоне ИТ [20].
Ввиду отсутствия единых стандартов лечения ЗТО сверхвысокого риска при резистентности к первой линии ХТ нами назначена терапия отчаяния — ИТ пембролизумабом.
К моменту получения заключения МГИ был проведен один курс ИТ. Согласно полученному протоколу тести- рования в опухолевом материале не обнаружены аллели партнера, что исключает гестационную природу хориокарциномы и окончательно подтверждает диагноз НХЯ. К моменту получения заключения МГИ был проведен один курс ИТ.
Исходя из данных клинических рекомендаций, первая линия лекарственного лечения НХЯ включает проведение многокомпонентной платиносодержащей ХТ (режим ВЕР) [10]. Однако в литературе имеются данные об успешном применении метотрексат-содержащих режимов ХТ (ЕМА-СО, ЕМА) у пациенток с НХЯ [21–23]. Принципы хирургического подхода в лечении НХЯ основаны на результатах исследований, полученных среди мужчин с ГО [10,12].
Учитывая результат МГИ, а также наличие у пациентки остаточной опухоли размерами более 1 см по данным контрольного обследования, ИТ была отменена, после чего выполнена циторедуктивная операция. По результатам ГИ достигнут полный лечебный патоморфоз.
Принимая во внимание различные подходы ведения гестационных и негестационных форм ХЯ, для подтверждения диагноза всем пациенткам с ХЯ рекомендовано выполнение МГИ, определяющего наличие аллелей партнера в опухолевом материале. Несмотря на высокую чувствительность и специфичность данного метода, рутинное его применение в практике в настоящий момент затруднительно ввиду дороговизны, низкой доступности, а также длительного ожидания результата.
ЗАКЛЮЧЕНИЕ
Сложности лечения НХЯ часто ассоциированы с некорректно проведенной дифференциальной диагностикой, недостаточной осведомленностью специалистов о данном заболевании, а также редкой ее встречаемостью. Описанный клинический случай демонстрирует возможности и ценность молекулярно-генетического тестирования ХЯ для окончательной верификации опухоли и назначения адекватного лечения.


