HRD-негативная карцинома яичника высокой степени злокачественности у пациентки с наследственной мутацией BRCA2
Автор: Соколенко А.П., Полетаева С.В., Шестакова А.Д., Городнова Т.В., Берлев И.В., Имянитов Е.Н.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 2 т.23, 2024 года.
Бесплатный доступ
Актуальность. Дефицит гомологичной рекомбинации (HRD) - это важный предиктивный маркер эффективности препаратов платины и ингибиторов поли (АДФ-рибоза)-полимеразы (PARP). Наследственные или соматические мутации генов BRCA1 или BRCA2 являются наиболее частой причиной HRD в карциномах яичника . Однако в некоторых случаях у носителей патогенных наследственных мутаций BRCA1/2 в опухоли сохраняется нормальная копия соответствующего гена и фенотип HRD не формируется. Цель исследования - описание морфологического и молекулярного портрета карциномы яичника высокой степени злокачественности у пациентки с наследственной мутацией BRCA2, не демонстрирующей дефицита гомологичной репарации ДНК. Описание клинического случая. Представлено наблюдение пациентки, 48 лет, с синхронными первично-множественными злокачественными новообразованиями: high-grade карциномой яичника и колоректальной аденокарциномой. У пациентки выявлен известный патогенный вариант BRCA2 c.658_659delGT [rs80359604]. Учитывая неопределенный гистологический вариант низкодифференцированной карциномы, а именно, отсутствие экспрессии маркеров серозной или эндометриоидной дифференцировки, а также высокую экспрессию HER2, выполнено дополнительное молекулярное исследование метастатических очагов в лимфатические узлы. Обнаружено, что в данной опухоли профиль хромосомной нестабильности не соответствует HRD и наблюдается делеция мутантного аллеля BRCA2, что исключает BRCA-подобный фенотип.
Карцинома яичника высокой степени злокачественности, дефицит системы репарации путем гомологичной рекомбинации, мутации brca1 и brca2, потеря гетерозиготности, brca-подобный фенотип
Короткий адрес: https://sciup.org/140305904
IDR: 140305904 | УДК: 618.11-006.6:575.224.2 | DOI: 10.21294/1814-4861-2024-23-2-139-146
Текст научной статьи HRD-негативная карцинома яичника высокой степени злокачественности у пациентки с наследственной мутацией BRCA2
Дефицит гомологичной рекомбинации (HRD, homologous recombination deficiency) – фенотип, характеризующийся неспособностью клеток эффективно исправлять двунитевые разрывы ДНК и межцепочечные сшивки. Наиболее точным механизмом репарации подобных повреждений является гомологичная рекомбинация (HRR, homologous recombination repair), которая позволяет достичь прецизионного восстановления ДНК за счет использования в качестве матрицы цепей ДНК гомологичной хромосомы [1]. Нормальное функционирование HRR обеспечивается целым рядом белков, среди которых ключевую роль играют BRCA1 и BRCA2. Феномен дефицита гомологичной рекомбинации был впервые описан при наследственном BRCA1/2 -ассоциированном раке молочной железы и яичника. Патогенез этих новообразований включает полную вну-триопухолевую инактивацию BRCA1 или BRCA2 , чаще всего за счет сочетания патогенной наследственной мутации и соматической инактивации оставшегося нормального аллеля. Механизмом инактивации второй копии гена могут быть как делеции соответствующего сегмента хромосомы
(loss-of-heterozygosity, LOH), так и соматические микромутации. Еще один вариант – нарушение экспрессии мРНК вследствие гиперметилирования или иных эпигенетических изменений [2]. Нарушение гомологичной рекомбинации сопровождается использованием альтернативных, гораздо менее точных путей репарации двуцепочечных разрывов ДНК, в частности негомологичного соединения концов (NHEJ, non-homologous end joining), и приводит к появлению характерного паттерна хромосомных изменений (genomic scar). Для оценки подобного HRD-ассоциированного геномного профиля предложено несколько подходов, например тест, оценивающий суммарный размер регионов с потерей гетерозиготности (genomic LOH, gLOH) [3]. Еще один известный тест – определение показателя HRD как суммы трех характеристик опухолевого генома: количества участков потери гетерозиготности размером более 15 Мб (LOH), хромосомных разрывов между фрагментами более 10 Мб (large-scale state transitions, LST) и участков аллельного дисбаланса в области теломер (telomeric allelic imbalance, TAI) [4–7]. Показатель HRD >42 считается признаком дефицита гомологичной рекомбинации.
Неспособность эффективно восстанавливать ДНК делает HR-дефицитные карциномы исключительно чувствительными к химиопрепаратам, вызывающим межцепочечные сшивки (например, производным платины), и ингибиторам PARP [8]. Таким образом, диагностика HRD имеет большое практическое значение, так как позволяет отбирать пациентов с опухолями, потенциально чувствительными к упомянутой лекарственной терапии. В некоторых случаях опухоли у носителей патогенных наследственных мутаций BRCA1/2 не демонстрируют инактивации нормального аллеля гена; это особенно характерно для новообразований, которые не относятся к спектру BRCA1/2 -ассоциированных опухолей [9–10]. В соответствии с современными рекомендациями для назначения PARP-ингибиторов достаточно обнаружения наследственной мутации BRCA1/2 . Между тем последующий анализ соматического статуса второго аллеля и/или паттерна хромосомной нестабильности позволил бы более точно предсказать чувствительность к терапии. В данном сообщении мы приведем клинический пример агрессивного течения карциномы яичника без дефицита гомологичной рекомбинации у носительницы мутации BRCA2 .
Клиническое наблюдение
Больная В., 48 лет, проходила лечение в ГБУЗ «Самарский областной клинический онкологический диспансер» с диагнозом первичномножественное злокачественное новообразование: рак яичника (С56), рак прямой кишки (С20). В июне 2021 г. при УЗИ органов малого таза обнаружено смещаемое образование в проекции правого яичника 141×92 мм с утолщенными стенками и густой взвесью. В августе 2021 г. выполнена лапаротомия, экстирпация матки с придатками, резекция большого сальника, удаление увеличенного парааортального лимфатического узла. Правый яичник представлен кистозной опухолью с коричневым содержимым. После патоморфоло-гического исследования гистологический диагноз сформулирован как злокачественная смешанная герминогенная опухоль (дисгерминома в сочетании с опухолью эндометриального синуса), метастаз злокачественной герминогенной опухоли в пара-аортальный лимфатический узел (pT1aN1bM0). В адъювантном режиме пациентка получила 6 циклов стандартной химиотерапии (паклитаксел и карбоплатин; последний цикл в феврале 2022 г.). В мае 2022 г. больная оперирована по поводу рака прямой кишки (pT1N0M0); при гистологическом исследовании установлена умеренно дифференцированная колоректальная аденокарцинома.
В октябре 2022 г. по результатам позитронноэмиссионной томографии и компьютерной томографии зарегистрировано прогрессирование заболевания: множественные метастазы в
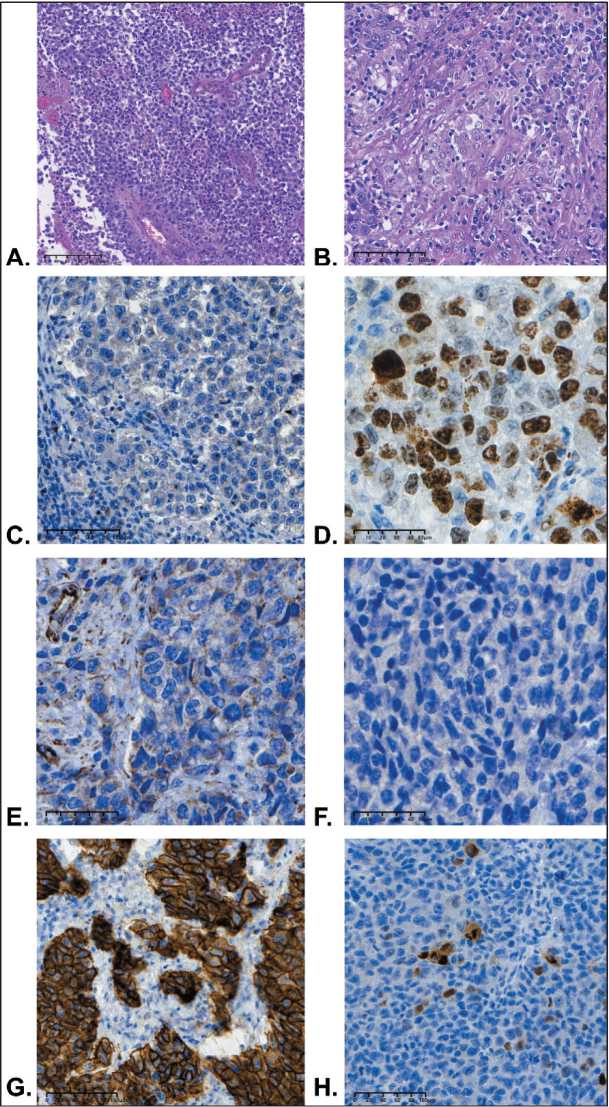
Рис. 1. Микрофото. HER2-позитивная карцинома яичника высокой степени злокачественности у пациентки с мутацией BRCA2 c.658_659delGT:
-
A. Фрагмент лимфоузла с комплексами неопластических клеток (образец 2021 г., ×100); В. Клетки низкодифференцированной карциномы (образец 2023 г., ×200); С. Отсутствие экспрессии OCT 3/4 (образец 2021 г., ×200). D. Положительная экспрессия Ki67 (образец 2021 г., ×400); E. Отсутствие ядерной экспрессии WT1 (образец 2023 г., ×400); F. Отсутствие экспрессии PAX8 (образец 2023 г., ×400); G. Диффузная интенсивная мембранная экспрессия HER2 (образец 2023 г., ×200); H. Экспрессия PgR до 10 % (образец 2021 г., ×200). Примечание: рисунок выполнен авторами
Fig. 1. Microphoto. HER2-positive high-grade carcinoma of the ovary in a BRCA2 c.658_659delGT carrier: A. Lymph node with neoplastic foci (specimen 2021, ×100); В. Poorly differentiated carcinoma (specimen 2023; ×200); C. Negative OCT 3/4 expression (specimen 2021, ×200); D. Expression of the Ki67 (specimen 2021, ×400); E. WT1 negative immunoexpression (specimen 2023; ×400); F. PAX8 negative immunoexpression (specimen 2023; ×400); G. Strong positive HER2 expression (specimen 2023; ×200); H. PgR expression up to 10 % (specimen 2021, ×200). Note: created by the authors
Таблица/table
ИГХ-исследование опухолевых образцов – метастазов карциномы яичника в парааортальный лимфатический узел (образец 2021 г.) и лимфоузел средостения (образец 2023 г.)
iHc analysis of metastatic lesions in paraaortic lymph node (specimen 2021) and mediastinal lymph node (specimen 2023)
|
ИГХ–маркер/ IHC marker |
Экспрессия в образце 2021 г./ Expression in 2021 sample |
Экспрессия в образце 2023 г./ Expression in 2023 sample |
|
CK7 |
Диффузная/Diffuse |
Фокальная/Focal |
|
CD117 |
Негативная/Negative |
Негативная/Negative |
|
OCT 3/4 |
Негативная/Negative |
Негативная/Negative |
|
TTF1 |
Негативная/Negative |
Негативная/Negative |
|
CK20 |
Негативная/Negative |
Негативная/Negative |
|
Synaptophysin |
Негативная/Negative |
Негативная/Negative |
|
WT1 |
Мембранно–цитоплазматическая/ |
Мембранно–цитоплазматическая/ |
|
Membranous and cytoplasmic |
Membranous and cytoplasmic |
|
|
CDX2 |
Фокальная ядерная/Focal nuclear |
Фокальная ядерная/Focal nuclear |
|
ER |
Негативная/Negative |
Негативная/Negative |
|
PgR |
Up to 10 % |
Негативная/Negative |
|
Her2 |
Диффузноинтенсивная мембранная (+++)/ |
Диффузноинтенсивная мембранная (+++)/ |
|
Diffuse membranous (+++) |
Diffuse membranous (+++) |
|
|
p53 |
Фокальная ядерная слабой интенсивности (дикий тип)/ |
|
|
Focal nuclear, weak intensity (wild–type) |
||
|
p63 |
До 20 % в очагах плоскоклеточной метаплазии/ |
|
|
Up to 20 % in squamous metaplasia foci |
||
|
MSH2 |
– |
Диффузная ядерная/Diffuse nuclear |
|
MSH6 |
– |
Диффузная ядерная/Diffuse nuclear |
|
MLH1 |
– |
Диффузная ядерная/Diffuse nuclear |
|
PMS2 |
– |
Диффузная ядерная/Diffuse nuclear |
|
Ki67 |
До 90 %/Up to 90 % |
До 90 %/Up to 90 % |
Примечание: таблица составлена авторами.
Note: created by the authors.
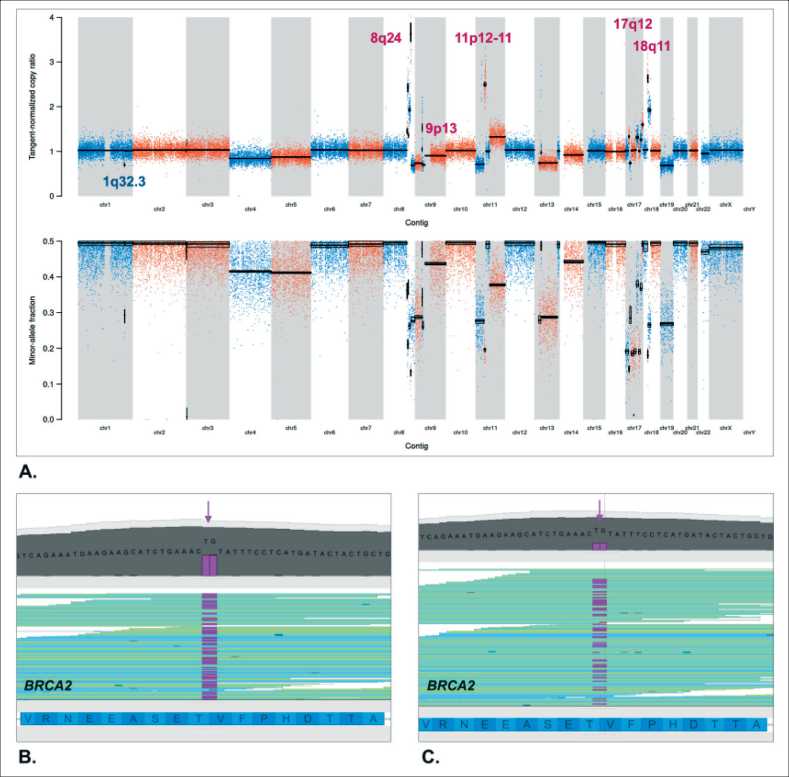
Рис. 2. Молекулярный анализ опухолевой ткани (образец 2021 г.): A. Профиль хромосомной нестабильности не-HRD типа, обозначены множественные амплификации; В. NGS-анализ BRCA2 в образце крови – выявлена делеция двух нуклеотидов c.658_659delGT; С. Анализ локуса мутации BRCA2 c.658_659delGT в опухолевом образце: отмечается уменьшение фракции прочтений с мутацией относительно нормальных прочтений, что соответствует потере гетерозиготности с утратой мутантного аллеля.
Примечание: рисунок выполнен авторами Fig. 2. Molecular analysis of ovarian tumor samples (specimen 2021):
A. Chromosomal instability consistent with non-HRD profile; B. NGS analysis of the BRCA2 coding sequence: c.658_659delGT pathogenic variant identified; C. Loss of heterozygosity in tumor tissue: lower proportion of reads with mutation compared to normal reads. Note: created by the authors лимфоузлы средостения. Период без рецидива составил 5 мес. В январе 2023 г. выполнена видеоторакоскопия с биопсией лимфатических узлов средостения. Опухолевый материал подвергнут иммуногистохимическому исследованию. По результатам ИГХ-исследования начальный морфологический диагноз дисгерминомы был исключен; гистотип опухолевых образцов 2021 г. (метастаз в парааортальный лимфатический узел) и 2023 г. (метастаз в лимфатический узел средостения) соответствовал серозной или эндометриоидной карциноме яичника high-grade с плоскоклеточной метаплазией, позитивным HER2-статусом (рис. 1, таблица). В образце опухолевой ткани из прямой кишки наблюдалась характерная для колоректальных аденокарцином диффузная ядерная экспрессия CDX2 и диффузная экспрессия CK20.
С октября 2022 г. по апрель 2023 г. пациентка не получала специфического противорецидивного лечения. В апреле и мае 2023 г. проведено 2 цикла монотерапии доцетакселом без клинического эффекта. В 2023 г. отмечалось значительное прогрессирование заболевания в виде множественных метастазов в надключичные, подмышечные лимфоузлы, мягкие ткани грудной клетки, капсулу печени, надпочечники. Период общего наблюдения составил 24 мес (последнее наблюдение – июнь 2023 г.)
Образцы крови и образцы метастатических опухолевых тканей направлены на молекулярногенетическое исследование в НМИЦ онкологии им. Н.Н. Петрова. При анализе полной кодирующей последовательности BRCA1/2 выявлен герминальный патогенный вариант BRCA2 c.658_659delGT [rs80359604]. При NGS-анализе опухолевой ткани c использованием панели SeqCap EZ CNV/LOH Backbone Design panel (Roche) установлено, что данная карцинома не характеризуется дефицитом гомологичной рекомбинации. Так, в опухолевой ткани наблюдалась делеция мутантной копии гена BRCA2, а профиль хромосомной нестабильности не соответствовал HRD. Величина показателя HRD составила 21, что значительно ниже формального порога для HRD-позитивного статуса (рис. 2). Были обнаружены амплификации 8q24 (MYC), 9p13 (PTENP1), 11p12-11 (HSD17B12), 17q12 (ERBB2), 18q11 (GATA6). Профиль хромосомной нестабильности дополнен анализом соматических микромутаций: выполнено таргетное высокопроизводительное секвенирование 165 он-коассоциированных генов: ABCB1, ABL1, ACVR2A, AKT1, ALK, APC, APOBEC3B, AR, ARAF, ARID1A, ASTE1, ATM, ATR, ATRX, B2M, BAP1, BCL2, BCOR, BRAF, BRCA1, BRCA2, BTK, EMSY, CCNB1, CCND1, CCNE1, CCNE2, CDH1, CDK1, CDK12, CDK2, CDK4, CDK6, CDKN1B, CDKN2A, CDKN2B, CD-KN2C, CEBPA, CHEK1, CHEK2, CIC, CREBBP, CSF1R, CTNNB1, CYLD, DDR2, DICER1, DNMT3A, EGFR, EP300, ERBB2, ERBB3, ERBB4, ERCC2,
ESR1, EZH2, FAT1, FBXW7, FGF1, FGFR1, FGFR2, FGFR3, FLT1, FLT3, FLT4, FOXA1, FOXL2, FUBP1, GATA3, GNA11, GNAQ, GNAS, H3F3A, HRAS, IDH1, IDH2, IGF1R, JAK1, JAK2, JAK3, KDR, KIT, KMT2C, KMT2D, KRAS, LATS1, LATS2, MAP2K1, MAP2K4, MAPK1, MAX, MCL1, MEN1, MET, MLH1, MSH2, MSH6, MTOR, MYC, MYCL, MYCN, MYD88, NF1, NF2, NFE2L2, NOTCH1, NOTCH2, NRAS, NSD1, NTRK1, PALB2, PAX5, PBRM1, PDGFRA, PDGFRB, PIK3CA, PIK3CB, PIK3R1, PIM1, PMS1, POLD1, POLE, PPP2R1A, PTCH1, PTEN, PTPN11, RAC1, RAD21, RAD51, RAD51C, RAD51D, RAF1, RB1, RBM10, RET, RHOA, RNF43, ROS1, RUNX1, SER-PINB3, SERPINB4, SETBP1, SETD2, SF3B1, SMAD2, SMAD4, SMARCA4, SMARCB1, SMO, SOX9, STAG2, STK11, SUFU, TAF1B, TERT, TET1, TET2, TGFBR1, TGFBR2, TP53, TP53BP1, TSC1, TSC2, VHL, WT1 [11]. В метастатических образцах 2021 и 2023 гг. идентифицированы мутации TP53 c.445dupT (фракции мутаций – 56 и 59 % в образцах 2021 и 2023 гг. соответственно) и CDKN2A c.100delG (фракции мутаций – 54 и 68 % в образцах 2021 и 2023 гг. соответственно). Некоторые мутации обнаруживались только в одном из образцов. В частности, в образце 2021 г. были выявлены соматические мутации MSH2 p.Leu679Trp (фракция мутации – 30 %) и PIK3CB IVS10-7T>A (30 %); в образце 2023 г. – TET2 p.Thr606Ser (24 % копий с мутацией) и CDH1 p.Gly354Trp (10 % копий с мутациями). Микросателлитная нестабильность не обнаружена. Внутриопухолевые мутации или нарушения копийности PTEN не обнаружены.
Обсуждение
Список литературы HRD-негативная карцинома яичника высокой степени злокачественности у пациентки с наследственной мутацией BRCA2
- Deans A.J., West S.C. DNA interstrand crosslink repair and cancer. Nat Rev Cancer. 2011; 11(7): 467-80. https://doi.org/10.1038/nrc3088.
- Iyevleva A.G., Imyanitov E.N. Cytotoxic and targeted therapy for hereditary cancers. Hered Cancer Clin Pract. 2016; 14(1): 17. https://doi.org/10.1186/s13053-016-0057-2.
- Swisher E.M., Lin K.K., Oza A.M., Scott C.L., Giordano H., Sun J., Konecny G.E., Coleman R.L., Tinker A.V., O'Malley D.M., Kristeleit R.S., Ma L., Bell-McGuinn K.M., Brenton J.D., Cragun J.M., Oaknin A., Ray-Coquard I., Harrell M.I., Mann E., Kaufmann S.H., Floquet A., Leary A., Harding T.C., Goble S., Maloney L., Isaacson J., Allen A.R., Rolfe L., Yelensky R., Raponi M., McNeish I.A. Rucaparib in relapsed, platinum-sensitive high-grade ovarian carcinoma (ARIEL2 Part 1): an international, multicentre, open-label, phase 2 trial. Lancet Oncol. 2017; 18(1): 75-87. https://doi.org/10.1016/S1470-2045(16)30559-9.
- Abkevich V., Timms K.M., Hennessy B.T., Potter J., Carey M.S., Meyer L.A., Smith-McCune K., Broaddus R., Lu K.H., Chen J., Tran T.V., Williams D., Iliev D., Jammulapati S., FitzGerald L.M., Krivak T., DeLoia J.A., Gutin A., Mills G.B., Lanchbury J.S. Patterns of genomic loss of heterozygosity predict homologous recombination repair defects in epithelial ovarian cancer. Br J Cancer. 2012; 107(10): 1776-82. https://doi.org/10.1038/bjc.2012.451.
- Popova T., Manié E., Rieunier G., Caux-Moncoutier V., Tirapo C., Dubois T., Delattre O., Sigal-Zafrani B., Bollet M., Longy M., Houdayer C., Sastre-Garau X., Vincent-Salomon A., Stoppa-Lyonnet D., Stern M.H. Ploidy and large-scale genomic instability consistently identify basal-like breast carcinomas with BRCA1/2 inactivation. Cancer Res. 2012; 72(21):5454-62. https://doi.org/10.1158/0008-5472.CAN-12-1470.
- Birkbak N.J., Wang Z.C., Kim J.Y., Eklund A.C., Li Q., Tian R., Bowman-Colin C., Li Y., Greene-Colozzi A., Iglehart J.D., Tung N., Ryan P.D., Garber J.E., Silver D.P., Szallasi Z., Richardson A.L. Telomeric allelic imbalance indicates defective DNA repair and sensitivity to DNA-damaging agents. Cancer Discov. 2012; 2(4): 366-75. https://doi.org/10.1158/2159-8290.CD-11-0206. Erratum in: Cancer Discov. 2013; 3(8): 952.
- Telli M.L., Timms K.M., Reid J., Hennessy B., Mills G.B., Jensen K.C., Szallasi Z., Barry W.T., Winer E.P., Tung N.M., Isakoff S.J., Ryan P.D., Greene-Colozzi A., Gutin A., Sangale Z., Iliev D., Neff C., Abkevich V., Jones J.T., Lanchbury J.S., Hartman A.R., Garber J.E., Ford J.M., Silver D.P., Richardson A.L. Homologous Recombination Deficiency (HRD) Score Predicts Response to Platinum-Containing Neoadjuvant Chemotherapy in Patients with Triple-Negative Breast Cancer. Clin Cancer Res. 2016; 22(15): 3764-73. https://doi.org/10.1158/1078-0432.CCR-15-2477.
- Imyanitov E., Sokolenko A. Integrative Genomic Tests in Clinical Oncology. Int J Mol Sci. 2022; 23(21): 13129. https://doi.org/10.3390/ijms232113129.
- Maxwell K.N., Wubbenhorst B., Wenz B.M., De Sloover D., Pluta J., Emery L., Barrett A., Kraya A.A., Anastopoulos I.N., Yu S., Jiang Y., Chen H., Zhang N.R., Hackman N., D'Andrea K., Daber R., Morrissette J.J.D., Mitra N., Feldman M., Domchek S.M., Nathanson K.L. BRCA locus-specific loss of heterozygosity in germline BRCA1 and BRCA2 carriers. Nat Commun. 2017; 8(1): 319. https://doi.org/10.1038/s41467-017-00388-9.
- Rempel E., Kluck K., Beck S., Ourailidis I., Kazdal D., Neumann O., Volckmar A.L., Kirchner M., Goldschmid H., Pfarr N., Weichert W., Hübschmann D., Fröhling S., Sutter C., Schaaf C.P., Schirmacher P., Endris V., Stenzinger A., Budczies J. Pan-cancer analysis of genomic scar patterns caused by homologous repair deficiency (HRD). NPJ Precis Oncol. 2022; 6(1): 36. https://doi.org/10.1038/s41698-022-00276-6.
- SokolenkoA.P., Gorodnova T.V., Bizin I.V., Kuligina E.S., Kotiv K.B., Romanko A.A., Ermachenkova T.I., Ivantsov A.O., Preobrazhenskaya E.V., Sokolova T.N., Broyde R.V., Imyanitov E.N. Molecular predictors of the outcome of paclitaxel plus carboplatin neoadjuvant therapy in high-grade serous ovarian cancer patients. Cancer Chemother Pharmacol. 2021; 88(3): 439-50. https://doi.org/10.1007/s00280-021-04301-6.
- Mavaddat N., Barrowdale D., Andrulis I.L., et al. Pathology of breast and ovarian cancers among BRCA1 and BRCA2 mutation carriers: results from the Consortium of Investigators of Modifiers of BRCA1/2 (CIMBA). Cancer Epidemiol Biomarkers Prev. 2012; 21(1): 134-47. https://doi.org/10.1158/1055-9965.EPI-11-0775.
- Li S., Silvestri V., Leslie G., et al. Cancer Risks Associated With BRCA1 and BRCA2 Pathogenic Variants. J Clin Oncol. 2022; 40(14):1529-41. https://doi.org/10.1200/JCO.21.02112.
- Gorodnova T.V., Sokolenko A.P., Kotiv Kh.B., Ivantsov A.O., Ibragimov Z.N., Berlev I.V., Urmancheeva A.F., Imyanitov E.N. Redkii sluchai razvitiya low-grade seroznoi kartsinomy yaichnika s mutatsiei NRAS u nositel'nitsy patogennogo varianta BRCA1. Akusherstvo i ginekologiya 2022, 4: 176-82. https://doi.org/10.18565/aig.2022.4.176-182.
- Ross D.S., Devereaux K.A., Jin C., Lin D.Y., Zhang Y., Marra A., Makker V., Weigelt B., Ellenson L.H., Chui M.H. Histopathologic features and molecular genetic landscape of HER2-amplified endometrial carcinomas. Mod Pathol. 2022; 35(7): 962-71. https://doi.org/10.1038/s41379-021-00997-2.
- Kotiv Kh.B., Gorodnova T.V., Lavrinovich O.E., Berlev I.V. Malignizirovannye endometrioz-assotsiirovannye ovarial'nye i ekstraovarial'nye neoplazii: obzor literatury. Opukholi zhenskoi reproduktivnoi sistemy 2022; 18(4): 127-37. https://doi.org/10.17650/1994-4098-2022-18-4-127-137.
- Sokolenko A.P., Bogdanova N., Kluzniak W., Preobrazhenskaya E.V., Kuligina E.S., Iyevleva A.G., Aleksakhina S.N., Mitiushkina N.V., Gorodnova T.V., Bessonov A.A., Togo A.V., Lubiński J., Cybulski C., Jakubowska A., Dörk T., Imyanitov E.N. Double heterozygotes among breast cancer patients analyzed for BRCA1, CHEK2, ATM, NBN/NBS1, and BLM germ-line mutations. Breast Cancer Res Treat. 2014; 145(2): 553-62. https://doi.org/10.1007/s10549-014-2971-1.
- Segev Y., Iqbal J., Lubinski J., Gronwald J., Lynch H.T., Moller P., Ghadirian P., Rosen B., Tung N., Kim-Sing C., Foulkes W.D., Neuhausen S.L., Senter L., Singer C.F., Karlan B., Ping S., Narod S.A.; Hereditary Breast Cancer Study Group. The incidence of endometrial cancer in women with BRCA1 and BRCA2 mutations: an international prospective cohort study. Gynecol Oncol. 2013; 130(1): 127-31. https://doi.org/10.1016/j.ygyno.2013.03.027.
- Sorouri K., Lynce F., Feltmate C.M., Davis M.R., Muto M.G., Konstantinopoulos P.A., Stover E.H., Kurian A.W., Hill S.J., Partridge A.H., Tolaney S.M., Garber J.E., Bychkovsky B.L. Endometrial Cancer Risk Among Germline BRCA1/2 Pathogenic Variant Carriers: Review of Our Current Understanding and Next Steps. JCO Precis Oncol. 2023; 7. https://doi.org/10.1200/PO.23.00290.
- De Jonge M.M., Auguste A., van Wijk L.M., Schouten P.C., Meijers M., Ter Haar N.T., Smit V.T.H.B.M., Nout R.A., Glaire M.A., Church D.N., Vrieling H., Job B., Boursin Y., de Kroon C.D., Rouleau E., Leary A., Vreeswijk M.P.G., Bosse T. Frequent Homologous Recombination Deficiency in High-grade Endometrial Carcinomas. Clin Cancer Res. 2019;25(3): 1087-97. https://doi.org/10.1158/1078-0432.CCR-18-1443.


