Хроническая болезнь почек и фибрилляция предсердий: подходы к выбору антиаритмической терапии
Автор: Татарский Б. А., Казеннова Н. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
В клинической практике нарушение функции почек достаточно часто сочетается с сердечно-сосудистыми заболеваниями, в частности с фибрилляцией предсердий (ФП). Как известно, почки осуществляют множество функций, включая выделительную, метаболическую и эндокринную. Кардио-ренальная ось регулируется таким образом, что нарушенный баланс приводит как к сердечному, так и к почечному ремоделированию. Следовательно, патофизиологические взаимосвязи между почками и сердцем имеют важное клиническое значение. Рассматривая необходимость создания основы для персонализированной помощи, ориентированной на пациента, в настоящее время представлены документы о позиции ряда ассоциаций и обществ, посвященных лечению больных с ФП и хронической болезнью почек (ХБП). Лечение ФП включает в себя профилактическую антикоагуляцию и фармакологическую терапию, направленную на удержание синусового ритма (СР) или коррекцию частоты желудочковых ответов. Вместе с тем при выборе оптимальной дозы пероральных прямых антикоагулянтных препаратов существует ряд разночтений в опубликованных регламентирующих документах различных кардиологических и нефрологических сообществ. Следует отметить, что в течение последних лет не было достигнуто значительного улучшения клинической фармакологии аритмий. Существующие фармакологические подходы коррекции аритмии у больных с ФП и ХБП лимитированы их ограниченной эффективностью и возможностью развития опасных эффектов, включающих проаритмический эффект в отношении желудочковых аритмий и органо-токсичные осложнения. Использование катетерной и хирургической аблации тормозится сложностью, стоимостью и высокой частотой рецидивов у больных с ХБП. Представляется, что антиаритмическим препаратам (ААП) придается недостаточно внимания по сравнению с антикоагулянтной терапией, особенно у больных с ФП и ХБП. В представленной обзорной статье рассматриваются подходы к выбору антиаритмической терапии у данной категории пациентов.
Фибрилляция предсердий, хроническая болезнь почек, антиаритмические препараты, проаритмия, гемодиализ
Короткий адрес: https://sciup.org/149144428
IDR: 149144428 | УДК: 616.12-008.313.2-085.222:616.61-036.12 | DOI: 10.29001/2073-8552-2023-38-4-20-28
Текст обзорной статьи Хроническая болезнь почек и фибрилляция предсердий: подходы к выбору антиаритмической терапии
Хроническая болезнь почек (ХБП) является часто встречающимся коморбидным состоянием у пациентов с фибрилляцией предсердий (ФП). Согласно современным представлениям, ХБП определяется как наличие патологических изменений почек, которые могут затрагивать их структуру и / или функцию в течение периода длительностью более 3 мес. с влиянием на здоровье пациента. В США встречаемость ХБП превышает 10% во взрослой популяции и достигает 47% у лиц старше 70 лет с тенденцией к ее повышению [1, 2]. Среди наиболее распространенных причин снижения продолжительности жизни ХБП поднялась с 36-го места в 1990 г. на 9-е место в 2016 г., а согласно рейтингу Глобального Бремени Болезней, ХБП – одна из десяти основных причин потери трудоспособности [3].
ФП и ХБП имеют общие факторы риска (возраст, артериальная гипертензия, сахарный диабет, клапанные пороки, острый коронарный синдром, сердечная недостаточность и др.). Эти заболевания регистрируются во всем мире с нарастающей частотой [4]. По данным регистра ORBIT-AF, у 30% пациентов с ФП отмечается
ХБП 3–5-й стадий [5], а по данным отечественного регистра РЕКВАЗА [6], примерно половина пациентов с ФП имеют сопутствующую ХБП. Как ФП, так и ХБП сопровождаются повышенным риском инсульта, развития сердечно-сосудистых заболеваний и смерти [7]. Кроме того, при данном клиническом сценарии отмечался тромбо-геморрагический парадокс, который характеризовался повышенным риском развития инсульта или системной тромбоэмболии (на 49%) и кровотечений (на 123%) [8].
Представляется, что уровень нарушения фильтрационной функции почек является независимым, значимым предиктором развития ФП. Вероятность возникновения ФП возрастала на 32% при скорости клубочковой фильтрации (СКФ) 30–59 мл/мин/1,73 м2 и на 57% при СКФ < 30 мл/мин/1,73 м2. Существует комплексное реципрокное соотношение между ФП и ХБП: ХБП не только предрасполагает к развитию ФП, но и наличие ФП сопряжено с ухудшением внутрипочечной гемодинамики, риском дальнейшего снижения СКФ и нарастания альбуминурии [8]. Так, у лиц с сочетанием ФП и ХБП регистрируется повышенный риск инсульта и смертности из-за их чрезмерного риска как для тромбоэмболических, так и для тяже- лых кровотечений по сравнению с пациентами только с наличием ФП или ХБП [9, 10]. Кроме того, лечение ФП у пациентов с ХБП представляет собой огромную клиническую задачу. В то время как варианты лечения, включая лекарственные средства, устройства и процедурные методы доступны, их использование в условиях ХБП является неоднозначным.
Существующие фармакологические подходы у больных с ФП и ХБП лимитированы их ограниченной эффективностью и возможностью развития опасных эффектов, включающих проаритмический эффект в отношении желудочковых аритмий и органо-токсичные осложнения. Использование катетерной и хирургической аблации тормозится сложностью, стоимостью и высокой частотой рецидивов у больных с ХБП [2]. Несмотря на значимые достижения в понимании электрофизиологических механизмов инициации и поддержания ФП, лечение этой аритмии в большинстве случаев остается симптоматическим. Оно включает в себя профилактическую антикоагуляцию и фармакологическую терапию, направленную на удержание синусового ритма (СР) или коррекцию частоты желудочковых сокращений (ЧСЖ).
Поскольку выбор терапии, в частности, антиаритми-ческих препаратов (ААП) у пациентов с ФП и ХБП зависит от степени выраженности нарушений функции почек, для повышения эффективности и безопасности лечения у данной категории больных требуется более дифференцированный подход к градации ее тяжести. Критерии диагностики ХБП довольно строго определены в большинстве клинических исследований, включавших пациентов с ФП.
Предложенная классификация стадий ХБП (табл. 1) основана на подходе, содержащем причину и тяжесть, выраженную в расчетной СКФ и уровне альбуминурии. Пороговый уровень СКФ < 60 мл/мин/1,73 м2 (категория СКФ G3a–G5) в течение более 3 мес. служит признаком ХБП. Альбуминурия включена в качестве дополнительного маркера тяжести повреждения, поскольку связана не только с прогрессированием ХБП, но также с худшим прогнозом, особенно со стороны сердечно-сосудистой системы [11].
Таблица 1. Критерии для диагностики хронической болезни почек: оценка почечной функции и категории почечной дисфункции [11]
Table 1. Criteria for the diagnosis of CKD: assessment of renal function and category of renal dysfunction [11]
|
Снижение СКФ GFR decrease |
СКФ <60 мл/мин/1,73 м2 CKD <60 ml/min/1.73 m2 |
||
|
Маркеры повреждения почек (≥1) Markers of kidney damage (≥1) |
– альбуминурия (AER ≥ 30 мг/24 ч, ACR ≥30 мг/г или ≥3 мг/ммоль) albuminuria (AER ≥ 30 mg/24 h, ACR≥30 mg/g or ≥3 mg/mmol – изменения мочевого осадка / changes in urinary sediment – канальцевая дисфункция / tubular dysfunction – гистологические изменения / histological changes – структурные изменения при визуализирующих методах исследования / structural changes in imaging – трансплантация почки в анамнезе / history of kidney transplantation |
||
|
Категория СКФ GFR category |
Стадия ХБП CKD stage |
СКФ CKD |
Описание Discription |
|
G1 |
1 |
≥90 |
Нормальная или высокая Normal or high |
|
G2 |
2 |
60–89 |
Умеренно сниженная Mildly decreased |
|
G3a |
3 |
45–59 |
Мягко сниженная до умеренного Mildly to moderately decreased |
|
G3b |
30–44 |
От умеренного до серьезного снижение Moderately to severely decreased |
|
|
G4 |
4 |
15–29 |
Резко сниженная Severely decreased |
|
G5 |
5 |
<15 |
Почечная недостаточность (требуется почечная заместительная терапия – диализ или трансплантация почек) Renal failure (renal replacement therapy is required - dialysis or kidney transplantation) |
Примечание: СКФ – скорость клубочковой фильтрации, ХБП – хроническая болезнь почек, ACR – соотношение альбумин/креатинин в моче, AER – скорость экскреции альбумина.
Note: GFR – glomerular filtration rate, CKD – chronic kidney disease, ACR – albumin/creatinine ratio in urine, AER – albumin excretion rate.
Снижение фильтрационной функции почек может иметь важное значение в отношении фармакокинетики (ФК) используемых медикаментозных препаратов. Основные изменения ФК препарата у пациентов с ХБП включают биодоступность, объем распределения, связывания с белками, метаболизм препарата и его выведение. Эти изменения могут привести к снижению способности выведения препаратов и / или их метаболитов, повышению чувствительности к медикаментам, снижению устойчивости к побочным эффектам, особенно в пожилом возрасте, и даже к потере эффективности. Для ААП, элиминируемых почками, наиболее опасны последствия накопления препарата, включая токсический и проаритмогенный эф- фекты с потенциальными жизнеугрожающими осложнениями [12, 13].
При прогнозировании влияния почечной дисфункции на метаболизм конкретного ААП у пациентов с ФП и ХБП возникают значительные трудности из-за отсутствия количественного алгоритма для прогнозирования «класс-специфичных» изменений препаратов различных классов [14, 15]. У пациентов с ХБП до принятия клинического решения о применении ААП следует собрать детальный анамнез с соответствующей демографической и клинической информацией, в том числе в отношении сопутствующей патологии и терапии; при этом должна быть оценена функция почек. Расчет- ная СКФ является стандартным показателем функции почек [14].
Несмотря на наличие нескольких методических рекомендаций [12, 13, 15], предлагающих оценивать уровень СКФ при решении вопроса о дозе используемого препарата, все еще остаются противоречия в отношении наилучшего способа принятия решений о применении стандартно используемых доз препаратов у пациентов с ХБП и ФП. Оценка СКФ может быть проведена при помощи нескольких формул (Кокрофт – Голта, CKD-EPI, MDRD), в которых сочетаются количественные показатели в отношении эндогенных веществ (уровень креатинина сыворотки) с факторами, специфичными для пациентов (возраст, масса тела, раса и пол), но каждая из этих расчетных формул имеет свои преимущества и недостатки. Вместе с тем, учитывая отсутствие единого мнения относительно наилучшей формулы, могут быть значительные различия между полученными значениями СКФ.
Медицинские регуляторные документы при выборе дозировки препарата все еще рекомендуют применять формулу для расчета клиренса креатинина (Кокрофт – Голта). Если же использовались расчетные формулы для определения СКФ (мл/мин/1,73 м2), то полученные результаты должны были быть пересчитаны в абсолютные значения СКФ в мл/мин. Объяснялось это тем, что коррекция дозы у пациентов со сниженной функцией почек должна быть основана на абсолютном значении СКФ, а не на стандартизованном значении к площади поверхности тела. Вместе с тем определение клиренса креатинина с использованием формулы Кокрофт – Голта применялось для выбора дозы прямых пероральных антикоагулянтов в рандомизированных клинических исследованиях. При выборе дозировки ААП приоритет указанных расчетных формул отсутствует, поскольку исследований такой направленности не проводилось [16]. Такая неопределенность вызывает беспокойство в отношении возможности неправильной дозировки препарата, поскольку многие часто используемые ААП у пациентов с ФП, ХБП или сердечной недостаточностью требуют коррекции дозы в зависимости от фильтрационной функции почек [17].
Пациенты с ФП и ХБП при возможности должны получать такое же лечение, что и пациенты с нормальной функцией почек. При этом необходимо принимать во внимание возможные серьезные побочные эффекты ААП, поскольку у большинства ААП имеется «узкое» терапевтическое окно [18]. Следовательно, дозировки могут нуждаться в коррекции с учетом потенциального удлинения периода полувыведения и снижения клиренса препарата. В ряде случаев некоторые препараты могут быть вообще непригодны для пациентов с ХБП. Дозы препаратов при лечении ФП и ХБП должны соответствовать инструкциям, одобренными регуляторными органами. К сожалению, все еще имеются противоречия в отношении факторов, которые необходимо учитывать при дозировании препаратов у пациентов с ХБП [14–16].
На рисунке 1 представлен алгоритм, демонстрирующий наиболее релевантные критерии, которые должны быть включены в междисциплинарный процесс принятия решений. Показания к стратегии контроля ритма или частоты у больных с ХБП отражают те же подходы, что и в популяции пациентов с ФП без заболевания почек [18].
При принятии решения о выборе стратегии контроля ритма или контроля частоты при ФП и ХБП следует учитывать множество аспектов: продолжительность ФП, тяжесть клинических симптомов, размер (индекс объема) левого предсердия (ЛП), гипертрофию и фракцию выброса левого желудочка (ФВЛЖ), возраст, коморбид-ность, почечный клиренс [19]. Прежние рандомизированные исследования продемонстрировали, что в общей популяции стратегии контроля ритма и контроля частоты эквивалентны в степени влияния на риски развития сердечной недостаточности, острого нарушения мозгового кровообращения (ОНМК) и выживаемость [20, 21]. Вместе с тем у пациентов с ФП и ХБП отсутствуют четкие доказательства относительно наилучшего подхода к выбору стратегии контроля ритма или контроля частоты. Независимо от выбора стратегии антикоагулянтная терапия должна быть продолжена в соответствии с рисками тромбоэмболических осложнений при отсутствии противопоказаний. Тактика назначения, режим дозирования антитромботической терапии и особенности лекарственных взаимодействий пероральных антикоагулянтов у пациентов с ФП и ХБП широко представлены в отечественных и зарубежных руководствах [13, 19, 22].
Самым значимым, доказанно обоснованным показанием к стратегии контроля ритма при ФП является снижение выраженности клинических симптомов, хотя у части пациентов могут регистрироваться бессимптомные / ма-лосимптомные формы ФП. Дополнительными факторами в пользу попыток контроля ритма являются: сложность в достижении адекватного контроля ЧСЖ, более молодой возраст пациентов, тахи-индуцированная кардиомиопатия, впервые зарегистрированный эпизод ФП либо ФП, спровоцированная острым заболеванием или хирургическим вмешательством, а также предпочтениями пациента. У пациентов на гемодиализе либо с нестабильной гемодинамикой во время диализа в связи с ФП может быть предпочтителен контроль ритма. Вместе с тем влияние такого лечебного подхода (ФП в принципе или ФП с нестабильной гемодинамикой) на исходы неизвестно [12].
Стратегия контроля ритма складывается из метода восстановления и последующего поддержания СР. Электрическая кардиоверсия (ЭКВ) – наиболее часто используемый метод восстановления СР у пациентов с персистирующей ФП и ХБП. Показано, что степень успешности ЭКВ одинакова вне зависимости от функции почек [23]. Однако риск рецидива ФП возрастает по мере снижения фильтрационной функции почек, хотя пациенты с легкой и умеренной степенями ХБП склонны к улучшению почечной функции при восстановлении СР [24]. Для поддержания СР в долгосрочной перспективе проведение только ЭКВ, как правило, недостаточно, и для контроля ритма необходимо назначение ААП или применение аблации. Поскольку ААП оказывают разнообразное действие на ионные каналы и / или рецепторы, то могут в некоторых обстоятельствах индуцировать иные нарушения ритма сердца, относящиеся к проаритмиям. Эти проаритмии могут быть более злокачественными, чем исходная аритмия (например, полиморфная желудочковая тахикардия по типу torsades de pointes , которая может трансформироваться в фибрилляцию желудочков). Как уже отмечалось, использование ААП ограничено у пациентов с ХБП из-за проблем с почечным клиренсом и проаритмоген-ными рисками. Риск проаритмического эффекта ААП в особенности повышен у пациентов со сниженной систолической функцией ЛЖ или в случае нарушений электролитного баланса. Оба эти состояния могут иметь место у пациентов с ХБП, а ХБП сама по себе может поражать
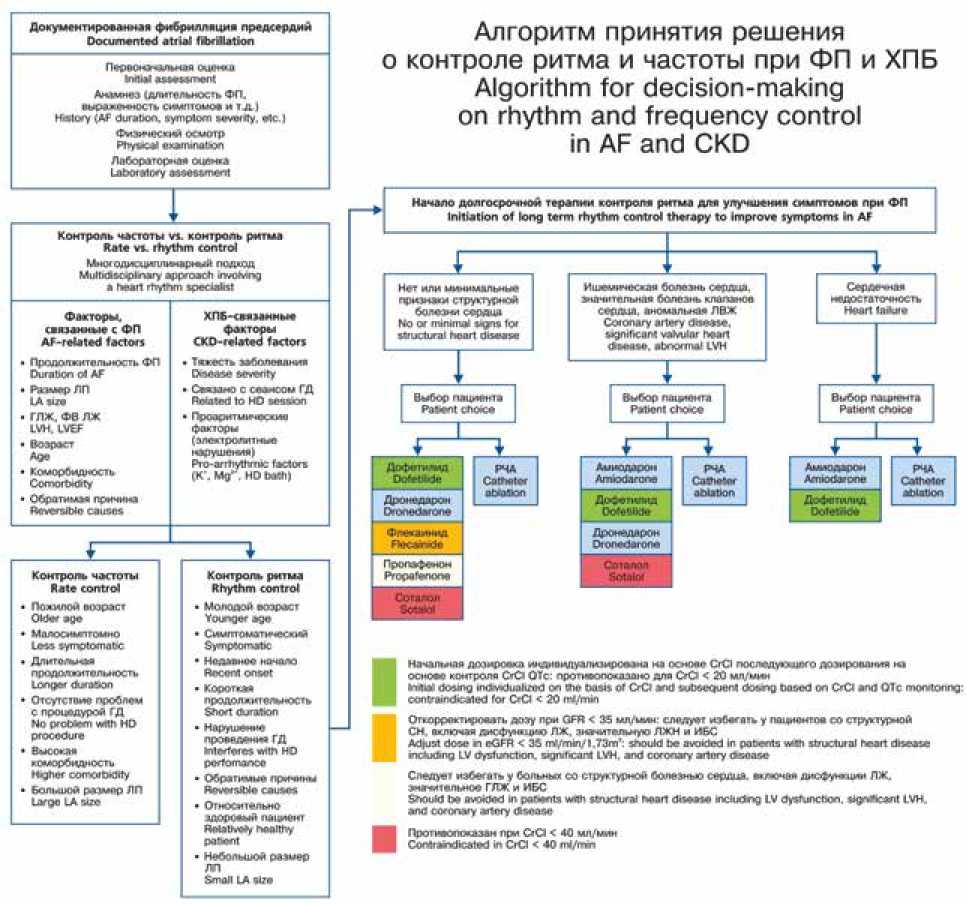
Алгоритм принятия решения о контроле ритма и частоты при ФП и ХПБ Algorithm for decision-making on rhythm and frequency control in AF and CKD
■ Началыгая дозировка индиводуалнзмроеьзна mi основе CrCI последующего дозирования на основе контроля СгО ОТс противопоказано для СгО < 20 мл/мин
■ Откорректировать wiy при GFR < 35 мл?мим следует избегin, у пшмонтов со структурной СН ги.л«очая дне Фу*««ц>ао лж, значительную ЛЖИ и ИБС Adjust dose п cGFR < 35 m#/mm/1.73m': should be avoided in patients wth structural heart disease including LV dysfixrction. significant LVH, and coronary artery dsoasc
Следуя?» избегать у больных со структурной болезнью сердив. ыгжхби дис=Фу>*иии ЛЖ. мачительное ГЛЖ и ИБС
Should be avoided in patients wan stnjcturai heart disease mciudng IV dysfunction. tignetewt LVH. and cor onary artery disease
Выбор гхшнеме» Patient choice
РЧА
MA Catheter atiUrtlon
РЧА Catheter ablation
Дронедарон Oronederone
Фле*аиннд Песвг-Эе
Документированная фибрилляция предсердий Docum#nte
Переоочалкмаа омами» inruei assessment
Ажтадяпз (ДЛИТелыкХТь ФП. еырвхо»е«ость симптомов и т д | History (AF duration, symptom savor fty, etc I ФчМКхМ «ХМОГР Phyvca» exammatex)
Лабораторная оценка Laboratory asaeasment
Контроль ритма Rhythm control
• Молодой возраст Younger ago
• Сммлггоьитмчослий Symptomatic
• Нодавнов начало Recent onset
• Короткая прздолхигегхгяхть Short duration
• Нарушение провядониа ГД interferes wtth НО portomonco
• Обрагимме лричигм Rovrwiuble causes
• Относительно одорсеый пациент Retathe», healthy
• Небольшой размер лп
Small LA tire
Контроль частоты Rate control
• Пожилой возраст Older age
• Млаосимптомно Less symptomatic
• Длито.-чмзя продолжите пмгость Longer duration
♦ Отсутствие проблем С процедурой ГД No problem with HD procedure к оморбцдносп.
M^hcr comortwltty
• Большой рвзмор ЛП Large LA sue
Начало долгосрочной терапии контроля ритма для упучеивния симптомов при ФЛ Initiation of long term rhythm control therapy to improve symptoms in AF
Ишемическая болезнь сердца, ^чтчнтепычгя болезнь клипэнов сордма. аномальная лвж Coronary *twy бпвме, wgnifcant vaMHar heart Оммае, abnormal LVH
Amiodarone
DoteMiOj
Нет или миннмапьнке примаки структурной болвэми сходна
No or minimal signs for structural heart disease
Сердечная недосгаточность Mewl Amtodarooe вы«ч» ruii»«owra Patient choc* Выбор пациента Patent thoc* Дофападад OA-bM. ■ Проп»с*нжазеи при ОО < *0 чл/мии OOTlnrKlicMed in OO < 40 mi/nw. Рис. 1. Алгоритм принятия решения о контроле ритма или частоты при фибрилляции предсердий и хронической болезни почек [18] Примечание: ФП – фибрилляция предсердий, ХБП – хроническая болезнь почек, ФВ – фракция выброса, СКФ – расчетная скорость клубочковой фильтрации, ГД – гемодиализ, ЛП – левое предсердие, ФВЛЖ – фракция выброса левого желудочка, ГЛЖ – гипертрофия левого желудочка. Дронедарон, флекаинид и дофетилид не зарегистрированы в Российской Федерации. Fig. 1. Algorithm for deciding on rhythm or rate control in AF and glomerular filtration rate [18] Note: AF – atrial fibrillation, LA – left atrium, LVH – left ventricular hypertrophy, LVEF – left ventricular ejection fraction, CKD – chronic kidney disease, HD – hemodialysis. Dronedaron, phlecainide and dofetilid are not registered in the Russian Federation. Контроль частоты vs. контроль ритма Rate vs rhythm control Мм<хс1Д1*^ципл»ыарьый осджпд Multidl6C<)k3ary »фргоасЬ invohmg a heart rhythm speciaint Факторы, связанные с ФП AF-reiated facto*) • П|юдолкит<1Пиность ФП Duration of AF • Размер ЛП LA size • ГЛЖ. ФВ лж LVH.LVEF • Во зрзст Age • Коморбидлость ComortNdity • OCpQTHUUdS причина Reversible causes ХПБ-сяяммиые факторы CKO-related factors • Тяжесть заболевания Oseese мчвпТу • Связано с сеансом ГД Retiiled to НО eeseon • Проарит мичесхио (з пент роли т ние марушегмя^ Pro-arrh^hmic factors (К . Mg^ HDbodi) различные системы органов, приводя к глубоким нарушениям ФК и фармакодинамики ААП, что способствует накоплению препарата и повышению его содержания в плазме [18]. В таблице 2 представлена характеристика ААП для поддержания СР при ФП и ХБП. Катетерная аблация более эффективна, чем только терапия ААП с целью поддержания СР. Безопасность и эффективность катетерной аблации при ФП у пациентов с ХБП была оценена в ряде исследований, где были показаны противоречивые результаты. Так, в одном из исследований [25] при наличии и отсутствии ХБП отмечалась одинаковая частота осложнений после вмешательства и последующих госпитализаций по поводу ФП, ЭКВ, повторных аблаций, хотя у пациентов с ХБП более часто развивалась сердечная недостаточность. В проведенном метаанализе 4 исследований использования радиочастотной изоляции легочных вен у пациентов с ХБП было продемонстрировано двукратное увеличение риска рецидивов ФП [26]. При использовании криоаблации более высокие риски рецидивов были отмечены среди пациентов с СКФ 30–59 мл/мин/1,73 м2 (ХБП G3), чем среди пациентов с ХБП G1 и G2 [27]. О случаях контраст-индуцированной нефропатии не сообщалось. По мнению ряда исследователей, поддержание СР методом аблации ассоциировано с улучшением расчетной СКФ, тогда как безуспешная аблация ассоциировалась с ее снижением [28]. Таблица 2. Характеристика антиаритмических препаратов для поддержания синусового ритма при фибрилляции предсердий и хронической болезни почек [14] Table 2. Characteristics of antiarrhythmic drugs for maintaining sinus rhythm in AF and CKD [14] Препараты Drugs Связывание с белками Protein binding Устранение Elimination Диализу-емость Dialysa-bility Дозирование в ХБП Dosing for CKD Особые соображения при ХБП Special considerations for CKD Флекаинид Flecainide 40% 35% выводится из организма без изменений в моче 35% is excreted from the body without changes in urine Нет No Снижение дозы, если CrCl < 35 мл/ мин Reduce dose if CrCl < 35 ml/min Не использовать при наличии значительного структурного заболевания сердца Do not use if significant structural heart disease is present Пропафенон Propafenone 95% 38–50% выводится с мочой в виде активных метаболитов (1% без изменений) 38–50% is excreted in urine as active metabolites (1% unchanged Нет No Рекомендуется тщательный мониторинг (поступление в больницу при прогрессирующей ХБП) Close monitoring is recommended (admission to hospital for advanced CKD) Не использовать при наличии значительного структурного заболевания сердца Do not use if significant structural heart disease is present Амиодарон Amiodarone 99% Нет почечной элиминации No renal elimination Нет No Нет требований к дозировке; взаимодействие со многими препаратами There are no dosage requirements; interaction with many drugs – Дронедарон Dronedarone 98% 6% выводится с мочой 6% is excreted in urine Вряд ли будет диализо-ван Unlikely to be dialized При почечной недостаточности адаптация дозы не требуется No dosage adjustment required in renal failure Не использовать, если ФВЛЖ <35% или недавно возникшая ЗСН Do not use if LVEF <35% or recent onset CHF Дофетилид Dofetilide 60–70% 80% выводится почками, как неизмененные (80%) или неактивные/минималь-но активные метаболиты 80% is excreted by the kidneys as unchanged (80%) or inactive/minimally active metabolites Неизвест-но Unknown Начальная доза индивидуализирована на основе CrCl и последующее дозирование на основе мониторинга CrCl и QTc Initial dose individualized based on CrCl and subsequent dosing based on monitoring of CrCl and QTc Противопоказан для CrCl <20 мл/мин Contraindicated at CrCl <20 ml/min Соталол Sotalol Не связывается с белками Does not bind to proteins 70% из организма без изменений в моче 70% excreted unchanged in urine Да, назначьте поддерж. дозу после диализа или добавьте 80 мг после ГД Yes, assign support. dose after dialysis or add 80 mg Относительное противопоказание с учетом риска проаритмических эффектов; в редких и отдельных случаях - доза должна быть уменьшена вдвое или уменьшена до четверти при ХБП Relative contraindication taking into account the risk of proarrhythmic effects; in rare and isolated cases - the dose should be halved or reduced to a quarter for CKD Относительное противопоказание ввиду риска проаритмических эффектов Relative contraindication due to risk of proarrhythmic effects Примечание: ЗСН – застойная сердечная недостаточность, ХБП – хроническая болезнь почек, CrCl – клиренс креатинина, ФВЛЖ – фракция выброса левого желудочка, ГД – гемодиализ. Дронедарон, флекаинид и дофетилид не зарегистрированы в Российской Федерации. Note: CHF – congestive heart failure, AF – atrial fibrillation, CKD – chronic kidney disease, CrCl – creatinine clearance, LVEF – left ventricular ejection fraction, HD – hemodialysis. Dronedarone, flecainide and dofetilide are not registered in the Russian Federation. В отличие от ситуации с ФП радиочастотная аблация для контроля ритма при трепетании предсердий (ТП) должна рассматриваться как терапия первой линии у пациентов с ХБП, учитывая высокую эффективность и низкий процент осложнений вмешательства. Вместе с тем пациенты с ХБП имеют более высокий риск возникновения ФП после аблации ТП, следовательно, им может потребоваться долгосрочный мониторинг для выявления ФП (особенно при наличии бессимптомного варианта аритмии) либо при рассмотрении вопроса отмены пероральной антикоагуляции. При принятии решения о применении ААП у пациентов на гемодиализе ключевой момент связан с выводимостью препарата, зависящей от размера молекул, связи с белками, объема распределения, растворимости в воде и клиренса. Некоторые технические аспекты процедуры диализа могут оказывать влияние на степень выведения препарата. Обычный подход требует знания «коэффициента просеивания», представляющего собой отношение концентрации препарата в ультрафильтрате и водной концентрации препарата в плазме перед фильтром. Чем ближе коэффициент к единице, тем более полное очищение от препарата происходит при диализе. У пациентов, получающих лечение гемодиализом, следует избегать применения прокаинамида и соталола. В противоположность этому, диализ оказывает малое влияние на клиренс амиодарона, при этом отсутствует необходимость коррекции дозы [14, 16]. Пациенты без четких показаний к контролю ритма по умолчанию должны придерживаться стратегии контроля частоты ритма. Было показано, что в общей популяции пациентов с постоянной ФП и сохранной ФВЛЖ более «мягкий контроль» ЧСЖ (то есть, менее 110 уд/мин) был эквивалентен «строгому» контролю частоты при сравнении комбинированной конечной точки. Эта точка включала ОНМК, сердечную недостаточность, летальность, потребность в имплантации кардиостимулятора или имплантированного кардиовертера-дефибриллятора [29]. Отсутствуют рандомизированные клинические исследования, сравнивающие стратегии контроля ритма и контроля частоты («строгий» и «мягкий») у пациентов с ФП и ХБП. Post-hoc анализ исследования GUSTO III показал, что выбор стратегии контроля ритма или контроля частоты не повлиял на краткосрочную или долгосрочную смертность вне зависимости от статуса болезни почек [30]. Особое внимание у больных с ФП и ХБП следует уделять вариативности выраженности симптоматики и потенциального повышения склонности к развитию тахи-индуцированной кардиомиопатии, также необходимо учитывать ФК и диализуемость препаратов, применяемых для контроля частоты ЧСЖ (табл. 3). Таблица 3. Характеристики антиаритмических препаратов, применяемых для контроля частоты сокращений желудочков у больных с фибрилляцией предсердий и хронической болезнью почек [14] Table 3. Characteristics of antiarrhythmic drugs used to control the ventricular rate in patients with AF and СKD [14] Препарат Drugs Связывание с белками Protein binding Устранение Elimination Диализу-емость Dialysability Дозирование в ХБП Dosing in CKD Атенолол Atenolol 5% Из организма без изменений в моче Excreted from the body without changes in urine Да Yes Может потребоваться уменьшить дозу May need to reduce dose Пропранолол Propranolol > 90% Печеночный метаболизм Hepatic metabolism Нет No Креатинин сыворотки может увеличиваться, но не требуется корректировка дозы Serum creatinine may increase but no dose adjustment is required Бисопролол Bisoprolol 30% 50% из организма без изменений в моче 50% excreted unchanged in urine Нет No Доза, возможно, должна быть уменьшена при тяжелой ХБП Dose may need to be reduced in severe CKD Метопролол Metoprolol 12% Печеночный метаболизм Hepatic metabolism Да Yes Снижение дозы не требуется No dose reduction required Карведилол Carvedilol 99% В основном, печеночным и 16% почечным путем Mainly hepatic and 16% renal route Нет No Конкретные рекомендации по корректировке дозы при почечной недостаточности отсутствуют No Specific recommendations for dose adjustment in renal failure are not available Лабеталол Labetalol 50% Неактивные метаболиты выводятся с мочой (5% без изменений) и желчью Inactive metabolites are excreted in urine (5% unchanged) and no bile Нет No Снижение дозы рекомендуется в пожилом возрасте Dose reduction is recommended in old age. Верапамил Verapamil 90% 70% выводится с мочой и 16% с калом 70% excreted in urine and 16% in feces Нет No Снижение дозы на 20–25%, если CrCl <10 мл/ мин, не очищается при гемодиализе Reduce dose by 20–25% if CrCl <10 ml/min, not cleared by hemodialysis Дилтиазем Diltiazem 70–80% 2–4% неизмененного препарата выводится с мочой 2–4% unchanged drug is excreted in urine Нет No Использовать с осторожностью Use with caution Дигоксин Digoxin 20–30% Основной путь элиминации – почечный (тесно коррелирующий с СКФ) с 25-28% элиминации вне почечными путями The main route of elimination is renal (closely correlated with GFR) with 25–28% elimination by non-renal routes Нет No Требуется адаптация дозировки, мониторинг сыворотки уровни дигоксина Dosage adaptation required, monitoring serum digoxin levels Note: AF – atrial fibrillation, CKD – chronic kidney disease. При невозможности достижения адекватного медикаментозного контроля частоты можно рассмотреть возможность аблации атриовентрикулярного соединения и имплантацию кардиостимулятора. Заключение Терапия пероральными антикоагулянтами является фундаментом профилактики инсульта у пациентов с ФП, имеющих дополнительные факторы риска. Наличие ХБП также сопровождается повышенным риском ишемических и геморрагических осложнений. Неотъемлемой частью лечения пациентов с ФП и ХБП является антиаритмическая терапия, использующаяся для контроля ритма или частоты. При принятии решения о выборе предпочтительной тактики ведения пациентов с ХБП и ФП следует учитывать, что у данной категории пациентов имеется много специфических характеристик, касающихся анамнеза, сопутствующих заболеваний, и по каждому пациенту должно быть принято индивидуальное решение. Также следует принимать во внимание многие аспекты: продолжительность ФП, тяжесть симптомов, почечный клиренс (риск токсичности, диализируемость) и потенциальные противопоказания к применению ААП из-за структурных заболеваний сердца, которые очень часто встречаются у этих пациентов. Кроме того, проаритмиче-ские эффекты (такие как удлинение интервала QT) могут быть выражены из-за дисбаланса электролитов при хроническом заболевании почек. До начала лечения ААП обязательной является оценка функции почек. У пациентов с установленным диагнозом ХБП необходимо проводить регулярное клиническое наблюдение с периодической повторной оценкой функции почек и обсуждением коррекции дозы ААП. В целом пациенты с ХБП должны получать такое же лечение, что и пациенты с нормальной функцией почек, когда это только возможно, но обязательно нужно принимать во внимание возможные серьезные побочные эффекты ААП.
Список литературы Хроническая болезнь почек и фибрилляция предсердий: подходы к выбору антиаритмической терапии
- Dan G.A., Martinez-Rubio A., Agewall S., Boriani G., Borggrefe M., Gaita F. et al. Antiarrhythmic drugs-clinical use and clinical decision making: a consensus document from the European Heart Rhythm Association (EHRA) and European Society of Cardiology (ESC) Working Group on Cardiovascular Pharmacology, endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS) and International Society of Cardiovascular Pharmacotherapy (ISCP). Europace. 2018;20(5):731-732an. https://doi.org/10.1093/europace/eux373.
- Potpara T.S., Jokic V., Dagres N., Marin F., Prostran M.S., Blomstrom-Lundqvist C. et al. Cardiac arrhythmias in patients with chronic kidney disease: implications of renal failure for antiarrhythmic drug therapy. Curr. Med. Chem. 2016;23(19):2070-2083. https://doi.org/10.2174/0929867323666160309114246.
- Andò G., Capranzano P. Non-vitamin K antagonist oral anticoagulants in atrial fibrillation patients with chronic kidney disease: A systematic review and network meta-analysis. Int. J. Cardiol. 2017;231:162-169. https://doi.org/10.1016/j.ijcard.2016.11.303.
- Hill N.R., Fatoba S.T., Oke J.L., Hirst J.A., O’Callaghan C.A., Lasserson D.S. et al. Global prevalence of chronic kidney disease - A systematic review and meta-analysis. PLoS One. 2016;11(7):e0158765. https://doi.org/10.1371/journal.pone.0158765.
- Steinberg B.A., Kim S., Piccini J.P., Fonarow G.C., Lopes R.D., Thomas L. et al. Insights from the Outcomes Registry for Better Informed Treatment of Atrial Fibrillation (ORBIT-AF) Registry. Circulation. 2013;128(7):721-728. https://doi.org/10.1161/CIRCULATIONAHA.113.002927.
- Бойцов С.А., Лукьянов М.М., Якушин С.С., Марцевич С.Ю., Воробьев А.Н., Загребельный А.В. и др. Регистр кардиоваскулярных заболеваний (РЕКВАЗА): диагностика, сочетанная сердечно-сосудистая патология, сопутствующие заболевания и лечение в условиях реальной амбулаторно-поликлинической практики). Кардиоваскулярная Терапия и Профилактика. 2014;13(6):44-50.
- Benjamin E.J., Blaha M.J., Chiuve S.E., Cushman M., Das S.R., Deo R. et al. American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics-2017 Update: A report from the American Heart Association. Circulation. 2017;135(10):e146-e603. https://doi.org/10.1161/CIR.0000000000000485.
- Heine G., Brandenburg V. Anticoagulation, atrial fibrillation and chronic kidney disease - whose side are you on? Kidney International. 2017;91:771-786. https://doi.org/10.1016/j.kint.2016.11.028.
- Alonso A., Lopez F.L., Matsushita K., Loehr L.R., Agarwal S.K., Chen L.Y. et al. Chronic kidney disease is associated with the incidence of atrial fibrillation: the Atherosclerosis Risk in Communities (ARIC) study. Circulation. 2011;123(25):2946-2953. https://doi.org/10.1161/CIRCULATIONAHA.111.20982.
- Guo Y., Wang H., Zhao X., Zhang Y., Zhang D., Ma J. et al. Sequential changes in renal function and the risk of stroke and death in patients with atrial fibrillation. Int. J. Cardiol. 2013;168(5):4678-4684. https://doi.org/10.1016/j.ijcard.2013.07.179.
- National Kidney Foundation. KDOQI Clinical Practice Guideline for Diabetes and CKD: 2012 update. Am. J. Kidney Dis. 2012;60(5):850-886. https://doi.org/10.1053/j.ajkd.2012.07.005.
- Kirchhof P., Benussi S., Kotecha D., Ahlsson A., Atar D., Casadei B. et al. 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS. Eur. Heart J. 2016;37(38):2893-2962. https://doi.org/10.1093/eurheartj/ehw210.
- Steffel J., Verhamme P., Potpara T.S., Albaladejo P., Antz M., Desteghe L. et al. The 2018 European Heart Rhythm Association Practical Guide on the use of non-vitamin K antagonist oral anticoagulants in patients with atrial fibrillation. Eur. Heart J. 2018;39(16):1330-1393. https://doi.org/10.1093/eurheartj/ehy136.
- Turakhia M.P., Blankestijn P.J., Carrero J.J., Clase C.M., Deo R., Herzog C.A. et al. Chronic kidney disease and arrhythmias: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Eur. Heart J. 2018;39:2314-2325. https://doi.org/10.1093/eurheartj/ehy060.
- Boriani G., Savelieva I., Dan G.A., Deharo J.C., Ferro C., Israel C.W. et al. Chronic kidney disease in patients with cardiac rhythm disturbances or implantable electrical devices: clinical significance and implications for decision making-a position paper of the European Heart Rhythm Association endorsed by the Heart Rhythm Society and the Asia Pacific Heart Rhythm Society. Europace. 2015;17(8):1169-1196. https://doi.org/10.1093/eurheartj/ehw210.
- Kumar S., Lim E., Covic A., Verhamme P., Gale C.P., Camm A.J. et al. Anticoagulation in concomitant chronic kidney disease and atrial fibrillation. JACC. 2019;74(17):2204-2215. https://doi.org/10.1016/j.jacc.2019.08.1031.
- Szummer K., Evans M., Carrero J.J., Alehagen U., Dahlström U., Benson L. et al. Comparison of the chronic kidney disease epidemiology collaboration, the modification of diet in renal disease study and the Cockcroft-Gault equation in patients with heart failure. Open Heart. 2017;4:e000568. https://doi.org/10.1136/openhrt-2016-000568.
- Turakhia M.P., Blankestijn P.J., Carrero J.J., Clase C.M., Deo R., Herzog C.A. et al. Chronic kidney disease and arrhythmias: conclusions from a Kidney Disease: Improving Global Outcomes (KDIGO) Controversies Conference. Eur. Heart J. 2018;39(24):2314-2325. https://doi.org/10.1093/eurheartj/ehy060.
- January C.T., Wann L.S., Calkins H., Chen L.Y., Cigarroa J.E., Cleveland J.C. Jr. et al. Focused Update of the 2014 AHA/ACC/HRS Guideline for the management of patients with atrial fibrillation. Circulation. 2019;140(2):e125-e151. https://doi.org/10.1161/CIR.0000000000000665.
- Wyse D.G., Waldo A.L., DiMarco J.P., Domanski M.J., Rosenberg Y., Schron E.B. et al. Atrial Fibrillation Follow-up Investigation of Rhythm Management Investigators. A comparison of rate control and rhythm control in patients with atrial fibrillation. N. Engl. J. Med. 2002;347(23):1825- 1833. https://doi.org/10.1056/NEJMoa021328.
- Wyse D.G. Rate control vs rhythm control strategies in atrial fibrillation. Prog. Cardiovasc. Dis. 2005;48(2):125-138. https://doi.org/10.1016/j.pcad.2005.06.008.
- Ревишвили А.Ш., Рзаев Ф.Г, Горев М.В., Нардая Ш.Г.; Всероссийское научное общество специалистов по клинической электрофизиологии, аритмологии и кардиостимуляции, Российское кардиологическое общество, Ассоциация сердечно-сосудистых хирургов. Диагностика и лечение фибрилляции предсердий: Клинические рекомендации. М.: 2017.
- Reinecke H., Nabauer M., Gerth A., Limbourg T., Treszl A., Engelbertz C. et al. Morbidity and treatment in patients with atrial fibrillation and chronic kidney disease. Kidney Int. 2015;87(1):200-209. https://doi.org/10.1038/ki.2014.195.
- Schmidt M., Daccarett M., Rittger H., Marschang H., Holzmann S., Jung Ph. et al. Renal dysfunction and atrial fibrillation recurrence following cardioversion. J. Cardiovasc. Electrophysiol. 2011;22(10):1092- 1098. https://doi.org/10.1111/j.1540-8167.2011.02069.x.
- Ullal A.J., Kaiser D.W., Fan J., Schmitt S.K., Than C.T., Winkelmayer W.C. et al. Safety and clinical outcomes of catheter ablation of atrial fibrillation in patients with chronic kidney disease. J. Cardiovasc. Electrophysiol. 2017;28(1):39-48. https://doi.org/10.1111/jce.13118.
- Li M., Liu T., Luo D., Li G. Systematic review and meta-analysis of chronic kidney disease as predictor of atrial fibrillation recurrence following catheter ablation. J. Cardiol. 2014;21(1):89-95. https://doi.org/10.5603/CJ.a2013.0116.
- Yanagisawa S., Inden Y., Kato H., Fujii A., Mizutani Y., Ito T. et al. Impaired renal function is associated with recurrence after cryoballoon catheter ablation for paroxysmal atrial fibrillation: a potential effect of non-pulmonary vein foci. J. Cardiol. 2017;69(1):3-10. https://doi.org/10.1016/j.jjcc.2016.07.008.
- Takahashi Y., Takahashi A., Kuwahara T., Okubo K., Fujino T., Takagi K. et al. Renal function after catheter ablation of atrial fibrillation. Circulation. 2011;124(22):2380-2387. https://doi.org/10.1161/CIRCULATIONAHA.111.047266.
- Van Gelder I.C., Groenveld H.F., Crijns H.J., Tuininga Y.S., Tijssen J.G., Alings A.M. et al. RACE II Investigators. Lenient versus strict rate control in patients with atrial fibrillation. N. Engl. J. Med. 2010;362(15):1363- 1373. https://doi.org/10.1056/NEJMoa1001337.
- Williams E.S., Thompson V.P., Chiswell K.E., Alexander J.H., White H.D., Ohman E.M. et al. Rate versus rhythm control and outcomes in patients with atrial fibrillation and chronic kidney disease: data from the GUSTO-III Trial. Cardiol. J. 2013;20(4):439-446. https://doi.org/10.5603/CJ.2013.0104.
- Weir M.A., Dixon S.N., Fleet J.L., Roberts M.A., Hackam D.G., Oliver M.J. et al. Beta-Blocker dialyzability and mortality in older patients receiving hemodialysis. J. Am. Soc. Nephrol. 2015;26(4):987-996. https://doi.org/10.1681/ASN.2014040324.


