Идентификация аддуктов сывороточного альбумина человека с цианидами масс-спектрометрическими методами
Автор: Дубровский Ярослав Александрович, Мурашко Е.А., Комбарова М.Ю., Подольская Е.П., Бабаков В.Н., Краснов Н.В., Радилов А.С.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия
Статья в выпуске: 1 т.23, 2013 года.
Бесплатный доступ
МАЛДИ-масс-спектрометрия была использована для выявления аддуктов цианидов с сывороточным альбумином человека. В триптическом гидролизате сывороточного альбумина человека, инкубированного с цианидами (натриевые и калиевые соли), удалось выявить модифицированный по Cys-34 пептид Cys-Pro-Phe-Glu-Asp-His-Val-Lys с M H + 999.44 Да. В результате взаимодействия образуется цистеин, содержащий группу SCN. Последовательность модифицированного пептида была подтверждена с помощью ВЭЖХ-МС-МС-анализа на приборе типа ионная ловушка.
Ионная ловушка, сывороточный альбумин, цианиды
Короткий адрес: https://sciup.org/14264841
IDR: 14264841 | УДК: 621.384.668.8:
Текст научной статьи Идентификация аддуктов сывороточного альбумина человека с цианидами масс-спектрометрическими методами
Масс-спектрометрия с мягкими методами ионизации позволяет определять следовые количества биомолекул. Анализ посттрансляционных модификаций белков реакционноспособными ксенобиотиками, в основном необратимо связывающимися с биомолекулами, получил название "аддуктомики". Биоактивные ксенобиотики, поступающие в организм, могут взаимодействовать непосредственно с белками-мишенями или в процессе биотрансформации образовывать реакционноспособные метаболиты. Практически все биологические макромолекулы, такие как ДНК, РНК и белки, могут взаимодействовать с электро- и нуклеофильными соединениями. Исходное соединение или его метаболиты выводятся из организма в течение нескольких дней. В результате детекция ксенобиотика становится возможной только высокочувствительными аналитическими методами. Аддукты с ДНК и белками сохраняются в организме на протяжении длительного времени.
В основном опубликованы работы научных групп, работающих над проблематикой уничтожения химического оружия. Фосфорорганические отравляющие вещества способны фосфонилиро-вать сывороточный альбумин и бутирилхолин-эстеразу [1–3]. Другой мажорный белок крови — гемоглобин способен образовывать аддукты с сернистым ипритом [4, 5]. N-концевой алкилированный валин был выявлен в организме спустя 94 дня после экспозиции [6]. Таким образом, аддукты ксенобиотиков с биомолекулами могут рассматриваться как потенциальные биомаркеры ретроспек- тивной химико-токсикологической диагностики.
К опасным токсикантам относится синильная кислота и ее соли (далее CN). Основными источниками загрязнения CN атмосферного воздуха является промышленность и выхлопные газы автомобильного транспорта. Также CN являются компонентами дыма от сигарет или дыма, образовавшегося в результате пожаров. Неорганические цианиды также широко используются в химической, кожевенной, текстильной промышленности, в фотографии, сельском хозяйстве, при добыче золота и в гальванопластике. CN или CN-содержащие сахара находятся в косточках фруктов, таких как персик, а также в других пищевых продуктах — миндале, шпинате, сое. Взаимодействие цианидов с цистиновыми группами белков было продемонстрировано еще в середине прошлого века. Однако с развитием масс-спектрометрии и биоаналитических методов появились возможности идентифицировать модифицированные аминокислоты в полипептидной цепи. Недавно было продемонстрировано, что масс-спектрометрически возможно определить фрагменты сывороточного альбумина, модифицированного цианидами. В триптическом гидролизате выявлены и идентифицированы основные участки связывания — Cys-34, -53, -124, -392, -477 [7].
Большинство работ выполнено на масс-спектрометрах с методом ионизации "электроспрей". Другой метод ионизации нелетучих термолабильных соединений МАЛДИ редко применяется в решении подобных задач, несмотря на то, что данный метод является мощным инструментом в исследованиях сложных смесей пептидов и для его использования не требуется дополнительной про-боподготовки. Время одного анализа может составлять менее одной минуты, а образец, нанесенный на масс-спектрометрическую мишень, может храниться длительное время, и имеется возможность провести повторный анализ.
Основной задачей данной работы являлась детекция аддуктов сывороточного альбумина с цианидами с использованием МАЛДИ-масс-спектро-метрии.
МАТЕРИАЛЫ И МЕТОДЫ
Реагенты и материалы : ацетонитрил, трифторуксусная кислота, муравьиная кислота, трипсин (proteomic grade), бикарбонат аммония, α-циано-4-гидроксикоричная кислота, этилацетат ( Sigma-Aldrich , США), соляная кислота (Вектон , Санкт-Петербург), деионизированная вода (18.2 МОм, Millipore , США).
Аппаратура : времяпролетный масс-спектрометр MALDI-TOF-TOF Axima Perfomance ( Shimadzu / Kratos Analytical , Великобритания), жидкостный хроматограф Infinity 1290 ( Agilent Technologies , США), ионная ловушка amaZon ETD ( Bruker Daltonik GmbH , Германия), твердотельный термостат ( Eppendorf , Германия).
Выделение сывороточного альбумина из плазмы крови человека
Для ингибирования протеаз к 100 мл донорской плазмы крови прилили 0.8 мл 0.25 М раствора ЭДТА. Далее к 100 мл плазмы крови при активном перемешивании добавили 16.6 г сульфата аммония, массовая концентрация соли в плазме составила 30 %. Осаждение белков проводили при 4°С в течение 4 ч. Осадок отделили центрифугированием при 4000 g в течение 20 мин, а к супернатанту для достижения 70 % насыщения постепенно при активном перемешивании добавили еще 25.3 г сульфата аммония. Осадок получили центрифугированием при 4000 g в течение 20 мин. Для осаждения альбумина к супернатанту добавили шестикратный объем холодного этанола. Образец оставили на ночь при 4 °С для полного выпадения осадка, надосадочную жидкость слили. Полученный альбумин промыли небольшим объемом холодного этанола и высушили с помощью лиофильной сушки.
Инкубирование выделенного сывороточного альбумина с цианистым натрием и калием
К 1 мл раствора белка (1 мг/мл) в 25 мМ аммо-ний-бикарбонатном буфере добавляли in vitro раствор цианидов до конечной концентрации 0.1 мг/мл. Смесь инкубировали в течение 3 ч при 37 °С.
Получение триптических гидролизатов сывороточного альбумина
К 100 мкл раствора модифицированного белка (1 мг/мл) добавляли 10 мкл раствора трипсина в 1 мМ HCl (0.1 мг/мл) и оставляли в термостате на 3 ч при 37 °С, после чего добавляли столько же трипсина и оставляли еще на 3 ч при 37 °С.
Нанесение образцов на масс-спектрометрическую мишень
На поверхность мишени смешивали 0.5 мкл раствора матрицы CHCA (5мг/мл, α-циано-4-гидроксикоричная кислота) с 0.5 мкл гидролизата и высушивали на воздухе до образования кристаллов.
Масс-спектрометрический анализ
Масс-спектрометрический анализ проводили с помощью времяпролетного масс-спектрометра Axima Perfomance с источником МАЛДИ, оснащенного УФ-лазером (337 нм) в режиме детектирования положительных ионов с использованием рефлектрона при следующих настройках ионного источника: напряжение 20 кВ, напряжение на линзах (lens) 6.5 кВ, напряжения на рефлектроне (Ref) 24.38 кВ. Ионы детектировали в диапазоне m/z от 700 до 5000 Да. Масс-спектры регистрировали при помощи программы Launchpad 2.8.4 MALDI-MS Shimadzu Biotech ( Shimadzu , Япония). Калибровку проводили по масс-спектру смеси пептидов: ангиотензин 2 ( М Н+ 1046.542 Да), ангиотензин 1 ( М Н+ 2296.685 Да), N-ацетил ренин ( М Н+ 1800.943 Да), адренокортикотропный гормон (1-17) ( М Н+ 2093.086 Да).
Обработка полученных МАЛДИ-масс-спектров
Обработку полученных МАЛДИ-масс-спектров проводили с помощью программ Launchpad 2.8.4 MALDI-MS Shimadzu Biotech ( Shimadzu , Япония) и MASCOT Distiller ( Matrix Science , Англия).
Условия хроматографического разделения
Объем вводимого образца 10 мкл. Колонка Zorbax SB-C18 2.1 x 150 мм, 3.5 мкм (Agilent, 830990902). Разделение смеси пептидов гидролизатов белков проводили в градиентном режиме. А — 1 % раствор ацетонитрила в 0.1 % водном растворе муравьиной кислоты, Б — 90 % раствор ацетонитрила в 0.1 % водном растворе муравьиной кислоты. 0–30 мин: от 95 % А / 5 % Б до 50 % А / 50 % Б; 30–50 мин: от 50 % А / 50 % Б до 10 % А / 90 % Б; 50–55 мин: от 10 % А / 90 % Б до 95 % А / 5 % Б; 55–60 мин: 95 % А / 5 % Б.
Скорость потока подвижной фазы 0.2 мл/мин.
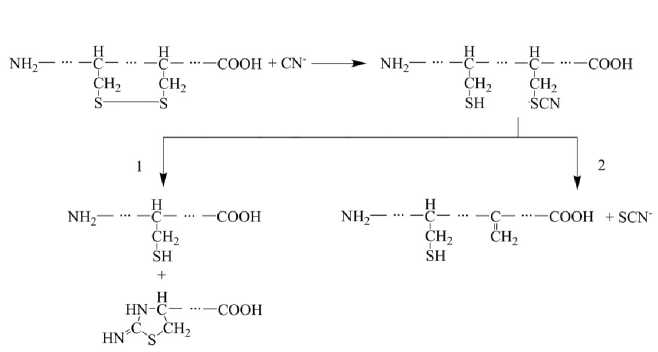
Рис. 1. Схема взаимодействия цианид-ионов с цистинами в белках и возможные пути метаболизма
Условия масс-спектрометрического детектирования
Выход из колонки был подсоединен к электро-спрейному источнику ионизации. Напряжение на капилляре 4000 В, давление на небулайзере 30 psi, скорость осушающего газа 9 л/мин, температура 250 °С. Масс-спектрометр Amazon ETD ( Bruker ) функционировал в режиме AutoMS(2) — автоматической фрагментации ионов. Данный режим предполагает циклическую работу: на первой стадии цикла происходит получение общего MS-спектра с последующим получением фрагментных спектров наиболее интенсивных родительских ионов. Общий спектр снимался в диапазоне m/z 300–1200 Да. Спектры дочерних ионов снимались для 2 наиболее интенсивных родительских ионов в диапазоне масс 100–1400 Да. Масс-спектры регистрировали при помощи программы trapControl V 7.0 ( Bruker Daltonik GmbH , Германия). Последующую первичную обработку проводили в программе DataAnalysis V 4.0 ( Bruker Daltonik GmbH , Германия).
Идентификация белков и пептидов
Идентификацию белков и пептидов проводили с помощью программ MASCOT Distiller ( Matrix Science , Англия) и BioTools V 3.2 ( Bruker Daltonik GmbH , Германия) в базах данных SwissProt. При этом использовали следующие параметры поиска в программе Mascot MS/MS Ion Search при обработке спектров гидролизата: точность определения массы — 0.1 Да, точность определения фрагмент-ных ионов — 0.8 Да, возможные модификации — Cyano (Δ М = 24.99 Да).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Синильная кислота или ее натриевая и калиевая соли могут попадать в организм при ингаляции, оральной или накожной экспозиции. Синильная кислота является слабой кислотой (pK a 9.22) и в организме в основном существует в форме HCN. Период полужизни в организме в свободном виде составляет меньше часа. Синильная кислота в основном трансформируется в менее токсичный и более устойчивый метаболит, тиоцианат (SCN). При взаимодействии цианидов с белками по дисульфидным связям происходит образование SCN и SH-групп (рис. 1) [8].
После инкубации белка с цианистым натрием или калием и последующим трипсинолизом в МАЛДИ-масс-спектрах был выявлен только один сигнал, отсутствующий в контроле, — сигнал с M H+ 999.44 Да (рис. 2). Данный пептид может входить в состав сывороточного альбумина человека, модифицированного CN по Cys-34. Следует отметить, что в результате гидролиза в присутствии трипсина должен образовываться пептид с аминокислотной последовательностью Ala-Leu-Val-Leu-Ile-Ala-Phe-Ala-Gln-Tyr-Leu-Gln-Gln-Cys CN -Pro-Phe-Glu-Asp-His-Val-Lys (фрагмент 21–41). В щелочной среде образовавшийся SCN-аддукт приводит к неспецифичному для трипсина разрыву пептидной связи с образованием пептида с N-концевым модифицированным цистеином (рис. 1, путь метаболизма 1) [9]. Таким образом, при гидролизе сывороточного альбумина в присутствии трипсина следует ожидать образования именно пептида Cys-Pro-Phe-Glu-Asp-His-Val-Lys (34–41 фрагмент).
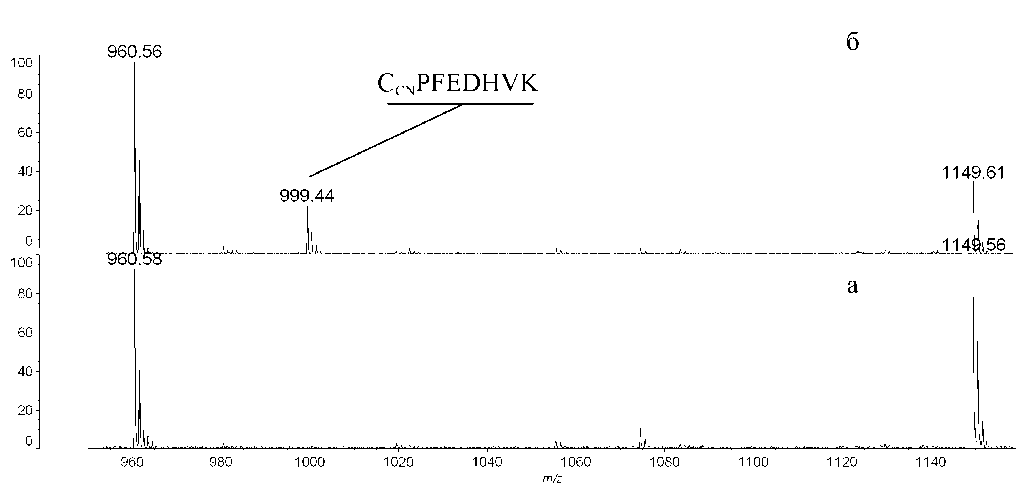
Рис. 2. МАЛДИ-масс-спектры триптических гидролизатов сывороточного альбумина человека. а — контроль, б — инкубированный с CN
Для подтверждения был проведен тандемный МАЛДИ-масс-спектрометрический анализ. К сожалению, полученные спектры имели небольшое количество фрагментных сигналов, и их недостаточно для достоверного восстановления аминокислотной последовательности.
Поскольку удалось выявить только один сигнал, отсутствующий в контроле, эксперимент был повторно проведен с использованием масс-спектрометра с методом ионизации "электроспрей". Результаты полностью согласуются с полученными с помощью МАЛДИ-масс-спектро-метра. После обработки спектров с помощью про- граммы Mascot удалось идентифицировать пептид с массой MMo 998.43 Да, модифицированный CN. С помощью тандемной масс-спектрометрии удалось восстановить аминокислотную последовательность, используя программный пакет BioTools V 3.2 (рис. 3).
В работе [8] было показано, что цианиды не могут взаимодействовать со свободными сульфгидрильными группами сывороточного альбумина быка. Нам удалось выявить только аддукт с Cys-34, который является единственным свободным цистеином в молекуле сывороточного альбумина человека.
Abs. I nt. * 1000
b I------- b-18
У I------- y-17 I------ y-18
с*
■р
-D
К
Р
D
■Е
•F
Р
(241.30 2+)
40- y-17 4 481.593
20-
о
147.300
Ту"1
129.290.
Ь1 I
130.4^0 "у-171!
22£и180
" Ь2
(249.74 2+) у 4 498.473
383.430 УЗ
-V —
1-----
4—р
—р
—I-----К---
■p---1—c*
502.430 498.473 1481.593
|!" 6Т' у 4 (249 74; 2*): :" - - -у--1-^4 <24.1-^2*>-
736.653
Ь-18 6 (368.83 2+)
627.440 774.560
'■у"5.....1 Уб
m/z
Рис. 3. Фрагментый масс-спектр пептида Cys-Pro-Phe-Glu-Asp-His-Val-Lys, обнаруженного в триптическом гидролизате сывороточного альбумина человека, инкубированного с CN (программа BioTools)
Данный результат может быть связан с тем, что в нашей работе мы использовали сывороточный альбумин человека, выделенный из донорской плазмы крови. Особенностью выделения является высаливание сульфатом аммония и преципитация фракции 70 % от насыщения сульфатом аммония ледяным этанолом. Таким образом, получается электрофоретически чистый нативный сывороточный альбумин. Сульфгидрильная группа Cys-34 активно участвует в осуществлении транспортной функции сывороточного альбумина и может ковалентно присоединять различные соединения, такие как глутатион, аминокислоту цистеин и другие низкомолекулярные соединения со свободными сульфгидрильными группами. Взаимодействие Cys-34 с цианидами может объясняться наличием в нативном альбумине пула занятого какими-либо соединениями цистеина. Эти соединения могут вытесняться цианидами по известным механизмам.
Отсутствие других модифицированных пептидов можно объяснить тем, что одним из возможных путей метаболизма присоединенного цианида является образование свободного тиоцианата и переход цистеина в дегидроаланин (рис. 1).
На ранней стадии хронического отравления неорганическими цианидами появляются головные боли, головокружение, общая слабость, ослабление памяти, бессонница, боли в области сердца, одышка, сухость в горле, диспепсические явления, усиленная потливость, что не всегда удается ассоциировать с отравлением. Высокая скорость выведения неорганических цианидов из организма затрудняет химико-токсикологический анализ. В связи с этим идентификация аддуктов с легкодоступными белками крови человека, в частности аддуктов сывороточного альбумина человека с цианидами, приобретает значимость в практической работе врачей гигиенического профиля и профпато-логов по экспертизе связи заболеваний с воздействием вредных факторов производственной среды.
В результате проделанной работы было показано, что разработанные ранее методы для обнаружения SCN-аддуктов с белками крови для ВЭЖХ-МС-МС могут быть успешно использованы на времяпролетных масс-спектрометрах с МАЛДИ-источником.


