Идентификация алкилированного аддукта сывороточного альбумина человека методами масс-спектрометрии
Автор: Краснов И.А., Подольская Е.П., Гончаров Н.В., Бабаков В.Н., Глашкина Л.М., Ермолаева Е.Е., Дубровский Я.А., Прокофьева Д.С., Войтенко Н.Г., Смолихина Т.И., Поляков Н.Б., Радилов А.С., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии. Интерпретация данных, методология, применение
Статья в выпуске: 4 т.18, 2008 года.
Бесплатный доступ
Исследована белковая фракция сыворотки крови человека, подвергавшаяся воздействию сернистого иприта (b,b'-дихлордиэтилсульфида, по международной номенклатуре HD) in vitro. Методами MALDI-TOF и ESI-TOF были обнаружены несколько пептидов альбумина, которые содержали ковалентную модификацию HD. Методами MALDI-TOF и MALDI-TOF-TOF был определен триптический пептид с молекулярной массой 2536.19 Да. Также методом ESI-TOF был обнаружен ряд химотриптических пептидов c молекулярными массами: 838.37 Да, 1200.53 Да, 2378.13 Да, модифицированных остатком HD и относящихся к альбумину.
Короткий адрес: https://sciup.org/14264572
IDR: 14264572 | УДК: 621.384.668.8:
Текст научной статьи Идентификация алкилированного аддукта сывороточного альбумина человека методами масс-спектрометрии
Широкое распространение различных вредных веществ в сельском хозяйстве (пестициды, инсектициды, различные удобрения), медицине, промышленности, а также необходимость утилизации химического оружия явились причиной пристального внимания к исследованию возможных методов диагностики интоксикации в России и за рубежом. Также высока заинтересованность научной и медицинской общественности в разработке методик обнаружения и идентификации отравлений малыми дозами отравляющих веществ (ОВ), эффекты воздействия которых могут проявиться через длительный промежуток времени уже после воздействия ОВ на организм человека. Ретроспективная диагностика необходима при биомониторинге персонала на предприятиях по уничтожению ОВ, а также экспертизе в случае террористического акта.
Одним из первых ОВ был сернистый иприт (b,b'-дихлордиэтилсульфид, HD). Последнее боевое применение этого газа произошло во время ирано-иракского вооруженного конфликта. В то же время были проведены обследования пострадавших, подвергавшихся его воздействию. Образцы крови пострадавших были заморожены, и идентификация метаболитов сернистого иприта и его аддуктов с белками крови проводилась через 10–15 лет после инцидента [1], когда появились новые методы аналитической биохимии. В ходе этих исследований был предложен вариант ретроспективной диагностики отравления HD иммуно-химическими методами. Также с помощью сочетания методов ГХ-МС и модифицированной мето- дики секвенирования белков, по Эдману, была определена ковалентная модификация гемоглобина с HD по N-концевому остатку валина [1]. Однако применение этих методов накладывает ряд ограничений на функциональность диагностики в связи с громоздкой и трудоемкой пробоподготовкой, а также с низкой чувствительностью секвенирования по Эдману, не позволяющей идентифицировать воздействие через значительные промежутки времени.
На сегодняшний день масс-спектрометрические технологии предоставляют исследователю полный набор методов и подходов к исследованию первичной структуры белка. Так, методы тандемной масс-спектрометрии вытеснили секвенирование по Эдману не только в области изучения первичной структуры белка, но и в области определения ковалентных модификаций отдельных аминокислот, а по сравнению с иммунохимическими методами эти методы не ограничивают исследования задачи малым набором доступных антител. Исследование HD-аддуктов белка альбумина плазмы крови человека представляется эффективным, в виду того что альбумин в отличие от гемоглобина является основным компонентом белкового пула плазмы и сыворотки крови человека. Концентрация альбумина в человеческой плазме крови составляет от 40 до 50 мг/мл (600–770 мкМ). Остальные белки представлены в плазме в более низких концентрациях. Это позволяет предполагать, что возможно обнаружение соединений HD—альбумин без его отделения от остальных белков плазмы. Период полужизни этого белка составляет ~25 дней, что позволяет проводить ретроспективную диагностику в течение нескольких недель после воз- действия ОВ. Известно, что альбумин образует ковалентные соединения с огромным количеством химических соединений. Образование таких комплексов показано для канцерогенов, относящихся к различным видам соединений, таким как бензолы [2, 3], полициклические ароматические гидрокарбонаты [4, 5], пищевые добавки 2-амино-3,8-диметилимидазогуиноксалин [6, 7], 2-амино-3-метилимидозол хинолин [8], 2-амино-1-метил-6-фенилимидазол пуридин [9] и афлатоксин [10]. Также показано, что сернистый иприт способен алкилировать остаток цистеина-34 сывороточного альбумина человека [11–13]. Участок алкилирования был обнаружен с помощью трипсинолиза альбумина из крови, обработанной радиоактивным [14C] HD. Чувствительный метод определения аддукта HD с альбумином был разработан на основе расщепления алкилированного альбумина ферментом проназой, при этом трипептид S-[2-(дигидроксиэтил)тио]этил-Cys-Pro-Phe выявлялся методом микроLC-MS-MS. Аддукты альбумина были обнаружены во всех случаях, когда концентрация HD соответствовала 0.4–1.8 мкМ [11]. Однако из-за малой массы маркерного трипептида, полученного проназным ферментолизом, существуют значительные ограничения для его использования в качестве маркера при анализах на современных MALDI масс-спектрометрах. Для приборов с методом ионизации "электроспрей" анализ триптического пептида ALVLIAFAQYLQQCPFEDHVK с массой 2536 Да также затруднен. Становится ясной необходимость разработки методик, которые могли бы полноценно осуществлять анализ на всех типах современных масс-спектрометров, в том числе отечественных (МХ-5303, МХ-5311, разработка ИАнП РАН). Требованиям такой методики удовлетворяет пептид LQQCPF с массой 838 Да, который может быть получен при ферментативном гидролизе альбумина химотрипсином.
МАТЕРИАЛЫ И МЕТОДЫ.
ПОЛУЧЕНИЕ ТРИПТИЧЕСКОГО
И ХИМОТРИПТИЧЕСКОГО ГИДРОЛИЗАТОВ БЕЛКОВ СЫВОРОТКИ КРОВИ ЧЕЛОВЕКА
Сыворотку крови получали от здоровых доноров. Использовали вакуумные системы для отбора крови (Becton Dickinson). Свежеполученную сыворотку крови инкубировали in vitro с сернистым ипритом в конечной концентрации 0.25 мг/мл при 37 °С в течение 1 ч.
К 50 мкл сыворотки крови, к которой был добавлен HD, добавляли 100 мкл 100 % ацетонитрила. Осадок отделяли центрифугированием в течение 10 минут при 16 000 оборотов в мин. Затем осадок промывали 50 мкл воды на холоду. После чего полученный осадок перерастворяли в 150 мкл
25 мМ раствора аммоний бикарбонатного буфера и отбирали аликвоту объемом 35 мкл. Далее триптический гидролиз белков плазмы крови проводили по методикам, описанным ниже.
К пробам модифицированной и немодифици-рованной сывороток крови человека добавляли раствор 25 мМ аммоний бикарбонатного буфера, содержащий трипсин (Sigma, proteomics grade) в соотношении с белком 1:100 по молярной концентрации. Трипсинолиз проходил в течение 9 ч при температуре 37 °С [14]. Свежеприготовленный раствор трипсина добавляли к белку каждые 3 ч.
Химотрипсинолиз проводили в течение 12 ч при температуре 37 °С [15]. К раствору белка каждые 4 ч добавляли свежеприготовленный раствор 10 мМ аммоний бикарбонатного буфера, содержавший химотрипсин (Sigma, proteomics grade) в соотношении с белком 1:150 по молярной концентрации.
МАСС-СПЕКТРОМЕТРИЧЕСКИЙ АНАЛИЗ МЕТОДОМ LC-ESI-TOF
Анализ проводили с помощью масс-спектрометра МХ-5310
Раствор, содержащий полученный гидролизат, разбавляли 2 %-й уксусной кислотой в 49 %-м ацетонитриле до конечной концентрации триптических пептидов 10–6 М. В микрошприц Hamilton объемом 100 мкл отбирали пробу в объеме 50 мкл, после чего соединяли с масс-спектрометром и проводили анализ. Основные настройки масс-спектрометра при проведении анализа:
-
• разность потенциалов между подающим капилляром и соплом 3000 В;
-
• напряжение, подаваемое на входное сопло, 70 В;
-
• потенциал на стержнях квадруполя PEAK-TO-PEAK (RF) 700 В.
Управление настройками масс-спектрометра проводили с помощью программы TOF control. Масс-спектры записывали с помощью программы TOF+. Обработку спектров проводили при помощи программного обеспечения TOF explorer v. 0.2. После определения центров масс масс-спектрометрических пиков к полученным данным был применен алгоритм разрешения зарядных и изотопных распределений IPEX. Полученный список моноизотопных масс составляющих пробы был экспортирован в Excel для последующей интерпретации. Масс-спектрометр МХ-5310, а также программное обеспечение для работы со спектрами и расчетов зарядных и изотопных распределений были разработаны в Лаборатории биомедицинской масс-спектрометрии Института аналитического приборостроения РАН.
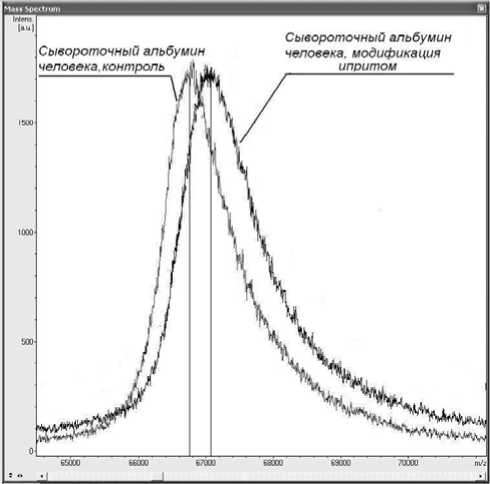
Рис. 1. Линейные спектры человеческого немодифи-цированного и модифицированного HD альбумина
МАСС-СПЕКТРОМЕТРИЧЕСКИЙ АНАЛИЗ МЕТОДОМ MALDI-TOF
Обессоливание проб производили на микроколонках, приготовленных из наконечников для микропипеток объемом 300 мкл и сорбента с привитой обратной фазой С18. После набивки такие колонки промывали небольшими объемами 100 % ацетонитрила, затем раствором 0.1 % трифторуксусной кислоты в воде.
На колонку наносили 5 мкл раствора образца в концентрации 10–4 M и промывали раствором 0.1 % трифторуксусной кислоты (ТФУ). После чего элюировали с колонки удерживаемые на ней пептиды раствором альфа-циано-4-гидроксикоричной кислоты (7 мг/мл) в 60 %-м ацетонитриле с 0.1 % ТФУ непосредственно на мишень.
Масс-спектрометрический анализ пептидов проводили на времяпролетном масс-спектрометре Ultraflex-TOF-TOF (Bruker Daltonics, Bremen, Germany) с источником MALDI, оснащенном УФ-лазером (337 нм) в режиме детектирования положительных ионов.
Ионы детектировали в диапазоне m / z от 700 до 3000. В качестве внутреннего стандарта использовали пики автолиза трипсина ( m / z 842.508, 1045.563, 2211.093), которые удалялись из масс-листов. Обработку спектров, полученных при помощи масс-спектрометра MALDI-TOF, проводили при помощи программного обеспечения "Flex Analysis 2.4" (Bruker Daltonics, Bremen, Germany).
Поиск в базе SwisProt осуществляли с помощью программного комплекса "MASCOT" (Matrix Science, Великобритания); при этом использовались следующие параметры поиска: точность определения массы — 100 ppm, возможные модификации — окисление метионина.
Точную моноизотопную массу и форму изотопного распределения для пептидов с нестандартными модификациями получали при помощи программы "MassPro".
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В линейном режиме работы прибора Ultraflex-TOF-TOF (MALDI) были получены спектры модифицированного и немодифицированного человеческого сывороточного альбумина. Наблюдаемое смещение массовых чисел между сигналами в спектрах позволяет предположить, что происходит присоединение остатков HD к белку (рис. 1). Сернистый иприт взаимодействует с сульфгидрильными группами аминокислот, входящих в состав белков. Наибольшей чувствительностью к HD обладает аминокислота цистеин. В результате взаимодействия HD с цистеином происходит алкилирование последнего [12] (рис. 2).
Также было известно, что из 35 остатков цистеина, содержащегося в альбумине, 34 образуют дисульфидные связи с образованием 17 цистинов в нативном состоянии белка. Таким образом, модификация HD наиболее вероятна по единственному не принимающему участия в образовании дисульфидных связей цистеину. Положение этого остатка в аминокислотной последовательности зрелого альбумина — 34 [15].
Для выявления аддуктов HD исследовали образцы сыворотки крови человека, которые подвергались воздействию HD in vitro . Нами был проведен триптический ферментолиз высокомолекулярной белковой фракции этих образцов. Полученные гидролизаты в дальнейшем исследовали с помощью масс-спектрометра Ultraflex-TOF-TOF. Далее в масс-спектрах проводили поиск сигналов, соответствующих модифицированным HD триптическим пептидам основного компонента сыворотки крови человека — альбумина.
Один из обнаруженных триптических пептидов с MH+ 2537.207 Да и аминокислотной последовательностью ALVLIAFAQYLQQCPFEDHVK соответствовал модифицированному HD пептиду сывороточного альбумина человека (рис. 3). Для получения дополнительных данных об аминокислотной последовательности и модификациях пептида с MH+ 2537.207 Да был проведен МС-МС-анализ, который подтвердил принадлежность этого пептида к сывороточному альбумину человека. Также была подтверждена модификация цистеина 34 сернистым ипритом (рис. 4).
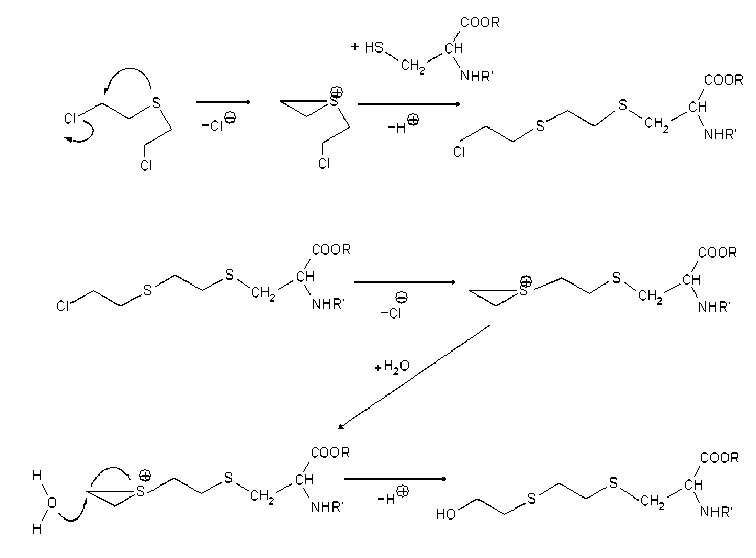
Рис. 2. Присоединение HD к остатку цистеина
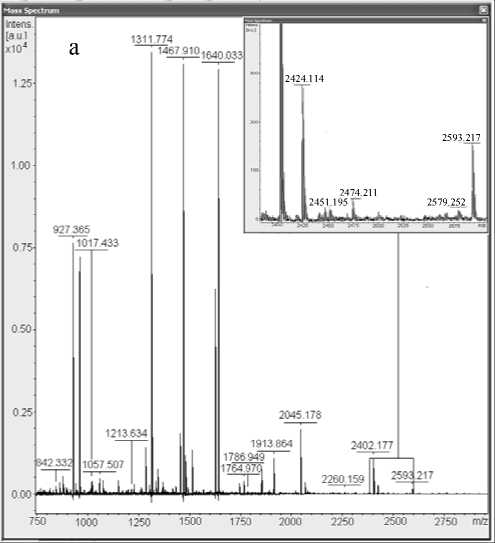
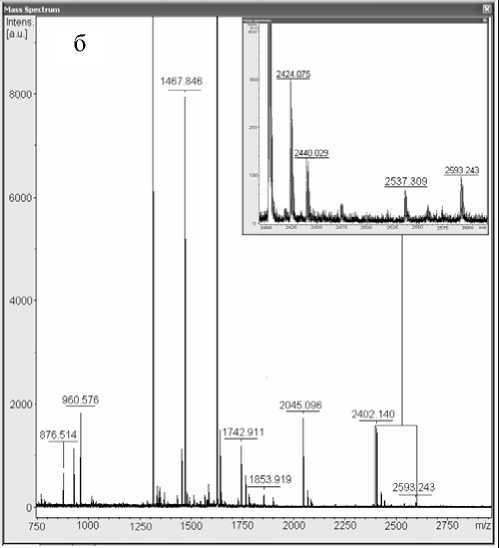
Рис. 3. Пептид ALVLIAFAQYLQQCPFEDHVK, модифицированный HD в гидролизате белков сыворотки крови. а — масс-спектр гидролизата образца сыворотки крови человека (контроль);
б — масс-спектр гидролизата образца сыворотки крови человека, подвергавшейся воздействию HD
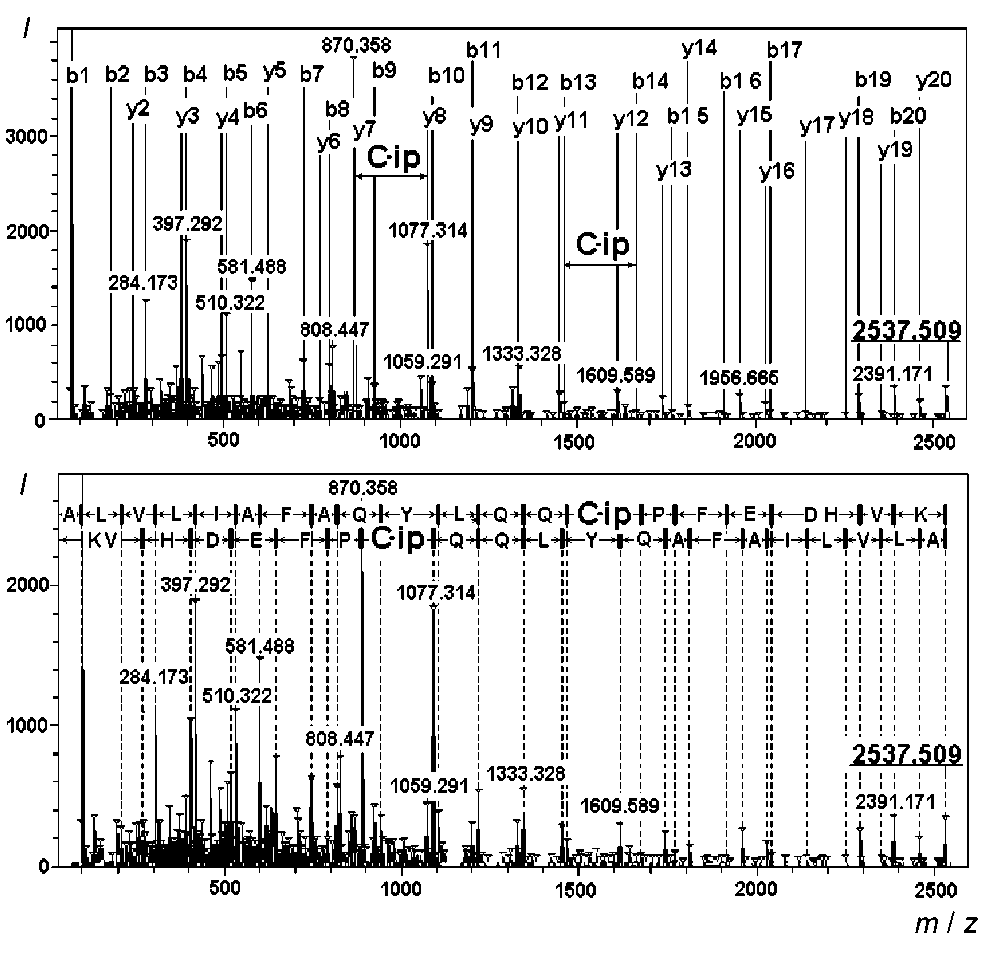
Рис. 4. МС-МС-спектр модифицированного HD по цистеину 34 триптического пептида сывороточного альбумина человека с аминокислотной последовательностью ALVLIAFAQYLQQCPFEDHVK
К сожалению, с помощью масс-спектрометров с типом ионизации "электроспрей" исследование и обнаружение маркерных пептидов с массами около 3 кДа затруднено. Образующиеся многозарядные ионы являются минорными компонентами смеси и теряются на фоне пула низкомолекулярных компонентов сыворотки крови. Также затрудняют обнаружение такого пептида возможные не-доразрывы аминокислотной последовательности при ферментолизе. Образующиеся пептиды имеют еще бόльшую массу (см. таблицу). Соответственно следующий этап исследования был ориентирован на получение маркерных пептидов альбумина, модифицированного HD, с меньшей молекулярной массой. Судя по теоретическому ферментолизу альбумина, проводимому с помощью специализированного программного обеспечения, различными ферментами такому требованию удовлетворяют пептиды, полученные химотриптическим фер-ментолизом. Теоретическая масса пептида, содержащего модифицированный остаток цистеина 34, с аминокислотной последовательностью LQQCPF составила 838.36 Да (МН+). Кроме того, при неполном прохождении реакции химотрипсинолиза
Массы и аминокислотные последовательности возможных продуктов трипсинолиза и химотрипсинолиза
|
Характеристика |
Значение |
||
|
Триптические пептиды альбумина, имеющие в составе цистеин 34 |
|||
|
№ |
1 |
2 |
3 |
|
Количество недора-зорванных связей МН+, Да МН++ HD, Да Аминокислотная последовательность |
0 2432.26 2537.20 ALVLIAFAQY- LQQCPFEDHVK |
1 3364.68 3469.72 DLGEENFKALVLIA- FAQYLQQCPFEDHVK |
1 3561.84 3666.88 ALVLIAFAQYLQQC- PFEDHVKLVNEVTEFAK |
|
Химотриптические пептиды альбумина, имеющие в составе цистеин 34 |
|||
|
№ |
1 |
2 |
4 |
|
Количество недора-зорванных связей |
0 |
1 |
1 |
|
МН+, Да |
734.34 |
1096.50 |
1952.06 |
|
МН++ HD, Да |
839.38 |
1201.54 |
2379.14 |
|
Аминокислотная последовательность |
LQQCPF |
AQYLQQCPF |
LQQCPFEDHVKLVNEVTEF |
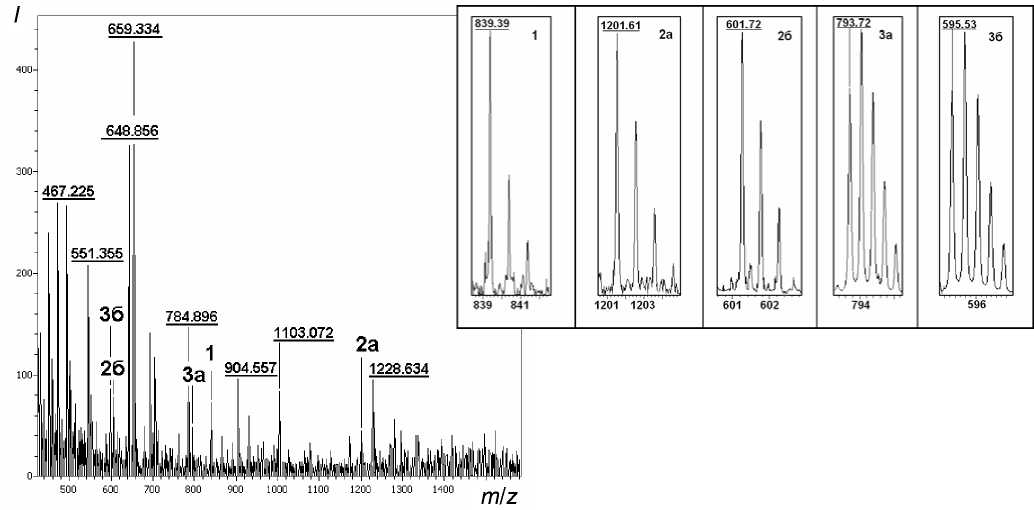
Рис. 5. Масс-спектр химотриптического гидролизата сыворотки крови человека, подвергнутой воздействию HD in vitro. Выделены сигналы пептидов, содержащих модификацию HD также образуются пептиды, которые могут быть более или менее успешно детектированы как методом MALDI, так и методом "электроспрей". Массы таких пептидов также представлены в таблице.
Химотриптическому ферментолизу подвергались белки сыворотки крови, которая инкубировалась с HD in vitro . В спектре химотриптического ферментолиза сыворотки крови был найден ряд сигналов, соответствующих химотриптическим пептидам альбумина, которые содержат цистеин 34 и остаток HD. В масс-спектре (рис. 4) представлены пептиды с аминокислотными последовательностями: LQQCPF (МН+ = 839.39 Да),
AQYLQQCPF (МН+= 1201.61 Да; М2Н+ =-
= 601.72 Да) и LQQCPFEDHVKLVNEVTEF (М3Н+= 793.72 Да, М4Н+= 595.53 Да). Как показано на рисунке, каждый из указанных сигналов обладает достаточной интенсивностью и может быть успешно детектирован.
Таким образом, результаты исследования указывают на возможность использования масс-спектрометрических методов MALDI-TOF и ESI-TOF для выявления факта интоксикации сернистым ипритом по продуктам его взаимодействия с сывороточным альбумином. Предлагаемые методы не требуют трудоемкой пробоподготовки, включающей в себя концентрирование биологического материала и дополнительные модификации цистеинов альбумина.


