Идентификация и выделение вируса контагиозной эктимы от овец в Республике Тыва в 2015 году
Автор: Янжиева Д.В., Сальников Н.И., Усадов Т.Р., Живодеров С.П., Сарыглар Л.К., Луницин А.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, микробиология, паразитология
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Контагиозная эктима - инфекционная болезнь овец и коз, характеризующаяся поражением слизистых оболочек ротовой полости, кожи губ, головы, молочных желез и конечностей. Вирус контагиозной эктимы (Orf virus, ВКЭ) - представитель рода Parapoxvirus в подсемействе Chordopoxvirinae семейства Poxviridae. Геном представлен линейной двухцепочечной молекулой ДНК размером 138 т.п.н., содержащей 132 открытые рамки считывания. Антигенная структура вируса недостаточно изучена, не все штаммы серологически идентичны, в связи с чем актуально выделение и изучение его новых изолятов. Анализ отечественной литературы показал отсутствие подобных работ на фоне малого числа зарегистрированных вспышек контагиозной эктимы в России. Мы впервые выделили ВКЭ от овец в Республике Тыва после экспериментального заражения полученным от них биоматериалом, идентифицировали его и изучили биологические свойства изолята. В августе 2015 года в Республике Тыва было зарегистрировано заболевание овец, характеризующееся развитием эритемы, везикул, пустул и струпьев на коже ушей и конечностей. Струпья от этих животных были взяты для выделения и идентификации возбудителя. С этой целью экспериментально заразили трех ягнят суспензией струпьев с кожи инфицированных животных (губы на границе кожной и слизистой поверхностей скарифицировали, а затем наносили инокулюм ватными тампонами). На 4-5-е сут после заражения на губах ягнят появились везикулы, перешедшие в стадию пустул и струпьев. Заживление поражений наблюдали через 2 нед. Суспензию струпьев от инфицированных животных использовали для инокуляции первичной культуры клеток почки овцы. На 7-е сут после инокуляции клеточный монослой собрали и провели 2-й пассаж. В монослоях 1-го и 2-го пассажей специфического цитопатического действия вируса не наблюдали. Смывы с кожи губ от экспериментально инфицированных ягнят исследовали методом ПЦР в реальном времени согласно описанному протоколу (G. Venkatesan с соавт., 2014). При этом ДНК вируса контагиозной эктимы была выявлена в смывах, полученных на 7-28-е сут после заражения. ДНК вируса контагиозной эктимы также обнаружили в струпьях от инфицированных ягнят и в лизатах клеточного монослоя после 2-го пассажа. При исследовании референтных образцов ДНК ВКЭ (штамм IA82), нодулярного дерматита (штамм Вакцинный), оспы овец (штаммы Монгольский и Б5/96), оспы коз (штамм ОК/А-04) положительные результаты получили только с ДНК ВКЭ, чем подтверждается специфичность системы. Аналитическая чувствительность ПЦР-РВ для выявления генома вируса контагиозной эктимы составила 1,3±0,03 lg ТЦД50/см3. Таким образом, возбудитель, вызвавший в 2015 году болезнь у овец в Республике Тыва, выделен в культуре клеток почки овцы от экспериментально инфицированных ягнят и идентифицирован как вирус контагиозной эктимы.
Овцы, контагиозная эктима, вирус, пцр, культура клеток
Короткий адрес: https://sciup.org/142213990
IDR: 142213990 | УДК: 636.32/38:619:578.821.6 | DOI: 10.15389/agrobiology.2016.6.861rus
Текст научной статьи Идентификация и выделение вируса контагиозной эктимы от овец в Республике Тыва в 2015 году
ли на коже есть порезы и царапины. Поражения развиваются в месте проникновения вируса, чаще на кистях рук (3).
Основной источник инфекции — больные животные, в организме которых вирус размножается. Во внешнюю среду он выделяется со струпьями, корочками и истечениями из ротовой полости, что вызывает заражение пастбищ, кормушек, воды, кормов, кошар, тепляков, загонов, подстилки. Вирусом загрязняется шерстный покров овец, предметы ухода, одежда чабанов. Овцы могут заразиться при пастьбе на инфицированных пастбищах, поедании зараженного сена, комбикорма, при приеме воды из зараженных водопоев, а также при непосредственном контакте с больными особями (1, 4). Болезнь распространяют и переболевшие вирусоносители, поступившие в благополучные хозяйства (1, 4, 5), следовательно, важен вирусологический контроль за перемещением животных.
У ВКЭ антигенная структура недостаточно изучена и не все штаммы серологически идентичны, в связи с чем актуально выявление и исследование его изолятов (3, 6-9). За рубежом общепринятая схема изучения свойств новых изолятов ВКЭ включает выделение возбудителя в культурах клеток овцы, секвенирование вариабельных участков генома и филогенетический анализ. Такой анализ выполнен для штаммов, полученных от коз в Корее, Индии, Гималаях и на Тайване (10-14). Изучены биологические свойства пяти штаммов ВКЭ от коз (Техас, 2003-2004 годы) (15). Описан способ идентификации и филогенетического анализа изолятов ВКЭ по данным секвенирования гена B2L (16), примененный для изучения штаммов от овец из Индии и Бразилии (17, 18). Разработаны и валидированы методы выявления генома этого вируса на основе ПЦР (19-21), проведено сравнение диагностических характеристик разных ПЦР-протоколов и выделения ВКЭ в культуре клеток (22). В отечественной литературе подобные работы отсутствуют, что, по-видимому, связано с недостаточным вниманием владельцев животных и ветеринарных специалистов к этой инфекции и, соответственно, с малым числом зарегистрированных вспышек контагиозной эктимы в России. Мы впервые выделили ВКЭ от овец в Республике Тыва, использовав собранный биоматериал для экспериментального заражения ягнят, и изучили биологические свойства изолята.
Цель работы заключалась в идентификации возбудителя, вызвавшего в 2015 году заболевание с симптомами контагиозной эктимы у овец в Республике Тыва.
Методика. Кожные струпья с конечностей и ушей, взятые у овец с признаками контагиозной эктимы, помещали в жидкость Эддингтона и транспортировали в термоконтейнере. Из биоматериала готовили 10 % суспензию, добавляя к навеске фосфатно-солевой буфер (137 мМ NaCl, 2,7 мМ KCl, 10 мМ Na 2 HPO 4 , 1,76 мМ NaH 2 PO 4 , pH 7,4) в соотношении 1:9 (масса/объем) и гомогенизировали в фарфоровой ступке. Суспензию осветляли центрифугированием (3 мин при 7000 об/мин). Биологические свойства вируса изучали при заражении трех ягнят в условиях вивария суспензией струпьев с кожи конечностей больных особей (инфекционный материал наносили ватными тампонами на скарифицированную поверхность губ на границе кожи и слизистой оболочки). Клинический осмотр животных проводили ежедневно, с мест введения вируса брали смывы.
Вирус выделяли в перевиваемой культуре клеток почки овцы (линия ПО-ВНИИВВиМ; музей Всероссийского НИИ ветеринарной вирусологии и микробиологии), выращенной в матрасах с посадочной площадью 150 см2. Суспензию струпьев от инфицированных животных пропускали через фильтр 45 мкм («Millipore», США), разбавляли средой Игла MEM с 862
антибиотиками (гентамицин — 50 мкг/мл, амфотерицин Б — 2,5 мкг/мкл) в соотношении 1:1. Далее 1 мл суспензии вносили в матрасы с культурой клеток и оставляли на 30 мин в СО2-инкубаторе MCO-18AC («Sanyo Electric Co., Ltd», Япония) при 37 °С. Культуральную среду декантировали, вносили 10 мл среды Игла MEM, содержащей 2 % фетальной телячьей сыворотки («Биолот», Россия), и 7 сут культивировали при тех же условиях. Затем монослой подвергали 3-кратному замораживанию и оттаиванию и использовали для 2-го пассажа (последующие пассажи не проводили).
Пробы биоматериала исследовали на наличие ДНК вируса контагиозной эктимы методом ПЦР в режиме реального времени (ПЦР-РВ). ПЦР выполняли на термоциклере Rotor Gene 6000 («Corbett Research Pty, Ltd», Австралия) по следующей программе: 10 мин при 95 °С — предварительная денатурация; 30 с при 95 °С, 1 мин при 60 °С — детекция по каналу Green. Реакционная смесь содержала 10 пмоль каждого праймера, 3 пмоль флуоресцентного зонда, 2,5 мкл 10½ ДНК-буфера, 10 ммоль смеси трифосфатов и 1,5 ед. активности Taq ДНК-полимеразы рекомбинантной («Thermo Fisher Scientific», США). Использовали праймеры OV RT-F (5´-TACACGGAGTTGGCCGTGATCTTGTA-3´) и OV RT-R (5´-CGCCAA-GTACAAGAAGCTGATGA-3´) и гибридизационный зонд OV Probe (5´-[FAM]TGCATCGAGTTGTAGATCTCGCGGT[BHQ-1]-3´), разработанные в 2014 году (23). Специфичность системы проверяли с образцами ДНК штаммов вирусов нодулярного дерматита, оспы овец, оспы коз и контагиозной эктимы (Коллекция микроорганизмов ВНИИВВиМ), аналитическую чувствительность теста контролировали с 10-кратными разведениями первичной культуры клеток синовиальной мембраны ягненка (музей ВНИИВВиМ), инфицированной вирусом контагиозной эктимы. Для титров приведены значения с относительным стандартным отклонением ±0,03 (24).
Результаты. В августе 2015 года в СПК «Бай-Хол» сумона Бай-Тал
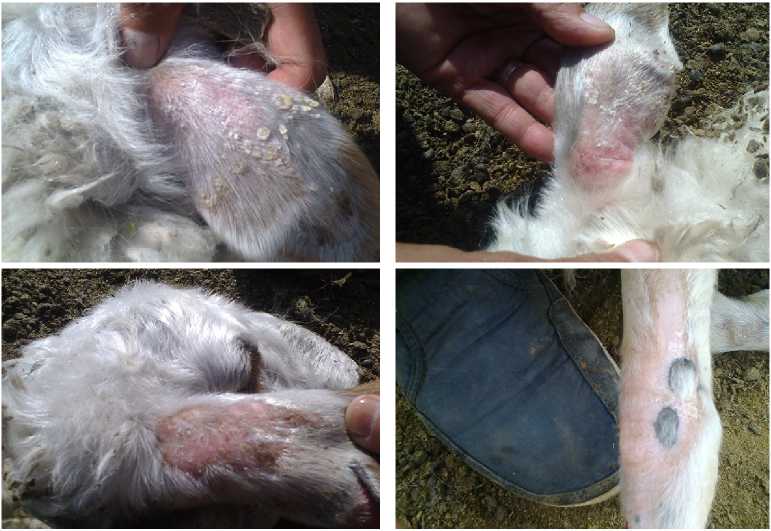
Клинические признаки контагиозной эктимы у овец: А, Б — струпья на коже ушей, В — пустулы на коже ушей, Г — пустулы на коже ноги (Республика Тыва, 2015 год).
(Эрзинский р-н, Республика Тыва) у овец и ягнят, родившихся в конце марта—начале апреля, было зарегистрировано заболевание, сопровождав- шееся поражением кожных покровов в виде струпьев на коже конечностей, ушей, носа. У ягнят сначала наблюдали покраснение кожного покрова в области ушей, затем на конечностях и в области ноздрей выпадала шерсть и происходило образование везикул и долго не заживающих язв (рис.). При экспериментальном заражении здоровых особей биоматериалом от больных животных на 4-5-е сут на местах введения вируса появились везикулы, которые через 1 сут превратились в пустулы. Подсыхая, пустулы образовывали серовато-коричневые струпья. Спустя 2 нед после экспериментального заражения происходило заживление поражений.
После двух пассажей (по 7 сут) в первичной культуре клеток ПО-ВНИИВВиМ специфическое цитопатическое действие вируса контагиозной эктимы не проявлялось. Репродукцию вируса в культуре клеток подтверждали выявлением его геномной ДНК методом ПЦР-РВ в лизате клеточного монослоя после 2-го пассажа (7 сут). Использованная система олигонуклеотидных праймеров и Taq-man зонд комплементарны гену ДНК-полимразы этого вируса (9). При исследовании референтных образцов ДНК ВКЭ (штамм IA82), нодулярного дерматита (штамм Вакцинный), оспы овец (штаммы Монгольский и Б5/96), оспы коз (штамм ОК/А-04) положительные результаты получили только с ДНК ВКЭ, чем подтверждается специфичность системы. Лизат культуры клеток ПО-ВНИИВВиМ, инфицированной ВКЭ (2-й пассаж), при этом был ПЦР-положительным. То есть только образцы ДНК ВКЭ оказались ПЦР-положительными, что также свидетельствовало о специфичности использованных праймеров и зонда.
Наибольшее разведение культурального материала, содержащего ВКЭ (референтный штамм IA82, инфекционная активность 5,3±0,03 lg ТЦД50/см3), для которого получили положительный ПЦР-результат, — 10-4 (табл. 1). Следовательно, аналитическая чувствительность ПЦР-РВ для выявления генома вируса контагиозной эктимы составила 1,3±0,03 lg ТЦД50/см3.
1. Аналитическая чувствительность ПЦР-РВ при выявлении генома вируса контагиозной эктимы
|
Разведение 1 |
Титр вируса, lg ТЦД 50 /см3 |
Пороговый цикл |
|
10-1 |
4,3±0,03 |
17,81 |
|
10-2 |
3,3±0,03 |
22,09 |
|
10-3 |
2,3±0,03 |
25,59 |
|
10-4 |
1,3±0,03 |
30,46 |
|
10-5 |
0,3±0,03 |
Нет значений |
П р и м еч а ни е. ПЦР-РВ — ПЦР в режиме реального времени. Пороговый цикл — цикл, на котором кривая флуоресценции пересекает пороговую линию.
Исследование материала от экспериментально зараженных овец показало, что на 7-28-е сут вирус накапливался в эпителии слизистой ротовой полости и в слюне в количестве, достаточном для идентификации в ПЦР-РВ (табл. 2). Ис- следование пустул, образовавшихся на местах введения вируса, а также культурального материала тоже дало положительный результат (Ct 8,1-9,3).
2. Пороговые циклы ПЦР-РВ при выявлении гено- Таким образом, ма вируса контагиозной эктимы в мазках из ро- мы впервые обнаружили товой полости в разные сроки после эксперимен- вирус контагиозной эк- тального заражения животных
|
Время, сут 1 |
1-й ягненок |
] 2-й ягненок |
] 3-й ягненок |
|
7 |
18,23 |
19,32 |
18,51 |
|
14 |
25,98 |
22,27 |
24,21 |
|
21 |
35,59 |
29,21 |
30,43 |
|
28 |
Отрицательный |
Отрицательный |
Отрицательный |
П р и м еч а ни е. ПЦР-РВ — ПЦР в режиме реального времени. Пороговый цикл — цикл, на котором кривая флуоресценции пересекает пороговую линию.
тимы у овец с симптомами этого заболевания, проявившегося в Республике Тыва в 2015 году, и изучили биологические свойства изолята. При экспериментальном заражении полевой изолят вызывал везикулярно-пустулезную сыпь в месте введения (на границе кожи и слизистой губ). Возбудитель был выделен из кожных струпьев от экс- периментально инфицированных животных в перевиваемой культуре клеток почки овцы и идентифицирован методом ПЦР в реальном времени.
Список литературы Идентификация и выделение вируса контагиозной эктимы от овец в Республике Тыва в 2015 году
- Коломыцев А.А., Закутский Н.И., Гузалова А.Г., Миколайчук С.В., Моргунов Ю.П. Контагиозный пустулезный дерматит овец и коз. Ветеринарная патология, 2008, 4: 31-37.
- Delhon G., Tulman E.R., Afonso C.L., Lu Z., de la Concha-Bermejillo A., Lehmkuhl H.D., Piccone M.E., Kutish G.F., Rock D.L. Genomes of the parapoxviruses Orf virus and bovine papular stomatitis virus. J. Virol., 2004, 78(1): 168-177 ( ) DOI: 10.1128/JVI.78.1.168-177.2004
- Bayindir Y., Bayraktar M., Karada N., Ozcan H., Kayabas U., Otlu B., Durmaz R., Doganay M. Investigation and analysis of a human orf outbreak among people living on the same farm. New microbiologica, 2011, 34: 37-43.
- Hosamani A., Scagliarini A., Bhanuprakash V., McInnes C.J., Singh R.K. Orf: an update on current research and future perspectives. Expert Review on Anti-infective Therapy, 2009, 7(7): 879-893 ( ) DOI: 10.1586/eri.09.64
- Bhanuprakash V., Venkatesan G., Balamurugan V., Hosamani M., Yogisharadhya R., Chauhan R.S., Pande A., Mondal B., Singh R.K. Pox outbreaks in sheep and goats at Makhdoom (Uttar Pradesh), India: evidence of sheep pox virus infection in goats. Transbound. Emerg. Dis., 2010, 57(5): 375-382 ( ) DOI: 10.1111/j.1865-1682.2010.01158.x
- Abubankr M.I., Abu-Elzein E.M., Housawi F.M., Abdelrahman A.O., Fadlallah M.E., Nayel M.N., Adam A.S., Moss S., Forrester N.L., Coloyan E., Gameet A., Al-Afaleq A.I., Gould E.A. Pseudo cow poxvirus: the etiological agent of contagious ecthyma (Auzdyk) in camels (Camelus dromedarius) in the Arabian peninsula. Vector Borne Zoonotic Diseases, 2007, 7(2): 257-260 ( ) DOI: 10.1089/vbz.2006.0627
- Abdelrabman K., Soliman H. Molecular and virological studies on contagious pustular dermatitis isolates from Egyption sheep and goats. Research in Veterinary Science, 2010, 89(2): 290-294 ( ) DOI: 10.1016/j.rvsc.2010.02.019
- Wise L.M., Savory L.J., Dryden N.H., Whelan E.M., Fleming S.B., Mercer A.A. The development of oral lesions in lambs naturally infected with orf virus. Veterinary Journal, 2007, 174(3): 663-664 ( ) DOI: 10.1016/j.tvjl.2006.10.024
- Venkatesan G., Balamurugan V., Bhanuprakash V. TaqMan based real-time duplex PCR for simultaneous detection and quantitation of Capri pox and Orf virus genomes in clinical samples. J. Virol. Methods, 2014, 201: 44-50 ( ) DOI: 10.1016/j.jviromet.2014.02.007
- Oem J.-K., Chung J.-Y., Kim Y.-J., Lee K.-K., Kim S.-H., Jung B.-Y., Hyun B.-H. Isolation and characterization of orf viruses from Korean black goats. J. Vet. Sci., 2013, 14(2): 227-230 ( ) DOI: 10.4142/jvs.2013.14.2.227
- Bora D.P., Barman N.N., Das S.K., Bhanuprakash V., Yogisharadhya R., Venkatesan G., Kumar A., Rajbongshi G., Khatoon E., Chakraborty A., Bujarbaruah K.M. Identification and phylogenetic analysis of orf viruses isolated from outbreaks in goats of Assam, a northeastern state of India. Virus Genes, 2012, 45: 98-104 ( ) DOI: 10.1007/s11262-012-0740-y
- Chan K.W., Lin J.W., Lee S.H., Liao C.J., Tsai M.C., Hsu W.L., Wong M.L., Shih H.C. Identification and phylogenetic analysis of orf virus from goats in Taiwan. Virus Genes, 2007, 35: 705-712 ( ) DOI: 10.1007/s11262-007-0144-6
- Mondal B., Bera A.K., Hosamani M., Tembhurne P.A., Bandyopadhyay S.K. Detection of orf virus from an outbreak in goats and its genetic relation with other parapoxviruses. Veterinary Research Community, 2006, 30: 531-539 ( ) DOI: 10.1007/s11259-006-3270-z
- Hosamani M., Yadav S., Kallesh D.J., Mondal B., Bhanuprakash V., Singh R.K. Isolation and characterization of an Indian orf virus from goats. Zoonoses Public Health, 2007, 54: 204-208 ( ) DOI: 10.1111/j.1863-378.2007.01046.x
- Musser J.M.B., Taylor C.A., Guo J., Tizard I.R., Walker J.W. Development of a contagious ecthyma vaccine for goats. Am. J. Vet. Res., 2008, 69: 1366-1370 ( ) DOI: 10.2460/ajvr.69.10.1366
- Hosamani M., Bhanuprakash V., Scagliarini A., Singh R.K. Comparative sequence analysis of major envelope protein gene (B2L) of Indian orf viruses isolated from sheep and goats. Vet. Microbiol., 2006, 116: 317-324 ( ) DOI: 10.1016/j.vetmic.2006.04.028
- Venkatesan G., Balamurugan V., Bora D.P., Yogisharadhya R., Prabhu M., Bhanuprakash V. Sequence and phylogenetic analyses of an Indian isolate of orf virus from sheep. Veterinaria Italiana, 2011, 47(3): 323-332.
- Abrahão J.S., Campos R.K., Trindade G.S., Guedes M.I., Lobato Z.I., Mazur C., Ferreira P.C., Bonjardim C.A., Kroon E.G. Detection and phylogenetic analysis of orf virus from sheep in Brazil: a case report. Virol. J., 2009, 6: 47 ( ) DOI: 10.1186/1743-422X-6-47
- Chan K.W., Hsu W.L., Wang C.Y., Yang C.H., Lin F.Y., Chulakasian S., Wong M.L. Differential diagnosis of orf viruses by a single-step PCR. J. Virol. Methods, 2009, 160(1-2): 85-89 ( ) DOI: 10.1016/j.jviromet.2009.04.025
- Gallina L., Dal Pozzo F., Mc Innes C.J., Cardeti G., Guercio A., Battilani M., Ciulli S., Scagliarini A. A real-time PCR assay for the detection and quantification of orf virus. J. Virol. Methods, 2005, 134: 140-145 ( ) DOI: 10.1016/j.jviromet.2005.12.014
- Nitsche A., Buttner M., Wilhelm S., Pauli G. Meyer H. Real-Time PCR detection of parapoxvirus DNA. Clin. Chem., 2006, 52(2): 316-319 ( ) DOI: 10.1373/clinchem.2005.060335
- Kottaridi C., Nomikou K., Lelli R., Markoulatos P., Mangana O. Laboratory diagnosis of contagious ecthyma: comparison of different PCR protocols with virus isolation in cell culture. J. Virol. Methods, 2006, 134: 119-124 ( ) DOI: 10.1016/j.jviromet.2005.12.005
- Venkatesan G., Balamurugan V., Bhanuprakash V. TaqMan based real-time duplex PCR for simultaneous detection and quantitation of Capri pox and Orf virus genomes in clinical samples. J. Virol. Methods, 2014, 201: 44-50 ( ) DOI: 10.1016/j.jviromet.2014.02.007
- Лакин Г.Ф. Биометрия. М., 1990.


