Идентификация мутаций генов MSTN и RYR 1, связанных с мясной продуктивностью животных
Автор: Тюлькин С.В., Нургалиев Ф.М., Ахметов Т.М., Вафин Р.Р.
Рубрика: Современные проблемы зооинженерии и селекции сельскохозяйственных животных
Статья в выпуске: 4 т.212, 2012 года.
Бесплатный доступ
В данной работе представлены результаты ДНК-анализа по выявлению мутаций в генах MSTN и RYR 1, связанных с мясной продуктивностью крупного рогатого скота и свиней, соответственно. Исследования показали, что у данных животных мутации в генах MSTN и RYR 1 отсутствуют.
Мясная продуктивность, мутация, ген, пцр, днк
Короткий адрес: https://sciup.org/14287736
IDR: 14287736 | УДК: 636.2.034:636.2.082.
Текст научной статьи Идентификация мутаций генов MSTN и RYR 1, связанных с мясной продуктивностью животных
Современное животноводство, используя самые последние достижения фундаментальных биологических наук, в том числе и генетики, позволяет добиваться увеличения эффективности разведения животных. Количественные признаки животных, такие как состав молока, качество туш и мяса, плодовитость, сопротивляемость или чувствительность к инфекциям в большинстве своем являются полигенными признаками, результатом взаимодействия многих генов. Влияние факторов окружающей среды модифицирует фенотипическую ценность данного признака. Введение в широких масштабах искусственного оплодотворения скота создало условия для передачи хозяйственно ценных генов, в частности, обуславливающих высокую молочную и мясную продуктивность. Идентификация генов, которые определяют то или иное развитие количественных признаков (главные гены количественных признаков – QTL – Quantitative Trait Loci), а также их мутаций, поиск молекулярно-генетических маркеров, тесно сцепленных с ними, является в настоящее время предметом интенсивных исследований (В.И. Глазко и др., 2001).
Среди мутаций крупного рогатого скота особый интерес привлекает мутация, обеспечивающая аномальное развитие мышечной массы – миостатин-mh. Тривиальное название мутации «двойной мускул» (синонимы: доппельлендеры, double-muscling, двойные мышцы, мышечная гипертрофия, мышечная суперплазмия и др.). Данная мутация рецессивна и ассоциирована с действием гена MSTN . Физиологическая сущность мутации миостатин-mh состоит в преодолении генетического контроля за гипертрофированным ростом мышечной массы. Мутация миостатин-mh-0 на 20% увеличивает мышечную массу. В новых условиях использования организма домашних животных, как мини-биофабрики по биосинтезу мышечного белка, внедрение данной мутации в систему разведения отдельных пород не только возможно, но может являться важным селекционным достижением [4, 2].
Ген RYR1 – главный ген стресса, качества мяса и мясных кондиций свиней. Мутация в этом гене ведет к заболеванию свиней – злокачественному гипертермическому синдрому и появлению животных с плохим качеством мяса – бледное, экссудативное, мягкое. Поэтому при создании новых типов и линий свиней необходим молекулярногенетический контроль гена RYR1 для снижения потерь мяса при его получении и обработки. Повышенная чувствительность к стрессам негативно отражается так же и на сохранности молодняка [5, 3].
В связи с этим, исследования, посвященные выявлению мутаций, связанных у крупного рогатого скота и свиней с мясной продуктивностью являются актуальными.
Материал и методика исследований. Для проведения исследований было отобрано 70 чистопородных и помесных по голштинской породе быков-производителей в ГУП ГПП «Элита» Высокогорского района и 75 голов молодняка свиней разных пород (25 голов – ландрас, 25 голов – чистопородная крупная белая, 25 голов – Аист 1, т.е. помеси ландрас х крупная белая) в ООО «Татмит-Агро» Сабинского района Республики Татарстан.
Для проведения ДНК-диагностики у крупного рогатого скота и свиней были отобраны пробы крови. Кровь, полученную у животных, вносили в пробирки с 100 мМ ЭДТА до конечной концентрации 10 мМ. ДНК из крови выделяли комбинированным щелочным способом.
Анализ локуса гена MSTN у крупного рогатого скота. АС-ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl2, 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 0,5 ед. Taq ДНК полимеразы, 0,5 мкМ праймера MS-F: 5/-GGGGGGGAGAGATTTT GGGCTTGATTGTGA-3/, 0,5 мкМ праймера MS-R: 5/-GGGGGGGTGCAATA ATCCAATCCCATCCAA-3/, сконструированных нами для амплификации фрагмента гена MSTN здоровых животных – 119 bp, больных животных – 108 bp, а животных-носителей мутации в гене MSTN – 119/108 bp., 1 мкл пробы ДНК в следующем режиме:
×1: 94 0С – 4 мин; ×40: 94 0С – 30 сек, 68 0С – 30 сек, 72 0С – 30 сек;
×1: 72 0С – 5 мин; хранение: 4 0С.
Анализ локуса гена RYR1 у свиней. ПЦР проводили на программируемом термоциклере «Терцик» (Россия) в объеме 20 мкл, содержащей буфер (60 мМ трис-HCl (рН 8,5), 1,5 мМ MgCl 2 , 25 мМ KCl, 10 мМ меркаптоэталол; 0,1 мМ тритон Х-100), 0,25 мМ dNTP, 1 ед. Taq ДНК полимеразы, 0,5 мкМ праймера RYR1-F: 5/-CCACACCCTCCCCGCAAGTGC-3/, 0,5 мкМ праймера RYR1-R: 5/-GCCAGGGAGCAAGTTCTCAGTAAT-3/, сконструированных Т.Д. Луерце и др. (T.D. Luerce et al., 2009) для амплификации фрагмента гена RYR1 длиной 144 пары нуклеотидов, 1 мкл пробы ДНК в следующем режиме:
×1:94 0С – 4 мин; ×40:94 0С – 10 сек, 56 0С – 10 сек, 72 0С – 10 сек;
×1:72 0С – 7 мин; хранение: 4 0С.
Для определения аллельного полиморфизма гена RYR1 по вариантам N и n 20 мкл ПЦР пробы обрабатывали 5 ед. эндонуклеазы рестрикции HspAI в 1×буфере «Y» фирмы СибЭнзим (Россия) при 370C в течение ночи.
Детекция. Для визуализации фрагментов ДНК пробы вносили в лунки 4% агарозного геля с содержанием этидия бромида (0,5 мкг/мл) и проводили горизонтальный электрофорез при 15 В/см в течение 40 мин в 1×ТВЕ буфере.
После электрофореза гель просматривали в УФ-трансиллюминаторе при длине волны 310 нм. Идентификацию генотипов определяли по количественным и качественным признакам ПЦР-ПДРФ.
Результаты собственных исследований. Для оценки качества работы протокола АС-ПЦР по выявлению у крупного рогатого скота мутации в гене MSTN была протестирована пара сконструированных нами праймеров: MS-F: 5/-GGGGGGGAGAGATTTTGGGCTTGATTGTGA-3/ и MS-R: 5/-GGGGGGG-TGCAATAATCCAATCCCATCCAA-3/.
Праймеры MS-R+MS-F инициируют амплификацию ПЦР-фрагмента для выявления мутации в гене MSTN крупного рогатого скота длиной 119 bp (здоровые животные, рис. 1), 108 bp (больные животные) и 119/108 bp (животные-носители мутации).
При изучение полиморфизма гена MSTN среди чистопородных и помесных по голштинской породе быков-производителей не выявлено ни одного животного с мутантным аллелем mh -локуса данного гена.
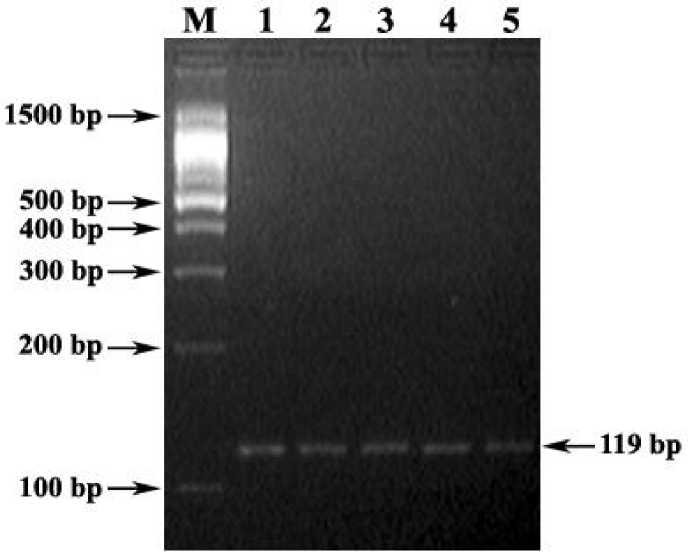
Рис. 1. Электрофореграмма результата аллель-специфичной ПЦР для генотипирования кр.рог. ск. по mh -локусу MSTN -гена (праймеры MS-F+MS-R)
Обозначения:
М) ДНК-маркеры 1500-100 bp (СибЭнзим);
1-5) ПЦР-фрагмент гомозиготного нормального генотипа MSTN -гена (119 bp)
Для оценки качества работы известного протокола генотипирования свиней по гену RYR1 нами были протестированы праймеры RYR1-F: 5/-CC-ACACCCTCCCCGCAAGTGC-3/ и RYR1-R: 5/-GCCAGGGAGCAAGTTCTC-AGTAAT-3/, сконструированные Т.Д. Луерце и др. (T.D. Luerce et al., 2009) по оптимизированной нами технике ПЦР-ПДРФ.
Праймеры RYR1-F+RYR1-R инициируют амплификацию фрагмента гена RYR1 (стрессового синдрома) свиней длиной 144 bp. RYR1- ПДРФ- HspAI -профиль здоровых животных = 102/42 bp (генотип NN ) (рис. 2),
Ml 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
300 bp->-
200 bp^-
100 hp-*-
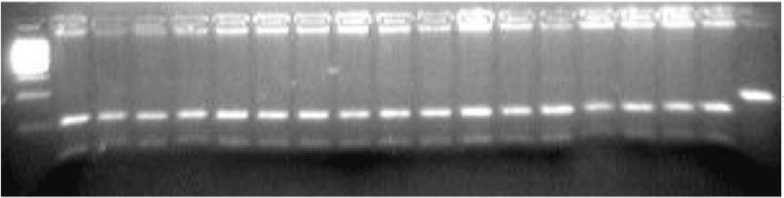
-<-144 bp
-^102 bp
■*— 42 bp
Рис. 2. Электрофореграмма результата ПЦР-ПДРФ гена RYR1 с праймерами RYR1-F+RYR1-R и эндонуклеазным расщеплением HspAI
Обозначения: М) ДНК-маркеры 1500-100 bp (СибЭнзим); 1-17) генотип NN (102/42 bp); 18) цельный ПЦР-фрагмент гена RYR1 (144 bp).
больных животных = 144 bp (генотип nn ), а животных-носителей мутантного аллеля n гена RYR1 =144/102/42 bp (генотип Nn ).
При исследовании молодняка свиней породы ландрас, чистопородной крупной белой и Аист 1 нами не выявлено наличие в их геноме мутантного аллеля n гена RYR1 .
Выводы. 1. Для эффективного выявления мутаций в генах MSTN и RYR1 , связанных с мясной продуктивностью у крупного рогатого скота и свиней необходимо использовать методы ДНК-анализа; 2. При скрининге гена MSTN среди чистопородных и помесных по голштинской породе быков-производителей и гена RYR1 среди молодняка свиней породы ландрас, чистопородной крупной белой и Аист 1 не выявлено наличие в них мутаций.
ЛИТЕРАТУРА: 1. Глазко, В.И. Введение в ДНК-технологии / В.И. Глазко, И.М. Дунин, Г.В. Глазко, Л.А. Калашникова // М.: ФГНУ «Росинформагротех», 2001. – 436 с. 2. Коновалов, В.С. Новые тенденции использования эволюционно-запрещенных мутаций в селекции крупного рогатого скота / В.С. Коновалов. – межд. науч.-методич. конференция «Современные проблемы эволюционной биологии» – 2009. – электорн. дан. – режим доступа : http://darwin200.narod.ru, свободный. 3. Лаломова, Е.В. Полиморфизм свиней по генам эстрогенового, пролактинового и рианодинового рецепторов : автореф. дисс. канд. биол. наук: 06.02.01 / Лаломова Елена Владимировна. – Лесные Поляны. – 2007. – 23 с. 4. Fahrenkrug, S.C. Technical Note: Direct Genotyping of the Double-Muscling Locus (mh) in Piedmontese and Belgian Blue Cattle by Fluorescent PCR / S.C. Fahrenkrug [et al.] // Animal Science. – 1999. – 77: 2028-2030. 5. Luerce, T.D. An improved method for characterization of the mutation associated to porcine stress syndrome by PCR amplification followed by restriction analysis / T.D. Luerce [et al.] // Ciência Rural, Santa Maria. – 2009. – V. 39. – n. 5. – Р. 15771580.
ИДЕНТИФИКАЦИЯ МУТАЦИЙ ГЕНОВ MSTN И RYR1 , СВЯЗАННЫХ С МЯСНОЙ ПРОДУКТИВНОСТЬЮ ЖИВОТНЫХ
Тюлькин С.В., Нургалиев Ф.М., Ахметов Т.М., Вафин Р.Р.
Резюме
В данной работе представлены результаты ДНК-анализа по выявлению мутаций в генах MSTN и RYR1 , связанных с мясной продуктивностью крупного рогатого скота и свиней, соответственно. Исследования показали, что у данных животных мутации в генах MSTN и RYR1 отсутствуют.
IDENTIFICATION MUTATIONS OF GENES MSTN AND RYR1 , THE ANIMALS CONNECTED WITH MEAT EFFICIENCY
Tjulkin S.V., Nurgaliev F.М., Ahmetov T.M., Vafin R.R.


