Идентификация пептидов сывороточного альбумина, модифицированных фосфорорганическими соединениями, с применением методов хроматографии и масс-спектрометрии
Автор: Гладилович Владимир Дмитриевич, Краснов И.А., Подольская Е.П., Дубровский Я.А., Войтенко Н.Г., Фиронов С.В., Бабаков В.Н., Гончаров Н.В., Краснов Н.В.
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Масс-спектрометрия для биотехнологии
Статья в выпуске: 4 т.20, 2010 года.
Бесплатный доступ
Одним из основных биомаркеров интоксикации фосфорорганическими соединениями (ФОС) является ковалентный аддукт ФОС с сывороточным альбумином. В данной работе предложена универсальная методика выделения фосфорсодержащих пептидов из биологических образцов, позволяющая выделить и идентифицировать пептиды сывороточного альбумина, модифицированные фосфорсодержащими соединениями. Предлагается комбинация аффинной хроматографии с использованием триазиновых красителей как сорбента и металл-аффинной хроматографии с использованием сорбентов с хелатированными ионами Fe3+ для выделения фосфонилированных параоксоном пептидов сывороточного альбумина. Идентификацию фосфонилированных пептидов проводили времяпролетной масс-спектрометрией с методом ионизации МАЛДИ. Впервые обнаружены и идентифицированы триптические пептиды сывороточного альбумина крысы, модифицированные остатком параоксона по тирозину-150 и тирозину-411.
Масс-спектрометрия, металл-аффинная хроматография, параоксон, сывороточный альбумин крысы
Короткий адрес: https://sciup.org/14264690
IDR: 14264690 | УДК: 577.112.6:
Текст научной статьи Идентификация пептидов сывороточного альбумина, модифицированных фосфорорганическими соединениями, с применением методов хроматографии и масс-спектрометрии
Фосфорорганические соединения (ФОС) используются как пестициды в сельском хозяйстве, антигельминты в медицине, добавки к гидравлическим жидкостям и масло для реактивных двигателей в авиации. Эти соединения токсичны для насекомых, рыб, птиц, млекопитающих и человека. ФОС также производили для вооруженных сил многих стран мира как химическое оружие, которое в настоящее время уничтожается в соответствии с конвенцией о запрещении химического оружия.
При определении степени и самого факта воздействия на организм ФОС наиболее простыми и распространенными являются биохимические методы измерения активности холинэстераз [1, 2, 3]. Однако эти методы не являются специфичными, т. е. не дают информации о том, что именно послужило причиной снижения активности холинэстераз — отравление ФОС, другим веществом или заболевание нетоксикологического генеза. В случае, когда имеются веские основания полагать, что причиной снижения активности холинэстераз является отравление ФОС, зачастую необходимо определить, какое именно соединение вызвало отравление. В настоящее время активно разрабатываются методы анализа ФОС в биопробах с целью химикотоксикологической диагностики отравлений.
Одним из стандартных методов качественного определения некоторых продуктов распада ФОС в организме (например, метилфосфоновой кислоты и алкилфосфонатов в случае поражения зарином, зоманом или ФОС V-типа) является газовая хро-мато-масс-спектрометрия в режиме статического парофазного анализа с предварительной деривати-зацией [4, 5]. Однако этот метод имеет достаточно низкую чувствительность и предполагает многоэтапную и трудозатратную пробоподготовку, что является его существенным недостатком. Еще одна существующая методика по определению возможных модификаций белков фосфорорганическими соединениями предполагает стадию реактивации, в которой остаток ФОС отщепляется от белка и, как правило, гидролизуется до метилфосфоновой кислоты или ее производных. Такая процедура достаточно трудоемка, но главное — она не всегда позволяет определить, какое именно соединение является причиной отравления, поскольку идентифицируется только продукт гидролиза (реактивации) [6, 7]. Альтернативным подходом для идентификации воздействия ФОС на организм может служить поиск белков и пептидов, модифицированных токсичным агентом либо его метаболитами [8], причем наиболее удобным объектом исследования представляется сывороточный альбумин. Альбумин является мажорным компонентом белковой фракции крови, это важнейший белок-переносчик, способный транспортировать со- единения различной химической природы, что дает основания предполагать образование аддуктов с токсичными агентами, в том числе с ФОС. Это и было показано в работах группы Оксаны Локридж (Oksana Lockridge, Eppley Institute and Department of Biochemistry and Molecular Biology, University of Nebraska Medical Center), в которых коммерческие препараты сывороточного альбумина человека обрабатывали значительным избытком ФОС [9, 10].
Время полужизни альбумина составляет примерно 24 дня, что позволяет определить факт интоксикации по выявлению аддукта спустя продолжительное время. Вместе с тем с течением времени количество модифицированного белка в организме уменьшается в силу естественных причин. В связи с этим необходимо обогащение пробы фосфорсодержащими пептидами. Несмотря на то что альбумин является мажорным компонентом плазмы и сыворотки крови, остальные присутствующие в них белки мешают анализу и получению достоверных результатов, увеличивая в несколько раз количество триптических пептидов в образце при гидролизе. Кроме того, фосфонилированные пептиды альбумина дают малоинтенсивные пики при масс-спектрометрическом анализе с источником ионизации MALDI.
Поиск пептидов, модифицированных фосфорсодержащими соединениями, затруднен малым числом сигналов модифицированных пептидов в спектре по отношению к немодифицированным и их низкой интенсивностью. В связи с этим требуется тщательная разработка новых подходов и методик обогащения пептидных смесей фосфорсодержащими пептидами, например с использованием таких методов, как аффинная и металл-аффинная (металл-хелатная) хроматографии.
Цель данной работы — разработка методов, позволяющих выделить и идентифицировать пептиды, содержащие ковалентные аддукты фосфорорганических соединений с сывороточным альбумином крысы, а также адаптация методов выделения альбумина из плазмы или сыворотки крови для химико-токсикологического анализа из образцов сыворотки крови крысы, инкубированных модельным ФОС — параоксоном — in vitro и in vivo .
МАТЕРИАЛЫ И МЕТОДЫ
При исследовании образования аддуктов альбумина крысы с ФОС к 1 мл раствора коммерческого препарата белка (Sigma, концентрация 1 мг/мл в 0.1 М аммонийбикарбонатном буфере) добавляли параоксон до конечной концентрации 0.1 мг/мл и инкубировали 1 ч при 37 °С. Белок осаждали двукратным объемом ацетонитрила, охлажденного до 4 °С, и центрифугировали при 16 000 g. Осадок перерастворяли в 100 мкл 0.1 М аммонийбикарбонатного буфера (NH4HCO3).
При исследовании образования аддуктов альбумина крысы в сыворотке крови к 1 мл сыворотки крови добавляли параоксон in vitro до конечной концентрации 0.1 мг/мл и инкубировали 1 ч при 37 °С. Белки осаждали двукратным объемом ацетонитрила и перерастворяли в 100 мкл 0.1 М ам-монийбикарбонатном буфере.
В токсикологическом эксперименте in vivo использовали крыс-самцов весом 250–300 г. Животные были экспонированы параоксоном подкожно дозой на уровне 1/5 ЛД 50 (80 мкг на животное). Образцы сыворотки были получены через 1 сутки после отравления.
Аффинная хроматография
В экспериментах по выделению сывороточного альбумина из сывороток крови использовали спиновые колонки Aurum ( Serum protein mini kit, Affi-Gel Blue/Affi-Gel protein A , Bio-Rad). Колонки промывали 2 раза по 1 мл буфера для связывания (фосфатный буфер, pH 7.0), затем центрифугировали до высыхания сорбента. В микропробирке смешивали 60 мкл сыворотки и 180 мкл буфера для связывания. 200 мкл раствора сыворотки наносили на сорбент, колонку помещали в новую микропробирку, инкубировали в течение 15 мин на качающейся платформе, центрифугировали 15 с при 10 000 g. Чтобы избежать неспецифичной сорбции, сорбент трижды промывали 100 мкл буфера для связывания и затем центрифугировали 15 с при 10 000 g. Элюцию с колонки проводили 100 мкл 6 М мочевины, инкубировали в течение 10 мин на качающейся платформе, затем центрифугировали 15 с при 10 000 g. Элюцию проводили дважды, элюат отбирали для трипсинолиза в растворе или проведения гель-электрофореза в ПААГ.
Ферментативный гидролиз белков трипсином в растворе
К раствору белка в микропробирке добавляли 50 мкл 0.1 М аммонийбикарбонатного буфера, 50 мкл 10 мМ раствора ДТТ (дитиотриэтол, Sigma) в 0.1 М аммонийбикарбонатном буфере и инкубировали в течение 45 мин при температуре 56 °С с последующим охлаждением до комнатной температуры. Затем для разрушения S-S-цистиновых связей в белке добавляли 50 мкл 20 мМ раствора йодацетамида (Sigma), выдерживали 40 мин при комнатной температуре в темноте. После этого добавляли трипсин (0.1 мг/мл), помещали в термостат на 3 ч при 37 °С, после чего добавляли столько же трипсина и оставляли еще на 3 ч при 37 °С. Количество добавляемого трипсина рассчитывали по мольному отношению белок/фермент 50 : 1.
Металл-аффинная хроматография на сорбенте, содержащем ионы железа (III)
Классическая методика была немного модифицирована для повышения эффективности обогащения пробы фосфорсодержащими пептидами. В качестве колонок использовали фильтры с мембраной (размер пор 0.45 мкм, Millex-LH), наполненные 100 мкл раствора сорбента (Fe 3+ -содержа-щий гель, PHOS-Select Iron Affinity Gel , Sigma). Колонку промывали 100 мкл 0.1 % трифторуксусной кислоты (ТФУ) и центрифугировали 30 с при 5000 g. Процедуру повторяли трижды. Образец (15 мкл триптического гидролизата) растворяли в 35 мкл 0.1 % ТФУ и наносили на сорбент. Фильтр помещали в микропробирку и инкубировали в течение 15 мин на качающейся платформе, после чего путем центрифугирования (30 с при 3000 g) проскок удаляли с фильтра в микропробирку. Чтобы избежать неспецифичной сорбции, сорбент трижды промывали 100 мкл 0.1 % ТФУ и центрифугировали 30 с при 5000 g. Затем сорбент промывали 100 мкл воды. Для ступенчатого элюирования на фильтр, помещенный в новую микропробирку, наносили 30 мкл первого элюирующего раствора (0.1 М аммонийбикарбонатный буфер), смесь инкубировали в течение 5 мин на качающейся платформе, после чего центрифугировали 30 с при 5000 g. Процедуру элюирования повторяли дважды. Затем на фильтр наносили 30 мкл второго элюирующего раствора (400 мМ гидрооксид аммония) и смесь инкубировали в течение 5 мин на качающейся платформе, после чего центрифугировали 30 с при 5000 g. Процедуру элюирования повторяли дважды, элюат отбирали для анализа.
Гель-электрофорез в денатурирующих условиях [9]
Разделение белков проводили с помощью метода электрофореза в полиакриламидном геле в денатурирующих условиях в присутствии 0.1 % додецилсулфатa натрия. В работе использовали 10 % разделяющий полиакриламидный гель.
После электрофореза гель окрашивали Кумасси бриллиантовым голубым, избыток красителя смывали 5 % уксусной кислотой. Окрашенные полосы, принадлежащие альбумину, вырезали скальпелем, гель измельчали и подвергали триптическому гидролизу.
Масс-спектрометрический анализ
Использовали времяпролетный масс-спектрометр Axima Performance с источником MALDI, оснащенным УФ-лазером (337 нм), в режиме детектирования положительных ионов с использованием режима рефлектрона при следующих на- стройках ионного источника: напряжение — 20 кВ; напряжение на линзах (Lens) — 6.5 кВ; напряжения на рефлектроне (Ref) — 24.38 кВ. Ионы детектировали в диапазоне m/z от 700 до 4000. Масс-спектры регистрировали при помощи программы MALDI-MS Shimadzu Biotech (Shimadzu, Япония). В качестве внутреннего стандарта использовали пики альбумина крысы (m/z 1455.8066, 1465.7797, 1609.7896, 1768.8686, 1960.0498, 2286.1077). Обработку спектров, полученных при помощи масс-спектрометра MALDI-TOF Axima, проводили в программе MALDI-MS Shimadzu Biotech (Shimadzu, Япония).
Точная моноизотопная масса и форма изотопного распределения для пептидов с нестандартными модификациями рассчитывались при помощи программы MassPro (ИАП РАН).
Поиск в базе SwisProt осуществляли с помощью двух программных комплексов: MASCOT (Matrix Science, Великобритания) и MS-Fit (University of California, San Francisco, URL: prospector.ucsf.edu). При этом использовали следующие параметры поиска: точность определения массы — 50 ppm; возможные модификации — окисление метионина, при необходимости — фиксированная модифицикация остатков цистеина йодацетамидом.
Для (МС-МС)-анализа из спектра пептидной смеси выделяли пик нужного пептида с допуском 10 ppm по массе, записывали фрагментный масс-спектр выбранного пептида. Идентификацию белков проводили в программе MS-Tag (University of California, San Francisco, URL: prospector.ucsf.edu), при этом использовали следующие параметры поиска: точность определения массы родительского иона — 200 ppm; точность определения массы фрагментов — 1000 ppm; возможные модификации — обработка йодацетамидом, в случае фосфорилированных пептидов — фосфорилирование, в случае поиска аддуктов параоксона — изменение массы на 136.03 Да; а также соответствующая пробе таксономика (бык, человек или крыса). Данные (МС-МС)-анализа представляли с помощью программы Sequence Viewer 2.0 (ИАП РАН).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Известно, что фосфорорганические соединения способны образовывать ковалентные аддукты с сывороточным альбумином человека [10–13]. Такие соединения являются перспективными биомаркерами, которые позволят определять факт интоксикации ФОС в ретроспективном химикотоксикологическом анализе.
Myosin, porcine 200 kDa p-Galactosidase 116 kDa
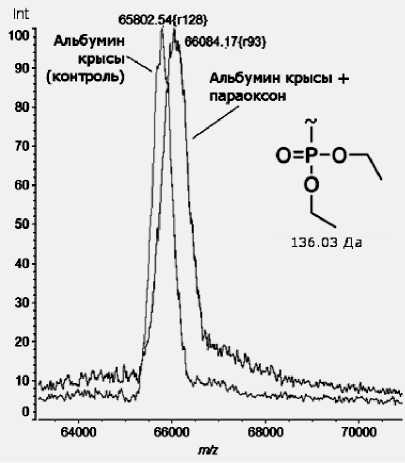
Рис. 1. Линейный масс-спектр сывороточного альбумина крысы, обработанного параоксоном in vitro (MALDI-TOF, режим linear)
Phosphorylase b 97 kDa
Albumin bovine 66 kDa

Ovalbumin 45 kDa

Белковый Сыворотка Альбумин Сыворотка маркер крысы после крысы крысы аффинной до аффинной хроматографии хроматографии
Рис. 2. Электрофореграмма сыворотки крови крысы после аффинной хроматографии, цельной сыворотки крови крысы и коммерческого препарата альбумина крысы
Для разработки методики, позволяющей обогащать образцы пептидами, модифицированными остатками ФОС, в качестве модельных объектов были выбраны параоксон и сывороточный альбумин крысы.
При сравнении линейных масс-спектров модифицированного и немодифицированного in vitro сывороточного альбумина крысы наблюдается смещение сигнала, принадлежащего модифицированному альбумину крысы, в область высоких масс примерно на 300 Да (рис. 1), что дает возможность предположить наличие двух модификаций на молекулу (масса остатка параоксона составляет 136.03 Да).
Несмотря на то что сывороточный альбумин является мажорным компонентом сыворотки и плазмы крови, сигналы других белков затрудняют анализ триптических пептидов альбумина, поэтому в рамках этой работы были рассмотрены различные способы выделения альбумина из сыворотки для дальнейшего анализа очищенного препарата.
Гель-электрофорез белка в денатурирующих условиях позволяет выделить белок из смеси. Однако такой метод имеет свои ограничения. Во-первых, количество белка, нанесенного для анализа, ограничено емкостью геля; во-вторых, триптический гидролиз в геле с последующей экстракци- ей пептидов обычно проходит с большими потерями (30–50 %). Кроме того, пробоподготовка включает в себя стадию инкубирования белка в буфере, содержащем денатурирующие агенты, при температуре 95 °С в течение 0.5–5 мин, что может привести к потерям модификаций.
Тем не менее был проведен эксперимент, в котором альбумин, выделенный из сыворотки, обработанной параоксоном in vitro, анализировали при помощи гель-электрофореза с проведением триптического гидролиза в геле и последующим масс-спектрометрическим анализом. Сигналы модифицированных пептидов обнаруживаются (данные не представлены), и при необходимости данная методика может быть использована в исследовательских экспериментах. При низком содержании модифицированного белка по сравнению с немоди-фицированным проблема выявления пептидов с модификациями остается.
Для выделения сывороточного альбумина из сыворотки крови можно также использовать метод аффинной хроматографии с использованием триазиновых красителей как сорбента, который позволяет достаточно специфично выделять альбумин из сыворотки крови за одну стадию [14].
При исследовании возможности модификации сывороточного альбумина крысы в сыворотке ключевой стадией эксперимента стала отработка методики выделения сывороточного альбумина из сыворотки крови. Для выделения использовали спиновые колонки Aurum (Bio-Rad, США) с сорбентом на основе триазинового красителя цибак-роновым синим Cibacron Blue . В качестве контроля чистоты выделения белка был использован метод гель-электрофореза в денатурирующих условиях (рис. 2).
Int
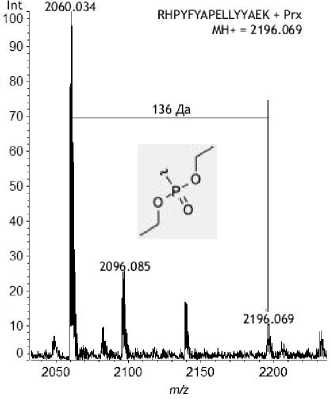
2060.034
YTQKAPQVSTPTLVEAAR * Prx MH + = 2096.085
а
1948.928
1960.058
136 Да
\ .0
A
2096.085
2000 2050
б
Int
1609.799
YTQKAPQV5TPTLVEAAR * Prx
МН-1960.050 * 136.028
1455.891
1768.873
1714.805
1948.928
2060.034
: 096.085
RHPYFYAPELLYYAEK * Prx
MH-2060.034 * 136.028
2286.109
Рис. 3. Масс-спектр сывороточного альбумина крысы, обработанного параоксоном in vitro , после металл-
аффинной
хромато-
графии на сорбенте, содержащем ионы Fe 3+ .
а
область масс
1940–2120 Да; б — об-
ласть
масс
2040–
йж^Мш
мЬ**^^*»*
1200 1300 1400 1500 1600 1700 1800 1900 2000 2100 2200 2300 2400
2250 Да (MALDI-TOF, режим reflectron)
На сегодняшний день не существует методики, которая позволяла бы выделить из сложных биологических образцов пептиды, модифицированные остатками ФОС, но существуют сорбенты для обогащения фосфорилированных пептидов, и общепризнанным методом выделения фосфорилированных пептидов является металл-аффинная хроматография [15]. Нами было сделано предположение, что с помощью металл-аффинной хроматографии также могут быть выделены и пептиды, модифицированные остатками ФОС.
Далее был проведен триптический гидролиз с последующей металл-аффинной хроматографией с использованием сорбента, содержащего Fe3+. Полученный элюат концентрировали с помощью вакуумного испарителя, после чего проводили масс-спектрометрический анализ (рис. 3). В масс-спектре было обнаружено 2 сигнала с МН+ 2096.085 Да и МН+ 2196.069 Да, которые могут принадлежать пептидам альбумина, модифициро- ванным параоксоном. Для обоих пептидов был проведен (МС-МС)-анализ, который показал, что присоединение остатка параоксона произошло по Y-411 в пептиде YTQKAPQVSTPTLVEAAR и по Y-150 в пептиде RHPYFYAPELLYYAEK соответственно (рис. 4).
Элюат после проведения аффинной хроматографии подвергали триптическому гидролизу с последующей металл-аффинной хроматографией и масс-спектрометрическим анализом. Как и в случае сыворотки человека, в масс-спектре был обнаружен только один сигнал, принадлежащий пептиду альбумина, модифицированного по Y-150. Соответственно при поиске пептидов, модифицированных остатками ФОС, более перспективным представляется использование метода металл-аффинной хроматографии.
На основании проведенного исследования предложена методика, включающая следующие стадии:

0 SOO 1000 1500 2000
Mroi/Clwrye
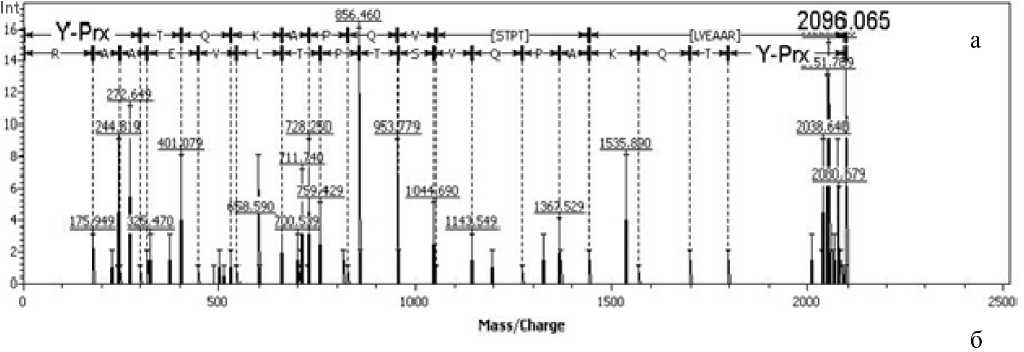
Рис. 4. (МС-МС)-спектры.
а — спектр пептида Y Prx TQKAPQVSTPTLVEAAR с МН + 2096.06 Да, принадлежащего сывороточному альбумину крысы и модифицированного параоксоном по тирозину-411; б — спектр пептида RHPYFY Prx APELLYYAEK с МН + 2196.07 Да, принадлежащего сывороточному альбумину крысы и модифицированного параоксоном по тирозину-150 (MALDI-TOF-TOF)
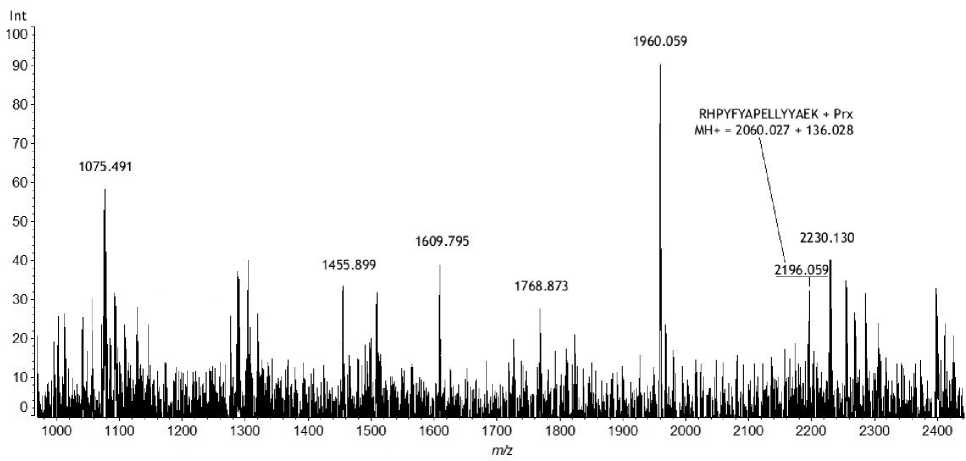
Рис. 5. Масс-спектр сыворотки крови крысы, экспонированной параоксоном in vivo , после аффинной хроматографии, трипсинолиза и металл-аффинной хроматографии на сорбенте, содержащем ионы Fe 3+ (MALDI-TOF, режим reflectron)
-
1. Выделение альбумина из сыворотки крови методом аффинной хроматографии на сорбентах, содержащих цибакроновый синий. При необходимости контроль чистоты выделенного альбумина осуществляется посредством гель-электрофореза в полиакриламидном геле.
-
2. Триптический гидролиз белка. При необходимости контроль прохождения гидролиза осуществляется при помощи МС-анализа гидролизата; также можно проводить предварительный поиск модифицированных пептидов.
-
3. Обогащение образца фосфорсодержащими пептидами с использованием металл-аффинной хроматографии на сорбентах, содержащих Fe 3+ .
-
4. МС-анализ пептидов после металл-аф-финной хроматографии. При необходимости — идентификация модифицированных пептидов (МС-МС-анализ).
Предложенная методика была применена при исследовании модификации сывороточного альбумина крысы в сыворотке, полученной от крыс, подвергшихся воздействию параоксона in vivo .
Сыворотку обрабатывали по описанной выше методике, а именно были проведены стадии аффинной хроматографии, трипсинолиза, металл-аффинной хроматографии и масс-спектрометрического анализа. На рис. 5 представлен масс-спектр элюата, полученного после проведения металл-аффинной хроматографии. Как и в случае эксперимента, проведенного in vitro, в масс-спектре обнаружен только пептид с МН+ 2196.059 Да. Тем не менее проведенный эксперимент показал, что разработанная методика позволяет обнаруживать пептиды, модифицированные остатком ФОС, в случае несмертельных отравлений.
Подобный подход в виде последовательных хроматографических обогащений фосфонилиро-ванных пептидов может быть использован для анализа и других белков крови, например бути-рилхолинэстеразы. Этот фермент может быть одностадийно выделен из сыворотки крови на аффинном сорбенте прокаинамид-сефарозе [16]. Фосфонилированный пептид активного центра бу-тирилхолинэстеразы также может быть обогащен методом металл-аффинной хроматографии.
ЗАКЛЮЧЕНИЕ
Таким образом, нами была разработана методика определения аддуктов фосфорорганических соединений (параоксон) с сывороточным альбумином крысы. Предложенная методика достаточно универсальна, поскольку на стадии выделения белка может быть использован аффинный сорбент для любого интересующего белка, а в качестве объекта исследования может быть использована не только сыворотка крови, но и цитоплазматический или ядерный лизат, лимфа и т. д.
С использованием данной методики впервые были обнаружены и идентифицированы триптические пептиды сывороточного альбумина крысы, модифицированные остатком параоксона по
Y-150 и Y-411. Разработанная методика была успешно опробована на образцах сыворотки крови крыс, подвергшихся воздействию параоксона in vivo , обнаружена модифицикация остатком параоксона по Y-150.


