ИК-спектроскопическое изучение растворов поверхностно-активных веществ в перхлорэтилене
Автор: Агеев Андрей Андреевич, Гуднин Николай Юрьевич, Лаврентьева Елена Юрьевна
Журнал: Вестник Ассоциации вузов туризма и сервиса @vestnik-rguts
Рубрика: Материаловедение изделий сервиса
Статья в выпуске: 4 т.4, 2010 года.
Бесплатный доступ
В работе предлагается метод ИК-спектрофотометрического изучения строения растворов поверх- ностно-активных веществ в перхлорэтилене. Растворитель выбран как наиболее часто используемый в технологии химической чистки. Изучены растворы Катамина АБ, Оксифоса Б и Неонола АФ-9-10 при Т = 293К и различных концентрациях ПАВ до критической концентрации мицеллообразования и после нее. Спектры сняты на приборе «SpectraLum - ФТ-02» с использованием жидкостной кюветы из KBr толщиной 0,1 мм.
Поверхностно-активные вещества, структура неводных растворов, спектроскопия, мицеллообразование
Короткий адрес: https://sciup.org/140209108
IDR: 140209108 | УДК: 541.18
Текст научной статьи ИК-спектроскопическое изучение растворов поверхностно-активных веществ в перхлорэтилене
Создание новых материалов с применением технологий молекулярного наслаивания требует контроля за образованием наноструктурных поверхностных слоев [1]. Однако непосредственное изучение свойств слоя веще- ства максимальной толщиной в несколько десятков нанометров — достаточно сложная экспериментальная задача. При адсорбции из растворов поверхностная фаза равновесна с объемной, поэтому удобнее в первую очередь
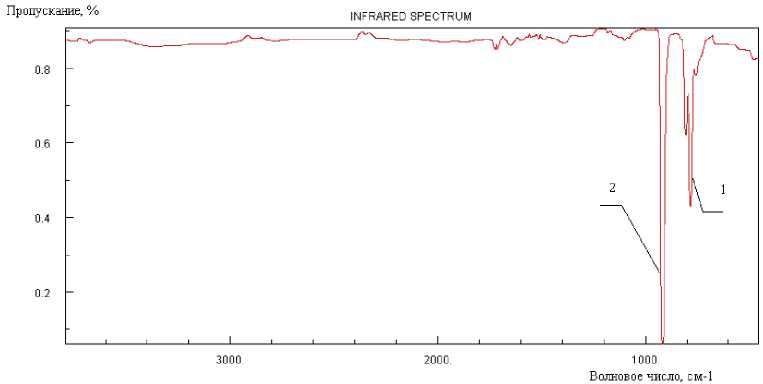
Рис. 1. Характерные пики поглощения ПХЭ, в области от 700 до 950 см-1, Т = 293К: 1 – Характеристическая частота поглощения ПХЭ – 778 см-1, CCl2.
2 – Характеристическая частота поглощения ПХЭ – 910 см-1, С = С.
изучить состояние распределяемого компонента в объеме раствора. К сожалению, структура неводных растворов поверхностно-активных веществ (ПАВ) исследована значительно меньше, чем структура водных.
В качестве отправной гипотезы была принята модель гармонического осциллятора, амплитуда колебаний которого определяется количеством поглощенной энергии излучения [2].
Конденсированное состояние вещества, в особенности жидкое, обусловлено в основном межмолекулярным взаимодействием. Силы Ван-дер-Ваальса, образующие структуру растворов, на порядок слабее ковалентных химических сил. Поэтому изучение взаимо- действия длинноволнового теплового излучения с веществом наиболее информативно для определения структурных изменений.
Характерными частотами поглощения теплового излучения для перхлорэтилена (ПХЭ) являются частоты от 700 до 950 см-1, проявляющиеся в виде двух ярко выраженных пиков поглощения 778 и 910 см-1 (рис. 1), которые соответствуют валентным колебаниям -ССl2- и -С=С- [3].
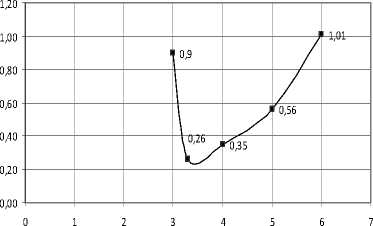
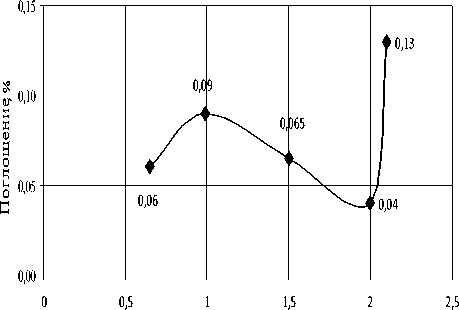
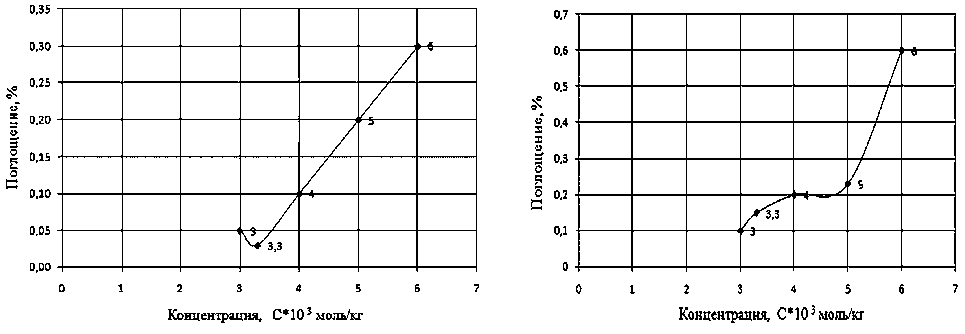
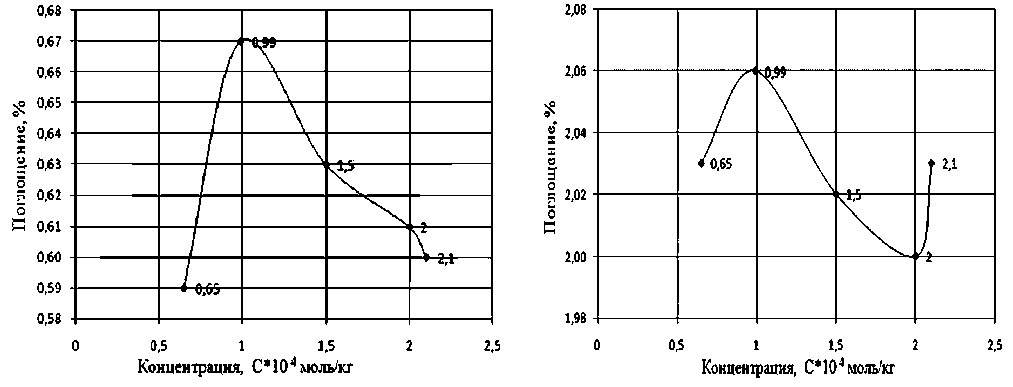
При увеличении концентрации ПАВ (Ка-тамина АБ, Оксифоса Б, Неонола АФ-9-10) характер этих пиков до ККМ изменяется незначительно, интенсивность пиков уменьшается, что свидетельствует об упрочнении структуры растворителя (рис. 2–7).
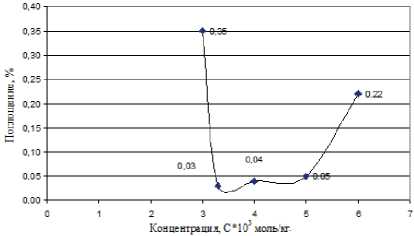
Рис. 2. Изменение поглощения ПХЭ на частоте 778 см-1 при различных концентрациях Неонола АФ 9–10, при Т = 293 К. ККМ = 4*10–3 моль/кг
Концентрация, С * 10 3 моль/ кг.
Рис. 3. Изменение поглощения ПХЭ на частоте 910 см-1 при различных концентрациях Неонола АФ 9–10, при Т=293 К. ККМ = 4*10–3 моль/кг
Концентрация, С * 10 4 моль/ кг.
Рис. 4. Изменение поглощения ПХЭ на частоте 778 см-1 при различных концентрациях Катамина АБ, при Т = 293 К. ККМ = 1,5*10–4 моль/кг
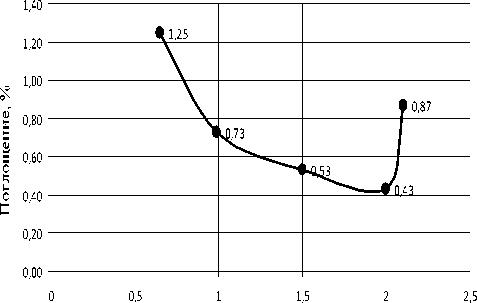
Концентрация, С * 10 4 моль/ кг.
Рис. 5. Изменение поглощения ПХЭ на частоте 910 см-1 при различных концентрациях Катамина АБ, при Т = 293 К. ККМ = 1,5*10–4 моль/кг
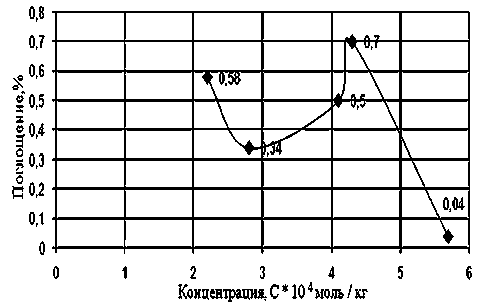
Рис. 6. Изменение поглощения ПХЭ на частоте 778 см-1 при различных концентрациях Оксифоса Б, при Т = 293 К. ККМ = 4,1*10–4 моль/кг
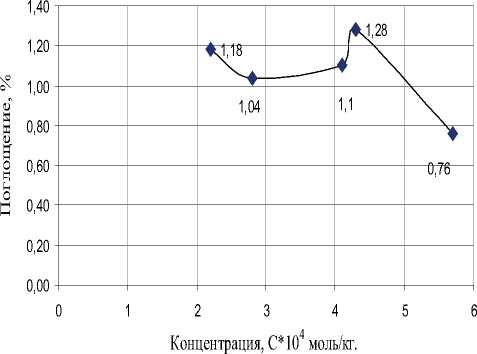
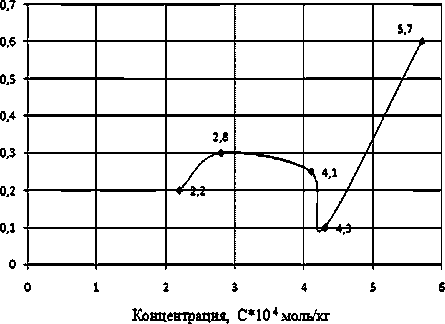
Рис. 7. Изменение поглощения ПХЭ на частоте 910 см-1 при различных концентрациях Оксифоса Б, при Т = 293 К. ККМ = 4,1*10–4 моль/кг
Наиболее вероятная причина этого — сольватация молекул ПАВ [4]. При приближении к точке ККМ характер спектров скачкообразно изменяется.
После точки ККМ интенсивность поглощения в растворах Неонола АФ-9–10 и Ката-мина АБ увеличивается, что указывает на разрыхление структуры растворителя (рис. 2–5). Наиболее вероятное объяснение этому — происходит десольватация молекул ПАВ при ми-целлообразовании [4]. Растворитель при ассоциации молекул ПАВ в мицеллы «выдавливается» из сольватных оболочек отдельных молекул.
Молекула Оксифоса Б в отличие от других ПАВ обладает двумя гидрофобными углеводо- родными радикалами, взаимовлияние которых усиливает межмолекулярные связи с молекулами сольватных оболочек. В результате десольватации при образовании мицелл Оксифоса Б не происходит. Поэтому при концентрациях выше ККМ в растворах Оксифоса Б интенсивность пиков поглощения ПХЭ на обеих характеристических частот падает (рис. 6, 7).
Для растворов Оксифоса Б в ПХЭ характерно проявление следующих колебаний [3, 5]: 1) 620 см-1 — деформационные — СН;
-
2) 910 см-1– неплоские деформационные — СН;
-
3) 1100 см-1 — скелетные валентные колебания;
-
4) 1240–1290 см-1 — валентные Р-О-С;
-
5) 1420–1470 см-1 — ассиметричные деформационные -СН3;
-
6) 2982–3060 см-1– ассиметричные валентные
-СН3.
Для всех частот с увеличением концентрации Оксифоса Б наблюдается закономерное увеличение поглощения согласно закону Бугера — Ламберта — Бера [2] (рис. 8). При приближении к точке ККМ зависимость претерпевает излом, сопровождающийся уменьшением поглощения. Предассоциаты ПАВ представляют собой жесткую структуру, менее склонную к поглощению энергии, чем сольватированные, но отдельные молекулы в растворе. При дальнейшем увеличении концентрации ПАВ выше
ККМ поглощение закономерно растет с увеличением числа мицелл.
При изучении растворов Неонола АФ-9–10 в перхлорэтилене были выявлены характерные пики поглощения для колебаний на следующих частотах [3, 5]:
-
1) 1190–1158 см-1 — скелетные валентные;
-
2) 1375–1385 и 1390–1406 см-1 — СН3 деформационные симметричные;
-
3) 2850 см-1 — СН2 валентные;
-
4) 2860–2880 см-1 — СН2 валентные симметричные.
Для всех видов колебаний при приближении к точке ККМ (4*10–3 моль/кг) наблюдается излом кривой поглощения (рис. 9).
|
5,7 |
|||||
|
2,8 |
|||||
|
4,1 / |
|||||
|
V 4,3 |
|||||
0 1 2 3 4 5 5
Концентрация, С* 10 4 моль/кг
а) б)
Рис. 8. Изменение поглощения характеристических групп Оксифоса Б при различных концентрациях в ПХЭ, при Т = 293 К. ККМ = 4,1*10-4 моль/кг:
а – изменение поглощения деформационных колебаний на частоте 620 см-1 группы СН;
б – изменение поглощения деформационных колебаний на частоте 2920–2930 см-1 группы СН3
а) б)
Рис. 9. Изменение поглощения характеристических групп Неонола А-Ф-9-10 при различных концентрациях растворов в ПХЭ, при Т = 293 К. ККМ = 4*10-3 моль/кг:
а – изменение поглощения скелетных валентных колебаний на частоте 1190—1158 см-1;
б – изменение поглощения деформационных симметричных колебаний группы СН3 на частоте 1375–1385 см-
а) б)
Рис. 10. Изменение поглощения характеристических групп Катамина АБ при различных концентрациях в ПХЭ, при Т = 293 К. ККМ = 1,5*10–4 моль/кг:
а – изменение поглощения деформационных колебаний СН группы на частоте 740–760 см-1;
б – изменение поглощения симметричных колебаний кольца на частоте 1125 см-1
Начало ассоциации сопровождается уменьшением поглощения молекулами ПАВ. После завершения ассоциации, поглощение закономерно увеличивается с увеличением числа мицелл.
При изучении раствора катамина АБ в пер-хлорэтилене были выявлены характерные пики поглощения, соответствующие функциональным группам катамина АБ [3, 5], а именно:
-
1) 670 см-1 — СН валентные;
-
2) 1590–1610 см-1— колебания кольца;
-
3) 740–760 см -1 — СН деформационные;
-
4) 1105–1116 см-1 — скелетные валентные;
-
5) 1375–138 см-1 — СН3симметричные деформационные;
-
6) 1125 см-1 — ассиметричные колебания кольца.
Для всех типов колебаний у Катамина АБ в молекулярной форме (до ККМ = 1,9*10–4 моль/кг) растет поглощение с увеличением концентрации ПАВ. При начале ассоциации поглощение уменьшается, за счет формирования мицеллярных структур (рис. 10).
Выводы
-
1. Структура растворителя до точки ККМ упрочняется молекулами ПАВ в результате сольватации.
-
2. В точке ККМ структура бинарного раствора меняется скачкообразно.
-
3. Образование мицелл приводит к «выдавливанию» растворителя из ближайшего окружения молекул ПАВ. Структура растворителя разрыхляется за счет увеличения числа мицелл, менее сольватированных, чем молекулы ПАВ. В случае Оксифоса Б, молекула которого имеет два гидрофобных радикала, мицеллообразование не сопровождается десольватацией молекул ПАВ.
-
4. Предассоциаты мицелл ПАВ представляют собой более жесткую структуру, чем отдельные молекулы ПАВ в растворах.
-
5. После точки ККМ строение молекулярного раствора остается постоянным, но растет число мицелл, результатом которого становится закономерное увеличение поглощения.
Список литературы ИК-спектроскопическое изучение растворов поверхностно-активных веществ в перхлорэтилене
- Агеев А. А., Волков В. А. Исследование мицеллообразования в неполярных растворителях. Коллоидный журнал. 2007. Т. 48. № 4. С. 952-956.
- Герцберг Г. Спектры и строение двухатомных молекул. М., 1949.
- Дункан В., Гордии Норманн Джонс. Применение спектроскопии в химии. М., 1959.
- Rosen M. J., Goldsmith H. A., Systematic Analysis of Surface-Active Agents, 2nd ed., Wiley-Interscience, New York, 1972.
- Hummel D. O., Identification and Analysis of Surface-Active Agents, Wiley-Interscience, New York, 1962.


