Иммунный статус и спектр цитокинов как прогностические признаки риска тяжелого течения заболевания и эффективности интенсивной терапии пациентов с коронавирусной инфекцией COVID-19
Автор: Садыков Валентин Фидаильевич, Полтавцева Римма Алексеевна, Чаплыгина Алина Вадимовна, Бобкова Наталья Викторовна
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Оценка риска в организации здравоохранения
Статья в выпуске: 4 (40), 2022 года.
Бесплатный доступ
Пандемия, вызванная новым штаммом коронавируса SARS-CoV-2 охватила весь мир, однако эффективных способов лечения этой тяжелейшей патологии до сих пор не создано. В настоящее время установлено, что риском тяжелого течения COVID-19 является не столько сам возраст пациента, сколько так называемые возрастные заболевания, в развитии которых прямо или опосредованно задействована ренин-ангиотензиновая система РАС. Вирус SARS-CoV-19 взаимодействует с одним из основных регуляторных элементов этой системы ACE2 и нарушает баланс двух ветвей РАС, что в итоге проявляется в росте уровня ангиотензина II, который через связывание с ангиотензиновым рецептором 1-го типа (AT1R) вызывает целый ряд патологических состояний, включая гипертонию, атеросклероз, сердечно-сосудистые заболевания, усиливает пролиферацию клеток, апоптоз, гибель эндотелиальных клеток сосудов и т.д., что нашло отражение во многих обзорах российских и зарубежных авторов. Однако другой, менее описанной, но не менее важной, мишенью действия ангиотензина II являются клетки врожденного и адаптивного иммунитета. Последствия этого взаимодействия подробно проанализированы в данном обзоре. При COVID-19 активируются дендритные клетки, увеличивается пролиферация макрофагов и инфильтрация нейтрофилов с дальнейшим включением в этот процесс CD4-лимфоцитов и других клеточных элементов системы адаптивного иммунитета. Гиперактивация иммунной системы сопровождается выбросом большого количества провоспалительных цитокинов, что и может привести к реализации цитокинового шторма. Картину усугубляет тормозное действие самого вируса на синтез сигнальных интерферонов на начальных этапах его интернализации в клетку. Отдельный раздел обзора посвящен проблеме прогнозирования риска развития тяжелого состояния и поиску его предикторов, используя анализ состояния РАС и соотношения клеточных элементов иммунной системы, что чрезвычайно важно для принятия решений об объеме необходимой медицинской помощи и стратегиях последующего лечения.
Covid-19, sars-cov-2, цитокиновый профиль, цитокиновый шторм, иммунные клетки, иммунодисрегуляция, фактор прогнозирования, иммунный статус, ренин-ангиотензиновая система (рас)
Короткий адрес: https://sciup.org/142236536
IDR: 142236536 | УДК: 615 | DOI: 10.21668/health.risk/2022.4.14
Текст обзорной статьи Иммунный статус и спектр цитокинов как прогностические признаки риска тяжелого течения заболевания и эффективности интенсивной терапии пациентов с коронавирусной инфекцией COVID-19
Садыков Валентин Фидаильевич – анестезиолог-реаниматолог (e-mail: ; тел.: 8 (910) 468-63-98; ORCID: .
Полтавцева Римма Алексеевна – кандидат биологических наук, ведущий научный сотрудник (e-mail: ; тел.: 8 (916) 549-01-68; ORCID: .
Чаплыгина Алина Вадимовна – младший научный сотрудник лаборатории клеточных механизмов патологии памяти (e-mail: ; тел.: 8 (925) 927-63-14; ORCID: .
Бобкова Наталья Викторовна – кандидат биологических наук, заведующий лабораторией клеточных механизмов патологии памяти (e-mail: ; тел.: 8 (903) 184-52-77; ORCID: .
является важным звеном в функционировании ре-нин-ангиотензиновой системы (РАС), которой принадлежит центральная роль в поддержании гомеостаза в организме путем регуляции взаимодействия сердечно-сосудистой, дыхательной, системы водносолевого и углеводного обменов и регуляции кровяного давления [5]. SARS-CoV-2, взаимодействуя с АСЕ2-рецептором, вносит существенный дисбаланс в функционирование этой жизненно важной системы. При этом необходимо учитывать и тот факт, что вирус, проникая в клетки, не только начинает активно размножаться, но и влияет на ответную реакцию клетки на свое вторжение. К настоящему времени уже опубликовано достаточно много обзоров в России и за рубежом, освещающих эти две стороны действия вируса на организм хозяина, однако практически отсутствует анализ тесной взаимосвязи этих двух систем. Поэтому целью данного обзора явился анализ последствий нарушений РАС, вызванных SARS-CoV-2, на состояние элементов врожденного и адаптивного иммунитета, а также оценка возможности прогноза течения заболевания с учетом их изменений.
Физиология РАС и ее связь с иммунной системой организма. В норме РАС обеспечивает поддержание гомеостаза путем регуляции взаимодействия сердечно-сосудистой, дыхательной, системы водно-солевого и углеводного обменов и регуляции кровяного давления [5].
Классическая РАС состоит из двух ветвей, первая из которых включает ангиотензин / ренин / ангиотензин I / ангиотензин-конвертирующий энзим (АСЕ) / ангиотензин II (ANG II) и его рецепторы AT1R и AT2R. Взаимодействие ANG II с AT1R сопровождается повышением кровяного давления, констрикцией сосудов, повышением активности ADAM17 [6], что приводит к появлению циркулирующей формы TNF- α с последующей индукцией провоспалительных цитокинов, усилению пролиферации, инфильтрации и апоптозу [5, 7]. В настоящее время уже установлено, что риском тяжелого течения COVID-19 является не столько сам возраст пациента, сколько так называемые возрастные заболевания, в развитии которых прямо или опосредованно задействована активация 1-й ветви и высокий уровень ANG II [8].
Вторая ветвь РАС открыта относительно недавно и включает ACE2/ANG 1–7/рецептор Mas (Mas R) [9]. Ее функция направлена на подавление гиперактивации 1-й ветви. ANG- (1–7) через взаимодействие с Mas-рецептором вызывает торможение NF-κB-сигнального пути и, как следствие, оказывает противовоспалительное и антиапоптозное действие [10], а также активирует врожденный иммунитет. АСЕ2 является связующим элементом этих двух ветвей РАС и является ключевым ферментом, превращающим ANG II (1-8) – лиганд AT1R в ANG (1–7) с последующей активацией MasR [11]. По-видимому, вирус, вызывая снижение плотности
ACE2-рецепторов, приводит к дисбалансу активности двух ветвей РАС со снижением содержания ANG 1–7 и повышением активности ANG II со всеми вытекающими негативными последствиями, что и лежит в основе более тяжелого течения болезни у людей пожилого возраста с сопутствующими патологиями, для которых характерен исходно сниженный уровень экспрессии рецептора АСЕ2 [12]. Закономерно, что повышение соотношения уровней ACE/ACE2 является предиктором развития острого респираторного дистресс-синдрома, который можно предотвратить применением ANG 1–7 [13]. Однако широкое внедрение ANG 1–7 в клиническую практику ограничено его быстрым разрушением в организме и, возможно, сложностью его доставки в ткань легких и мозга при внутривенном введении. Недавно появились данные, что MasR может активироваться не только ANG 1–7, но и нейропептидом FF, аламан-дином, ангиотензинами III и IV, а также ангиопротек-тином и другими агонистами MasR, разработка которых представляет перспективное направление терапии COVID-19. В настоящее время на разных стадиях клинических испытаний находится более семи соединений, активирующих или усиливающих экспрессию MasR, а также агонистов этого вида рецепторов [14–19]. Из обзора литературы следует, что для лечения COVID-19 и других вирусных инфекций, возбудители которых используют ACE2, для коррекции нарушений РАС предпочтение следует отдавать стойким аналогам ANG 1–7, активирующим MasR.
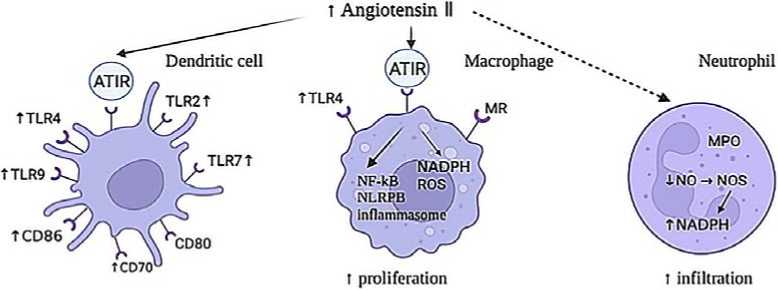
AT1R локализуется на мембранах многих клеток. Не составляют исключение и клетки, входящие в систему врожденного и адаптивного иммунитетов. На рис. 1 и 2 схематически представлены события, разворачивающиеся при COVID-19 на фоне повышенного уровня ангиотензина II.
В системе врожденного иммунитета наблюдается не только активация дендритных клеток, пролиферация макрофагов и инфильтрация нейтрофилов, но и усиление синтеза провоспалительных цитокинов на фоне повышения чувствительности мембранных Toll-like-рецепторов 2, 4, 7-го и 9-го подтипов, ответственных за узнавание микробных и вирусных патогенов. Сходные события происходят и с клетками адаптивной иммунной системы (см. рис. 2). Лимфоциты T4-helpers через выделение многочисленных провоспалительных цитокинов дополнительно активируют элементы этой системы, что происходит на фоне ослабления тормозного влияния со стороны Т-регуляторных клеток и снижения количества выделяемого противовоспалительного цитокина 10.
Установлено, что вирус SARS-CoV-2 может проникать в мозг и взаимодействовать с АСЕ2-рецеп-торами, локализованными на мембранах астроцитов и микроглии [20], где расположены также и многочисленные рецепторы AT1R и TLRs [21]. На рис. 3 схематично представлены последствия взаимодействия вируса с АСЕ2 и TLR на фоне повышенного
Innate immunity

Chemokines MCP- VCCR2 MCP-2/CCL8
Cytokines
Components of the RAS ACE
Renin secretion
TNFa
IL-10, IL-6, IL-12, IL-15, IL-17, IL-22
Рис. 1. Схема событий при COVID-19: избыток ангиотензина II действует на клетки врожденного иммунитета через рецепторы ATIR и TLR; повышается активность дендритных клеток, увеличивается пролиферация макрофагов и выработка АФК и NF-kB; нейтрофилы, хоть и не имеют прямого рецептора для взаимодействия, приобретают способность к инфильтрации и увеличивают производство NADPH
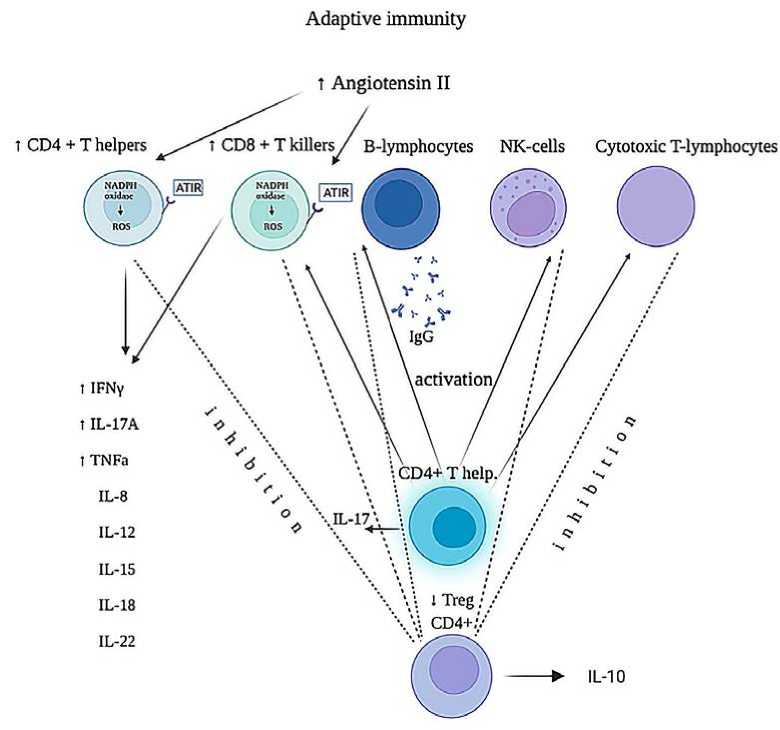
Рис. 2. Схема событий при COVID-19 с клетками адаптивной иммунной системы:
избыток ангиотензина II активирует CD4-лимфоциты, которые запускают дальнейший каскад реакций; при этом снижается количество регуляторных Т-клеток, осуществляющих тормозное влияние, в результате чего все клетки становятся гиперактивными, и запускается реакция цитокинового шторма
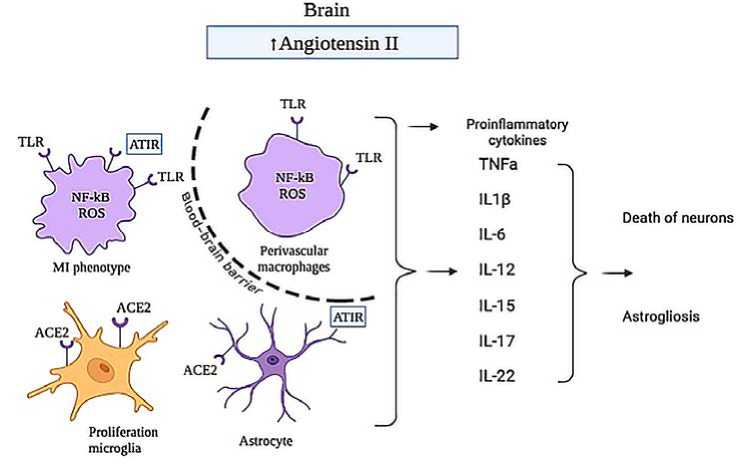
Рис. 3. Схема последствия воздействия вируса COVID-19: накопление ангиотензина II в мозге при блокаде ACE2-рецептора вирусом SARS-CoV-2 действует на рецепторы AT1R и TLR, что приводит к активации провоспалительного пути, выработке активных форм кислорода, синтезу многочисленных провоспалительных цитокинов и гибели нейронов на фоне астроглиоза
уровня ангиотензина II в мозге. Микроглия приобретает провоспалительный фенотип, соответствующий нейровоспалению, увеличивается проницаемость ГЭБ, происходит гибель нейронов и астроглиоз. Макрофаги в сосудистом русле активируются и через выделение активных форм кислорода и провоспалительных цитокинов, что повышает проницаемость ГЭБ и ведет к гибели нейронов, что впоследствии проявляется в виде разнообразных неврологических осложнений после выздоровления.
Важно отметить, что при использовании растворимого внемембранного sACE 2 в качестве лечебного средства для связывания вируса не наблюдалось значительного улучшения состояния у больных COVID-19, что, возможно, объясняется образованием иммунных комплексов «рекомбинантный sACE2+SARS-CoV-2», вызывающих у пациентов аутоиммунный ответ с образованием антител не только против вируса, но и против частей рецепторов ACE и ACE2 с последующим поражением всех органов и тканей, в которых экспрессируются эти рецепторы, с усугублением тяжести заболевания [22].
Механизм нарушения ответной реакции иммунной системы на заражение вирусом SARS-COV-2. На первый взгляд, взаимодействие SARS-CoV-2 мало отличается от такового для других вирусов: вначале связывается c эндосомальными Toll-like-рецепторами 3-го и 7-го типов и цитоплазматическими РНК-рецепторами, затем запускается каскад реакций врожденного иммунитета, происходит активация NF-κB- и IRF-путей, продукция интерферонов, интерлейкина-1 и -6, активируется адаптивный клеточный и, как следствие, гуморальный иммунитет. Однако SARS-CoV-2 запускает воспали- тельный каскад, не давая организму сформировать иммунный ответ, что сопровождается мощным выбросом провоспалительных цитокинов, усугубляет воспалительную реакцию и приводит к массивному повреждению различных тканей иммунными комплексами.
При более детальном анализе этого вопроса можно видеть, что коронавирус проявляет способность к активации синтеза альфа- и гамма-интерфе-ронов в клетке хозяина, а последние могут взаимодействовать с регуляторным сайтом, расположенным в промотере гена Ace2, что приводит к усилению синтеза АСЕ2, тем самым продлевая возможность дальнейшего распространения вируса в зараженном организме [23]. Поэтому перегрузка активированной вирусом интерфероновой системы стимуляторами иммунитета может привести к обратному эффекту – вызвать «цитокиновый шторм» и необходимость использования супрессоров иммунной системы [24], включая антитела к провоспали-тельным цитокинам или их рецепторам, таким как IL-6 и фактор некроза опухоли альфа (TNF-α) или их рецепторам. Предполагаемый механизм, приводящий к развитию «цитокинового шторма», заключается в поэтапном вовлечении ряда внутриклеточных сигнальных путей хозяина. Вошедшая в клетку вирусная РНК узнается эндосомальными РНК-рецепторами хозяина, TLR3 и TLR7, а также цитозольным сенсором РНК, RIG-I/MDA5, что вызывает активацию сигнального каскада NF-κB и IRF3 с транслокацией этих транскрипционных факторов в ядро и стимуляцией экспрессии интерферонов 1-го типа (альфа- и гамма-интерферонов) с последующим их выделением во внеклеточную среду. Интерфероны взаимодействуют с мембранными рецепторами IFNAR и активируют JAK-STAT-систему. Далее происходит фосфорилирование белков STAT1 и STAT2, которые благодаря комплексообразованию с IRF9 проникают в ядро, где стимулируют ряд генов (ISGs), на промоторе которых расположен элемент ISRE, регулирующий силу ответной реакции. Таким образом, коронавирус грубо вмешивается в формирование защитной реакции на этапе синтеза интерферонов и на этапе фосфорилирования СТАТ1. Первоначально задержанная стимуляция ISGs затем реализуется в гиперактивации экспрессии провоспа-лительных цитокинов [24]. Учитывая выраженную гиперреакцию иммунной системы пациентов, зараженных новой инфекцией COVID-19, можно полагать, что особую роль в определении раннего прогноза тяжести течения заболевания играет состояние иммунного статуса пациента.
Осложнения и предикторы тяжелого течения СOVID-19. Клиническая картина у больных новой коронавирусной инфекцией COVID-19 варьируется от легкой до тяжелой, при этом доля последней наряду с числом летальных случаев неуклонно растет по всему миру. В связи с этим возникает острая необходимость в надежных прогностических признаках тяжести течения данного заболевания [25]. На основании анализа обзоров по прогностическим факторам можно сделать вывод о наличии как минимум 49 переменных, представляющих ценную прогностическую информацию о смертности или тяжелом течении заболевания у пациентов с COVID-19. Выявленные переменные включают социально-демографические признаки, анамнестические данные о сопутствующих заболеваниях, результаты физикального осмотра, лабораторные и рентгенологические данные. Выбор наиболее информативных факторов уже на раннем этапе необходим для определения эффективной тактики лечения [26].
Наиболее ранними предикторами ухудшения состояния больных при COVID-19 являются повышенные значения IL-6, IL-10 и С-реактивного белка (CRP), а также снижение количества лимфоцитов [27]. Так, установлено, что при двусторонней пневмонии у 3–4 % пациентов отмечается развитие острого респираторного дистресс-синдрома (ОРДС), который у 3/4 таких больных сопровождается тромботической коагулопатией, в терминальных стадиях приводящей к тромбозам и «цитокиновому шторму», вызываемому системным выделением провоспалительных цитокинов: интерлейкинов IL-2, IL-6, IL-7, гранулоцит колоние-стимулирующего фактора, C-X-C motif хемокина 10 (CXCL10), хе-мокина (C-C motif) лиганда 2 (CCL2) и фактора некроза опухолей альфа (TNF- α ), при этом отмечается лейкопения, свидетельствующая о сниженном клеточном иммунитете [28].
В настоящее время уже не вызывает сомнения существование неразрывной внутренней связи между иммунитетом и секрецией цитокинов, высокие уровни которых на фоне низкого количества субпопуляций лимфоцитов были связаны с повышенным риском смерти от COVID-19. Была создана модель прогнозирования на основе IL-8 и количества CD4+ T-клеток и NK-клеток, показавшая хорошие результаты в прогнозировании смерти пациентов с COVID-19. При использовании порога 0,075 чувствительность и специфичность модели прогнозирования составляли 90,20 и 90,26 % соответственно. Среди всех переменных нейтрофилы, IL-6, CD3, -CD56, CD16-клетки и лейкоциты были четырьмя наиболее влиятельными факторами в тяжелых случаях, тогда как в легких случаях первыми пятью переменными были CD, CD56, CD16+ клетки, PD-1+ NK-клетки, NK-клетки, CD4+/CD8+и перфорин. Вместе с тем нейтрофилы внесли наибольший вклад в эту модель, что согласуется с более сильным воспалительным ответом у тяжелых пациентов с COVID-19. Кроме того, для определения хода развития болезни была продемонстрирована полезность измерения подмножеств NK-клеток на ранней стадии госпитализации [29]. Динамический мониторинг цитокинов и субпопуляций лимфоцитов дает потенциальную ценность для управления процессом болезни. Крупные метаанализы выявили отрицательную корреляцию между падением клеточного иммунитета и увеличением уровня провоспалительных цитокинов для прогнозирования перехода от легкой степени течения заболевания к тяжелой [28], при этом в периферической крови происходит значительное уменьшение лимфоцитов, моноцитов, CD4+T-клеток, CD8+ T-клеток, CD3-клеток, клеток CD19 и естественных киллеров (NK), а также увеличение интерлейкина-2 (IL-2), IL-2R, IL-4, IL-6, IL-8, IL-10, TNF-α и интер-ферона-гамма (INF-γ) [30]. Увеличение концентрации в крови плазмина и плазминогена также является биомаркером повышенной восприимчивости к SARS-CoV-2, поскольку протеаза плазмин может разрезать соответствующий сайт S-белка SARS-CoV-2, что повышает его вирулентность [31]. Мощным прогностическим фактором развития тяжелой формы COVID-19 является рост отношения нейтрофилов к лимфоцитам (NLR) и нейтрофилов к CD8 + Т-клеткам (N8R) [32].
Как уже указывалось, одним из ключевых признаков тяжелого течения заболевания при COVID-19 является патологическая гиперактивация иммунитета, где центральная роль отведена активации нейтрофилов. Протеомное профилирование плазмы поперечных и продольных когорт госпитализированных пациентов с COVID-19 выявило характерные признаки активации нейтрофилов, включая резистин, липокалин-2, фактор роста гепатоцитов, интерлейкин-8 и фактор, стимулирующий колонии гранулоцитов, которые были самыми сильными предикторами критического течения заболевания. Важным открытием стал факт, что сигнатура активации нейтрофилов была повышена уже в первый день госпитализации у тех пациентов, у которых впоследствии состояние ухудшилось до критического и требовало перевода в отделение интенсивной терапии. Исследователями было выдвинуто предположение, что высокие уровни G-CSF стимулируют экстренный гранулопоэз для увеличения продукции нейтрофилов, а IL-8 (CXCL8) управляет миграцией нейтрофилов в легкие и, возможно, другие ткани. Там нейтрофилы активируются и высвобождают RETN, LCN2, HGF, MMP8 и другие белки с антимикробными и другими воспалительными функциями, которые также вызывают значительные побочные повреждения легких, сосудистой сети и других органов [33]. Известно, что NK-клетки и Т-клетки играют жизненно важную роль в противовирусном иммунитете. Исследования больных с COVID-19 показали, что количество и частота CD4+Т-клеток, CD8+Т-клеток и NK T-клеток в тяжелых случаях были значительно ниже, чем в легких случаях. Значительно повышенные уровни экспрессии PD-1 и CD244 на CD8+Т-клетках указывают на истощение Т-клеток у пациентов с COVID-19 и на снижение экспрессии CD27 на CD8+Т-лимфоцитах в тяжелых случаях по сравнению с легким течением заболевания. Поэтому в качестве предиктора риска для выявления «тяжелых» пациентов эффективно использовать характеристики иммунных клеток и цитокинов.
Прогнозирование риска развития тяжелого состояния – чрезвычайно важная задача, поскольку может помочь в принятии решений об объеме необходимой медицинской помощи и стратегиях последующего лечения. Текущие исследования в этом направлении сосредоточены на ряде предикторов среди клинических и лабораторных данных (модели 4C Deterioration и 4C Mortality Score). Однако важно отметить, что ковариация между прогнозами 4C Deterioration и 4C Mortality не различалась по полу или этнической принадлежности, но ослаблялась у молодых возрастных групп [34]. Коллектив зарубежных ученых из Университета штата Аризона, Гарвардского университета и Национального центра биотехнологической информации (США) разработали математическую модель, позволяющую оценивать вероятность развития цитокинового шторма при COVID-19 в зависимости от интенсивности стимуляции выработки цитокинов иммунными клетками с использованием многочисленных параметров. К сожалению, о возможности развития острого респираторного дистресс-синдрома в ряде мест судят по более простым параметрам, таким как появление высокой температуры, уровню С-белка, снижению числа лимфоцитов, прогрессированию поражения легких, снижению сатурации. Данные исследований показывают, что в процессе оценки тяжести состояния и прогнозирования летального исхода должно учитываться влияние иммуногенетики пациента, а именно гендерных иммуногенетических различий. Так, в настоящее время уже доказано участие локуса AB0, генов HLA, регулирующих экспрессию последова- тельностей ДНК, кодирующих цитокины и хемокины [35]. Также было установлено, что пожилые люди мужского пола являются группой повышенного риска тяжелого течения заболевания, развития пневмонии с респираторным дистресс-синдромом и смерти. Возраст является ключевым фактором заболеваемости и смертности от COVID-19, поэтому понимание связанных с возрастом иммунных характеристик пациентов и состояния обеих ветвей РАС с анализом соотношения АСЕ/АСЕ2 важно для определения профилактических и терапевтических стратегий. Так, на основании исследования был выявлен ведущий характерный возрастной иммунный признак, связанный с тяжестью заболевания, а именно определены циркулирующие факторы – CXCL8, IL-10, IL-15, IL-27 и TNF-α – положительно коррелирующие с пожилым возрастом, более длительной госпитализацией и более тяжелой формой заболевания [36].
Выводы. Анализ многочисленных публикаций, посвященных различным нарушениям в функционировании РАС и иммунной системы при COVID-19, позволил прийти к заключению о существовании тесной взаимосвязи между этими системами. Связующим элементом является рецептор АСЕ2, играющий основную роль в интернализации вируса в клетку. Повышение уровня ангиотензина II в результате блокады АСЕ2-рецептора и взаимодействие с АТ1R-рецепторами, локализованными на ряде клеточных элементов врожденного и приобретенного иммунитетов, приводит к гиперактивации последних, что сопровождается синтезом и мощным выбросом во внеклеточное пространство большого количества разнообразных провоспали-тельных хемо- и цитокинов, что представляет угрозу развития цитокинового шторма. По-видимому, особенностью SARS-CoV-2 является его способность запускать воспалительный каскад до формирования защитного иммунного ответа из-за задержки синтеза интерферонов. Анализ литературы по предикторам тяжелого течения болезни позволил прийти к однозначному выводу, что величина соотношения уровней АСЕ/АСЕ2 и иммунный статус больного даже на начальных стадиях заболевания позволяют оценить риск тяжелого течения. Самое пристальное внимание следует уделять изменению состояния нейтрофилов. Таким образом, анализ представленных в обзоре материалов имеет значение не только для фундаментальной медицины, но и содержит данные для практической оценки прогноза течения заболевания и выбора оптимальной тактики лечения.
Финансирование. Работа выполнена при поддержке гранта РНФ (Проект № 18-15-00392).
Список литературы Иммунный статус и спектр цитокинов как прогностические признаки риска тяжелого течения заболевания и эффективности интенсивной терапии пациентов с коронавирусной инфекцией COVID-19
- The interacting physiology of COVID-19 and the renin-angiotensin-aldosterone system: Key agents for treatment / E.R. Lumbers, R. Head, G.R. Smith, S.J. Delforce, B. Jarrott, J.H. Martin, K.G. Pringle // Pharmacol. Res. Perspect. - 2022. -Vol. 10, № 1. - P. e00917. DOI: 10.1002/prp2.917
- Роль ренин-ангиотензин-альдостероновой системы во взаимодействии с коронавирусом SARS-CoV-2 и в развитии стратегий профилактики и лечения новой коронавирусной инфекции (COVID-19) / А.Я. Фисун, Д.В. Чер-кашин, В.В. Тыренко, К.В. Жданов, К.В. Козлов // Артериальная гипертензия. - 2020. - Т. 26, № 3. - С. 248-262. DOI: 10.18705/1607-419X-2020-26-3-248-262
- Qiu J. Covert coronavirus infections could be seeding new outbreaks // Nature. - 2020. DOI: 10.1038/D41586-020-00822-X
- A pneumonia outbreak associated with a new coronavirus of probable bat origin / P. Zhou, X.-L. Yang, X.-G. Wang, B. Hu, L. Zhang, W. Zhang, H.-R. Si, Y. Zhu [et al.] // Nature. - 2020. - Vol. 579, № 7798. - P. 270-273. DOI: 10.1038/S41586-020-2012-7
- Angiotensin-Converting Enzyme 2: SARS-CoV-2 Receptor and Regulator of the Renin-Angiotensin System: Celebrating the 20th Anniversary of the Discovery of ACE2 / M. Gheblawi, K. Wang, A. Viveiros, Q. Nguyen, J.-C. Zhong, A.J. Turner, M.K. Raizada, M.B. Grant, G.Y. Oudit // Circ. Res. - 2020. - Vol. 126, № 10. - P. 1456-1474. DOI: 10.1161/CIRCRESAHA.120.317015
- Reactive oxygen species and p38 mitogen-activated protein kinase mediate tumor necrosis factor a-converting enzyme (TACE/ADAM-17) activation in primary human monocytes / A.J. Scott, K.P. O'Dea, D. O'Callaghan, L. Williams, J.O. Dokpesi, L. Tatton, J.M. Handy, P.J. Hogg, M. Takata // J. Biol. Chem. - 2011. - Vol. 286, № 41. - P. 35466-35476. DOI: 10.1074/JBC.M111.277434
- Chappell M.C. Biochemical evaluation of the renin-angiotensin system: the good, bad, and absolute? // Am. J. Physiol. Heart Circ. Physiol. - 2016. - Vol. 310, № 2. - P. H137-H152. DOI: 10.1152/AJPHEART.00618.2015
- WHO Director-General's remarks at the media briefing on 2019-nCoV on 11 February 2020 [Электронный ресурс] // World Health Organization. - 2022. - URL: https: //www.who.int/director-general/speeches/detail/who-director-general-s-remarks-at-the-media-briefing-on-2019-ncov-on-11-february-2020 (дата обращения: 01.05.2022).
- Angiotensin-(1-7) is an endogenous ligand for the G protein-coupled receptor Mas / R.A.S. Santos, A.C. Simoes e Silva, C. Maric, D.M.R. Silva, R.P. Machado, I. de Buhr, S. Heringer-Walther, S.V.B. Pinheiro [et al.] // Proc. Natl Acad. Sci. USA. - 2003. - Vol. 100, № 14. - P. 8258-8263. DOI: 10.1073/PNAS.1432869100
- Suppressing inflammation by inhibiting the NF-kB pathway contributes to the neuroprotective effect of angiotensin- (1-7) in rats with permanent cerebral ischaemia / T. Jiang, L. Gao, J. Guo, J. Lu, Y. Wang, Y. Zhang // Br. J. Pharmacol. - 2012. - Vol. 167, № 7. - P. 1520-1532. DOI: 10.1111/J.1476-5381.2012.02105.X
- Santos R.A.S., Ferreira A.J., Simöes e Silva A.C. Recent advances in the angiotensin-converting enzyme 2-angiotensin( 1 -7)-Mas axis // Experimental Physiology. - 2008. - Vol. 93, № 5. - P. 519-527. DOI: 10.1113/expphysiol.2008.042002
- The pivotal link between ACE2 deficiency and SARS-CoV-2 infection / P. Verdecchia, C. Cavallini, A. Spanevello, F. Angeli // Eur. J. Intern. Med. - 2020. - Vol. 76. - P. 14-20. DOI: 10.1016/j.ejim.2020.04.037
- Acute respiratory distress syndrome leads to reduced ratio of ACE/ACE2 activities and is prevented by angio-tensin-(1-7) or an angiotensin II receptor antagonist / R.M. Wösten-Van Asperen, R. Lutter, P.A. Specht, G.N. Moll, J.B. van Woensel, C.M. van der Loos, H. van Goor, J. Kamilic [et al.] // J. Pathol. - 2011. - Vol. 225, № 4. - P. 618-627. DOI: 10.1002/path.2987
- Vascular relaxation, antihypertensive effect, and cardioprotection of a novel peptide agonist of the MAS receptor / S.Q. Savergnini, M. Beiman, R.Q. Lautner, V. de Paula-Carvalho, K. Allahdadi, D. Caires Pessoa, F. Pereira Costa-Fraga, R.A. Fraga-Silva [et al.] // Hypertension. - 2010. - Vol. 56, № 1. - P. 112-120. DOI: 10.1161/hypertensionaha.110.152942
- AVE 0991, a nonpeptide mimic of the effects of angiotensin-(1-7) on the endothelium / G. Wiemer, L.W. Do-brucki, F.R. Louka, T. Malinski, H. Heitsch // Hypertension. - 2002. - Vol. 40, № 6. - P. 847-852. DOI: 10.1161/01.HYP.0000037979.53963.8F
- Angiotensin-converting enzyme 2 activator diminazene aceturate prevents lipopolysaccharide-induced inflammation by inhibiting MAPK and NF-kB pathways in human retinal pigment epithelium / L. Tao, Y. Qiu, X. Fu, R. Lin, C. Lei, J. Wang, B. Lei // Journal of Neuroinflammation. - 2016. - Vol. 13, № 1. - P. 35. DOI: 10.1186/S12974-016-0489-7
- Liraglutide Enhances the Activity of the ACE-2/Ang(1-7)/Mas Receptor Pathway in Lungs of Male Pups from Food-Restricted Mothers and Prevents the Reduction of SP-A / J. Fandiño, A.A. Vaz, L. Toba, M. Romaní-Pérez, L. González-Matías, F. Mallo, Y. Diz-Chaves // Int. J. Endocrinol. - 2018. - Vol. 2018. - P. 6920620. DOI: 10.1155/2018/6920620
- A Novel Angiotensin-(1-7) Glycosylated Mas Receptor Agonist for Treating Vascular Cognitive Impairment and Inflammation-Related Memory Dysfunction / M. Hay, R. Polt, M.L. Heien, T.W. Vanderah, T.M. Largent-Milnes, K. Rodgers, T. Falk, M.J. Bartlett [et al.] // J. Pharmacol. Exp. Ther. - 2019. - Vol. 369, № 1. - P. 9-25. DOI: 10.1124/JPET.118.254854
- Within the Brain: The Renin Angiotensin System / L. Jackson, W. Eldahshan, S.C. Fagan, A. Ergul // Int. J. Mol. Sci. -2018. - Vol. 19, № 3. - P. 876. DOI: 10.3390/IJMS19030876
- COVID-19 - A Theory of Autoimmunity Against ACE-2 Explained / P. McMillan, T. Dexhiemer, R.R. Neubig, B.D. Uhal // Front. Immunol. - 2021. - Vol. 12. - P. 582166. DOI: 10.3389/fimmu.2021.582166
- The SARS-CoV-2 spike protein alters barrier function in 2D static and 3D microfluidic in vitro models of the human blood-brain barrier / T.P. Buzhdygan, B.J. DeOre, A. Baldwin-Leclair, H. McGary, R. Razmpour, P.A. Galie, R. Potula, A.M. Andrews, S.H. Ramirez // bioRxiv: The Preprint Server for Biology. - 2020. DOI: 10.1101/2020.06.15.150912
- TLR4 and AT1R mediate blood-brain barrier disruption, neuroinflammation, and autonomic dysfunction in spontaneously hypertensive rats / F.E. Mowry, S.C. Peaden, J.E. Stern, V.C. Biancardi // Pharmacol. Res. - 2021. - Vol. 74. -P. 105877. DOI: 10.1016/j.phrs.2021.105877
- Translating IL-6 biology into effective treatments / E.H. Choy, F. De Benedetti, T. Takeuchi, M. Hashizume, M.R. John, T. Kishimoto // Nature Reviews. Rheumatology. - 2020. - Vol. 16, № 6. - P. 335-345. DOI: 10.1038/S41584-020-0419-Z
- Evaluation of angiotensin-converting enzyme (ACE), its homologue ACE2 and neprilysin in angiotensin peptide metabolism / G.I. Rice, D.A. Thomas, P.J. Grant, A.J. Turner, N.M. Hooper // Biochem. J. - 2004. - Vol. 383, pt 1. -P. 45-51. DOI: 10.1042/BJ20040634
- Velavan T.P., Meyer C.G. Mild versus severe COVID-19: Laboratory markers // Int. J. Infect. Dis. - 2020. - Vol. 95. -P. 304-307. DOI: 10.1016/j.ijid.2020.04.061
- Prognostic factors for severity and mortality in patients infected with COVID-19: A systematic review / A. Izcovich, M.A. Ragusa, F. Tortosa, M.A.L. Marzio, C. Agnoletti, A. Bengolea, A. Ceirano, F. Espinosa [et al.] // PLoS One. - 2020. -Vol. 15, № 11. - P. e0241955. DOI: 10.1371/journal.pone.024195526
- Laboratory Biomarkers Predicting COVID-19 Severity in the Emergency Room / R. Assandri, E. Buscarini, C. Canetta, A. Scartabellati, G. Vigano, A. Montanelli // Arch. Med. Res. - 2020. - Vol. 51, № 6. - P. 598-599. DOI: 10.1016/j.arcmed.2020.05.011
- The role of cytokine profile and lymphocyte subsets in the severity of coronavirus disease 2019 (COVID-19): A systematic review and meta-analysis / H. Akbari, R. Tabrizi, K.B. Lankarani, H. Aria, S. Vakili, F. Asadian, S. No-roozi, P. Keshavarz, S. Faramarz // Life Sci. - 2020. - Vol. 258. - P. 118167. DOI: 10.1016/j.lfs.2020.118167
- Elevated Exhaustion Levels of NK and CD8 + T Cells as Indicators for Progression and Prognosis of COVID-19 Disease / M. Li, W. Guo, Y. Dong, X. Wang, D. Dai, X. Liu, Y. Wu, M. Li [et al.] // Front. Immunol. - 2020. - Vol. 11. -P. 580237. DOI: 10.3389/fimmu.2020.580237
- Longitudinal characteristics of lymphocyte responses and cytokine profiles in the peripheral blood of SARS-CoV-2 infected patients / J. Liu, S. Li, J. Liu, B. Liang, X. Wang, H. Wang, W. Li, Q. Tong [et al.] // EBioMedicine. - 2020. -Vol. 55. - P. 102763. DOI: 10.1016/j.ebiom.2020.102763
- Becker R.C. COVID-19 update: Covid-19-associated coagulopathy // J. Thromb. Thrombolysis. - 2020. - Vol. 50, № 1. - P. 54-67. DOI: 10.1007/S11239-020-02134-3
- Characteristics of SARS-CoV-2 and COVID-19 / B. Hu, H. Guo, P. Zhou, Z.-L. Shi // Nat. Rev. Microbiol. - 2021. -Vol. 19, № 3. - P. 141-154. DOI: 10.1038/S41579-020-00459-7
- A neutrophil activation signature predicts critical illness and mortality in COVID-19 / M.L. Meizlish, A.B. Pine, J.D. Bishai, G. Goshua, E.R. Nadelmann, M. Simonov, C.-H. Chang, H. Zhang [et al.] // Blood Adv. - 2021. - Vol. 5, № 5. -P. 1164-1177. DOI: 10.1182/bloodadvances.2020003568
- Risk stratification of patients admitted to hospital with COVID-19 using the ISARIC WHO Clinical Characterisation Protocol: development and validation of the 4C Mortality Score / S.R. Knight, A. Ho, R. Pius, I. Buchan, G. Carson, T.M. Drake, J. Dunning, C.J. Fairfield [et al.] // BMJ. - 2020. - Vol. 370. - P. m3339. DOI: 10.1136/bmj.m333934
- Relationship Between the ABO Blood Group and the Coronavirus Disease 2019 (COVID-19) Susceptibility / J. Zhao, Y. Yang, H. Huang, D. Li, D. Gu, X. Lu, Z. Zhang, L. Liu [et al.] // Clin. Infect. Dis. - 2021. - Vol. 73, № 2. - P. 328-331. DOI: 10.1093/cid/ciaa1150
- Age-severity matched cytokine profiling reveals specific signatures in COVID-19 patients / R. Angioni, R. Sánchez-Rodríguez, F. Munari, N. Bertoldi, D. Arcidiacono, S. Cavinato, D. Marturano, A. Zaramella [et al.] // Cell Death Dis. - 2020. -Vol. 11, № 11. - P. 957. DOI: 10.1038/S41419-020-03151-Z


