Иммунобиологическая оценка кандидатного вакцинного штамма МК-200 вируса африканской чумы свиней
Автор: Власов М.Е., Кудряшов Д.А., Колбасова О.Л., Лыска В.М., Моргунов С.Ю., Пивова Е.Ю., Дюмин М.С., Синдрякова И.П., Середа А.Д.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, микробиология, иммунология
Статья в выпуске: 4 т.59, 2024 года.
Бесплатный доступ
Африканская чума свиней (АЧС, возбудитель - вирус африканской чумы свиней, African swine fever virus, ASFV, Asfarviridae, Asfivirus) - смертельная геморрагическая вирусная инфекция домашних свиней и евразийских диких кабанов (Sus scrofa). В зависимости от свойств изолятов/штаммов течение болезни может быть сверхострым, острым, подострым, хроническим и бессимптомным. Глобальная эпизоотия АЧС стимулировала работы по получению и изучению свойств кандидатных вакцинных штаммов, в первую очередь рекомбинантных и аттенуированных, рассматриваемых в качестве основы вакцин первого поколения. В настоящем исследовании впервые выявлены два цикла репликации вирусной ДНК в организме свиней, инокулированных кандидатным вакцинным штаммом МК-200 вируса АЧС: первый - на 17-21-е сут, второй - на 56-70-е сут после введения вируса. Цель работы - иммунобиологическая оценка кандидатного вакцинного штамма МК-200 вируса африканской чумы свиней по результатам наблюдения за клиническим состоянием животных, по содержанию вирусоспецифической ДНК и вирусоспецифических антител в пробах, полученных от свиней. Работу проводили в 2022 году в Федеральном исследовательском центре вирусологии и микробиологии (ФГБНУ ФИЦВиМ). Использовали клинически здоровых свиней ( Sus domesticus ) породы крупная белая 2-3-месячного возраста. Вирулентные штаммы вируса АЧС - Мозамбик-78 (III сероиммунотип, V генотип) и Ставрополь 01/08 (VIII сероиммунотип, II генотип) и аттенуированный штамм МК-200, полученный посредством селекции из штамма Мозамбик-78, с инфекционными титрами 107,0-108,0 ГАЕ50/мл были получены в Государственной коллекции микроорганизмов ФГБНУ ФИЦВиМ. Приготовление первичной культуры клеток лейкоцитов свиней (ЛС) осуществляли в соответствии с ГОСТ 28573-90. Инфекционные титры вируса АЧС определяли в культуре клеток ЛС в реакции гемадсобции и рассчитывали по методу Б.А. Кербера в модификации И.П. Ашмарина. Схема эксперимента включала внутримышечную инокуляцию 10 свиньям вируса АЧС (штамм МК-200) в дозе 106,0 ГАЕ50 на 0-е сут. Образцы для исследования отбирали на 0-е, 3-и, 5-е, 7-е, 14-е, 17-е, 21-е, 28-е, 35-е, 42-е, 49-е, 56-е, 63-и, 70-е, 77-е сут после инъекции (с.п.и.). Температуру тела у экспериментальных животных измеряли ректально в течение всего срока наблюдения. Образцы крови получали пункцией яремной вены. Для получения образцов слюны свиней время для жевания прядей веревки (ООО «ТД ПРОМТ», Россия) ограничивали 30 мин. Мокрые пряди веревок отжимали в чистые полиэтиленовые пакеты (ООО «ТД ПРОМТ», Россия) и переливали собранную слюну в центрифужные пробирки («Thermo Fisher Scientific», США). Мазки с внутренней стороны щеки получали с помощью стерильного полиэфирного зонда-тампона с пластиковым аппликатором («МиниМед», Россия). Для выделения нуклеиновых кислот использовали систему ДНК MagMAX™ Pathogen RNA/DNA Kit («Thermo Fisher Scientific», США). ПЦР-РВ проводили с использованием тест-системы IDEXX RealPCR ASFV DNA Mix («IDEXX», США). Для обнаружения антител к белкам вируса АЧС в сыворотке крови свиней применяли тест-систему ID Screen® African Swine Fever Competition («IDVet», Франция). Была установлена линейная зависимость между показателями Ct и инфекционными титрами в 10-кратных разведениях вирусосодержащих суспензий, полученных при заражении культуры клеток ЛС вирусом АЧС штаммов Мозамбик-78 или Ставрополь 01/08. Это позволило переводить данные, полученные при дальнейшем исследовании проб крови и ротовой полости в ПЦР-РВ, в значения инфекционных титров. Из 10 животных, которым инокулировали штамм МК-200, только у трех было зарегистрировано кратковременное (на 1-2 сут) повышение температуры тела выше физиологической нормы (40,1-40,6 °С) в период с 5-х по 7-е с.п.и. У остальных животных на протяжении первых 10 сут температура тела соответствовала показателям физиологической нормы. В период с 8-х по 77-е с.п.и. у всех свиней клинические признаки АЧС отсутствовали. В исследуемых образцах вирусную ДНК выявляли с 3-5-х сут с.п.и. Минимальные показатели (максимальное количество исследуемой матрицы) порогового цикла (Ct) при постановке ПЦР-РВ установлены в период с 17-21-х с.п.и., доля положительных проб в исследованных образцах достигала 60-100 %. Рассчитанные на основании линейной зависимости между инфекционными титрами вируса АЧС и показателями Ct значения виремии не превышали 104,0 ГАЕ50/мл в период с 0-х до 63-х с.п.и. и были ниже 101,9 ГАЕ50/мл с 70-х с.п.и. В течение эксперимента у животных наблюдали цикличную виремию и формирование возможности вирусовыделения через ротовую полость. Это указывает на риски горизонтальной и вертикальной передачи вакцинного штамма восприимчивым свиньям при прямом или непрямом контактах. Разработчикам кандидатных живых вакцин против АЧС рекомендовано предоставлять данные об исследовании виремии и вирусовыделения за период от 2,5 до 4 мес после прививки.
Африканская чума свиней, кандидатные вакцины, иммунобиологическая оценка, пцр-рв
Короткий адрес: https://sciup.org/142243770
IDR: 142243770 | УДК: 619:616.98:578.842.1:615.371 | DOI: 10.15389/agrobiology.2024.4.787rus
Текст научной статьи Иммунобиологическая оценка кандидатного вакцинного штамма МК-200 вируса африканской чумы свиней
Африканская чума свиней (АЧС, возбудитель — вирус африканской чумы свиней, African swine fever virus , ASFV, сем. Asfarviridae , род Asfivirus ) — смертельная геморрагическая вирусная инфекция свиней и евразийских диких кабанов ( Sus scrofa ), которая в традиционном субсахарном нозоареале эволюционирует в сильватическом цикле между бородавочниками ( Phaco-choerus africanus ) и аргазидными клещами ( Ornithodoros moubata) . Вирус африканской чумы свиней характеризуется значительной изменчивостью иммунобиологических и генетических свойств.
При острой форме инфекции 100 % животных погибают в течение 5-10 сут после начала проявления клинических признаков заболевания (1, 2). Занос восточноафриканского вируса АЧС генотипа II на Кавказ в 2007 году привел к тому, что заболевание получило широкое распространение в Восточной и Центральной Европе, а с 2018 года — в Китае и многих других странах Азии (3, 4). Глобальная эпизоотия АЧС стимулировала исследования по получению и изучению свойств кандидатных вакцинных штаммов, в первую очередь рекомбинантных и аттенуированных, рассматриваемых в качестве основы вакцин первого поколения. Однако из-за отсутствия международно признанных протоколов (стандартов) для лабораторной оценки вакцинных штаммов и вакцин против АЧС имеет место вариативность экспериментальных подходов, применяемых научными группами, что затрудняет интерпретацию и сравнение результатов испытаний (5). Это создает проблемы для компетентных органов и учреждений, ответственных за выдачу разрешений на производственные испытания и применение вакцин.
Исходными следует считать требования к вакцинным штаммам вируса АЧС и вакцинным препаратам на их основе, разработанные в 1980-х годах специалистами ГНУ ВНИИВВиМ Россельхозакадемии (ныне ФГБНУ Федеральный исследовательский центр вирусологии и микробиологии) и Главного управления ветеринарии МСХ СССР. Вакцинные штаммы должны были быть слабо или умеренно реактогенными, не реверсибельными, обусловливать ограниченную по срокам виремию, не вызывать осложнений аллергической или аутоиммунной природы, не передаваться интактным свиньям при их совместном содержании с привитыми. Вакцинные препараты, изготовленные на основе аттенуированных штаммов, должны были быть безвредными для свиней в 5-10-кратной прививочной дозе и обеспечивать формирование защиты на 7-14-е сут после прививки против референсного вирулентного штамма гомологичного сероиммунотипа не менее чем у 75 % животных продолжительностью не менее 4 мес (6).
В 2021 году Всемирная организация по охране здоровья животных (World Organisation for Animal Health, WOAH) инициировала работу по достижению консенсуса относительно методов и критериев оценки кандидат-ных вакцин первого поколения (живых) против АЧС. Дискуссии ведутся по определению критериев гомологичности и гетерологичности изолятов/штам-мов вируса АЧС (7-9), подбору экспериментальных животных (10-12), способам (13) и кратности вакцинации (14), дозам вакцинного (15) и вирулентного (14, 16) штаммов, оценке клинических (17, 18) и патологоанатомических (19-21) признаков, периодам наблюдения после вакцинации и контрольного заражения, методам оценки (22-24) и предельным уровням виремии (25), выделению вируса после вакцинации и контрольного заражения (26-28), сероконверсии (29) и протективности (22), реверсии (30) и трансмиссии вируса (31-33), полевым стандартам эффективности (13, 33, 34).
Солидарное понимание перечисленных и других критериев может быть сформировано в результате всестороннего теоретического анализа и детального экспериментального обоснования.
В большинстве работ сроки изучения виремии и вирусовыделения после введения животным кандидатных вакцинных штаммов и контрольного заражения составляют соответственно 21-28 и 14-28 сут (16, 25, 34). В результате сведения об их иммунобиологических свойствах ограничены кратким периодом испытаний, что позднее может привести к проблемам при регистрации вакцин и, как следствие, необходимости проведения дополнительных длительных экспериментов. Поскольку четкой грани между поствакцинальными реакциями и бессимптомной/хронической формами АЧС нет, сведения о них можно рассматривать симультанно (39).
У свиней, инокулированных умеренно вирулентным штаммом Neth-erlands’86, в образцах крови выживших (2/3) животных вирусный геном выявляли методом ПЦР-РВ до 91-х сут (срок наблюдения) (28). Обращает на себя внимание тот факт, что у свиней, привитых первым коммерческим вакцинным штаммом ASFV-G-ΔI177L (как его называют авторы вакцины), уровни виремии на 28-е сут составляли от 102,0 до 106,6 ГАЕ 50 /мл (22, 30). Наличие виремии через 28-35 сут после инъекции может быть следствием недостаточно индуцированной иммунологической защиты и служить причиной последующей горизонтальной и/или вертикальной передачи вакцинного штамма соответственно интактным животным или плодам (6). Поэтому целесообразно исследовать не только виремию, но и присутствие кан-дидатного вакцинного штамма в ротовой полости у привитых особей.
В настоящем исследовании впервые выявлены два цикла репликации вирусной ДНК в организме свиней, инокулированных кандидатным вакцинным штаммом МК-200 вируса АЧС: первый — на 17-21-е сут, второй — на 56-70-е сут после введения вируса.
Цель работы — иммунобиологическая оценка кандидатного вакцинного штамма МК-200 вируса африканской чумы свиней по результатам наблюдения за клиническим состоянием животных, по содержанию вирусоспецифической ДНК и вирусоспецифических антител в биоматериале.
Методика. Работу проводили в 2022 году в Федеральном исследовательском центре вирусологии и микробиологии (ФГБНУ ФИЦВиМ). Использовали 10 клинически здоровых свиней ( Sus domesticus ) породы крупная белая 2-3-месячного возраста, полученных из отдела подготовки подопытных животных ФГБНУ ФИЦВиМ. Животных размещали в индивидуальных станках. Условия содержания и эвтаназии свиней соответствовали протоколу Guide for the Care and Use of laboratory Animals, AVMA Guidelines (35).
Вирулентные штаммы вируса АЧС — Мозамбик-78 (III сероиммуно-тип, V генотип) и Ставрополь 01/08 (VIII сероиммунотип, II генотип) и аттенуированный штамм МК-200, полученный посредством селекции из штамма Мозамбик-78, с инфекционными титрами 107,0-108,0 ГАЕ 50 /мл были взяты из Государственной коллекции микроорганизмов ФГБНУ ФИЦВиМ.
Приготовление первичной культуры клеток лейкоцитов свиней (ЛС) осуществляли в соответствии с ГОСТ 28573-90 (36). Инфекционные титры вируса АЧС штаммов Мозамбик-78 и Ставрополь 01/08 определяли в культуре клеток ЛС в реакции гемадсобции и рассчитывали по методу Б.А. Кербера в модификации И.П. Ашмарина (37, 38).
Схема эксперимента включала внутримышечную инокуляцию вируса АЧС (штамм МК-200) в дозе 106,0 ГАЕ50 10 свиньям на 0-е сут. Образцы для исследования отбирали на 0-е, 3-и, 5-е, 7-е, 14-е, 17-е, 21-е, 28-е, 35-е, 42-е, 49-е, 56-е, 63-и, 70-е, 77-е сут после инъекции (с.п.и.). Температуру тела измеряли ректально в течение всего срока наблюдения.
После эвтаназии проводили общее патологоанатомическое исследование селезенки, легких, миндалин, почек и по меньшей мере трех различных лимфатических узлов (включая лимфатический узел, ближайший к месту прививки, желудочно-печеночные и подчелюстные узлы).
Образцы крови получали пункцией яремной вены. Набирали 10 мл крови в пробирку с антикоагулянтом и 10 мл — в пробирку с активатором свертывания крови. Для получения образцов слюны свиней время для жевания прядей веревки (ООО «ТД ПРОМТ», Россия) ограничивали 30 мин. Мокрые пряди веревок отжимали в чистые полиэтиленовые пакеты (ООО «ТД ПРОМТ», Россия) и переливали собранную слюну в центрифужные пробирки («Thermo Fisher Scientific», США). Мазки с внутренней стороны щеки получали с помощью стерильного полиэфирного зонда-тампона с пластиковым аппликатором («МиниМед», Россия). Далее зонд-тампон помещали в 2 мл стерильного фосфатного буферного раствора с рН 7,2 (ФБР) и перемешивали в течение 1 мин. Образцы центрифугировали при 2000 g в течение 2 мин (Eppendorf Mini Spin, «Eppendorf AG», Германия). Полученные надосадочные жидкости сывороток крови, слюны, мазков с внутренней стороны щеки и образцы крови аликвотировали в 1-2 мл криопробирки («Thermo Fisher Scientific», США), на которые наклеивали этикетки с указанием индивидуального номера животного, даты отбора и типа образца. Пробы хранили при - 40 ° С до проведения исследований.
Для выделения нуклеиновых кислот использовали систему ДНК MagMAX™ Pathogen RNA/DNA Kit («Thermo Fisher Scientific», США). ПЦР-РВ проводили с использованием тест-системы IDEXX RealPCR ASFV DNA Mix («IDEXX», США) на приборе CFX96 Touch™ («Bio-Rad», США) с программным обеспечением Bio-Rad CFX Manager.
Для обнаружения антител к белкам вируса АЧС в сыворотке крови свиней применяли тест-систему ID Screen® African Swine Fever Competition («IDVet», Франция) с использованием термошейкера для иммунопланшета BioSan PST-60HL («BioSan», Латвия) и иммунохимического анализатора Sunrise («Tecan Austria GmbH», Австрия). Согласно инструкции изготовителя, для каждого образца по оптической плотности (ОП) рассчитывали S/N %, где S = ОП образец — ОП положительный контроль ; N = ОП отрицательный контроль - ОП положительный контроль , и вычисляли показатель вирусоспецифических антител (100 — S/N) %, значение которого было тем выше, чем больше вирусоспецифических антител содержалось в образце.
Результаты обрабатывали в программе Microsoft Excel 2016. Данные представлены в виде средних арифметических значений ( M ) и стандартных ошибок среднего (±SEM). Сравнение между группами данных проводили с использованием t -критерия Стьюдента. Различия считали статистически значимыми при p < 0,05.
Результаты. Мы провели эксперименты по сопоставлению результатов ПЦР-РВ (значения Ct) и инфекционных титров (ГАЕ 50 /мл) в 10-кратных разведениях вирусосодержащих суспензий, полученных посредством заражения культуры клеток ЛС вирусом АЧС штаммов Мозамбик-78 или Ставрополь 01/08 (рис. 1). Установлена линейная зависимость между инфекционными титрами и показателями Ct. Это позволило переводить данные, полученные при исследовании проб крови и образцов из ротовой полости в ПЦР-РВ, в значения инфекционных титров. Например, показаниям Ct 30, 35, 40 соответствовали значения инфекционных титров вируса АЧС 104,1, 103,3, 101,9 ГАЕ 50 /мл.
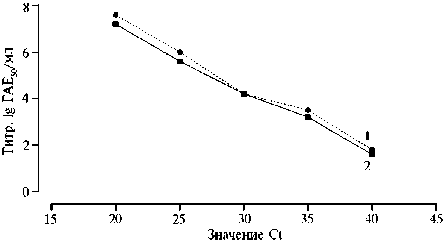
Рис. 1. Зависимость между показателями, полученными в ПЦР-РВ (Ct) , и инфекционными титрами (lg ГАЕ 50 /мл) в культуре клеток лейкоцитов свиней ( Sus domesticus ) породы крупная белая, инфицированных штаммами Ставрополь 01/08 (1) или Мозамбик-78 (2) вируса африканской чумы свиней (ФГБНУ ФИЦВиМ, 2022 год) .
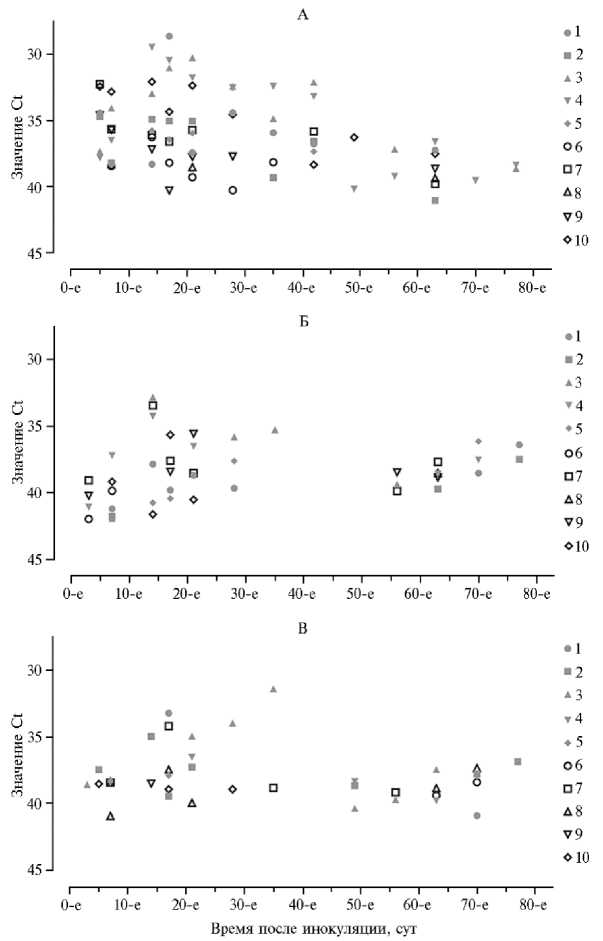
Рис. 2. Абсолютные значения Ct, полученные при исследовании в реакции ПЦР-РВ проб крови (А) , слюны (Б) и мазков с внутренней стороны щеки (В) , отобранных у свиней ( Sus domesticus )
породы крупная белая, которые были внутримышечно инокулированы штаммом МК-200 вируса африканской чумы свиней в дозе 106,0 ГАЕ 50 , в зависимости от времени после инокуляции .
Справа — номера свиней с 1 по 10 (ФГБНУ ФИЦВиМ, 2022 год) .
Из 10 животных, которым инокулировали штамм МК-200, только у трех было зарегистрировано кратковременное (на 1-2 сут), незначительное повышение температуры тела выше физиологической нормы (40,1-40,6 °С) в период с 5-х по 7-е с.п.и. У остальных животных на протяжении первых 10 сут температура тела соответствовала показателям физиологической нормы. В период с 8-х по 77-е с.п.и. у всех свиней клинические признаки АЧС отсутствовали. По окончании эксперимента у всех животных не было выявлено характерных для АЧС патологоанатомических изменений.
При исследовании проб крови первые положительные результаты по выявлению генома вируса АЧС методом ПЦР-РВ были отмечены на 5-е с.п.и. у 70 % животных (Ct min — 37,8, max — 32,4). В период с 7-х до 21-е с.п.и. у 90-100 % свиней пробы крови были положительными (40,328,6), с 28-х до 42-е с.п.и. — у 50-70 % (40,3-32,1), с 49-х по 56-е с.п.и. — у 20 % (40,2-36,3), на 63-и с.п.и. — у 70 % (41,0-36,6), с 70-х по 77-е с.п.и. — у 10-20 % (39,5-38,4) (рис. 2, А). В период с 5-х до 63-х с.п.и. расчетная виремия была в пределах от 104,0 ГАЕ 50 /мл до 102,0 ГАЕ 50 /мл, а с 70-х с.п.и. у 80-90 % животных виремия оказалась ниже 101,9 ГАЕ50/мл или отсутствовала.
В образцах слюны (см. рис. 2, Б) первые положительные пробы были отмечены с 3-х с.п.и. у 40 % (42,0-39,0) животных, в период с 7-х до 21-х с.п.и. — у 50-60 % (41,9-32,4), на 28-е с.п.и. — у 30 % (39,7-35,8), на 35-е с.п.и. — у 10 % (35,6). С 42-х по 49-е с.п.и. ДНК вируса АЧС в образцах слюны не выявляли. В период с 56-х до 77-х с.п.и. положительными были пробы у 30-50 % (39,7-36,1) свиней, что больше, чем в пробах крови. В пробах слюны положительные показания Ct были в пределах 32,4-42,0, что соответствует инфекционности вируса АЧС от 103,8 до 101,0 ГАЕ 50 /мл.
В мазках с внутренней стороны щеки (см. рис. 2, В) положительные пробы выявляли с 3-х по 14-е с.п.и. у 10-40 % животных (40,9-34,9), на 1721-е с.п.и. — у 40-60 % (39,9-33,2), на 28-35 с.п.и. — у 20 % (38,9-31,4). На 42-е с.п.и. все пробы были отрицательными, на 49-56-е с.п.и. положительные пробы были выявлены у 20-30% животных (40,4-38,3), на 63-70 с.п.и. — у 40 % (40,9-37,3), на 77-е с.п.и. — у 10 % (36,8). В пробах мазков с внутренней стороны щеки показания Ct находились в пределах 31,4-40,9, что соответствовало инфекционным титрам вируса АЧС от 103,8 до 101,9 ГАЕ 50 /мл.
Результаты статистического анализа наших данных подтвердили наличие двух пиков репродукции вируса АЧС (рис. 3). Средние значения минимальных и максимальных показателей Ct в основаниях и вершинах первого (17-21 с.п.и.) и второго (63 с.п.и.) пиков статистически значимо различались ( n = 10, р < 0,05).
На 7-е с.п.и показатели вирусоспецифических антител у 9 из 10 свиней были в диапазоне от 1 до 59 %, на 14-е с.п.и. — от 58 до 90 %. К 28-м с.п.и. они достигали максимальных значений 95-100 % и оставались на постоянном уровне до окончания эксперимента (данные не приведены). Только у животного ¹ 8 диагностически отрицательные (менее 60 %) значения показателей вирусоспецифических антител регистрировали с 0-х до 49-х с.п.и. С 56-х по 77-е с.п.и. они были диагностически положительными (достигали 100 %). Вероятно, это было связано с индивидуальными особенностями иммунной системы.
В зависимости от свойств изолятов/штаммов и способов инокуляции выделение вируса АЧС с секретами и экскретами начинается через 1-7 с.п.и.
(39-41). В нашем эксперименте в крови и образцах из ротовой полости свиней ДНК вируса АЧС штамма МК-200 начинали выявлять на 3-и–5-е с.п.и. Незначительный подъем температуры тела у 30 % животных происходил на 2 сут позже.
Рис. 3. Средние значения Ct ( n = 10, M ±SEM) , полученные при исследовании в реакции ПЦР-РВ проб крови (А) , слюны (Б) , мазков с внутренней стороны щеки (В) у свиней ( Sus domesticus ) породы крупная белая, которые были внутримышечно инокулированы штаммом МК-200 вируса африканской чумы свиней в дозе 106,0 ГАЕ 50 , в зависимости от времени, прошедшего после инокуляции (ФГБНУ ФИЦВиМ, 2022 год) .
Минимальные показатели (максимальное количество исследуемой матрицы) порогового цикла при постановке ПЦР-РВ, полученные при исследовании проб крови, слюны, мазков с внутренней стороны щеки, были установлены в период с 17-21-х с.п.и., доля положительных проб достигала 60-100 %. С 28-х по 49-е с.п.и. отмечали снижение с 20-30 % до 0 % доли положительных проб слюны и мазков с внутренней стороны щеки. С 56-х по 70-е с.п.и. в пробах слюны и мазках с внутренней стороны щеки наблюдался второй пик доли положительных проб — от 30 до 40 %. В пробах крови второй пик был зарегистрирован на 63-е с.п.и. — 70 %.
Наши результаты по срокам обнаружения вирусной ДНК в исследованных образцах и наличию двух пиков репликации штамма МК-200 вируса АЧС в организме свиней близки к сведениям, опубликованным H.C. de Carvalho Ferreira с соавт. (42). Было показано, что у большинства свиней, выживших после внутримышечного или интраназального введения умеренно вирулентных изолятов Malta’78 и Netherlands’86 вируса АЧС, пробы крови и образцы из ротовой полости оставались положительными в ПЦР-РВ в течение, как минимум, 70 сут. Уровень обнаружения вирусной ДНК в ротовой полости был максимальным во время фазы проявления клинических признаков АЧС, второй пик экскреции, по данным ПЦР-РВ, приходился на 55-70-е с.п.и. Последний связывали с репликацией вируса в миндалинах или лимфатических узлах (43). Авторы пришли к заключению, что персистентно инфицированные животные могут выделять вирус АЧС из ротовой полости и передавать его восприимчивым свиньям при прямом или непрямом контактах (42). Это было подтверждено результатами испытаний вакцины против АЧС из штамма ASFV-G-ΔI177, названной ее авторами «первой коммерческой». Методом ПЦР-РВ установлена контактная передача вакцинного вируса 30 % нативных животных, содержащихся совместно с вакцинированными. В сыворотках крови 50 % нативных свиней выявлены вирусоспецифические антитела, что однозначно свидетельствует о передаче вакцинного вируса (30).
В период с 0-х до 63-х с.п.и. значения виремии в нашем опыте не превышали 104,0 ГАЕ 50 /мл и с 70-х с.п.и. были ниже 101,9 ГАЕ 50 /мл. Тем не менее у некоторых животных виремия могла продолжаться до 77 с.п.и. Об аналогичных результатах сообщали французские исследователи (44), которые из вирулентного штамма Georgia 2007/1 получили аттенуированный кандидатный вакцинный штамм ASFV-989. Его внутримышечное или оро-назальное введение защищало 100 % свиней от заражения родительским штаммом через 28 сут. По результатам оценки геномной нагрузки методом ПЦР-РВ были рассчитаны уровни виремии штамма ASFV-989: на 5-е с.п.и. — 105,9 ГАЕ 50 /мл, на 35-е — 104,5 ГАЕ 50 /мл, на 56-е с.п.и. — 103,5 ГАЕ 50 /мл, на 70-е —102,0 ГАЕ 50 /мл, на 100-е — 100,7 ГАЕ 50 /мл (44).
Показания Ct в ПЦР-РВ в исследованных нами пробах из ротовой полости на 70-77-е с.п.и. оказались сопоставимы с таковыми в пробах крови. Репродукция вируса может происходить в лимфоузлах и железах, расположенных рядом с ротовой полостью. Недавно было показано, что через 2 мес после введения свиньям рекомбинантного аттенуированного штамма ASFV-GZΔI177LΔCD2vΔMGF вирусную ДНК выявляли в околоушной слюнной железе и в меньшей концентрации (в 1,5 раза) — в паховых лимфоузлах (33).
Таким образом, у свиней породы крупная белая, инокулированных кандидатным вакцинным штаммом МК-200 вируса африканской чумы свиней (АЧС), в течение 2,5 мес наблюдалась цикличная виремия и формировалась возможность для вирусовыделения через ротовую полость. Это указывает на риски вертикальной и горизонтальной передачи кандидатного вакцинного штамма восприимчивым свиньям при прямом или непрямом контакте. Однако, учитывая тот факт, что количество и частота выделения 794
вируса, наблюдаемые после 35-х с.п.и., сравнительно меньше, риски передачи в этот период будут ниже, чем в первые 35 с.п.и. Разработчикам кан-дидатных живых вакцин против АЧС целесообразно рекомендовать предоставлять данные об исследовании виремии и вирусовыделения (пробы слюны) за период от 2,5 до 4 мес после прививки. Обобщение результатов наших наблюдений за клиническим состоянием животных, определения вирусной ДНК в крови и пробах из ротовой полости дает основание считать, что инфекция, вызванная штаммом МК-200 вируса АЧС, протекала в бессимптомной (70 %) или хронической (30 %) формах.
Список литературы Иммунобиологическая оценка кандидатного вакцинного штамма МК-200 вируса африканской чумы свиней
- Blome S., Franzke K., Beer M. African swine fever — a review of current knowledge. Virus Research, 2020, 287: 198099 (doi: 10.1016/j.virusres.2020.198099).
- Boinas F.S., Hutchings G.H., Dixon L.K., Wilkinson P.J. Characterization of pathogenic and non-pathogenic African swine fever virus isolates from Ornithodoros erraticus inhabiting pig premises in Portugal. Journal of General Virology, 2004, 85(8): 2177-2187 (doi: 10.1099/vir.0.80058-0).
- Dixon L.K., Alonso C., Escribano J.M., Martins C., Revilla Y., Salas M.L., Takamatsu H. Asfarviridae. Virus taxonomy. Classification and nomenclature of viruses. Ninth report of the international committee on taxonomy of viruses (ICTV). Elsevier, Oxford, 2011: 153-162.
- Alonso C., Borca M., Dixon L., Revilla Y., Rodriguez F., Escribano J.M., ICTV Report Consortium. CTV virus taxonomy profile: Asfarviridae. Journal of General Virology, 2018, 99(5): 613-614 (doi: 10.1099/jgv.0.001049).
- Brake D.A. African swine fever modified live vaccine candidates: transitioning from discovery to product development through harmonized standards and guidelines. Viruses, 2022, 14(12): 2619 (doi: 10.3390/v14122619).
- Sereda A.D., Balyshev V.M., Kazakova A.S., Imatdinov A.R., Kolbasov D.V. Protective properties of attenuated strains of African swine fever virus belonging to seroimmunotypes I-VIII. Pathogens, 2020, 9(4): 274 (doi: 10.3390/pathogens9040274).
- Середа А.Д., Балышев В.М. Антигенное разнообразие вируса африканской чумы свиней. Вопросы вирусологии, 2011, 56(4): 38-42.
- Bosch-Camós L., Alonso U., Esteve-Codina A., Chang C.Y., Martín-Mur B., Accensi F., Muñoz M., Navas M.J., Dabad M., Vidal E., Pina-Pedrero S., Pleguezuelos P., Caratù G., Salas M.L., Liu L., Bataklieva S., Gavrilov B., Rodríguez F., Argilaguet J. Cross-protection against African swine fever virus upon intranasal vaccination is associated with an adaptive-innate immune crosstalk. PLoS Pathogens, 2022, 18(11): e1010931 (doi: 10.1371/journal.ppat.1010931).
- Duc Hien N., Trung Hoang L., My Quyen T., Phuc Khanh N., Thanh Nguyen L. Molecular characterization of African swine fever viruses circulating in Can Tho City, Vietnam. Veterinary Medicine International, 2023: 8992302 (doi: 10.1155/2023/8992302).
- Goatley L.C., Nash R.H., Andrews C., Hargreaves Z., Tng P., Reis A.L., Graham S.P., Netherton C.L. Cellular and humoral immune responses after immunisation with low virulent African swine fever virus in the large white inbred Babraham line and outbred domestic Pigs. Viruses, 2022, 14(7): 1487 (doi: 10.3390/v14071487).
- Sang H., Miller G., Lokhandwala S., Sangewar N., Waghela S.D., Bishop R.P., Mwangi W. Progress toward development of effective and safe African swine fever virus vaccines. Frontiers inVeterinary Science,2020, 7: 84 (doi: 10.3389/fvets.2020.00084).
- Lohse L., Nielsen J., Uttenthal А., Olesen A.S., Strandbygaard B., Rasmussen T.B., Belsham G.J., Bоtner A. Experimental infections of pigs with African swine fever virus (genotype II); studies in young animals and pregnant sows. Viruses, 2022, 14(7): 1387 (doi: 10.3390/v14071387).
- Deutschmann P., Carrau T., Sehl-Ewert J., Forth J.H., Viaplana E., Mancera J.C., Urniza A., Beer M., Blome S. Taking a promising vaccine candidate further: efficacy of ASFV-G-MGF after intramuscular vaccination of domestic pigs and oral vaccination of wild boar. Pathogens, 2022, 11(9): 996 (doi: 10.3390/pathogens11090996).
- Ding M., Dang W., Liu H., Zhang K., Xu F., Tian H., Huang H., Shi Z., Sunkang Y., Qin X., Zhang Y., Zheng H. Sequential deletions of interferon inhibitors MGF110-9L and MGF505-7R result in sterile immunity against the Eurasia strain of Africa swine fever. Journal of Virology, 2022, 96(20): e0119222 (doi: 10.1128/jvi.01192-22).
- Borca M.V., Rai A., Ramirez-Medina E., Silva E., Velazquez-Salinas L., Vuono E., Pruitt S., Espinoza N., Gladue D.P. A cell cultureadapted vaccine virus against the current African swine fever virus pandemic strain. Journal of Virology,2021, 95(14): e00123-21 (doi: 10.1128/JVI.00123-21).
- Gladue D.P., Ramirez-Medina E., Vuono E., Silva E., Rai A., Pruitt S., Espinoza N., VelazquezSalinas L., Borca M.V. Deletion of the A137R gene from the pandemic strain of African swine fever virus attenuates the strain and offers protection against the virulent pandemic virus. Journal of Virology, 2021, 95(21): e01139-21 (doi: 10.1128/JVI.01139-21).
- King K., Chapman D., Argilaguet J.M., Fishbourne E., Hutet E., Cariolet R., Hutchings G., Oura C.A., Netherton C.L., Moffat K., Taylor G., Le Potier M.F., Dixon L.K., Takamatsu H.H. Protection of European domestic pigs from virulent African isolates of African swine fever virus by experimental immunisation. Vaccine, 2011, 29(28): 4593-4600 (doi: 10.1016/j.vaccine.2011.04.052).
- Gallardo C., Soler A., Nieto R., Sánchez M.A., Martins C., Pelayo V., Carrascosa A., Revilla Y., Simón A., Briones V., Sánchez-Vizcaíno J.M., Arias M. Experimental transmission of African swine fever (ASF) low virulent isolate NH/P68 by surviving pigs. Transboundary and Emerging Diseases, 2015, 62(6): 612-622 (doi: 10.1111/tbed.12431).
- Salguero F.J. Comparative pathology and pathogenesis of African swine fever infection in swine. Frontiers in Veterinary Science, 2020, 7: 282 (doi: 10.3389/fvets.2020.00282).
- Sehl-Ewert J., Deutschmann P., Breithaupt A., Blome S. Pathology of African swine fever in wild boar carcasses naturally infected with German virus variants. Pathogens, 2022, 11(11): 1386 (doi: 10.3390/pathogens11111386).
- Howey E.B., O'Donnell V., de Carvalho Ferreira H.C., Borca M.V., Arzt J. Pathogenesis of highly virulent African swine fever virus in domestic pigs exposed via intraoropharyngeal, intranasopharyngeal, and intramuscular inoculation, and by direct contact with infected pigs. Virus Research, 2013, 178(2): 328-339 (doi: 10.1016/j.virusres.2013.09.024).
- Attreed S.E., Silva C., Abbott S., Ramirez-Medina E., Espinoza N., Borca M.V., Gladue D.P., Diaz-San Segundo F. A Highly effective African swine fever virus vaccine elicits a memory T cell response in vaccinated swine. Pathogens, 2022, 11(12): 1438 (doi: 10.3390/pathogens11121438).
- Niederwerder M.C., Hefley T.J. Diagnostic sensitivity of porcine biological samples for detecting African swine fever virus infection after natural consumption in feed and liquid. Transboundary and Emerging Diseases, 2022, 69: 2727-2734 (doi: 10.1111/tbed.14424).
- Abkallo H.M., Hemmink J.D., Oduor B., Khazalwa E.M., Svitek N., Assad-Garcia N., Khayumbi J., Fuchs W., Vashee S., Steinaa L. Co-deletion of A238L and EP402R genes from a genotype ix African swine fever virus results in partial attenuation and protection in swine. Viruses, 2022, 14(9): 2024 (doi: 10.3390/v14092024).
- Pérez-Núñez D., Sunwoo S.Y., García-Belmonte R., Kim C., Vigara-Astillero G., Riera E., Kim D.M., Jeong J., Tark D., Ko Y.S., You Y.K., Revilla Y. Recombinant African swine fever virus Arm/07/CBM/c2 lacking CD2v and A238L is attenuated and protects pigs against virulent Korean Paju strain. Vaccines, 2022, 10(12): 1992 (doi: 10.3390/vaccines10121992).
- Yang H., Peng Z., Song W., Zhang C., Fan J., Chen H., Hua L., Pei J., Tang X., Chen H., Wu B. A triplex real-time PCR method to detect African swine fever virus gene-deleted and wild type strains. Frontiers in Veterinary Science,2022, 9: 943099 (doi: 10.3389/fvets.2022.943099).
- Elnagar A., Blome S., Beer M., Hoffmann B. Point-of-care testing for sensitive detection of the african swine fever virus genome. Viruses, 2022, 14(12): 2827 (doi: 10.3390/v14122827).
- Petrov A., Forth J.H., Zani L., Beer M., Blome S. No evidence for long-term carrier status of pigs after African swine fever virus infection. Transboundary and Emerging Diseases, 2018, 65: 1318-1328 (doi: 10.1111/tbed.12881).
- Walczak M., Frant M., Juszkiewicz M., Mazur-Panasiuk N., Szymankiewicz K., Bruczyńska M., Woźniakowski G. Vertical transmission of anti-ASFV antibodies as one of potential causes of seropositive results among young wild boar population in Poland. Polish Journal of Veterinary Sciences, 2020, 23(1): 21-25 (doi: 10.24425/pjvs.2019.131415).
- Tran X.H., Phuong L.T.T., Huy N.Q., Thuy D.T., Nguyen V.D., Quang P.H., Ngôn Q.V., Rai A., Gay C.G., Gladue D.P., Borca M.V. Evaluation of the safety profile of the ASFV vaccine candidate ASFV-G-I177L. Viruses, 2022, 14(5): 896 (doi: 10.3390/v14050896).
- Friedrichs V., Reicks D., Hasenfuß T., Gerstenkorn E., Zimmerman J.J., Nelson E.A., Carrau T., Deutschmann P., Sehl-Ewert J., Roszyk H., Beer M., Christopher-Hennings J., Blome S. Artificial insemination as an alternative transmission route for African swine fever virus. Pathogens, 2022, 11(12): 1539 (doi: 10.3390/pathogens11121539).
- Eblé P.L., Hagenaars T.J., Weesendorp E., Quak S., Moonen-Leusen H.W., Loeffen W.L.A. Transmission of African swine fever virus via carrier (survivor) pigs does occur. Veterinary Microbiology, 2019, 237: 108345 (doi: 10.1016/j.vetmic.2019.06.018).
- Liu Y., Xie Z., Li Y., Song Y., Di D., Liu J., Gong L., Chen Z., Wu J., Ye Z., Liu J., Yu W., Lv L., Zhong Q., Tian C., Song Q., Wang H., Chen H. Evaluation of an I177L gene-based five-gene-deleted African swine fever virus as a live attenuated vaccine in pigs. Emerging Microbes & Infections, 2023, 12(1): 2148560 (doi: 10.1080/22221751.2022.2148560).
- Kitamura T., Masujin K., Yamazoe R., Kameyama K, Watanabe M., Ikezawa M., Yamada M., Kokuho T. A spontaneously occurring African swine fever virus with 11 gene deletions partially protects pigs challenged with the parental strain. Viruses, 2023, 15(2): 311 (doi: 10.3390/v15020311).
- National Research Council (US) Committee for the Update of the Guide for the Care and Use of Laboratory Animals. Guide for the care and use of laboratory animals. Eighth Edition. The National Academies Press, Washington, DC, 2011.
- ГОСТ 28573-90 Свиньи. Методы лабораторной диагностики африканской чумы свиней. М., 2005.
- Chapter 3.8.1. African swine fever (infection with African swine fever virus). In: Manual of diagnostic tests and vaccines for terrestrial animals. World Organisation for Animal Health (OIE), Paris, France, 2019.
- Ашмарин И.П., Васильев Н.Н., Амбросов В.А. Быстрые методы статистической обработки и планирование экспериментов. Л., 1974.
- Hamdy F.M., Dardiri A.H. Clinical and immunologic responses of pigs to African swine fever virus isolated from the Western Hemisphere. American Journal of Veterinary Research,1984, 45(4): 711-714.
- McVicar J.W. Quantitative aspects of the transmission of African swine fever. American Journal of Veterinary Research, 1984, 45(8): 1535-1541.
- Ekue N.F., Wilkinson P.J., Wardley R.C. Infection of pigs with the Cameroon isolate (Cam/82) of African swine fever virus. Journal of Comparative Pathology, 1989, 100(2): 145-154 (doi: 10.1016/0021-9975(89)90125-4).
- de Carvalho Ferreira H.C., Weesendorp E., Elbers A.R., Bouma A., Quak S., Stegeman J.A., Loeffen W.L. African swine fever virus excretion patterns in persistently infected animals: a quantitative approach. Veterinary Microbiology, 2012, 160(3-4): 327-340 (doi: 10.1016/j.vetmic.2012.06.025).
- Oura C.A., Powell P.P., Parkhouse R.M. African swine fever: a disease characterized by apoptosis. Journal of General Virology, 1998, 79(6): 1427-1438 (doi: 10.1099/0022-1317-79-6-1427).
- Bourry O., Hutet E., Le Dimna M., Lucas P., Blanchard Y., Chastagner A., Paboeuf F., Le Potier M.F. Oronasal or intramuscular immunization with a thermo-attenuated ASFV strain provides full clinical protection against Georgia 2007/1 challenge. Viruses, 2022, 14: 2777 (doi: 10.3390/v14122777).


