Иммунофармакологические аспекты применения хорионического гонадотропина
Автор: Заморина Светлана Анатольевна, Кочурова Софья Вадимовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 4, 2019 года.
Бесплатный доступ
Представлены данные о роли хорионического гонадотропина (ХГ) в регуляции иммунной системы. Проанализированы эффекты ХГ в отношении функциональной активности дендритных клеток, основных субпопуляций Т-хелперов (Th1, Th2, Th17, Treg), Т-клеток иммунной памяти, а также В-лимфоцитов. Иммунофармакологический потенциал гормона тесно связан с его способностью модулировать функциональную активность перечисленных субпопуляций клеток иммунной системы. Помимо целевых эффектов ХГ, связанных с его действиями на уровне репродуктивных тканей, в обзоре рассмотрены перспективы в терапии аутоиммунных заболеваний и пострансплантационных осложнений. Эффекты ХГ на уровне иммунной системы имеют значение в связи с его применением в курсах подготовки к экстракорпоральному оплодотворению (ЭКО). Таким образом, благодаря плейотропному воздействию ХГ на организм и наличию нецелевых эффектов, спектр его применения имеет потенциал к расширению.
Хорионический гонадотропин (хг), дендритные клетки (dc), индоламин-2, 3-диоксигеназа (ido), т-хелперы (th), т-регуляторные клетки (treg), т- клетки иммунной памяти
Короткий адрес: https://sciup.org/147227114
IDR: 147227114 | УДК: 557.175.6 | DOI: 10.17072/1994-9952-2019-4-471-481
Текст научной статьи Иммунофармакологические аспекты применения хорионического гонадотропина
Хорионический гонадотропин (ХГ) – ключевой белковый гормон беременности, который модулирует процессы стероидогенеза у эмбриона и обладает мощным иммунорегуляторным потенциалом. ХГ небезосновательно считают «гормоном жизни и смерти» [Acevedo, 2002], а также «научным чудом» [Cole, 2012]. Группа молекул ХГ играет критическую роль как в процессах беременности, сопровождая развитие и рождение человека, так и в развитии некоторых видов онкологических заболеваний. В основе столь уникальных качеств гормона лежит, по-видимому, его аномально высокий заряд и длительный период полураспада in vivo (36 ч.) в сравнении с другими регуляторными молекулами [Сole, 2012]. Основным местом синтеза ХГ является синцитиотрофобласт; гормон продуцируется клетками трофобласта, пузырного заноса, де-структирующей хориоаденомы и хориокарциномы [Midgley, Pierce, 1962]. У человека к 9–11 неделе беременности концентрация ХГ достигает макси-
мума, затем она снижается и держится на одном уровне вплоть до родов [Cole, 2012].
ХГ способен секретироваться не только во время беременности, но и во время нормального менструального цикла в период окна имплантации секреторным эндометрием небеременных женщин [Ackermann, Alexander, 2009, 2011]. S. Schug с коллегами изучал возможность использования этого гормона как диагностического критерия для характеристики эндометрия лютеиновой фазы [Schug et al., 2019]. В этом исследовании выяснили, что с прогрессированием секреторной трансформации эндометрия и повышением экспрессии ХГ возрастало количество CD45-позитивных лимфоцитов. Это согласуется с тем, что ХГ действует как хемоаттрактант, например, для регуляторных Т-клеток (Treg) [Schumacher et al., 2009]. Также показана статистически значимая корреляция между экспрессией ХГ эндометрия, CD45-позитивной инфильтрацией лейкоцитов, концентрацией прогестерона в сыворотке и правильной секреторной трансформацией эндометрия, что позволяет предположить, что ХГ является возможным диагностическим критерием для характеристики эндометрия лютеиновой фазы.
Ключевую роль гормона в благоприятном развитии беременности подчеркивает тот факт, что полиморфизмы в структуре генов ( cgb5 и cgb8 ) β– субъединицы ХГ ассоциированы с рекуррентными самопроизвольными абортами [Rull et al., 2008]. Относительно недавно стало известно, что некоторые миссенс-мутации в структуре этих генов приводят к неадекватной сборке субъединиц гормона с последующей потерей его биологической активности, вследствие чего у носительниц таких миссенс-мутаций в анамнезе верифицируются реккурент-ные самопроизвольные аборты [Nagirnaja et al., 2012].
Как известно, вырабатываемый трофобластическими клетками, ХГ стимулирует инвазию цитотрофобластов и поддерживает рост плода и плаценты [Cole, 2010]. Эти данные согласуются с выводами, полученными C. Choux c соавторами в ретроспективном исследовании, включающем 149 одноплодных беременностей после ЭКО [Choux et al., 2019]. Было выяснено, что уровень материнского ХГ коррелирует со степенью инвазии плаценты. Так, недостаточная инвазия плаценты после переноса свежих эмбрионов, которая соотносится с увеличением частоты отслойки плаценты [Healy et al., 2010] и риском возникновения преэклампсии [Imudia et al., 2013], коррелировала с более низкими уровнями ХГ, и напротив, чрезмерная инвазия соответствовала более высоким уровням ХГ. Более ранние данные сообщают, что высокие уровни материнского ХГ соответствуют большему объему плаценты, и соответственно низкие уровни – меньшему объему [Hui et al, 2005].
Таким образом, очевидно, что ХГ имеет огромное значение в процессах репродукции и играет ключевую роль в формировании иммунной толерантности к полуаллогенному эмбриону.
ХГ как фармакологический препарат – целевые эффекты
ХГ как фармакологический препарат применяется при гипофункции половых желез, обусловленных гипоталамо-гипофизарными нарушениями [Клиническая …, 2017]. У женщин показанием к применению ХГ является ановуляторное бесплодие, ановуляторная дисфункция яичников, отсутствие или нарушение менструального цикла, недостаточность желтого тела, позднее половое развитие, привычный и угрожающий выкидыш, дисфункциональные маточные кровотечения. У мужчин это гипогонадотропный гипогонадизм, задержка полового созревания, гипогенитализм, гипоплазия яичек, адипозогенитальный синдром, гипофизарная карликовость с явлениями полового инфантилизма, нарушение сперматогенеза. У детей показанием к применению ХГ является крипторхизм. ХГ стимулирует синтез половых гормонов в яичниках и тестикулах, овуляцию, сперматогенез, обеспечивает функцию жёлтого тела; стимулирует развитие половых органов и вторичных половых признаков [Клиническая ..., 2017].
В настоящее время препараты ХГ получают из мочи беременных и выпускают в лиофилизированном виде в пузырьках по 5.000 или 10.000 МЕ для внутримышечного введения. В 2001 г. был начат выпуск препарата ХГ, полученного с помощью рекомбинантной технологии. Рекомбинантный ХГ (rec-hCG) доступен в шприцах-ручках, содержащих 250 мкг чистого ХГ, что эквивалентно приблизительно 6.750 МЕ ХГ в моче [Leao, Esteves, 2014].
В России на момент 2019 г. продаётся препарат ХГ производства Московского эндокринного завода под непатентованным названием «Хорионический гонадотропин», а также препараты: Прегнил (Pregnyl®) фирмы Organon, Профази (Profasi®) фирмы Industria Farmaceutica Serono, Хорагон (Choragon®) фирмы Ferring, и рекомбинантный препарат Овитрель (Ovitrelle®) фирмы Мерк Се-роно (Merck Serono ®).
Роль ХГ в регуляции основных субпопуляций клеток иммунной системы, формирующих толерантность
ХГ считается одним из основных факторов, формирующих иммунную толерантность во время беременности [Shumacher et al., 2013]. Он участвует в формировании необходимого баланса между субпопуляциями хелперных Т-лимфоцитов Th1/Th2 и Treg/Th17 в период беременности, модулируя также активность B-лимфоцитов, Т-клеток иммунной памяти и клеток моноцитарномакрофагального ряда [цит. по: Заморина, 2017].
Так, известно, что ХГ вовлекает в формирование иммунологической толерантности дендритные клетки [Wan et al., 2008]. В частности, ХГ в сочетании с липополисахаридами (ЛПС) в экспериментах на мышиных дендритных клетках повышал соотношение продукции ИЛ-10/ИЛ-12p70, снижал уровень ФНО-α и угнетал антиген-специфическую пролиферацию Т-лимфоцитов. В то же время, ХГ, в сочетании с ИФН-γ, снижал ИЛ-10 и ФНО-α, а также блокировал экспрессию MHC II. Помимо этого, ХГ повышал уровень мРНК индоламин-2,3-диоксигеназы (IDO) в этих клетках, что в перспективе ведет к угнетению Т-клеточной пролиферации. Известно, что высокий уровень IDO блокирует антифетальные клеточно-опосредованные иммунные реакции матери [Mellor, Munn, 2001]. Таким образом, ХГ формирует толерогенный фенотип дендритных клеток, что чрезвычайно важно в контексте взаимодействия мать-плод.
В условиях in vitro ХГ в высокой концентрации, соответствующей таковой в I триместре беременности, повышал ЛПС-индуцированную активность IDO в моноцитах [Заморина, 2017].
В 2018 г. было исследовано влияние ХГ на количество и фенотип различных подгрупп дендритных клеток человека и их способность индуцировать толерантность к плоду. Несмотря на то, что нативный ХГ в данном исследовании не оказывал значительного влияния на процесс созревания всех подмножеств дендритных клеток периферической крови, он, как и рекомбинантный препарат, снижал их способность секретировать ИЛ-8 и ИЛ-10, а также уменьшал экспрессию МНС II. На основании этого, авторы заключили, что наблюдаемое состояние неполной активации дендритных клеток имеет решающее значение для поддержания толерантности плода [Sauss et al., 2018].
Известно, что в клетках синцитиотрофобласта детектируется постоянный уровень мРНК IDO, который повышается под воздействием ХГ [Lei et al., 2007], при этом изолированные α- и β-субъединицы ХГ не оказывали стимулирующего эффекта. Важно отметить, что под воздействием ХГ повышалась не только экспрессия IDO, но и его ферментативная активность [Lei et al., 2007]. ИФН-γ, являясь индуктором IDO в различных тканях, оказывал синергичный с ХГ эффект на повышение уровня мРНК IDO в клетках синцитиотро-фобласта. Этими же авторами показано, что ХГ регулирует уровень IDO в клетках синцитиотро- фобласта, вовлекая ЛГ/ХГ-рецептор. Блокада синтеза рецептора приводила к отмене эффекта ХГ. Известно, что повышение уровня IDO в фетопла-центарной зоне приводит к отмене активации лимфоцитов. В то же время, неудачные беременности сопровождаются дефективной регуляцией IDO со стороны ХГ [Lei et al., 2007].
В период нормально протекающей беременности в иммунной системе матери цитотоксический ответ в отношении плода предотвращается посредством смещения баланса Th1/Th2 в направлении доминирования Th2-субпопуляции хелперных Т-лимфоцитов и подавления провоспалительных Th1-иммунных механизмов, в соответствии с которыми изменяется и спектр циркулирующих цитокинов [Saito et al. 2010]. Нарушение перестройки цитокинового баланса может быть причиной появления осложнений при беременности. Так, ХГ участвует в формировании необходимого баланса между субпопуляциями Th1/Th2, что было продемонстрировано при помощи оценки уровня ИЛ-4 и ИФН-γ в супернатантах культур клеток [Куклина, Ширшев, 2003]. При помощи серии экспериментов, при которых уровень данных цитокинов оценивался и на внутриклеточном уровне, эти данные получили дополнительное подтверждение [Замо-рина, 2017].
В исследованиях на мышах установлено, что ХГ способствует миграции Treg в фетоплацентар-ную зону, которая сопровождается их одновременной пролиферацией и повышает экспрессию мРНК IDO в клетках плаценты [Norris et al., 2011]. Важно отметить, что эффекты ХГ зависят от типа его молекулы: так, дисрегуляция (преобладание гипергликозилированного ХГ (h-hCG), расщепленного ХГ или свободной β-субъединицы) может приводить к развитию преэклампсии за счет снижения продукции ИЛ-10, уровня IDO, Treg и повышения Th17 [Norris et al., 2011]. У человека ХГ повышает содержание Treg-клеток на периферии и привлекает их непосредственно в зону фетопла-центарного контакта [Schumacher et al., 2009]. U.A. Kayisli с коллегами показали, что ХГ может быть ключевым фактором развития локальной иммунной толерантности, через апоптоз, опосредованный Fas/Fas-лигандом. ХГ повышает экспрессию fasL клетками эндометрия человека, тем самым участвуя в контроле инвазии трофобласта и также индуцируя апоптоз Т-лимфоцитов [Kayisli et al., 2003].
Установлено, что во время беременности происходит увеличение пула Treg периферической крови за счет пролиферации естественных Treg, а также за счет индукции адаптивных Treg [Shumacher, 2009]. Не исключено, что повышение содержания Treg в периферической крови на ранних сроках нормально текущей беременности свя- зано именно с действием данного гормона [Heikkinen et al., 2004]. Подтверждением служит тот факт, что у женщин, проходящих подготовку в цикле ЭКО и принимающих ХГ по определенным схемам, в периферической крови повышается уровень Treg [Koldehoff et al., 2011].
Одним из наиболее значимых механизмов формирования иммунологической толерантности является поддержание баланса между Treg и субпопуляциями Т-хелперов 17го типа (Th17) [Wang et al., 2010]. Treg играют важную роль в супрессии иммунного ответа, в том числе секретируют ИЛ-10 – противовоспалительный цитокин, который подавляет пролиферативный ответ Т-клеток на антигены и митогены, продукцию всех провоспали-тельных цитокинов, а также секрецию активированными моноцитами ИЛ-1β, ФНО-α и ИЛ-6. Так, установлено, что ХГ в концентрациях, соответствующих II-III и I триместру (10 и 100 МЕ/мл, соответственно) увеличивал количество Treg и стимулировал секрецию этими клетками ИЛ-10. В отношении Th17 показано, что ХГ снижал количество этих клеток в культуре СD4+-лимфоцитов, одновременно снижая способность этих клеток секретировать ИЛ-17А [Заморина, Ширшев, 2013]. Помимо этого, гормон достоверно снижает экспрессию хемокинового рецептора CCR6, необходимого для направленной миграции Th17 в очаг воспаления [Maddur et al., 2012].
Довольно интересно, что в исследованиях in vitro ХГ не оказывал влияния на уровень рекомбиназы RAG-1 в регуляторных субпопуляциях Т-хелперных клеток человека (Treg, Th17) [Ширшев и др., 2019]. Из этого следует, что регуляторные эффекты ХГ, по-видимому, не затрагивают процессы ревизии Т-клеточного рецептора Treg и Th17.
Известно, что в материнском кровотоке в период беременности циркулируют отдельные клетки плода, небольшие фрагменты ворсин хориона и микрочастицы синцитиотрофобласта [Germain et al., 2007]. Наличие антигенной стимуляции запускает сложный многоступенчатый процесс дифференцировки клеток адаптивного иммунного ответа, при этом наивные лимфоциты после взаимодействия со специфическим антигеном дифференцируются в эффекторные клетки, и часть из них приобретают свойства клеток памяти [Geginat, Lanzavecchia, Sallusto, 2003].
Однако исследований, посвященных дифференцировке Т-клеток в клетки памяти при беременности, крайне мало. Нашими работами установлена роль ХГ в регуляции активности Т-клеток иммунной памяти, ассоциированная с подавлением экспрессии активационных маркеров CD28 и CD25 на этих клетках. Депрессивные эффекты ХГ реализовались только на уровне CD4+-лимфоцитов, не затрагивая субпопуляцию CD8+ [Раев и др., 2017]. В то же время ХГ не влиял на экспрессию маркера пролиферации CD71 наивными Т-клетками и Т-клетками памяти. Установлено, что ХГ угнетал экспрессию мРНК гена hTERT в наивных Т-клетках (CD45RA+) и Т-клетках иммунной памяти (CD45RO+), что приводит к снижению репликативного потенциала клеток. Так, ХГ снижал число пролиферирующих Т-клеток иммунной памяти, оцениваемых по фенотипическим признакам методом дифференциального гейтирования. Параллельно оценивали экспрессию генов U2af1l4, Gfi1, hnRNPLL, регулирующих альтернативный сплайсинг гена Ptprc, кодирующего CD45, поскольку именно по этому маркеру дифференцируются Т-клетки иммунной памяти. Установлено, что ХГ стимулировал экспрессию генов U2af1l4, hnRNPLL, ответственных за сборку CD45RO в Т-клетках иммунной памяти, но снижал экспрессию Gfi1 в этих клетках. В целом, ХГ способствует дифференцировке Т-клеток иммунной памяти за счет повышения экспрессии CD45RO, но снижает их функциональную активность, связанную с экспрессией CD25 [Zamorina et al., 2018].
В 2016 г. T.E. Keiffer с коллегами показали, что физиологическая беременность не влияет на количество периферических CD8+-лимфоцитов памяти (CD45RO+CD8+), но существенно регулирует функции CD4+-лимфоцитов памяти [Keiffer et al., 2016]. В частности, во время беременности достоверно повышается количество так называемых «эффекторных» Т-клеток памяти (CD45RO+CD4+CCR7-), а спустя 18 месяцев после родов показано повышение количества эффекторных (CD45RO+CD4+CCR7-) и центральных Т-клеток памяти (CD45RO+CD4+CCR7+) [Раев и др., 2017]. Авторы считают, что гипотеза о том, что во время беременности генерируются долгоживущие Т-клетки памяти, специфичные к фетоплацентар-ным антигенам, подтверждается этими исследованиями. Мы предполагаем, что белки и гормоны, ассоциированные с беременностью, являются одними из факторов, не позволяющих сформироваться и реализоваться иммунному ответу на фе-топлацентарные антигены. Особенно это касается ХГ, играющего важную роль в формировании иммунной толерантности в период беременности.
На данный момент мало сведений о роли B-лимфоцитов в формировании иммунной толерантности in vivo . Существует предположение, что В-клетки, продуцирующие ИЛ-10 (Breg), вовлекаются в формирование иммунной толерантности во время беременности у мышей и людей [Fettke et al., 2016]. Используя модельные клеточные системы для человека и мыши, эти же авторы показали, что фетальные трофобласты позитивно регулируют генерацию В-клеток, продуцирующих ИЛ-10.
Важно, что именно ХГ, но не прогестерон, эстроген или их комбинация, способствовал изменениям фенотипа В-клеток и увеличивал продукцию ими ИЛ-10, которая была отменена после блокирования ХГ антителами. Фенотип В-клеток, индуцированный ХГ, не был связан с усиленным галактози-лированием, сиалилированием или фукозилирова-нием подклассов IgG в Fc-регионе. В системе in vitro ХГ индуцировал синтез асимметрически гликозилированных антител в Fab-регионе [Fettke et al., 2016].
Относительно недавно установлено, что уро-
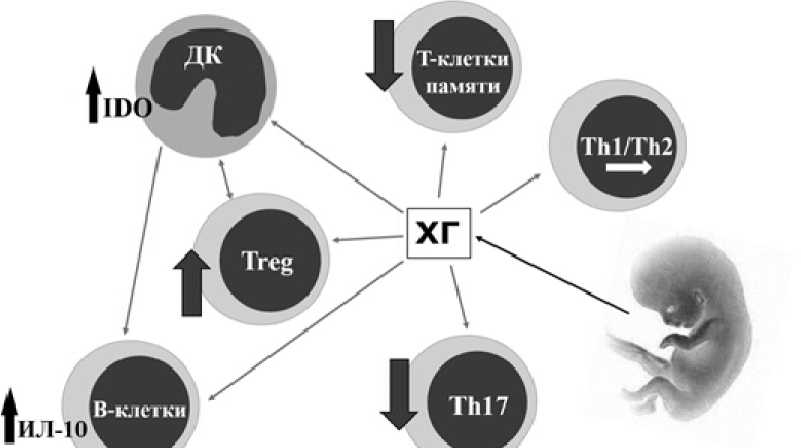
Влияние ХГ на ключевые субпопуляции клеток иммунной системы, ответственных за поддержание иммунной толерантности:
ДК – дендритные клетки, Treg – Т-регуляторные клетки, Th1 – Т-хелперы первого типа, Th2 – Т-хелперы второго типа, Th17 – T-хелперы 17го типа, IDO – индоламин-2,3-диоксигеназа, ИЛ-10 – интерлейкин 10
Иммунофармакологические аспекты применения ХГ – нецелевые эффекты
Благодаря наличию некоторых уникальных качеств, ХГ имеет высокий терапевтический потенциал. Однако, мы рассмотрим только иммунофар-макологические аспекты его действия.
В первую очередь, это связано с его применением в курсах подготовки к экстракорпоральному оплодотворению (ЭКО). Введение ХГ является „золотым‟ стандартом в стимулировании индукции овуляции как замещение лютеинизирующего гормона (ЛГ) в середине цикла [Leao, Esteves, 2014]. Исследования показывают, что клиническая эффективность нативных и рекомбинантных препаратов не различается. Так, в мета-анализе, включающем 11 рандомизированных контролируемых схем ЭКО с 1 187 женщинами M.A. Youssef и соавторы сравнили рекомбинантные препараты вень Breg у пациенток со спонтанным абортом ниже в сравнении со здоровыми беременными женщинами, что подчеркивает важную роль этих клеток в процессе беременности. Более того, ХГ, по-видимому, влияет на генерацию плазматических клеток, а также на их способность продуцировать специфический тип блокирующих (pregnancy-protective) антител [Shumacher, 2017].
В итоге становится очевидно, что ХГ участвует в регуляции основных параметров иммунной толерантности (рисунок) и играет ключевую роль в сохранении беременности.
ХГ с ХГ из мочи в отношении конечного созревания ооцитов. Не было обнаружено существенного различия при сопоставлении основного результата у этих двух препаратов: коэффициент продолжающейся беременности/частота живородящих родов [Youssef et al., 2011].
В настоящее время исследуется влияние препарата ХГ на приживаемость эмбрионов при ЭКО. M. Gao с коллегами в своей работе показали влияние разных концентраций ХГ на приживаемость и благоприятное протекание беременности при переносе эмбрионов [Gao et al., 2019]. Мета-анализ включал в себя 15 рандомизированных клинических испытаний с 2 763 участниками. Было обнаружено, что в группе исследований с применением ХГ в концентрации 500 МЕ, достигались оптимальные результаты беременности, в сравнении с теми работами, когда использовались концентрации 700 и 1000 МЕ. В целом этот мета-анализ показал, что у бесплодных женщин, получавших внутриматочную инъекцию ХГ перед переносом эмбрионов, наблюдались значительно более высокие показатели живорождения, продолжающейся беременности, имплантации, а также более низкая частота выкидышей.
Относительно недавно подтверждено, что ХГ влияет на исход беременности у женщин с рецидивирующей неудачей имплантации через регулирование хомингового предпочтения Treg [Diao et al., 2017]. Похожее исследование на данную тему, проведенное X. Liu с соавторами, также подтвердило данные о действии ХГ. Было выполнено проспективное когортное исследование для оценки влияния внутриматочного введения ХГ на исходы беременности в циклах переноса эмбрионов, с участием 153 человек (152 цикла). Пациенты в группе, получавшей ХГ, имели значительно более высокие показатели клинической беременности, имплантации и числа живорождений, чем в контрольной группе, у них также был значительно более высокий процент периферических Tregs, чем в контроле [Liu et al., 2019]. Важно отметить, что для повышения уровня рецептивности эндометрия в протоколе ЭКО гормон применяется внутрима-точно до пересадки бластоцисты [Makrigiannakis et al., 2017]. Помимо этого, описаны протоколы введения ХГ-обработанных аутологических моно-нуклеарных клеток периферической крови в полость матки перед внесением эмбриона для имму-нодуляции эндометрия, что повышает вероятность имплантации после неудачных попыток ЭКО [Makrigiannakis et al., 2017].
Кроме того, описаны удачные попытки применения ХГ в терапии состояний «трансплантат против хозяина», причем улучшение состояния пациентов сопровождалось повышением экспрессии IDO мононуклеарными клетками [Elmaagacli et al., 2014].
Аутоиммунные заболевания, такие как ревматоидный артрит и синдром Шегрена, имеют менее выраженную клиническую манифестацию во время беременности, за счет особого состояния иммунитета матери. Применение ХГ в моделях на животных имитирует преимущества беременности в контексте аутоиммунных заболеваний [Rao, 2016]. На основе рандомизированных клинических испытаний, сравнивающих применение ХГ с текущей терапией и/или плацебо, применение гормона может быть рекомендовано в терапии ревматоидного артрита, синдрома Шегрена, диабета 1 типа и анкилозирующего спондилоартрита, течение которых также улучшается во время беременности [Rao, 2016].
-
A. De и соавторы выяснили, что при воздействии на клетки адаптивного иммунитета ХГ способен вызывать аутореактивные ответы [De et al., 2018]. Такой эффект гормона был продемонстрирован в опытах с мышами, склонными к систем-
- ной красной волчанке (СКВ). Введение ХГ повышало общую аутореактивность с усиленным образованием аутоантител, также наблюдалось возрастание синтеза цитокинов, ассоциированных с СКВ. По мнению авторов статьи, эти результаты могут дать представление о связи между наличием более высоких уровней ХГ (или введением ХГ) с наличием или появлением гуморального аутоиммунитета.
В 1995 г. было замечено терапевтическое влияние ХГ на саркому Капоши, ассоциированную с ВИЧ первого типа [Борисова и др., 2017], с того же времени идёт обсуждение об анти-ВИЧ активности ХГ, точнее, его свободной β-субъединицы. На данный момент апоптотическое влияние ХГ на клетки саркомы Капоши объясняют его взаимодействием с рецептором TGF-β [Lee-Huang et al., 1999]. Также были выявлены компоненты препарата ХГ, влияющие на ВИЧ in vitro , ими оказались вещества, подобные уринарным формам лизоцима С, РНКазы U и РНКазы А. Эти ферменты обладают сильной противовирусной активностью и способны разрушать структуру ВИЧ [Lee-Huang et al., 1999; Abdallah et al., 2004].
Интересно, что ХГ применяется также в схемах наращивания мышечной массы в бодибилдинге как отдельно, так и совместно с анаболическими стероидами. Также показана полная неэффективность использования данного препарата при употреблении внутрь в составе пищевых добавок. В США с 6 декабря 2011 г. лекарства и пищевые добавки, содержащие человеческий ХГ, находятся под запретом [HCG Diet Products …, 2011].
Итак, благодаря терапевтическим свойствам ХГ и его широкому спектру воздействия на организм, возможно его применение в наиболее разнообразных областях медицины для лечения и профилактики различных патологий. В целом, ХГ является одним из факторов, способствующих поддержанию иммунологической толерантности при беременности и протектирует реакции, направленные на сохранение плода.
Список литературы Иммунофармакологические аспекты применения хорионического гонадотропина
- Борисова М.А., Моисеенко Д.Ю., Смирнова О.В. Хорионический гонадотропин человека: неизвестное об известном // Физиология человека. 2017. Т. 43, № 1. С. 97-110.
- Заморина С.А. Механизмы иммуномодулирующей активности хорионического гонадотропина: монография. Пермь: Стиль МГ, 2017. 168 с.
- Заморина С.А., Ширшев С.В. Хорионический гонадотропин - фактор индукции иммунной толерантности при беременности // Иммунология. 2013. Т. 34, № 2. С. 105-107.
- Клиническая фармакология и фармакотерапия: учебник / под ред. В.Г. Кукеса, А.К. Стародубцева. М.: ГЭОТАР-Медиа, 2017. 1024 с.
- Куклина Е.М., Ширшев С.В. Регуляция окислительной активности нейтрофилов хорионическим гонадотропином. Роль женских половых стероидных гормонов // Известия АН. Сер. биол. 2003. № 4. С. 399-404.
- Раев М.Б. и др. Влияние хорионического гонадотропина на конверсию фенотипа и экспрессию гена hTERT Т-лимфоцитами разной степени дифференцировки // Биомедицинская химия. 2017. Т. 63, № 6. С. 539-545.
- Ширшев С.В. и др. Влияние эстриола, хорионического гонадотропина и онкостатина М на экспрессию рекомбиназы RAG-1 в регуляторных субпопуляциях Т-лимфоцитов // Бюллетень экспериментальной биологии и медицины. 2019. Т. 167, № 1. С. 63-67.
- Abdallah M.A. et al. Human fetal non-gonadal tissues contain human chorionic gonadotropin/luteinizing hormone receptors // Journal of Clinical Endocrinology and Metabolism. 2004. Vol. 89, № 2. P. 952.
- Acevedo H.F. Human chorionic gonadotropin (hCG), the hormone of life and death: a review // Journal of Experimental Therapeutics and Oncology. 2002. Vol. 2, № 3. P. 133-45.
- Choux C. et al. Placental volume and other first-trimester outcomes: are there differences between fresh embryo transfer, frozen-thawed embryo transfer and natural conception? // Reproductive BioMedicine Online. 2019. Vol. 38. Iss. 4. P. 538-548.
- Cole L. A. Biological functions of hCG and hCG-related molecules // Reproductive Biology and Endocrinology. 2010. Vol. 8. № 102.
- Cole L.A. HCG, the wonder of today's science // Reproductive Biology and Endocrinology. 2012. Vol. 10. P. 24.
- De A. et al. Human Chorionic Gonadotropin Influences Systemic Autoimmune Responses // Front Endocrinol (Lausanne). 2018. Vol. 9. P. 742.
- DOI: 10.3389/fendo.2018.00742
- Diao L.H. et al. Human chorionic gonadotropin potentially affects pregnancy outcome in women with recurrent implantation failure by regulating the homing preference of regulatory T cells // American Journal of Reproductive Immunology. 2017. Vol. 77, № 3. P. 1-8.
- Elmaagacli A.H. et al. Human chorionic gonadotropin and indolamine 2,3-dioxygenase in patients with GVHD // Bone Marrow Transplant. 2014. Vol. 49, № 6. Р. 800-805.
- Fettke F. et al. Maternal and Fetal Mechanisms of B Cell Regulation during Pregnancy: Human Chorionic Gonadotropin Stimulates B Cells to Produce IL-10 While Alpha-Fetoprotein Drives Them into Apoptosis // Frontiers of Immunology. 2016. Vol. 7. P. 495.
- Gao M. et al. Intrauterine injection of human chorionic gonadotropin before embryo transfer can improve in vitro fertilization-embryo transfer out-comes: a meta-analysis of randomized controlled trials // Fertility and Sterility. 2019. Vol. 112, № 1.
- Geginat J., Lanzavecchia A., Sallusto F. Proliferation and differentiation potential of human CD8+ memory T-cell subsets in response to antigen or homeostatic cytokines // Blood. 2003. Vol. 101. P. 4260-4266.
- Germain S.J. et al. Systemic inflammatory priming in normal pregnancy and preeclampsia: the role of circulating syncytiotrophoblast microparticles // Journal of Immunology. 2007. Vol. 178. P. 5949-5956.
- HCG Diet Products Are Illegal / U.S. Food and drug. 2011.
- Hui P.W. et al. Maternal serum pregnancy-associated plasma protein-A and free β-human chorionic gonadotrophin in pregnancies conceived with fresh and frozen-thawed embryos from in vitro fertilization and intracytoplasmic sperm injection // Prenatal Diagnosis. 2005. Vol. 25. P. 390-393.
- Imudia A.N. et al. Elective cryopreservation of all embryos with subsequent cryothaw embryo transfer in patients at risk for ovarian hyperstimulation syndrome reduces the risk of adverse obstetric outcomes: a preliminary study // Fertility and Sterility. 2013. Vol. 99. P. 168-173.
- Kayisli U.A. et al. Human chorionic gonadotropin contributes to maternal immunotolerance and endometrial apoptosis by regulating Fas-Fas ligand system // Journal of Immunology. 2003. Vol. 171, № 5. P. 2305-2313.
- Koldehoff M. et al. Modulating impact of human chorionic gonadotropin hormone on the maturation and function of hematopoietic cells // Journal of Leukocyte Biology. Vol. 90(5). 2011. P. 1017-1026.
- Leao R., Esteves S. Gonadotropin therapy in assisted reproduction: an evolutionary perspective from biologics to biotech // Clinics. 2014. Vol. 69(4). P. 279-293.
- Lee-Huang S. et al. Lysozyme and RNAses as anti-HIV components in beta-core preparations of human chorionic gonadotropin // Proceedings of the National Academy of Sciences. 1999. Vol. 96, № 6. P. 2678.
- Lei Z.M. et al. Upregulation of placental indoleamine 2,3-dioxygenase by human chorionic gonadotropin // Biology of Reproduction. 2007. Vol. 76, № 4. P. 639-44.
- Liu X. et al. Intrauterine administration of human chorionic gonadotropin improves the live birth rates of patients with repeated implantation failure in frozen-thawed blastocyst transfer cycles by increasing the percentage of peripheral regulatory T cells // Archives of Gynecology and Obstetrics. 2019. Vol. 299, Iss. 4. P. 1165-1172.
- Мaddur M.S. et al. Th17 Cells: Biology, Pathogenesis of Autoimmune and Inflammatory Diseases, and Therapeutic Strategies // American Journal of Pathology. 2012. Vol. 181. P. 8-18.
- Makrigiannakis A. et al. The Role of HCG in Implantation: A Mini-Review of Molecular and Clinical. // International Journal of Molecular Sciences. 2017. Vol. 18. P. 1305.
- Mellor A.L., Munn D.H. Tryptophan catabolism prevents maternal T-cell from activating lethal antifetal immune responses // Journal of Reproductive Immunology. 2001. Vol. 52. P. 5-13.
- Midley A.R.J., Pierce G.B. Immunohistochemical localization of human chorionic gonadotropin // Journal of Experimental Medicine. 1962. Vol. 115. P. 289-294.
- Nagirnaja L. et al. Structural and functional analysis of rare missense mutations in human chorionic gonadotrophin β-subunit. // Molecular Human Reproduction. 2012. Vol. 18, № 8. P. 379-390.
- Norris W. et al. Review: hCG, preeclampsia and regulatory T cells // Placenta. 2011. Vol. 32, № 2. P. 182-185.
- Rao C.V. Potential Therapy for Rheumatoid Arthritis and Sjögren Syndrome With Human Chorionic Gonadotropin // Reproductive Sciences. 2016. Vol. 23(5). P. 566-571.
- DOI: 10.1177/1933719115597765
- Rull K. et al. Chorionic gonadotropin beta-gene variants are associated with recurrent miscarriage in two European populations. // Journal of Clinical Endocrinology and Metabolism. 2008. Vol. 93, № 12. P. 4697-4706.
- Saito S. et al. Th1/Th2/Th17 and regulatory T-cell paradigm in pregnancy // American Journal of Reproductive Immunology. 2010. Vol. 601, № 63. P. 601-610.
- Sauss K. et al. The pregnancy hormone human chorionic gonadotropin differentially regulates plasmacytoid and myeloid blood dendritic cell subsets // American Journal of Reproductive Immunology. 2018. e12837.
- Schug S. et al. Endometrial human chorionic gonadotropin (hCG) expression is a marker for adequate secretory transformation of the endometrium // Archives of Gynecology and Obstetrics. 2019. Vol. 299, Iss. 6. P. 1727-1736.
- Schumacher A. Human Chorionic Gonadotropin as a Pivotal Endocrine Immune Regulator Initiating and Preserving Fetal Tolerance // International Journal of Molecular Sciences. 2017. Vol. 18(10).
- Schumacher A. et al. Human chorionic gonadotropin attracts regulatory T cells into the fetalmaternal interface during early human pregnancy // Journal of Immunology. 2009. Vol. 9. P. 5488-5497.
- Schumacher A. et al. Human chorionic gonadotropin as a central regulator of pregnancy immune tolerance // Journal of Immunology. 2013. Vol. 190(6). P. 2650-2658.
- Zimmermann G., Ackermann W., Alexander H. Epithelial human chorionic gonadotropin is expressed and produced in human secretory endometrium during the normal menstrual cycle // Biology of Reproduction. 2009. Vol. 80, Iss. 5. P. 1053-1065.
- Zimmermann G., Ackermann W., Alexander H. Expression and production of human chorionic gonadotropin (hCG) in the normal secretory endometrium: evidence of CGB7 and/or CGB6 beta hCG subunit gene expression // Biology of Reproduction. 2011. Vol. 86(3), Iss. 87.
- Wan H. et al. Chorionic gonadotropin induces dendritic cells to express a tolerogenic phenotype // Journal of Leukocyte Biology. 2008. Vol. 83, № 4. P. 894-901.
- Wang W.J. et al. Increased prevalence of T helper 17 (Th17) cells in peripheral blood and decidua in unexplained recurrent spontaneous abortion patients // Journal of Reproductive Immunology. 2010. Vol. 84(2). P. 164-170.
- Youssef M.A. et al. Recombinant versus urinary human chorionic gonadotrophin for final oocyte maturation triggering in IVF and ICSI cycles // Cochrane Database of Systematic Reviews. 2011. Vol. 4. CD003719.
- Zamorina S.A. et al. The role of human chorionic gonadotropin in regulation of naïve and memory T cells activity in vitro // International Immunopharmacology. 2018. Vol. 54. P. 33-38.


