Иммунологические критерии оценки эффективности консервативного лечения больных с ранними стадиями остеоартроза крупных суставов
Автор: Сазонова Н.В., Чепелева М.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2008 года.
Бесплатный доступ
Изучено влияние комплексного, патогенетически обоснованного консервативного лечения, включающего применение хондропротекторов, НПВП, препаратов кальция, физиотерапевтических процедур, ЛФК на показатели системного иммунного ответа у 87 больных с идиопатическим остеоартрозом коленного и тазобедренного суставов I-II стадии. Показано, что в процессе лечения достоверно не меняются основные показатели клеточного и гуморального иммунитета (CD3+, CD3+CD4+, CD3+CD8+, CD3-CD19+, CD3-CD16+CD56+, CD3+CD16+CD56+, CD3+CD25+, IgA, IgM, IgG), которые исходно не отличаются от значений контрольной группы и не выходят за пределы нормативных границ. В группе пациентов с хорошими и удовлетворительными результатами лечения выявлено статистически значимое снижение сывороточного IL-1β в сроки 6-24 месяца, сывороточного TNFα в сроки 12-24 месяца после начала консервативной терапии. При отсутствии терапевтического эффекта (сохранении болевого синдрома) отмечено кратковременное снижение уровня IL-1β через 6 месяцев, концентрации TNFα через 12 месяцев после начала курсового лечения. Полученные данные рекомендуется использовать для оценки эффективности лечебных мероприятий у пациентов с ранними стадиями остеоартроза крупных суставов в амбулаторно-поликлинических условиях.
Остеоартроз, консервативная терапия, иммунитет, цитокины
Короткий адрес: https://sciup.org/142121119
IDR: 142121119
Текст научной статьи Иммунологические критерии оценки эффективности консервативного лечения больных с ранними стадиями остеоартроза крупных суставов
Остеоартроз - болезнь, обусловленная действием биологических и механических факторов, дестабилизирующих нормальные отношения между процессами деградации и синтеза хондроцитов, внеклеточного матрикса суставного хряща и субхондральной кости [3].
Только раннее выявление остеоартроза и своевременное начало лечебных мероприятий может предотвратить развитие грубых деформаций суставных поверхностей и обеспечить стабилизацию патологического состояния. В результате поздней диагностики дистрофических заболеваний какое-либо консервативное воздействие на синовиальную среду суставов становится неэффективным [5]. В таких случаях приходится прибегать к оперативным методам лечения. Хирургические вмешательства на суставе, способные значительно улучшить качество жизни больных людей, относятся к дорогостоящему виду медицинской помощи, имеют ряд противопоказаний, нередко приводят к развитию послеоперационных осложнений. В связи с этим актуальность и экономическая значимость разработки методов диагностики и лечения начальных проявлений остеоартроза существенно возрастает [12].
В последние годы ведётся интенсивный поиск маркеров деградации и репарации суставных тканей, способных дать объективную информацию о течении патологического процесса, позволяющих осуществлять мониторинг консервативного патогенетического лечения, включая оценку хондропротекторных свойств лекарственных препаратов [4, 9, 11, 15].
При остеоартрозе наиболее значимые изменения происходят в суставном хряще, а также в субхондральной кости и синовиальной оболочке. Возможности непосредственно исследовать эти структуры ограничены, в связи с чем в амбулаторно-поликлинических условиях наиболее актуален выбор доступных, малоинвазивных методов лабораторной диагностики.
Цель настоящей работы – изучить влияние комплексного консервативного лечения на иммунный статус пациентов с остеоартрозом крупных суставов и выявить наиболее информативные лабораторные иммунологические тесты для оценки эффективности проводимой терапии.
МАТЕРИАЛЫ И МЕТОДЫ
Обследовано 87 пациентов с клиническими и рентгенологическими признаками идиопатического остеоартроза коленного и тазобедренного суставов I (n=39) и II стадии (n=48) в возрасте 44,0±1,87 лет, обратившихся в поликлинику ФГУ «РНЦ «ВТО» им акад. Г.А. Илизарова для проведения консервативного лечения, включающего применение хондропротекторов, НПВП, препаратов кальция, физиотерапевтических процедур, ЛФК. Длительность заболевания в среднем составляла 3,0±1,95 лет.
Состояние клеточного иммунитета изучали посредством типирования лимфоцитов периферической крови методом лазерной проточной цитофлюорометрии на цитометре «BECKMAN COULTER EPICS XL» (США). Для идентификации лимфоцитов и определения их субпопуляционного состава применялся набор моноклональных антител (МКАТ) компании «Immunotech» (Франция). Т-лимфоциты (CD3+), Т-хелперы (CD3+CD4+), цитотоксические Т-лимфоциты (CD3+CD8+), В-лимфоциты (CD3-CD19+), естественные киллеры (CD3-CD16+CD56+), естественные киллеры / Т-лимфоциты (CD3+CD16+CD56+), CD3+CD25+, несущие маркеры ранней активации Т-лимфоцитов, CD3+HLA-DR, несущие маркеры поздней активации Т-лимфоцитов, идентифицировали с помощью МКАТ, меченых фикоэритрином (РЕ) и флуоресци-низотиоцианатом (FITC). Количественное определение иммуноглобулинов классов А, М, G осуществлялось методом ИФА на иммуноферментном ана-
РЕЗУЛЬТАТЫ
При обращении в поликлинику Центра пациенты предъявляли жалобы на диффузную непостоянную боль в суставе, возникающую во время или сразу после физической нагрузки, непродолжительные ночные боли, умеренно выраженную болезненность околосуставных тканей.
Анализ особенностей иммунного статуса больных с ранними стадиями остеоартроза крупных суставов показал следующее: абсолютные значения лимфоцитов, гранулоцитов, моноцитов в первой (I) и во второй (II) группах достоверно не отличались от контрольных показателей (табл. 1). Абсолютное и относительное содержание Т-лимфоцитов (CD3+), В-лимфоцитов (CD3-CD19+) у пациентов с суставной патологией также было нормальным. Субпопуляционные нарушения отсутствовали (табл. 2).
лизаторе BIO-TEK Instruments Inc, EL x 808 (CША) с использованием набора реагентов ЗАО «Вектор-Бест» (Новосибирск). Определение ЦИК проводилось методом преципитации 3,5 % ПЭГ (ММ 6000). Определение уровня сывороточных цитокинов (IL-1β, TNFα) осуществлялось методом ИФА с применением диагностических тест-систем ООО «Цитокин» (Санкт-Петербург). В качестве контрольных использовались иммунологические показатели 29 добровольцев аналогичного возраста, у которых отсутствовали клинические признаки остеоартроза. В обследуемую выборку не входили носители вирусов гепатитов В и С, лица с отягощенным аллергическим анамнезом. Иммунологическое обследование проводилось до лечения, через 6, 12, 15-24 месяца после начала комплексной, патогенетически обоснованной консервативной терапии.
Ретроспективно пациенты были разделены на 2 группы. Первую (I) группу составили 76 (87,4 %) больных с хорошими и удовлетворительными результатами консервативного лечения (существенное уменьшение интенсивности болевых ощущений в пораженном суставе, стойкий терапевтический эффект не менее 24 месяцев). Во вторую (II) группу вошли 11 (12,3 %) пациентов с неудовлетворительными результатами проведенной терапии (сохранение болевого синдрома).
Полученные данные обрабатывались с помощью методов непараметрической статистики с использованием U-критерия Вилкоксона с применением программного обеспечения AtteStat 1.0 [1].
ОБСУЖДЕНИЕ
Уровень сывороточных иммуноглобулинов классов А, М, G не выходил за пределы нормативных границ (табл. 3). В обеих группах достоверные отличия были выявлены в отношении CD25+ и HLA-DR – позитивных Т-лимфоцитов и сывороточных ЦИК, играющих существенную роль в поддержании гомеостаза, являясь составной частью иммунорегуля-торного процесса, где ведущее место принадлежит активации Т-клеток. Обращало на себя внимание статистически значимое повышение относительного и абсолютного количества естественных киллеров / Т-лимфоцитов (CD3+CD16+CD56+) (p<0.05), биологическая роль которых реализуется через их цитотоксические эффекты [6]. Зарегистрированные в отношении CD3+CD16+CD56+ изменения, по нашему мнению, могут служить косвенным доказа- тельством участия внутриклеточных микроорга- суставных и околосуставных тканях при идиопати- низмов в развитии патологических изменений в ческом остеоартрозе.
Показатели периферической крови после проведения курса консервативной терапии
Показатели клеточного иммунитета после проведения курса консервативной терапии
Содержание сывороточных иммуноглобулинов основных классов и ЦИК
Таблица 1
|
Лимфоциты (109/л) |
Моноциты (109/л) |
Гранулоциты (109/л) |
|
|
Контрольная группа: |
|||
|
1,5±0,09 |
0,26±0,03 |
3,2±0,17 |
|
|
До лечения: |
|||
|
I |
1,4±0,06 |
0,2±0,01 |
3,4±0,15 |
|
II |
1,3±0,09 |
0,2±0,04 |
3,4±0,38 |
|
6 месяцев после начала консервативной терапии: |
|||
|
I |
1,5±0,11 |
0,2±0,02 |
3,3±0,16 |
|
II |
1,7±0,24 |
0,2±0,02 |
3,6±0,47 |
|
12 месяцев после начала консервативной терапии: |
|||
|
I |
1,4±0,07 |
0,2±0,02 |
3,1±0,13 |
|
II |
1,5±0,11 |
0,2±0,04 |
3,0±0,21 |
|
15-24 месяца после начала консервативной терапии: |
|||
|
I |
1,3±0,11 |
0,2±0,04 |
3,7±0,33 |
|
II |
1,5±0,19 |
0,2±0,07 |
3,6±0,51 |
Примечание: I – группа больных с хорошими и удовлетворительными результатами лечения, II - группа больных с неудовлетворительными результатами лечения.
Таблица 2
|
СD3+ |
СD3-CD19+ |
CD3+CD4+ |
CD3+CD8+ |
CD3+CD16+CD56+ |
CD3-CD16+CD56+ |
CD3+HLA-DR |
CD3+CD25+ |
|
|
Контрольная группа: |
||||||||
|
% |
74,2±1,19 |
9,7±0,81 |
46,6±1,49 |
24,2±1,66 |
4,5±0,57 |
13,1±1,24 |
2,5±0,34 |
15,1±0,79 |
|
109/л |
1,12±0,063 |
0,16±0,017 |
0,71±0,043 |
0,36±0,031 |
0,07±0,009 |
0,2±0,023 |
0,04±0,004 |
0,2±0,02 |
|
До лечения: |
||||||||
|
% |
73,2±0,94 |
10,7±0,57 |
49,1±1,07 |
23,2±0,95 |
↑ 8,9±0,69* |
10,9±0,63 |
↑ 5,0±0,48+ |
↑ 25,1±0,99+ |
|
I 109/л |
1,0±0,05 |
0,16±0,012 |
0,67±0,036 |
0,31±0,022 |
↑ 0,12±0,011* |
0,15±0,011 |
↑ 0,07±0,006+ |
↑ 0,3±0,02+ |
|
% |
70,2±2,29 |
9,7±0,96 |
44,4±3,02 |
25,0±0,41 |
↑ 11,7±1,49* |
15,7±2,41 |
↑ 5,2±1,35+ |
↑ 29,6±1,88+ |
|
II 109/л |
0,9±0,07 |
0,14±002 |
0,56±0,052 |
0,32±0,048 |
↑ 0,14±0,017* |
0,19±0,021 |
↑ 0,07±0,002+ |
↑ 0,4±0,03+ |
|
6 месяцев начала консе |
рвативной терапии: |
|||||||
|
% |
73,5±1,26 |
10,0±0,62 |
44,9±1,63 |
26,7±1,63 |
10,4±0,89 |
12,8±1,06 |
4,6±0,43 |
↓ 19,6±1,25 * |
|
I 109/л |
1,13±0,09 |
0,16±0,014 |
0,69±0,064 |
0,41±0,037 |
0,16±0,002 |
0,19±0,015 |
0,07±0,004 |
0,3±0,02 |
|
% |
72,4±2,22 |
10,8±0,14 |
47,5±3,57 |
22,1±2,19 |
8,8±1,02 |
14,8±2,29 |
6,5±1,01 |
↓ 19,1±2,04 * |
|
II 109/л |
1,03±0,17 |
0,19±0,016 |
0,64±0,02 |
0,36±0,037 |
0,15±0,025 |
0,2±0,047 |
0,06±0,002 |
0,3±0,06 |
|
12 месяцев после начала консервативной терапии: |
||||||||
|
% |
72,5±1,52 |
10,1±0,63 |
45,3±1,54 |
25,1±1,59 |
10,3±0,79 |
12,8±0,89 |
5,0±0,55 |
↓ 19,9±1,23 * |
|
I 109/л |
1,0±0,054 |
0,14±0,012 |
0,63±0,04 |
0,34±0,028 |
0,14±0,015 |
0,17±0,012 |
0,07±0,007 |
0,3±0,03 |
|
% |
70,8±3,11 |
11,2±0,97 |
44,9±3,84 |
21,8±1,97 |
10,3±1,06 |
14,7±3,08 |
5,4±0,97 |
↓ 18,1±2,31 * |
|
II 109/л |
1,03±0,11 |
0,17±0,03 |
0,67±0,101 |
0,36±0,02 |
0,15±0,02 |
0,21±0,042 |
0,08±0,003 |
0,2±0,05 |
|
15-24 месяца начала консервативной терапии: |
||||||||
|
% |
67,4±2,27 |
11,6±0,97 |
44,1±1,17 |
23,7±1,93 |
11,1±2,03 |
13,8±1,35 |
4,3±0,49 |
22,3±1,77 |
|
I 109/л |
0,9±0,07 |
0,17±0,02 |
0,6±0,05 |
0,29±0,03 |
0,14±0,03 |
0,17±0,019 |
0,06±0,007 |
0,3±0,04 |
|
% |
70,7±3,23 |
9,4±1,37 |
40,9±4,08 |
24,5±3,89 |
9,7±1,17 |
15,2±2,19 |
4,0±1,35 |
22,1±1,78 |
|
II 109/л |
1,0±0,09 |
0,13±0,034 |
0,6±0,07 |
0,35±0,08 |
0,14±0,03 |
0,23±0,07 |
0,05±0,009 |
0,3±0,02 |
Примечание: + - p<0,05 относительно показателей контрольной группы; I – группа больных с хорошими и удовлетворительными результатами лечения, II - группа больных с неудовлетворительными результатами лечения; * - p<0,05 относительно значений дооперационного периода.
Таблица 3
|
IgA (мг/мл) |
IgM (мг/мл) |
IgG (мг/мл) |
ЦИК (у.е.) |
|
|
Контрольная группа: |
||||
|
1,55±0,347 |
1,58±0,774 |
13,1±1,79 |
28,2±1,62 |
|
|
До лечения: |
||||
|
I |
1,54±0,111 |
1,46±0,117 |
11,5±0,65 |
↑ 47,5±2,852+ |
|
II |
1,49±0,192 |
1,88±0,427 |
11,2±0,16 |
↑ 52,1±6,49+ |
|
6 месяцев после начала консервативной терапии: |
||||
|
I |
1,38±0,123 |
1,38±0,187 |
11,5±1,08 |
49,1±3,06 |
|
II |
1,19±0,284 |
1,75±0,422 |
15,2±2,85 |
45,3±3,61 |
|
12 месяцев после начала консервативной терапии: |
||||
|
I |
1,24±0,245 |
1,16±0,157 |
14,1±1,42 |
50,7±4,75 |
|
II |
1,19±0,261 |
1,29±0,197 |
13,8±2,26 |
55,3±5,19 |
|
15-24 месяца после начала консервативной терапии: |
||||
|
I |
1,36±0,401 |
1,21±0,155 |
13,2±1,65 |
47,7±1,02 |
|
II |
1,51±0,192 |
1,88±0,427 |
12,4±2,42 |
46,3±3,69 |
Примечание: I – группа больных с хорошими и удовлетворительными результатами лечения, II - группа больных с неудовлетворительными результатами лечения; + - p<0,05 относительно показателей контрольной группы.
Из литературных источников известно, что важнейшим звеном в патогенезе остеоартроза является дисбаланс цитокинов [2, 7, 8]. Провоспали-тельные (деструктивные) цитокины, в частности IL-1β, TNFα, IL-6, IL-17, инициируют увеличение высвобождения протеаз, угнетают синтез протеогликанов и коллагенов хондроцитами. Деструктивные (противовоспалительные) цитокины, такие как IL-4 и IL-10, блокируют продукцию IL-1, увеличивают выработку антогониста рецептора IL-1 (IL-1RA) и снижают уровень NO-синтазы в хондроцитах [3, 10]. При этом главными медиаторами костной резорбции и местной воспалительной реакции при остеоартрозе являются IL-1β и TNFα [13, 14]. Согласно многочисленным исследованиям, в синовиальной мембране, синовиальной жидкости и хрящевой ткани больных остеоартрозом обнаруживаются повышенные концентрации данных цитокинов, в то же время сведения о содержании IL-1β и TNFα в периферической крови больных с ранними стадиями остеоартроза крупных суставов достаточно противоречивы. Исследуя уровень сывороточных цитокинов у пациентов с остеоартрозом коленного и тазобедренного суставов I-II стадии до начала курсового лечения, мы получили следующие результаты: в обеих группах наблюдалась тенденция к повышению содержания IL-1β (рис. 1), а концентрация TNFα достоверно превышала контрольные значения (p<0,05), оставаясь при этом в пределы нормативных границ (рис. 2).
Согласно современным представлениям, консервативное лечение пациентов с дегенеративнодистрофическими заболеваниями должно быть комплексным и патогенетически обоснованным. Медикаментозная терапия включала применение хондропротекторов, обладающих способностью ингибировать протеолитические ферменты, стимулировать синтез протеогликанов хондроцитами и гиалуроновой кислоты синовиоцитами, улучшать реологические свойства синовиальной жидкости [4]. Больные получали хондролон или алфлутоп по 1 мл (№ 15) внутримышечно, далее - терафлекс по 2 капсулы 3 раза в сутки на протяжении 3 недель, в последующем - по 1 капсуле 2 раза в сутки в течение 2 месяцев. В комплекс лечебных мероприятий также входили нестероидные противовоспалительные препараты (НПВП), обезболивающее и противовоспалительное действие которых обусловлено угнетением активности циклооксигеназы (ЦОГ) – ключевого фермента метаболизма арахидоновой кислоты. Нимулид применялся по 1 таблетке 2 раза в сутки в течение 14 дней, диклофенак – по 1 таблетке (25 мг) 3 раза в сутки на протяжении 7 дней. Для профилактики осложнений со стороны желудочно – кишечного тракта всем пациентам назначался омез по 1 капсуле перед завтраком на время приёма НПВП. Курс консервативного лечения в среднем продолжался 3 месяца.
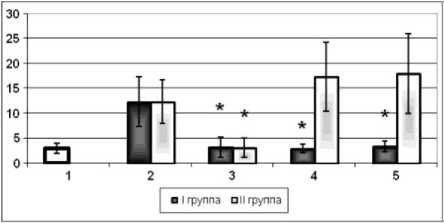
Рис. 1. Содержание IL-1β: 1 – контрольная группа, 2 – до лечения, 3 - 6 месяцев после начала консервативной терапии, 4 – 12 месяцев после начала консервативной терапии, 5 – 18-24 месяца после начала консервативной терапии; * - p<0,05 относительно исходных значений
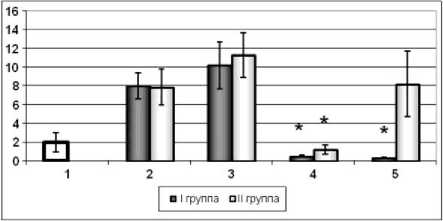
Рис. 2. Содержание TNFα: 1 – контрольная группа, 2 – до лечения, 3 - 6 месяцев после начала консервативной терапии, 4 – 12 месяцев после начала консервативной терапии, 5 – 18-24 месяца после начала консервативной терапии; * - p<0,05 относительно исходных значений
Кроме того, больные посещали лечебную физкультуру, способствующую уменьшению артралгий и улучшению функций пораженных суставов. Также пациентам проводились физиотерапевтические процедуры (электрофорез, ультразвук, лазер, магнит), способствующие купированию болевого синдрома, уменьшению отека околосуставных тканей, рефлекторного спазма околосуставных мышц, улучшению микроциркуляции.
На протяжении всего периода наблюдения (24 месяца) в обеих группах на исходном уровне сохранялось содержание лимфоцитов, моноцитов, гранулоцитов, CD3+, CD3+CD4+, CD3+CD8+, CD3-CD19+, CD3-CD16+CD56+, CD3+CD16+CD56+, CD3+HLADR, ЦИК, IgA, IgM, IgG. Через 6-12 месяцев после начала курсового лечения, независимо от полученных результатов, достоверно снижалось относительное количество Т-лимфоцитов, экспрессирующих CD25+ (IL-2R, Tac) антиген, являющийся низкоафинным рецептором интерлейкина-2 (p<0,05). При этом абсолютные значения показателя достоверно не менялись (см. табл. 2).
Наиболее значимые изменения были выявлены в отношении исследуемых цитокинов. Как в первой (I), так и во второй (II) группах через 6 месяцев после начала консервативной терапии регистрировалось достоверное снижение уровня сывороточного IL-1β (p<0,05). При этом у пациентов с хорошими и удовлетворительными ре- зультатами лечения эти изменения сохранялись на протяжении всего периода наблюдения, а в группе с отсутствием терапевтического эффекта - не более 6 месяцев (рис. 1). Содержание TNFα достоверно снижалось через 12 месяцев после начала консервативной терапии в обеих группах (p<0,05). Однако в группе с неудовле- творительными результатами лечения на последующем этапе наблюдения данный показатель возвращался к исходным значениям, а в группе с хорошими и удовлетворительными результатами TNFα сохранялся на уровне значений контрольной группы (рис. 2).
ЗАКЛЮЧЕНИЕ
Системный иммунологический ответ организма на дегенеративно-дистрофические изменения в суставных тканях на ранних стадиях идиопатического гонартроза и коксартроза проявляется умеренным увеличением в периферической крови количества естественных киллеров / Т-лимфоцитов (CD3+CD16+CD56+), клеток, экспрессирующих маркеры ранней (CD25+) и поздней (HLA-DR) активации Т-лимфоцитов, повышением концентраций сывороточных ЦИК и TNFα.
Проведение комплексной, патогенетически обоснованной консервативной терапии, включающей применение хондропротекторов, НПВП, препаратов кальция, физиотерапевтических процедур, ЛФК не оказывает существенного влияния на основные показатели клеточного и гуморального иммунитета (CD3+, CD3+CD4+, CD3+CD8+, CD3-CD19+, CD3-CD16+CD56+, CD3+CD16+CD56+, CD3+CD25+, IgA, IgM, IgG), которые исходно не отличаются от значений контрольной группы и не выходят за пределы нормативных границ.
Наиболее информативной является динамика сывороточных IL-1β и TNFα, ключевых цитокинов, в наибольшей степени причастных к деструкции хрящевой ткани. У пациентов с хорошими и удовлетворительными результатами лечения содержание IL-1β в периферической крови достоверно снижается в сроки 6-24 месяца, а концентрация TNFα – в сроки 12-24 месяца после начала консервативной терапии. При отсутствии терапевтического эффекта (сохранении болевого синдрома) изменения в отношении исследуемых цитокинов являются кратковременными. Уровень IL-1β снижается через 6 месяцев, а содержание TNFα -через 12 месяцев после начала курсового лечения.
Таким образом, в амбулаторно-поликлинических условиях для оценки эффективности лечебных мероприятий у пациентов с ранними стадиями остеоартроза крупных суставов рекомендуется исследование сывороточных цитокинов IL-1β и TNFα до лечения, IL-1β через 12 и 24 месяца, TNFα через 24 месяца после начала консервативной терапии.


