Иммунологические особенности остеоартроза крупных суставов различной этиологии
Автор: Чепелева Марина Владимировна, Швед Наталья Сергеевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2012 года.
Бесплатный доступ
Представлены данные по анализу особенностей иммунного статуса 159 больных с идиопатическим, гипопластическим, посттравматическим остеоартрозом коленного и тазобедренного суставов, коксартрозом - исходом АНГБ, остеоартрозом крупных суставов, развившимся на фоне ревматоидного артрита.
Иммунная система, остеоартроз
Короткий адрес: https://sciup.org/142121533
IDR: 142121533
Текст научной статьи Иммунологические особенности остеоартроза крупных суставов различной этиологии
Диагностика и лечение тяжелых форм остеоартроза относятся к числу актуальнейших задач современной медицины.
Многие исследователи сходятся во мнении, что факторами, способствующими хронизации патологического процесса при остеоартрозе, являются нарушения в системе иммунитета, но их конкретные механизмы до конца не изучены [4, 5, 7, 8, 9]. Дан- ные об изменениях иммунного статуса при одних и тех же нозологических формах неоднозначны, противоречивы и не позволяют выработать единой концепции для их оценки.
Цель настоящего исследования – изучить влияние этиологического фактора на иммунный статус больных остеоартрозом крупных суставов.
МАТЕРИАЛЫ И МЕТОДЫ
Представленные в работе результаты получены при обследовании 159 пациентов с остеоартрозом II-III стадии в возрасте 29 лет – 72 года, из них 21 – с идиопатическим остеоартрозом тазобедренного сустава, 42 – с идиопатическим остеоартрозом коленного сустава, 12 – с гипопластическим остеоартрозом коленного сустава, 13 – с посттравматическим остеоартрозом тазобедренного сустава, 28 – с посттравматическим остеоартрозом коленного сустава, 32 – с исходом асептического некроза головки бедра (АНГБ) и 11 – с остеоартрозом крупных суставов, развившимся на фоне ревматоидного артрита. Пациенты с патологией тазобедренного и коленного суставов проходили плановое хирургическое лечение в ортопедических отделениях ФГБУ «РНЦ «ВТО» им. академика Г. А. Илизарова за период с 2004 по 2009 год.
Типирование лимфоцитов периферической крови осуществлялось методом лазерной про- точной цитометрии на цитометре «BECKMAN COULTER EPICS XL» (США) [3]. Т-лимфоциты (CD3+CD19-), Т-хелперы (CD3+CD4+), цитотоксические Т-лимфоциты (CD3+CD8+), В-лимфоциты (CD3-CD19+), натуральные киллеры (CD3-CD16+CD56+), натуральные киллеры / Т-лимфоциты (CD3+CD16+CD56+), CD3+HLA-DR, несущие маркеры поздней активации Т-лимфоцитов, идентифицировали с помощью моноклональных антител (МКАТ), меченых фикоэритрином (РЕ) и флуоресцинизотио-цианатом (FITC). Использовался набор МКАТ компании «Immunotech» (Франция). Количественное определение иммуноглобулинов классов А, М, G осуществлялось методом ИФА на иммуноферментном анализаторе BIO-TEK Instruments Inc, ELx808 (CША) с использованием набора реагентов ЗАО «Вектор-Бест» (Новосибирск), цитокинов IL-6, TNFα методом ИФА на иммуноферментном анализаторе BIO-TEK Instruments Inc, ELx808 (CША) с использованием диа- гностических тест-систем фирмы «BioSource Europe» (Бельгия). Определение уровня ЦИК проводилось методом преципитации 3,5 % ПЭГ (ММ 6000).
В качестве контрольных использовались иммунологические показатели 29 добровольцев аналогичного возраста, у которых отсутствовали клинические признаки остеоартроза. В обследуемую выборку не входили носители вирусов гепатитов В и С, лица с отягощенным аллергическим анамнезом. Забор крови осуществлялся из локтевой вены натощак.
Полученные данные были обработаны с помощью методов непараметрической статистики с использованием U-критерия Вилкоксона для не- зависимых выборок (Гельфгат Е. Л. с соавт., 2000; Гланц С., 1998; Гублер Е. В., 1978). Статистические гипотезы считали подтвержденными при уровне значимости pu<0,05. Учитывая применение непараметрических методов статистики, результаты исследования были представлены в виде медиан и интерквартильных размахов. При обработке полученных данных применяли программное обеспечение AtteStat 1.0, разработанное в информационно-вычислительном центре ФГБУ «РНЦ «ВТО» им. акад. Г. А. Илизарова» и выполненное как надстройка к «Microsoft Exсel» программного продукта «Microsoft Office» [1].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ результатов исследования показал следующее: в синовиальной жидкости больных остеоартрозом, независимо от этиологии заболевания, наблюдалось увеличение содержания иммуноглобулинов классов А и G (IgА, IgG) (рис. 1, 2), выявлялся IgM, который, согласно литературным данным, отсутствует в синовиальной среде здорового сустава (рис. 3) [3]. Концентрация цитокинов в синовиальной жидкости больных остеоартрозом различной этиологии была существенно выше, чем в периферической крови (табл. 1, 2). Согласно литературным данным, дисбаланс цитокинов приводит к разрушению структурной и функциональной целостности хрящевого экстрацеллюлярного матрикса. Цитокины, необходимые в небольших количествах для поддержания гомеостаза, начинают в избытке выявляться в синовиальной жидкости, их повышенная продукция способствует прогрессированию патологического процесса, и, как следствие, развитию дегенеративно-дистрофических и воспалительных изменений в суставных тканях [2, 6]. В синовиальной жидкости больных остеоартрозом отмечалось увеличение содержания TNFα, являющегося одним из главных медиаторов костной резорбции и местной воспалительной реакции. Было выявлено повышение концентрации IL-6 – одного из наиболее активных цитокинов, участвующих в реализации иммунного ответа, для которого характерны не только провоспалительные эффекты, но и противовоспалительные свойства, опосредованные с одной стороны ингибицией продукции IL-1 и TNFα, а с другой стороны – активацией синтеза и секреции антагонистов провоспалительных цитокинов IL-1pa и растворимых рецепторов TNFα (табл. 1, 2).
Содержание Т- и B-лимфоцитов в периферической крови во всех группах не выходило за пределы нормативных границ (табл. 3). В то же время у пациентов с посттравматическим коксартрозом и гонартрозом было выявлено статистически значимое, в сравнении с показателями больных остеоартрозом другой этиологии, снижение количества CD3+CD19-, преимущественно за счёт популяции Т-хелперов (CD3+CD4+). Данные изменения мы расценили как пролонгированную иммунологическую реакцию на последствия травматического разрушения тканей сустава.
У пациентов с посттравматическим, гипопластическим, идиопатическим остеоартрозом, коксар-трозом – исходом АНГБ-соотношение CD3+CD4+ к CD3+CD8+ достоверно не отличалось от значений контрольной группы (рис. 4). У больных с остеоартрозом, развившимся на фоне ревматоидного артрита, наблюдалось увеличение данного индекса за счёт более высоких, чем в контроле, значений CD3+CD4+ и более низких значений CD3+CD8+.
В периферической крови больных идиопатическим, посттравматическим остеоартрозом, коксартрозом – исходом АНГБ, ревматоидным артритом отмечалось повышение содержания ЕКТ (CD3+CD56+CD16+) – особой категории лимфоидных клеток, биологическая роль которых реализуется через их цитотоксические эффекты. Увеличение абсолютного и относительного количества ЕКТ у этой категории пациентов может служить косвенным доказательством участия микроорганизмов в развитии патологических изменений в суставных и околосуставных тканях при остеоартрозе.
В периферической крови больных остеоартрозом крупных суставов независимо от этиологии заболевания мы обнаружили более высокие, чем в контрольной группе, значения лимфоцитов, экспрессирующих активационные маркеры (HLA-DR). Учитывая важнейшую роль HLA-DR – молекул в процессах антигенного распознавания и запуска каскада молекулярных процессов формирования специфического иммунного ответа, можно предположить, что увеличение числа Т-лимфоцитов, экспрессирующих эти гликопротеины, является отражением процессов системной активации клеток иммунной системы в ходе распознавания собственных антигенов соединительной ткани, а также микробных пептидов, которые при остеоартрозе могут рассматриваться как антигены эндогенного происхождения. Повышение количества CD3+HLA-DR клеток выявлялось у пациентов независимо от этиологии заболевания, что свидетельствует в пользу его патогенетической значимости, подтверждая участие аутоиммунных процессов в развитии патологических изменений при остеоартрозе.
Значительное повышение концентрации ЦИК, IgM и IgG наблюдалось у пациентов с ревматоидным артритом, что было обусловлено воспалительной реакцией и выраженным аутоиммунным компонентом (рис. 5) (табл. 4). Статистически значимое, в сравнении с показателями контрольной группы, увеличение уровня сывороточных ЦИК было выявлено также у пациентов с идиопатическим, посттравматическим остеоартрозом коленного и тазобедренного суставов, коксартрозом – исходом АНГБ. Однако, несмотря на достоверные отличия, у этой категории больных содержание ЦИК не выходило за пределы границ физиологической нормы.
Наиболее приближенными к значениям контрольной группы были показатели системы иммунитета у больных гипопластическим коксартрозом, так как для данной патологии свойственна, в первую очередь, ана-томо – биомеханическая неполноценность сустава с сохраненным гиалиновым хрящём и менее выраженными дегенеративными и воспалительными изменениями в синовиальной среде, чем при остеоартрозе другой этиологии. Наиболее выраженными были изменения иммунного статуса у пациентов с остеоартрозом, развившимся на фоне ревматоидного артрита, в основе патогенеза которого лежат генетически детерминированные аутоиммунные процессы, обусловленные дефицитом Т-супрессорной функции лимфоцитов.
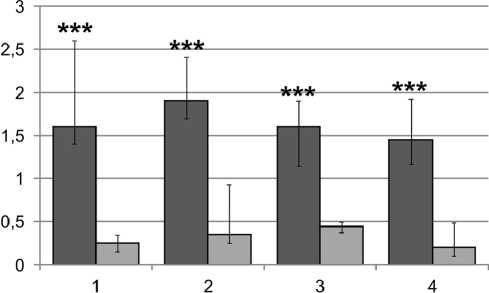
Рис. 1. Концентрация IgA в периферической крови (первый столбец) и синовиальной жидкости (второй столбец): 1 – идиопатический ОА крупных суставов; 2 – посттравматический ОА крупных суставов; 3 – остеоартроз – исход АНГБ; 4 – гипопластический ОА тазобедренного сустава; *** p<0,001 относительно значений синовиальной жидкости
12 3 4
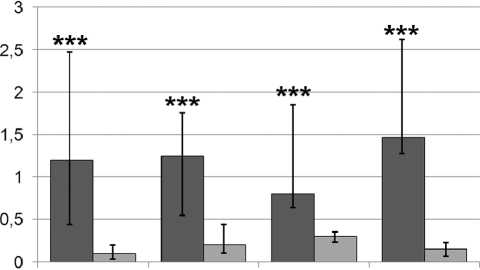
Рис. 2. Концентрация IgG в периферической крови (первый столбец) и синовиальной жидкости (второй столбец): 1 – идиопатический ОА крупных суставов; 2 – посттравматический ОА крупных суставов; 3 – осте-артроз – исход АНГБ; 4 – гипопластический ОА тазобедренного сустава; * - p<0,05, ** - p<0,01, *** - p<0,001 относительно значений синовиальной жидкости
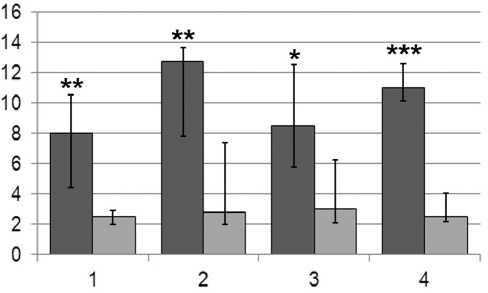
Рис. 3. Концентрация IgМ в периферической крови (первый столбец) и синовиальной жидкости (второй столбец): 1 – идиопатический ОА крупных суставов; 2 – посттравматический ОА крупных суставов; 3 – остеартроз – исход АНГБ; 4 – гипопластический ОА тазобедренного сустава; *** – p<0,001 относительно значений синовиальной жидкости
Уровень цитокинов в синовиальной жидкости у пациентов с ОА коленного и тазобедренного суставов различной этиологии (медианы значений показателей и интерквартильные размахи)
Таблица 1
|
Группы |
Показатели |
|
|
IL-6 (пг/мл) |
TNFα (пг/мл) |
|
|
Идиопатический ОА коленного сустава (n=15) |
128,6 (31,5÷291,0) |
6,04 (4,46÷15,7) |
|
Посттравматический ОА коленного сустава (n=10) |
159,4 (58,5÷315,0) |
8,43 (6,31÷9,84) |
|
ОА тазобедренного сустава - исход АНГБ (n=10) |
165,0 (27,9÷302,5) |
5,08 (2,54÷7,62) |
Примечание: * - p<0,05, **- p<0,01 относительно показателей контрольной группы.
Таблица 2
Уровень сывороточных цитокинов в периферической крови пациентов с ОА коленного и тазобедренного суставов различной этиологии (медианы значений показателей и интерквартильные размахи)
|
Группы |
IL-6 (пг/мл) |
TNFα (пг/мл) |
|
Контрольная группа (n=29) |
0,91 (0÷2,12) |
1,58 (0÷8,74) |
|
Идиопатический ОА тазобедренного сустава (n=21) |
0,1 (0÷0,9) |
1,3 (0÷9,04) |
|
Идиопатический ОА коленного сустава (n=42) |
0,1 (0÷2,3) |
3,3 (1,3÷5,2) |
|
Гипопластический ОА тазобедренного сустава (n=12) |
0 (0÷0,6) |
0 (0÷1,87) |
|
Посттравматический ОА тазобедренного сустава (n=13) |
0,14 (0,07÷0,21) |
2,6 (3,9÷5,2) |
|
Посттравматический ОА коленного сустава (n=28) |
2,25 (0,93÷2,52) |
3,6 (2,6÷6,01) |
|
ОА тазобедренного сустава - исход АНГБ (n=32) |
0,42 (0÷2,3) |
0,65 (0÷2,6) |
Примечание: * - p<0,05, **- p<0,01 относительно показателей контрольной группы.
Таблица 3
Показатели клеточного иммунитета у пациентов с остеоартрозом коленного и тазобедренного суставов различной этиологии
|
Значения |
Показатели |
||||||
|
СD3+CD19- |
СD3-CD19+ |
CD3+CD4+ |
CD3+CD8+ |
CD3-CD16+CD56+ |
CD3+CD16+CD56+ |
СD3-HLA-DR |
|
|
Контрольная группа (n=29) |
|||||||
|
% |
75,6 (71,3÷77,5) |
10,1 (8,0 ÷11,7) |
50,3 (43,4÷52,4) |
22,1 (17,1÷25,9) |
12,3 (11,1÷16,2) |
3,9 (2,7÷4,2) |
2 (1,2÷2,9) |
|
109/л |
1,32 (1,02÷1,41) |
0,14 (0,12÷0,21) |
0,79 (0,67÷0,92) |
0,35 (0,28÷0,52) |
0,24 (0,19÷0,26) |
0,05 (0,04÷0,08) |
0,03 (0,02÷0,04) |
|
Идиопатический ОА тазобедренного сустава (n=21) |
|||||||
|
% |
76,5 (72,8÷78,7) |
9,7 (6,6 ÷10,7) |
45,5 (41,7÷53,5) |
29 (26,6÷33,0) |
10,4 (8,9÷14,1) |
↑6,9** (4,0÷7,5) |
↑4,0** (2,9÷6,3) |
|
109/л |
1,07 (0,95÷1,41) |
0,14 (0,09÷0,18) |
0,71 (0,56÷0,86) |
0,38 (0,34÷0,5) |
0,16 (0,11÷0,28) |
↑0,1** (0,07÷0,15) |
↑0,06* (0,04÷0,1) |
|
Идиопатический ОА коленного сустава (n=42) |
|||||||
|
% |
74,4 (69,1÷76,3) |
9,9 (5,8 ÷13,6) |
44,6 (42,2÷53,5) |
28 (19,6÷32,8) |
12,6 (11,5÷14,9) |
↑6,8** (4,5÷8,4) |
↑5,9** (4,2÷6,7) |
|
1109/л |
1,21 (1,02÷1,47) |
0,19 (0,07÷0,26) |
0,77 (0,56÷0,98) |
0,43 (0,34÷0,49) |
0,19 (0,09÷0,28) |
↑0,09** (0,07÷0,19) |
↑0,09** (0,07÷0,12) |
|
Гипопластический ОА тазобедренного сустава (n=12) |
|||||||
|
% |
71 (67,5÷76,3) |
10,6 (4,9 ÷14,3) |
45,5 (41,9÷48,8) |
25,3 (20,4÷28,3) |
14,6 (8,3÷18,1) |
4,9 (2,4÷6,8) |
↑3,2* (2,1÷4,1) |
|
109/л |
0,9 (0,8÷1,1) |
0,18 (0,06÷0,22) |
0,54 (0,51÷0,8) |
0,27 (0,21÷0,32) |
0,19 (0,13÷0,23) |
0,06 (0,04÷0,09) |
0,04 (0,02÷0,05) |
|
Посттравматический ОА тазобедренного сустава (n=13) |
|||||||
|
% |
↓65,6** (64,6÷68,4) |
9,8 (7,2 ÷10,1) |
↓42,6* (37,4÷44,9) |
23,3 (19,6÷25,4) |
↑21,8** (18,6÷24,5) |
↑5,6* (5,4÷7,5) |
↑4,0* (2,6÷4,5) |
|
109/л |
0,91 (0,77÷1,06) |
0,12 (0,1÷0,14) |
↓0,65* (0,37÷0,69) |
0,26 (0,21÷0,5) |
0,34 (0,19÷0,43) |
↑0,1* (0,09-0,17) |
↑0,04* (0,04÷0,06) |
|
Посттравматический ОА коленного сустава (n=28) |
|||||||
|
% |
↓66,6** (53,9÷70,7) |
9,5 (8,4÷12,1) |
↓41,0** (34,9÷43,2) |
23,1 (19,1÷26,3) |
↑19,8* (15,6÷23,9) |
↑5,2* (4,4÷6,7) |
↑4,0* (3,2÷4,5) |
|
109/л |
1,07 (0,74÷1,23) |
0,16 (0,09÷0,18) |
↓0,62* (0,38÷0,7) |
0,39 (0,29÷0,47) |
0,26 (0,21÷0,29) |
0,08 (0,05÷0,09) |
↑0,06** (0,05÷0,11) |
|
ОА тазобедренного сустава - исход АНГБ (n=32) |
|||||||
|
% |
75,5 (72,1÷78,7) |
9,2 (7,3÷12,0) |
50,5 (42,4÷53,9) |
23,8 (18,5÷29,6) |
12 (6,2÷14,6) |
↑5,6* (4,0÷8,3) |
↑4,0** (3,7÷5,1) |
|
109/л |
1,36 (1,11÷1,46) |
0,18 (0,1÷0,23) |
0,86 (0,75÷0,98) |
0,39 (0,33÷0,49) |
0,19 (0,12÷0,26) |
0,06 (0,03÷0,11) |
↑0,06* (0,04÷0,11) |
|
ОА коленного сустава, развившийся на фоне ревматоидного артрита (n=11) |
|||||||
|
% |
76,1 (70,1÷78,2) |
8,3 (7,0÷11,8) |
55,1 (45,4÷56,8) |
19,2 (16,5÷22,6) |
14,5 (8,5÷16,1) |
↑6,1* (4,0÷8,3) |
↑4,0* (2,7÷5,5) |
|
109/л |
1,3 (1,01÷1,32) |
0,17 (0,1÷0,2) |
0,9 (0,7÷1,01) |
↓0,25* (0,19÷0,3) |
0,19 (0,09÷0,24) |
↑0,09* (0,07÷0,16) |
↑0,05* (0,04÷0,07) |
Примечание: * - p<0,05, **- p<0,01 относительно показателей контрольной группы.
Таблица 4
Уровень сывороточных иммуноглобулинов основных классов у пациентов с ОА коленного и тазобедренного суставов различной этиологии (медианы значений показателей и интерквартильные размахи)
|
Группы |
IgA (мг/мл) |
IgM (мг/мл) |
IgG (мг/мл) |
|
Контрольная группа (n=29) |
2,39 (1,87÷3,26) |
1,46 (0,79÷2,17) |
14,4 (10,9÷18,5) |
|
Идиопатический ОА тазобедренного сустава (n=21) |
2,03 (1,5÷2,99) |
1,5 (0,74÷2,46) |
10,6 (7,3÷12,7) |
|
Идиопатический ОА коленного сустава (n=42) |
1,47 (1,03÷2,07) |
0,85 (0,62÷1,5) |
7,6 (5,9÷13,7) |
|
Гипопластический ОА тазобедренного сустава (n=12) |
1,49 (1,26÷1,98) |
1,45 (1,21÷2,84) |
11,2 (8,9÷12,5) |
|
Посттравматический ОА тазобедренного сустава (n=13) |
1,58 (1,23÷1,86) |
1,58 (1,11÷2,89) |
11,7 (7,9÷17,1) |
|
Посттравматический ОА коленного сустава (n=28) |
2,17 (1,51÷3,96) |
1,03 (0,84÷1,72) |
17,3 (10,6÷24,8) |
|
ОА тазобедренного сустава - исход АНГБ (n=32) |
↓1,55* (1,08÷1,86) |
0,9 (0,7÷1,2) |
↓8,5** (5,6÷10,1) |
|
ОА, развившийся на фоне ревматоидного артрита (n=11) |
2,5 (2,05÷3,3) |
↑2,4* (2,08÷3,04) |
↑22,4* (17,9÷25,5) |
Примечание: * - p<0,05, **- p<0,01 относительно показателей контрольной группы.
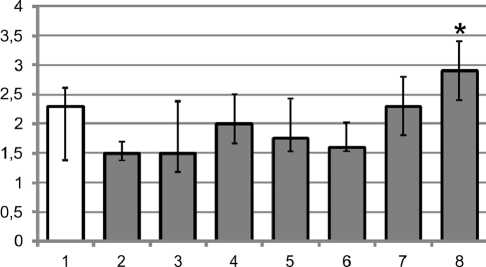
Рис. 4. CD4+/СD8+ у пациентов с ОА крупных суставов различной этиологии (у.е.): 1– контрольная группа, 2 – идиопатический ОА коленного сустава, 3 – идиопатический ОА тазобедренного сустава, 4 – гипопластический ОА тазобедренного сустава, 5 – посттравматический ОА коленного сустава, 6 – посттравматический ОА тазобедренного сустава, 7 – остеоартроз тазобедренного сустава – исход АНГБ; 8 – остеоартроз, развившийся на фоне ревматоидного артрита; * – p<0,05 относительно значений контрольной группы
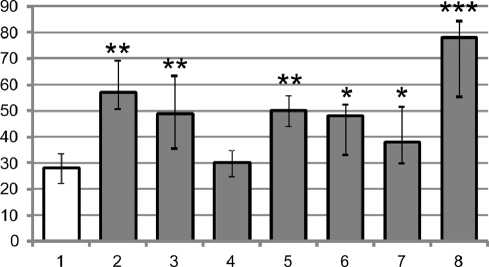
Рис. 5. Уровень ЦИК у пациентов с ОА крупных суставов различной этиологии (у.е.): 1– контрольная группа, 2 – идиопатический ОА коленного сустава, 3 – идиопатический ОА тазобедренного сустава, 4 – гипопластический ОА тазобедренного сустава, 5 – посттравматический ОА коленного сустава, 6 – посттравматический ОА тазобедренного сустава, 7 – остеоартроз тазобедренного сустава – исход АНГБ; 8 – остеоартроз, развившийся на фоне ревматоидного артрита; * – p<0,05, ** - p<0,01, *** – p<0,001 относительно значений контрольной группы
ЗАКЛЮЧЕНИЕ
Таким образом, этиология оказывает влияние на иммунный статус больных коксартрозом и го-нартрозом II-III стадии, что необходимо учитывать при лабораторном иммунологическом мониторинге
эндопротезирования или других видов хирургических вмешетельств, применяемых для лечения остеоартроза на поздних стадиях патологического процесса.


