Иммунотерапия в комплексном лечении фоновой и предраковой патологии шейки матки
Автор: Леваков С.А., Кедрова А.Г., Ванке Н.С., Саркисова А.А., Кожурина К.А.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (1), 2010 года.
Бесплатный доступ
Понятие «предраковые заболевания шейки матки» появилось в 1947 г. Оно объединило ряд патологических процессов, характеризующихся наличием структурных и клеточных изменений многослойного плоского эпителия шейки матки (ШМ) с нарушением слоистости и повышенной митотической активностью, но без вовлечения в процесс базальной мембраны. Подобные изменения, без лечения, наиболее часто приводили к развитию рака. Такая трансформация не является стремительным процессом, а занимает от 3 до 8 лет.
Предраковые заболевания шейки матки, рак шейки матки, вирусы папиллом человека (hpv)
Короткий адрес: https://sciup.org/14338316
IDR: 14338316
Текст научной статьи Иммунотерапия в комплексном лечении фоновой и предраковой патологии шейки матки
Клиническая больница № 83 ФМБА России
Понятие «предраковые заболевания шейки матки» появилось в 1947г. Оно объединило ряд патологических процессов, характеризующихся наличием структурных и клеточных изменений многослойного плоского эпителия шейки матки (ШМ) с нарушением слоистости и повышенной митотической активностью, но без вовлечения в процесс базальной мембраны. Подобные изменения, без лечения, наиболее часто приводили к развитию рака [1,2]. Такая трансформация не является стремительным процессом, а занимает от 3 до 8 лет [2]. На сегодняшний день, несмотря, на значительный прогресс в диагностике и лечении предраковой патологии ШМ, статистические данные остаются неутешительными, констатируя по РФ около 13 тысяч новых случаев инвазивного рака ШМ в год [3]. При этом частота фоновой и предраковой патологии, в том числе, таких опасных форм, как внутриэпителиальная цервикальная неоплазия и лейкоплакия с вирусными поражениями, неуклонно возрастает. Печален и тот факт, что большое число современных женщин и не подозревает о наличии разнообразной и не безопасной патологии ШМ, часто протекающей скрыто, без клинических проявлений. Реальной профилактической мерой для предупреждения рака ШМ является своевременное выявление и лечение фоновых и предраковых состояний, которые составляют от 30 до 45% от всех обращений на амбулаторном приеме врача гинеколога в женской консультации. Неутешительные данные статистики по увеличению числа таких больных на 1,5-2,5% в год в репродуктивно активной возрастной группе от 20 до 40 лет делают необходимым поиск оптимальных схем лечения, что имеет большое социальное значение. Основополагающий вклад в решение проблемы РШМ внесли труды Х. Цур Хаузена и его коллег, в 1974,1983,1996 годах, открывших вирусы папиллом человека (HPV) и доказавших их онкогенный риск. Так, их разновидности HPV 16/18 являются основным этиологическим фактором развития диспластических процессов (CIN I-III, cervical intraepithelial neoplasia) и РШМ. Такая папилломовирусная инфекция передается половым путем, отличается высокой контагиозностью и быстрым распространением, но при нормальной местной иммунной и гормональной реакции имеет тенденцию к самоизлечению у 80-85% женщин в течение 8-14 месяцев [4]. При более длительной персистенции вируса в базальном слое эпителия возникают изменения, требующие врачебного контроля и лечения, так как могут переходить в рак. Дело в том, что длительная активация экспрессии вирусных онкогенов инициирует многостадийный процесс генетических и эпигенетических нарушений, способствующих опухолевой прогрессии. Эти нарушения затрагивают гены, контролирующие иммунный ответ, регуляцию клеточного цикла и апоптоз. Уже при легкой степени дисплазии (CIN I), у больных с выявленной вирусной инфекцией — HPV/16(+),частота аллельных делеций в области участка 6 хромосомы (6p21.3) достигает 42%. Данные нарушения изменяют главный комплекс гистосовместимости (HLA класса III), а также снижают функциональную активность провоспалительных цитокинов TIF и IL-6, что приводит к неполноценности иммунного ответа [5]. Дополнительно несостоятельность местного иммунитета, при персистенции HPV16, проявляется в снижении уровня иммуноглобулинов IgA/IgG в цервикальной слизи [6]. Также роль иммунодефицита, как фактора, влияющего на частоту заболеваний ШМ была доказана у ВИЧ — инфицированных больных [7]. По мнению В.Н. Прилепской нарушения системы местного иммунитета объясняют высокую частоту рецидивов папилловирусных поражений ШМ после любого проведенного стандартного лечения (таблица1) [8].
Таблица 1. Эффективность основных методов лечения предраковой патологии ШМ.
|
Деструктивные методы |
Цитотоксические препараты |
|
|
Физические: Эффект 60-95%, рецидивы от 10 до 25% |
Хирургическое иссечение |
Подофиллин Подофиллотоксин (кондилин) 5-фторурацил Проспидин Этопозидовая мазь Эффективность 20-75%, рецидивы 20%. Есть токсичность!!! |
|
Электрохирургические методы |
||
|
Криодеструкция |
||
|
Лазеровапоризация |
||
|
Химические, эффект 40-70%, рецидивы от 15 до 40% |
Азотная кислота |
|
|
Трихлоруксусная кислота |
||
|
Солковагин (уксусная+щавелевая+молочная+азотная кислоты+ионы металлов) |
||
|
Ферезол |
||
Неспецифическая противовирусная и общеукрепляющая терапия (витамины В6, С, Е), десенсибилизирующие средства, транквилизаторы, препараты интерферонов и их индукторы, озонотерапия, адапто-гены (настойка элеутерококка, китайского лимонника), синтетические иммуномодуляторы (пентоксил, мети-лурацил, ликопид, неовир, пановир, изопринозин, по-лиоксидоний и др.) часто назначаются дополнительно. Такая терапия достаточно дорогостоящая и, иногда, малоэффективна, так как на сегодняшний день нет препаратов, избирательно воздействующих на вирус папилломы человека, а назначение иммунотропных препаратов требует знаний механизма их действия на иммунную систему. Таким образом, представляется целесообразным определить роль иммунотропной терапии в комплексном лечении предраковой патологии ШМ. При этом необходимо основываться на факте, что наиболее часто применяемые препараты не являются специфичными, а их длительное и бесконтрольное применение зачастую не приводит к излечению от HPV, а усугубляет иммуносупрессию. По данным литературы, эффективность терапии напрямую зависит от: уровня синтеза онкобелка Е7, степени потери гетерозиготности в локусе D6S291 и от числа копий ДНК вируса (метод Hybrid Capture II) [9]. Препарат для иммунокоррекции должен обладать следующими характеристиками: наличие иммуномодулирующих и иммуностимулирующих свойств; клинически доказанная эффективность; хорошая биодоступность; безопасность и минимальные побочные проявления; высокая совместимость с другими препаратами; наличие предсказуемых и хорошо изученных схем метаболизма. Основываясь на данных опроса врачей женских консультаций наиболее часто применялись иммуномодуляторы (табл.2). Их эффективность, оцененная по элиминации HPV16/18 составила 45-55% в монорежиме, и 75- 95% при комплексом лечении, после деструкции ШМ (Таблица 2).
противовоспалительным действием, что снижает степень интоксикации, и выраженность воспалительного процесса [16]. Несмотря на то, что эффект интерферонов является ранним, короткосрочным и неспецифичным, они тормозят «горизонтальное» распространение вирусов, повышая вирусоустойчивость неинфициро-ванных эпителиальных клеток. Каждый препарат имеет свой механизм противовирусного действия, но все они задерживают или блокируют его репликацию, нарушая способность к самовоспроизведению. Иммунный ответ под воздействием иммунотропных препаратов можно представить в несколько этапов: стимуляция биохимических процессов в макрофагах и увеличение продукции цитокинов (интерлейкинов и интерферонов); усиление пролиферации Т-лимфоцитов, T-хелперов и естественных клеток-киллеров. При этом происходит активация хемотаксической и фагоцитарной активности моноцитов, макрофагов и полиморфно-ядерных клеток, в частности, за счет увеличения цГМФ. Основным фактором, препятствующим активной репликации вируса, являются NK клетки и зрелые цитотоксические T-лимфоциты (CD8+), очевидным свойством которых является их направленность действия на клетку-мишень с вирусными частицам, а также стимуляция выработки интерферонов. Роль и механизм направленного действия иммунотропных препаратов при патологии шейки матки, в основном, изучался в нерандомизированных исследованиях у больных с выявленным HPV 16/18. Так, данные полученные при применении препарата Изопринозин показали элиминацию вируса при проведении монотерапии в 66% наблюдениях, а при комплексном воздействии эффективность достигала 98%. За двух летний период наблюдения препарат уменьшал число рецидивов болезни в 7 раз в группе из 126 больных с CIN II [17]. Наш опыт включает применение: изопринозина, панавира, аллокин-альфа в комплексном лечении больных с фоновыми и предраковыми со-
Таблица 2. Сводные данные эффективности иммунотропной терапии в комплексном лечении интраэпителиальных неоплазий ШМ (CIN).
|
Препараты |
Эффективность после оного — двух курсов терапии |
Автор, год |
|
Панавир |
55 %-90,5% в зависимости от степени CIN |
Иванян А.М., Мелихова Н.Ю. 2004 [10] |
|
Изопринозин |
76-95,3% |
Григорьева Е.Е., Линаск Л.И., 2008 [11] |
|
Ликопид |
92-95% |
Агикова Л. А., 1996 [12] |
|
Неовир |
55-75% |
Сафронникова Н.Р., 2002 [13] |
|
Индукторы интерферонов (Виферон, Циклоферон) |
45-82%, комплексное воздействие |
Почтаренко ОВ., Галустян С. 2007 [14] |
|
Иммунофан |
75-85%, в зависимости от степени CIN |
Подистов Ю.И., 2005 [15] |
Активность таких препаратов связана с их способностью индуцировать образование высоких титров эндогенных интерферонов в организме. Например, внутримышечное введение 250 мг Неовира, по выявляемым сывороточным титрам, эквивалентно введению 6-9 миллионов МЕ рекомбинантного альфа-интерферона [13]. Также указанные препараты активирует звенья неспецифического иммунитета, стимулируя стволовые клетки костного мозга, Т-лимфоциты и макрофаги, усиливая синтез цитокинов (ИЛ-1, ИЛ -2, ИЛ-6, ФНО-a) и нормализуя баланс между субпопуляциями Т- хелперных и Т-супрессорных клеток. Неспецифический иммунитет изменяется за счет усиления фагоцитарной активности нейтрофилов, активации NK-клеток и повышенного синтеза иммуноглобулинов. Некоторые из иммуномодулирующих препаратов, например Галавит, обладают стояниями ШМ, инфицированных вирусом папилломы человека (HPV).
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследование являлось проспективным, открытым и несравнительным. Обследовано 84 больных с псевдоэрозиями, лейкоплакиями, дисплазиями ШМ (CIN I-III степени). Методом полимеразной цепной реакции (ПЦР) у 60 (71,4%)пациенток был выявлен вирус папилломы тип 16. Из них лечение изопринозином получили 35 (58,3%) пациенток, панавиром — 14 (23,3%) больных и аллокином-альфа – 11 (18,3%). Все больные разделены на три подгруппы в зависимости от диагноза, который устанавливался на основании цитологического и/или гистологического исследований: группа I -псевдоэрозии и лекоплакии – 12 (20%) женщин; группа
II: CIN I- 29(48,3%), и группа III – CIN II - III -19 (31,7%). Возраст пациенток составил от 21 до 42 лет, общее состояние по шкале активности ВОЗ 0-1. В исследование не включались больные, подвергнутые ранее любому виду противовирусной терапии и пациентки, имеющие серьезные сопутствующие заболевания. Каждая пациентка проходила обследование и оценивалась в соответствие с тяжестью патологии. Из особенностей менструальной и репродуктивной функции следует отметить, что у 26 (43,3%) больных ранее производилось искусственное прерывание беременности, а у 34 (56,6%) выявлялась урогенитальная инфекция. С целью изучения влияния иммуномодуляторов на иммунологические показатели в процессе терапии нами были исследованы иммунограммы до начала терапии и через 1 месяц по ее окончанию.
Изопринозин назначали по 1000 мг (2 таблетки) х 3 раза в день в течение 10 дней. Панавир 0,04% раствор в/в, струйно, по 5мл через день, курс 5 инъекций. Алло-кин – альфа (аллоферон) вводился путем 3-х кратной подкожной инъекции по 1мг 1,3,5 дни лечения. У 34 (56,7%) женщин иммунотерапия назначалась совместно с антибиотиками в зависимости от бактериальной чувствительности. Стандартная схема включала: левофлоксацин (элефокс, флорацид, таваник) 500мг х один раз в день – 14 дней и метронидазол (трихопол) 500мг х 2 раза в день –14 дней с оценкой эффекта через 4-6 недель. Деструктивное, местное лечение проводилось препаратом «солковагин» –8 (13,3%) больных, лазервапоризация – 19(31,7%), криодеструкция – 21 (35%), электроконизация ШМ – 12 (20%).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование исходного иммунного статуса не показало серьезных изменений ни в одной из групп пациенток. Практически все средние значения находились в пределах диапазона физиологической нормы. Однако относительное содержание лимфоцитов CD8+ у 17(60,7%) больных CIN II и III было чуть ниже нижней границы и составляло 23,45±2,1%. Проведенное лечение приводило к увеличению числа Т-лимфоцитов, причем как CD16+ клеток, так и CD8+, хотя последнее могло происходить за счет части клеток CD4+ , при этом также увеличилось число В -лимфоцитов (рис.1).
Таким образом, после применения иммуномодуляторов происходила активация NK- клеток и
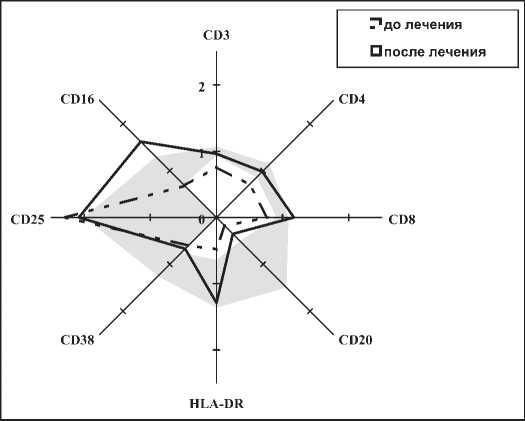
Рисунок 1. Иммунный статус больных с фоновыми и предраковыми состояниями ШМ.
зрелых цитотоксических T-лимфоцитов(CD8+). При фоновых заболеваниях и начальных вариантах CIN вирус находится в эписомальном состоянии, поэтому для эго элиминации, на этом этапе, подходит активация любого звена иммунитета как клеточного, так и гуморального. Именно поэтому при начальном уровне патологии может наступить самоизлечение. Противовирусный механизм иммуномодулирующих препаратов также проявляется при эписомальном состоянии вируса. Например, Изопринозин меняет сферическую структуру рибосом. Интеграции вируса в геном клетки приводит к более грубым нарушениям эпителия и возникает CIN II–III, что сопровождается делецией гена Е2, влияющего на синтез двух важных белков онкогенеза Е6 и Е7. Их повышенный уровень изменяет синтез белков апаптоза: p53 (E6) и Rb (E7), что преждевременно активирует переход клетки в S-фазу цикла [18]. На этом этапе притивови-русное воздействие возможно только при повреждении клетки-мишени с помощью NK- клеток, зрелых цитотоксических T-лимфоцитов(CD8+) и макрофагов, что является ключевым препятствием для активной репликации вируса. Поэтому на стадии умеренной и тяжелой дисплазии одни противовирусные препараты бессильны остановить процесс опухолевой трансформации и эти клетки должны быть удалены любым из известных методов: электрокоагуляция, криодеструкция, лазеровапаризация, электроконизация ШМ. Применение иммунотропных препаратов после деструктивных методов улучшает неспецифический иммунитет, способствует лучшему заживлению и, как следствие, уменьшает риск развития рецидива заболевания (таблица 3) [18].
На первом этапе лечения иммунокорелирующие препараты могут быть применены при фоновых процессах ШМ и при начальных формах дисплазии (CIN I), что сопровождается значительным снижением активности вируса HPV16 и 18 типов, определяемых при ПЦР — диагностике. При этом уже после первого курса лечения тест на HPV – инфекциюстановится отрицательным у 36 (87,8%) больных. В других случаях одни противовирусные препараты не могут остановить процесс опухолевой трансформации, так как инфицированные клетки не содержат вирус в традиционном понимании и больные с CINII-III должны подвергаться деструктивным методам лечения: электрокоагуляции, криодеструкции, лазеровапаризации, электро-конизации ШМ. Противовирусное же лечение должно проводиться на втором этапе с целью нормализации местного иммунитета и профилактики рецидива заболевания. Необходимо помнить, что иммунотропные препараты могут назначаться в комплексном лечении и в острый период заболевания вместе с базисной антибиотикотерапией, либо сразу после ее окончания. С профилактической целью препараты могут использоваться в виде монотерапии. Длительное назначение и высокие дозы иммуномодуляторов могут привести к иммунодепрессивному эффекту. Выполнение основных принципов назначения иммунотропных препаратов сокращает возможность развития побочных эффектов. Иммунотропные препараты не являются панацеей в лечении умеренной и тяжелой форм дисплазий ШМ, они только усиливают действие базисной деструктивной терапии.
Список литературы Иммунотерапия в комплексном лечении фоновой и предраковой патологии шейки матки
- Киселев В.И, Ашрафян Л.А, Бударина С.О. Этиологическая роль вируса папилломы человека в развитии рака шейки матки: генетические и патогенетические механизмы, возможности терапии и профилактики.//Гинекология №4 том 6/2004 стр.174-179.
- Киселев Ф.Л., Киселева Н.П., Кобзева В.К. Статус ДНК вируса папилломы человека в опухолях шейки матки.//Молекулярная биология. 2001 т.35 №3 стр. 470-476.
- Состояние онкологической помощи населению России в 2006 году/Под редакцией акад. В.И. Чисова, В.В. Старинского, Г.В. Петровой. М. ФГУ МНИЩИ им. Герцена. 2007, с.180
- Boer M.A., Peters Lex A., Mohammed Farid Aziz., et.al. Human papillomavirus type 16 E6, E7 and L1 variants in cervical cancer in Indonesia, Suriname., and the Netherlands.//J. G.O. 94(2004) 488-494
- Биджиева Б.А., Осташкин А.С., Мазуренко Н.Н.//Особенности полиморфизма генов цитокинов у больных раком шейки матки. Вопросы онкологии, 2007. 53(1),стр. 7-10
- Benton E.C., Arends M.J.//Human papillomavirus in the immunosuppressed. In: Lancet. Papillomavirus Reviews: Current Research on Papillomaviruses. Leeds: Leeds University Press, 271-297, 1996
- Ebrahim SH, McKenna MT, Selik R, et.al.//AIDS-Associated Cervical Cancer in Europe and USA, 1994-2000. International Conference on AIDS. Int Conf AIDS. 2002 Jul 7-12; 14: abstract no. ThPeC7486
- Кулаков В.И., Прилепская В.Н.//Профилактика рака шейки матки. Клинические рекомендации. Москва 2008г. стр. 67
- Khleif S.N. Molecular mechanisms of human papillomavirus-induced carcinogenesis: insights on potential targets for prevention//Orlando, ASCO 2005, Educational book p. 407410
- Иванян А. Н., Н. Ю. Мелихова, Е. В. Голицина//Оптимизация комплексной терапии патологии шейки матки, обусловленной вирусом папилломы человека. Гинекология 2004, Т6,№1, стр. 45
- Григорьева Е.Е., Линаск Л.И.//РМЖ. 2008; 16: 19: 1221-1225.
- Агикова Л.А. Рациональная иммунокорригируюшая терапия гликопином больных с папилломавирусной инфекцией шейки матки: Автореф. дис.. канд. мед. наук. М., 1996.
- Сафронникова Н.Р. Мерабишвили В.М.//Профилактика вирусзависимых онкологических заболеваний. Диагностика и лечение папилломавирусной инфекции/пособие для врачей. Онкология.-2002.-№3.-166-172.
- Почтаренко О.В., С.А.Галустян. Опыт применения виферона 1 млн ме и метода радиоволновой хирургии при лечении поражений аногенитальной области вирусом папилломы человека.//Журнал «Врач и аптека ХХI века»№3/2007 г.Краснодар (стр.28-29)
- Подистов Ю.И., Короткова О.В., Ротобельская Л.Е. Иммунологические подходы к использованию иммуномодуляторов при предраковых состояниях ШМ.//Медицинская иммунология. 2004, Т.6 №3-5 стр.45.
- Кротин П.Н., Павленко Е.О., Ландина О.Ю., Меркулова Л.В. Опыт лечения дисплазии шейки матки у женщин с HPV препаратом Галавит//Лечащий врач, № 8, 2003 С. 75
- Башмакова М.А., Савичева А.М. 2002г Изопринозин (терапевтическое применение, фармакокинетика).//М.: Мед. кн.; Н. Новгород: Изд-во НГМА, 1999. -15 с.
- Swartz R.J., Cox D.D., Cantor S.B. A new methodology to compare clinical strategies with application in screening and diagnosis for caervical intraepithelial neoplasia (CIN). ASCO 2004., abs. 6105


