Имплантация самораскрывающегося каркаса транскатетерного клапана in vitro в 3D модель сердца пациента с дисфункцией пути оттока из правого желудочка
Автор: Войтов А.В., Манукян С.Н., Владимиров С.В., Бородин В.П., Кобелев Е., Журавлева И.Ю., Архипов А.Н., Горбатых А.В., Рзаева К.А., Ничай Н.Р., Богачев-прокофьев А.В., Сойнов И.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.39, 2024 года.
Бесплатный доступ
Актуальность. Транскатетерная имплантация клапана легочной артерии является одним из самых актуальных вопросов эндоваскулярной хирургии врожденных пороков сердца. Однако на данный момент не существует «идеального» клапана для транскатетерной имплантации. Баллонорасширяемые клапаны легочной артерии для транскатетерной имплантации имеют прямой каркас, из-за чего приходится выполнять предварительное стентирование нативного выходного отдела правого желудочка или клапаносодержащего кондуита во избежание периоперационных осложнений. Данная тактика увеличивает время проведения вмешательства, усложняет технику имплантации клапана, а также повышает стоимость операции. Альтернативой являются самораскрывающиеся клапаны, которые направлены преимущественно на устранение легочной регургитации. Определение адекватной зоны имплантации для имплантации клапана имеет решающее значение для успешного лечения дилатированного нативного пути оттока из правого желудочка (ПОПЖ). Именно поэтому большую роль в предоперационном протоколе исследования изображений, полученных в ходе проведения компьютерной томографии (КТ), играет 3D реконструкция с детализаций анатомических структур на каждом уровне.Цель: оценить свойства транскатетерного самораскрывающегося каркаса клапана легочной артерии и выполнить ее имплантацию in vitro в 3D модель сердца пациента с дисфункцией ПОПЖ. Материал и методы. Разработана модель самораскрывающегося нитинолового каркаса транскатетерного клапана для имплантации в позицию клапана легочной артерии, основанная на наиболее часто встречаемой анатомии дисфункции пути оттока из правого желудочка. Проведены тесты радиальных усилий каркаса и испытания загрузки клапана в систему доставки. Создана 3D реконструкция правых отделов сердца с нижней полой веной с детализаций анатомических структур на каждом уровне.Результаты. Напечатана физическая 3D модель на SLA 3D принтере «Formlabs Form 3B+» из фотополимера Elastic 50A (Formlabs Inc., США). В условиях рентгеноперационной выполнена тестовая имплантация каркаса клапана легочной артерии. Имплантация показала хорошие характеристики имплантируемого каркаса, отмечается полное раскрытие каркаса, отсутствие деформации, плотное прилегание к стенкам ствола легочной артерии.Заключение. Путем оптимизации конструкции опорного каркаса удалось усовершенствовать транскатетерную модель каркаса клапана, основанную на анализе наиболее часто встречаемых дисфункций ПОПЖ. 3D печатные конструкции позволяют безопасно выполнять тестирование разрабатываемых моделей транскатетерных клапанов, а также выявлять и своевременно устранять имеющиеся недостатки.
Биопротез, транскатетерный клапан легочной артерии, 3d печать, инновации
Короткий адрес: https://sciup.org/149145639
IDR: 149145639 | УДК: 616.124.3-089.843-092.4 | DOI: 10.29001/2073-8552-2024-39-2-104-111
Текст научной статьи Имплантация самораскрывающегося каркаса транскатетерного клапана in vitro в 3D модель сердца пациента с дисфункцией пути оттока из правого желудочка
Войтов А.В., Манукян С.Н., Владимиров С.В., Бородин В.П., Кобелев Е., Журавлева И.Ю., Архипов А.Н., Горбатых А.В., Рзаева К.А., Ничай Н.Р., Богачев-Прокофьев А.В., Сой-нов И.А. Имплантация самораскрывающегося каркаса транскатетерного клапана in vitro в 3D модель сердца пациента с дисфункцией пути оттока из правого желудочка. Сибирский журнал клинической и экспериментальной медицины. 2024;39(2):104–111.
Voitov A.V., Manukian S.N., Vladimirov S.V., Borodin V.P., Kobelev E., Zhuravleva I.Yu., Arkhipov A.N., Gorbatykh A.V., Rzayeva K.A., Nichay N.R., Bogachev-Prokophiev A.V., Soynov I.A. Implantation of a self-expanding transcatheter valve in vitro into a 3D heart model of a patient with right ventricular outflow tract dysfunction. Siberian Journal of Clinical and Experimental Medicine. 2024;39(2):104–111.
Дисфункция пути оттока из правого желудочка (ПОПЖ) наблюдается у пациентов после хирургической коррекции врожденных пороков сердца, связанных реконструкцией или протезированием оттока из правого желудочка в легочную артерию. Дисфункция ПОПЖ чаще всего проявляется легочной регургитацией, но также может быть следствием стеноза анастомоза или клапана, перегиба кондуита / гомографта, пролиферации неоинтимы, кальцификации или сдавления грудины. Трансаннулярная пластика при тетраде Фалло сопровождается нарушением целостности клапана легочной артерии, что приводит к развитию значительной легочной регургитации у 50% пациентов в отдаленном периоде [1, 2].
Протезирование легочной артерии с использованием кондуитов применяется у пациентов с атрезией клапана легочной артерии, транспозицией магистральных артерий и стенозом легочной артерией, двойным отхождением магистральных сосудов от правого желудочка и стенозом пути оттока в легочную артерию, во время процедуры Росса, а также у пациентов, которым выполняется репротезирование клапана легочной артерии. Наиболее часто для протезирования ПОПЖ используются легочные аллографты, ксенокондуиты или трубчатые протезы без клапана [3]. Эти кондуиты со временем подвержены дисфункции, особенно расположенные вне анатомического положения, что приводит к легочной регургитации и / или стенозу. Легочная регургитация в конечном итоге вызывает прогрессирующую дилатацию и дисфункцию правого и левого желудочков, аритмии и внезапную сердечную смерть [4, 5].
Хирургическая замена легочного клапана или кондуита является окончательной процедурой лечения дисфункции ПОПЖ, чтобы предотвратить развитие необратимого повреждения правого желудочка [6]. Однако хирургическое вмешательство становится технически сложным с каждой последующей процедурой из-за выраженного спаечного процесса [7].
Транскатетерная имплантация клапана легочной артерии – малоинвазивная интервенционная методика, предлагающая альтернативу хирургическому вмешательству у пациентов с дисфункцией ПОПЖ. Наиболее часто применяются баллонорасширяемые клапаны, однако они имеют прямой каркас, из-за чего приходится выполнять предварительное стентирование нативного выходного отдела правого желудочка или клапаносодержащего кондуита во избежание периоперационных осложнений. Данная тактика увеличивает время проведения вмешательства, усложняет технику имплантации клапана, а также повышает стоимость операции. На данный момент не существует «идеального» клапана для транскатетерной имплантации, так как в отдаленном послеоперационном периоде в 30% случаев возникает инфекционный эндокардит [8].
Альтернативой являются самораскрывающиеся клапаны, направленные преимущественно на устранение легочной регургитации и нивелирующие недостатки баллонорасширяемых клапанов. На данный момент в мире ведется активная разработка различных моделей клапанов, совершенствуется антикальциевая обработка створчатого аппарата, оптимизируются самораскрываю-щиеся каркасы клапанов, усовершенствуется доставляющая система [7–9]. В нашей лаборатории разработан каркас клапана с доставляющей системой, основанной на 3D моделях ранее оперированных пациентов, учли недостатки ранее разработанных клапанов [12]. На этапе доклинических испытаний мы решили смоделировать имплантацию каркаса клапана в физическую 3D модель пациента с дисфункцией ПОПЖ.
Определение адекватной зоны имплантации для имплантации клапана имеет решающее значение для успешного лечения дилатированного нативного ПОПЖ. Именно поэтому большую роль в предоперационном протоколе исследования изображений, полученных в ходе проведения компьютерной томографии (КТ), играет 3D реконструкция с детализаций анатомических структур на каждом уровне.
Цель: протестировать модель каркаса транскатетерного самораскрывающегося клапана легочной артерии на доклиническом испытании in vitro на 3D распечатанной модели сердца пациента с дисфункцией ПОПЖ.
Материал и методы
На базе лаборатории биопротезирования центра новых хирургических технологий НМИЦ им. ак. Е.Н. Ме-шалкина разработан прототип самораскрывающегося нитинолового каркаса транскатетерного легочного клапана, основанный на различной вариабельности анатомии ПОПЖ [12].
Конструктивно каркас представляет собой трубку, состоящую из сетчатых элементов в средней и нижней части, и проволочную конструкцию в верхней части (рис. 1). Общая длина каркаса составляет 76,5 мм. Диаметр в средней части, в зоне створчатого аппарата – 25 мм. Кондуит плавно расширяется в нижней части (в зоне имплантации в выводной отдел правого желудочка) до 30,8 мм, там же имеются четыре круглых крепежных элемента для удержания в транскатетерной системе доставки. Верх каркаса представляет из себя проволочную конструкцию в форме короны диаметром 29,9 мм и высотой 15 мм. Такая форма верха каркаса необходима для атравматического прилегания к бифуркации легочной артерии без оказания какого-либо препятствия потоку крови.
Каркас протеза изготовлен из сплава с памятью формы никелида титана. Технология изготовления включала лазерную резку заготовки каркаса из трубки диаметром 4,5 мм и толщиной стенки 0,3 мм, соответствующей стандарту ASTM 2633–13 (Standard Specification for Wrought Seamless Nickel-Titanium Shape Memory Alloy Tube for Medical Devices and Surgical Implants), согласно развертке, разработанной на этапе компьютерного моделирования. Лазерная резка выполнена на специализированной лазерной системе для прецизионной резки труб LK-Laser JWM200 (Китай). Вырезанную на лазере заготовку каркаса протеза постепенно, в несколько этапов, растягивали до требуемой формы с применением технологии термоформования. Процесс термоформования выполнен в программируемой муфельной вакуумной печи Programat
P310 (Австрия) с дальнейшей закалкой в воде. На этапе постобработки, включающей процесс микроабразив-ного очищения поверхности и электрополировку, каркас протеза очищался от оксидной пленки, осуществлялось сглаживание острых кромок, придание блеска и гладкости поверхности.
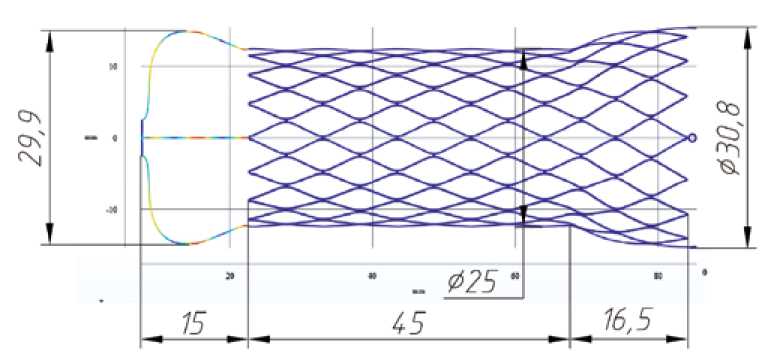
Рис. 1. Схема разрабатываемого каркаса клапана для транскатетерной имплантации Fig. 1. The scheme of transcatheter rame valve
Прототип системы доставки представляет собой катетер диаметром 18 Fr, состоящий из ручки управления, катетерной части и загрузочной капсулы. С помощью ручки управления производится контроль степени высвобождения каркаса клапана из загрузочной капсулы, катетерная часть придает основную длину, необходимую для доступа к месту имплантации, загрузочная капсула удерживает и обеспечивает доставку самораскрывающего каркаса. Кроме того, система транскатетерной доставки дает возможность повторно собрать и изменить положение самораскрывающегося каркаса клапана для точной имплантации за счет немедленной обратной связи между ручкой и открытием капсулы. Производительность загрузки каркаса клапана в систему доставки протестирована с использованием охлажденного физиологического раствора температурой 0–2 °С, который позволил сжать опорный каркас и упаковать в загрузочную капсулу системы доставки.
Для создания физической 3D модели был отобран пациент: 15-летний – мальчик (рост – 1,87 м, вес – 85 кг, площадь поверхности тела – 2,11 м2), который перенес процедуру баллонной вальвулопластики клапана легочной артерии в младенческом возрасте, с жалобами на одышку и повышенную утомляемость при физической нагрузке. По данным магнитно-резонансной томографии сердца отмечается дилатация правого желудочка (конечно-диастолический объем – 162 мл/м2, конечно-систолический объем – 69 мл/м2) с выраженной легочной регургитацией и отсутствием градиента на ветвях легочной артерии и клапане легочной артерии. Согласно разработанной нами классификации, выходной отдел правого желудочка был 3-го типа. Данные магнитно-резонансной томографии показали путь оттока тубулярной формы, с проксимальным и дистальным диаметром 26 и 27 мм со- ответственно. Учитывая анатомические критерии, пациент является отличным кандидатом на транскатетерное протезирование клапана легочной артерии.
Для создания 3D модели была выполнена КТ-ангиография на аппарате Aquilion One 320 (Toshiba, Япония) c толщиной реконструируемого слоя не более 1 мм и реконструкцией серий в фазу диастолы, свободной от артефактов движения. Дальнейшая постпроцессинговая обработка изображений осуществлялась в программном обеспечении Materialise Mimics Innovation Suite Research 21.0 (Materialise NV, Бельгия).
Процесс создания 3D реконструкций включал в себя серию последовательных этапов: выбор оптимального набора медицинский изображений, сегментация анатомических структур с учетом их КТ-плотности, выделение необходимых структур с использованием специальных наборов инструментов, создание оболочки для выделенных полостей сердца и магистральных сосудов, удаление полости структур и имеющихся их наложений, возникающих при их тесном соприкосновении (рис. 2).
Анатомическая 3D модель (рис. 3), включающая правые отделы сердца, системные вены и легочную артерию для печати, была получена из DICOM изображений КТ в специализированном программном обеспечении Materialise Mimics (Materialise NV, Бельгия). 3D печать осуществлялась на SLA 3D принтере Formlabs Form 3B+ из фотополимера Elastic 50A (Formlabs Inc., США). Модели, изготовленные из данного полимера, имеют физико-механические свойства, близкие к натуральному силикону (твердость по Шору 50А, прозрачность). Высота слоя печати составляла 100 мкм, модель печаталась из трех частей и склеивалась между фрагментами фотополимером Elastic 50A при воздействии излучения внешнего ультрафиолетового диода, излучающего на длине волны 405 нм.
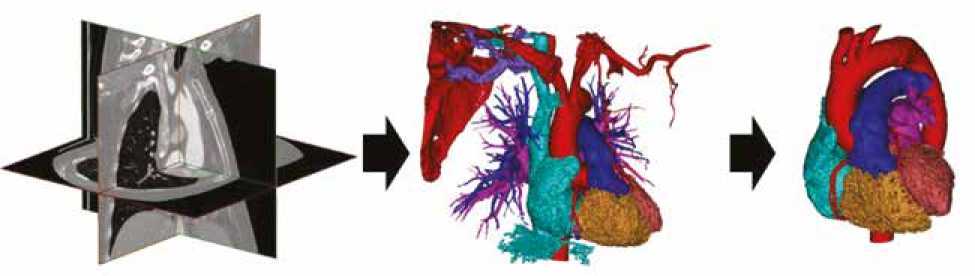
Рис. 2. Этап создания 3D печатной модели сердца и сосудов
Fig. 2. Stage of creating a 3D printed model of the heart and blood vessels

Рис. 3. Реальная 3D модель правых отделов сердца с нижней полой веной
Fig. 3. Real 3D model of the right side of the heart with the inferior vena cava
Результаты
Каркас клапана был установлен в 3D модель пациента для оценки морфологических характеристик стент-карка-са (прилегание и степень деформации), фиксации (риск миграции устройства) и функции клапана, выведенной из возможной деформации среднего сегмента каркаса. На основании этой оценки были выбраны оптимальный размер и место крепления. На рисунке 4 представлены этапы имплантации.
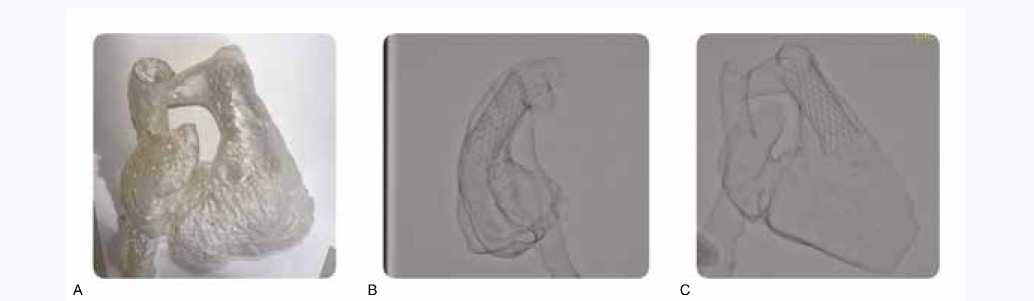
Рис. 4. Имплантация каркаса клапана in vitro в силиконовую 3D модель сердца пациента. А – общий вид протеза в модели, В – рентгенограмма, вид сбоку, С – рентгенограмма, вид в прямой проекции
Fig. 4. Implantation of a valve frame in vitro into a silicone 3D model of the patient’s heart. A – general view of the prosthesis in the model, B – side view of the radiograph, C – frontal view of the radiograph
Обсуждение
Транскатетерная имплантация клапана легочной артерии является одним из самых актуальных вопросов эндоваскулярной хирургии врожденных пороков сердца. Однако на данный момент не существует «идеального» клапана для транскатетерной имплантации, удовлетворяющего все запросы практикующего врача. Для транскатетерных баллонорасширяемых клапанов легочной артерии характерен прямой каркас, вследствие чего приходится выполнять престентирование нативного выходного отдела правого желудочка или клапаносодержащего кондуита во избежание периоперационных осложнений. Данная тактика увеличивает время проведения вмешательства, усложняет технику имплантации клапана, а также повышает стоимость операции.
Альтернативой являются самораскрывающиеся клапаны, направленные преимущественно на устранение легочной регургитации и не требующие предварительного стентирования зоны имплантации. Определение адекватной зоны имплантации клапана имеет решающее значение для успешного лечения дилатированного нативного ПОПЖ из-за хронической легочной регургитации.
Следующим важным критерием успеха транскатетерного протезирования легочной артерии является оценка угла между выходным отделом правого желудочка и легочной артерией, что важно для определения полной совместимости измерительных линий с плоскостями зоны приземления (например, плоскостью кольца или плоскостью синотубулярного соединения). При анализе двухмерных изображений КТ нельзя не учесть, что каждая плоскость (плоскость синуса, плоскость кольца легочного клапана) определяется тремя точками на каждом уровне. Именно поэтому большую роль в предоперационном протоколе исследования КТ изображений играет 3D реконструкция с детализаций анатомических структур на каждом уровне [12–15].
Техническая сложность при имплантации транскатетерного легочного клапана заключается в том, что он должен не только устранить дисфункцию клапана легочной артерии, но и не вызывать компрессию коронарных артерий, деформацию корня аорты, повреждение кондуита или нативного выходного отдела правого желудочка, а также главных ветвей легочной артерии [15].
При создании конструкции опорного каркаса клапана мы учитывали все анатомические особенности выходного отдела правого желудочка с использованием трехмерной модели, по данным мультиспиральной компьютерной томографии [12]. В данном исследовании мы описываем внешние габаритные характеристики новой отечественной конструкции самораскрывающегося опорного каркаса легочного клапана. По сравнению с существующими транскатетерными легочными клапанами гантелеобразная конструкция каркаса позволяет избежать миграции биопротеза, перфорации ствола или ветвей легочной артерии во время имплантации и деформации корня аорты и других более редких осложнений, что значительно снижает хирургический риск.
Другие биопротезы клапанов Edwards SAPIEN и Melody Valve, зарегистрированные в Российской Федерации, имеют прямой опорный каркас и требуют предварительного стентирования нативного выходного отдела правого желудочка или клапаносодержащего кондуита и могут использоваться лишь в 20% случаев [11, 12]. Транскатетерная имплантация легочного биопротеза как метод лечения тяжелой легочной регургитации является альтернативой открытой хирургической коррекции из-за низкого риска периоперационных осложнений. Однако необходимы дополнительные исследования, направленные на создание легко имплантируемого и прочного ни-тинолового каркаса легочного клапана, в доклинических испытаниях которого необходимо оценить взаимодействие транскатетерного биопротеза и системы доставки, а также проконтролировать высвобождение биопротеза из загрузочной капсулы и фиксацию в зоне имплантации.
Развитие технологий трехмерного проектирования в настоящее время позволяет создавать виртуальные либо физические 3D модели для более детального понимания анатомии и возможности имплантации транскатетерного биопротеза, а также снизить риск интраоперационных осложнений. Также 3D технологии активно используются в создании прототипов клапана, модели для усовершенствования оперативной техники, учитывая возможность провести неограниченное колличество вмешательств и отточить каждый этап операции, также 3D модели активно применяются для обучения студентов, ординаторов и молодых хирургов.
Процесс создания 3D модели заключается в получении КТ снимков высокого разрешения, с последующей сегментацией анатомических структур. Затем проводится компьютерное проектирование и создание 3D файла в формате, распознаваемом 3D принтером. Заключительным этапом выполняется печать физической модели.
Важным этапом в создании 3D печатной модели является процедура постобработки данных изображения, известная как сегментация, с использованием специального программного обеспечения для постобработки изображений. Этот процесс включает в себя автоматическое или полуавтоматическое разграничение интересующих структур и преобразование в цифровые модели геометрической сетки. Сегментация требует всесторонних знаний анатомии сердца, интерпретации изображений и навыков использования программного обеспечения для постобработки изображений. Для выполнения сегментации изображений доступно несколько алгоритмов, наиболее часто используемыми являются многоплоскостное преобразование, увеличение областей, рендеринг поверхности / объема и проецирование максимальной / минимальной интенсивности [11, 15].
В ходе эксперимента по загрузке каркаса клапана система доставки позволила вместить в загрузочную капсулу сжатый каркас и в дальнейшем осуществить последовательное высвобождение в 3D модели сердца человека.
В дальнейшем мы планируем завершить первые доклинические испытания створчатого аппарата из конского, свиного и бычьего перикардов с целью гистологической оценки степени повреждения волокон створок при компрессии и загрузке в систему доставки и сравнения с контрольным образцом. Планируем имплантировать биопротез на изолированном свином сердце и крупных лабораторных животных с целью анализа фиксации биопротеза в зоне посадки и определения состоятельности имплантируемого клапана в течение 6 и 12 мес. после операции, а также оценить скорость обызвествления за данный период наблюдения.
Заключение
Путем оптимизации конструкции опорного каркаса удалось усовершенствовать транскатетерную модель каркаса клапана, основанную на анализе наиболее часто встречаемых дисфункций ПОПЖ.
3D печатные конструкции позволяют безопасно выполнить тестирование разрабатываемых моделей транскатетерных клапанов, а также выявить и своевременно устранить имеющиеся недостатки.
Для его использования в качестве медицинского изделия необходимы дальнейшие доклинические испытания, в частности гистологическая и гидродинамическая оценка состоятельности створчатого аппарата и имплантация крупным лабораторным животным.
Список литературы Имплантация самораскрывающегося каркаса транскатетерного клапана in vitro в 3D модель сердца пациента с дисфункцией пути оттока из правого желудочка
- Сойнов И.А., Журавлева И.Ю., Кулябин Ю.Ю., Ничай Н.Р., Афанасьев А.В., Алешкевич Н.П. и др. Клапансодержащие кондуиты в детской кардиохирургии. Хирургия. Журнал им. Н.И. Пирогова. 2018;(1):75-81. https://doi.org/10.17116/hirurgia2018175-81.
- Nordmeyer J., Ewert P., Gewillig M., AlJufan M., Carminati M., Kretschmar O. et al. Acute and midterm outcomes of the post-approval MELODY Registry: a multicentre registry of transcatheter pulmonary valve implantation. Eur. Heart J. 2019;40(27):2255-2264. https://doi.org/10.1093/eurheartj/ehz201.
- Рзаева К.А., Тимченко Т.П., Журавлева И.Ю., Архипов А.Н., Горбатых А.В., Войтов А.В. и др. Технические характеристики самораскрывающегося клапана для лечения клапанной патологии легочной артерии. Патология кровообращения и кардиохирургия. https://doi.org/;26(3):85-90.DOI: 10.21688/1681-3472- 2022-3-85-90.
- Bonhoeffer P., Boudjemline Y., Saliba Z., Hausse A.O., Aggoun Y., Bonnet D., Sidi D., Kachaner J. Transcatheter implantation of a bovine valve in pulmonary position: a lamb study. Circulation. 2000;102(7):813-816. https://doi.org/10.1161/01.cir.102.7.813.
- Fasel J.H., Aguiar D., Kiss-Bodolay D., Montet X., Kalangos A., Stimec B.V. et al. Adapting anatomy teaching to surgical trends: a combination of classical dissection, medical imaging, and 3D-printing technologies. Surg. Radiol. Anat. 2016;38(3):361-367. https://doi.org/10.1007/s00276-015-1588-3.
- Valverde I., Sarnago F., Prieto R., Zunzunegui J.L. Three-dimensional printing in vitro simulation of percutaneous pulmonary valve implantation in large right ventricular outflow tract. Eur. Heart J. 2016;38(16):1262- 1263. https://doi.org/10.1093/eurheartj/ehw546.
- Lurz P., Coats L., Khambadkone S., Nordmeyer J., Boudjemline Y., Schievano S., et al. Percutaneous pulmonary valve implantation: impact of evolving technology and learning curve on clinical outcome. Circulation. 2008;117(15):1964-1972. https://doi.org/10.1161/CIRCULATIONAHA.107.735779.
- Schievano S., Capelli C., Young C., Lurz P., Nordmeyer J., Owens C. et al. Four-dimensional computed tomography: a method of assessing right ventricular outflow tract and pulmonary artery deformations throughout the cardiac cycle. Eur. Radiol. 2011;21(1):36-45. https://doi.org/10.1007/s00330-010-1913-5.
- Anwar S., Singh G.K., Miller J., Sharma M., Manning P., Billadello J.J. et al. 3D printing is a transformative technology in congenital heart disease. JACC Basic Transl. Sci. 2018;3(2):294-312. https://doi.org/10.1016/j.jacbts.2017.10.003.
- Nollert G., Fischlein T., Bouterwek S., Böhmer C., Klinner W., Reichart B. Long-term survival in patients with repair of tetralogy of Fallot: 36-year follow-up of 490 survivors of the first year after surgical repair. J. Am. Coll. Cardiol. 1997;30(5):1374-1383. https://doi.org/10.1016/s0735-1097(97)00318-5.
- Canan A., Ocazionez-Trujillo D., Vargas D., Foley T.A., Cabalka A.K., Rajiah P.S. Pre- and postprocedure imaging of transcatheter pulmonary valve implantation. Radiographics. 2022;42(4):991-1011. https://doi.org/10.1148/rg.210160.
- Сойнов И.А., Манукян С.Н., Рзаева К.А., Войтов А.В., Тимченко Т.П., Кобелев Е. и др. Варианты дисфункций пути оттока из правого желудочка. Кардиология и сердечно-сосудистая хирургия. 2023;16(4):351357. https://doi.org/10.17116/kardio202316041351.
- Biglino G., Capelli C., Binazzi A., Reggiani R., Cosentino D., Migliavacca F. et al. Virtual and real bench testing of a new percutaneous valve device: A case study. EuroIntervention. 2012;8(1):120-128. https://doi.org/10.4244/EIJV8I1A19.
- Ansari M.M., Cardoso R., Garcia D., Sandhu S., Horlick E., Brinster D. et al. Percutaneous pulmonary valve implantation: Present status and evolving future. J. Am. Coll. Cardiol. 2015;66(20):2246-2255. https://doi.org/10.1016/j.jacc.2015.09.055.
- Han Y., Shao Z., Sun Z., Han Y., Xu H., Song S. et al. In vitro bench testing using patient-specific 3D models for percutaneous pulmonary valve implantation with Venus P-valve. Chin. Med. J. (Engl.). 2023; Online ahead of print. https://doi.org/10.1097/CM9.0000000000002793.


