In vivo эффективность полимерных гидрогелей, импрегнированных антибактериальным препаратом, при хроническом остеомиелите
Автор: Цискарашвили А.В., Меликова Р.Э., Волков А.В., Зайцева О.С., Пхакадзе Т.Я., Артюхов А.А., Сокорова Н.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 5 т.29, 2023 года.
Бесплатный доступ
Введение. Полиметилметакрилат (ПММА) является распространенной депо-системой при лечении хронического остеомиелита. Однако множество существующих недостатков не позволяет считать его идеальной.Цель. В условиях in vivo изучить эффективность купирования хронического остеомиелита большеберцовой кости на модели кроликов полимерным гидрогелем, содержащим антибиотик, и сравнить с ПММА.Материалы и методы. Исследование выполнено на голени 25 половозрелых кроликов породы Шиншилла. Была создана модель хронического остеомиелита большеберцовой кости. Инфекционным агентом выбран метициллинчувствительный штамм Staphylococcus aureus (MSSA), высокоактивный в отношении цефазолина. Через 21 день после клинико-лабораторного, рентгенологического имикробиологического подтверждения диагноза приступали к хирургической санации, методика для всех животных была одинаковой. Опытной группе (n = 11) имплантировали полимерный гидрогель, сравнительной (n = 11) - ПММА, контрольной (n = 3) - имплантация не производилась. В послеоперационном периоде проводили мониторинг локального статуса, веса и температуры тела животных, микробиологическое и рентгенологическое исследование. Животных выводили поэтапно. Биоптаты направляли на бактериологическое и гистоморфометрическое исследование. Статистическое сравнение групп выполнено при помощи критериев Манна - Уитни, Краскелла - Уоллиса и Тьюки, для контрольной группы использовали описательную статистику.Результаты. В опытной группе во всех случаях послеоперационные раны зажили своевременно, уровни WBC и СРБ значимо (p = 0,040) снизились с 14 и 21 суток соответственно. Микробиологически роста микрофлоры из отделяемого раны и биоптатов не выявлено, рентгенологически прогрессирование хронического остеомиелита не наблюдалось, гистоморфометрически отмечено достоверное (p = 0,002) эффективное купирование воспалительного процесса. В случае сравнительной группы с 7-х послеоперационных суток потребовалась системная антибиотикотерапия. Уровни маркеров воспаления снижались менее эффективно, чем в опытной группе. MSSA верифицировался из отделяемого раны и биоптатов почти на каждом контрольном сроке. Рентгенологически и гистоморфометрически (p = 0,001) в среднем наблюдалась картина обострения остеомиелита. В контрольной группе системная терапия не дала положительной динамики.Обсуждение. Сравнительный анализ показал, что гидрогель в отличие от ПММА достоверно купирует хронический остеомиелит без дополнительной вспомогательной системной антибиотикотерапии и не вызывает материал-ассоциированную резорбцию костной ткани. При этом клинико-лабораторная картина полностью соответствует данным микробиологии, рентгенологии и гистоморфометрии.Заключение. Гидрогель, импрегнированный антибиотиком, достоверно и эффективно купирует хронический остеомиелит по сравнению с ПММА.
Хронический остеомиелит, полимерный гидрогель, костный цемент, полиметилметакрилат, ортопедическая инфекция, пмма, in vivo исследование, экспериментальная модель
Короткий адрес: https://sciup.org/142239034
IDR: 142239034 | УДК: 616.71-018.46-002:615.281-454.1:616-092.4 | DOI: 10.18019/1028-4427-2023-29-5-535-545
Текст научной статьи In vivo эффективность полимерных гидрогелей, импрегнированных антибактериальным препаратом, при хроническом остеомиелите
Хронический остеомиелит является актуальной проблемой в современной травматологии и ортопедии, поскольку считается одним из тяжелых хирургических инфекционных осложнений [1], на долю которого приходится 3-25 % всех заболеваний опорно-двигательной системы [2]. Как известно, при хронизации остеомиелита запускается целый каскад последовательных реакций, в результате которых развивается воспаление, образуются микробные биопленки, приводящие к формированию секвестров и разрушению костной ткани [1, 3].
Основным методом борьбы с микробными биопленками является удаление инфицированного имплантата при его наличии, радикальная хирургическая санация и комбинация локальной и системной антибактериальной терапии. Сочетание местной и системной терапии показало лучшую эрадикацию инфекции на животных моделях по сравнению с использованием только системных антибиотиков, поскольку бактериальная биопленка ограничивает проникновение последних, что, в конечном итоге, способствует изменению метаболического состояния колоний микроорганизмов и приобретению ими резистентности к используемому препарату [4]. В качестве местной терапии применяют депо-системы. Наиболее распространенной в клинической практике системой для доставки антибиотиков в очаг инфекции является костный цемент на основе полиметилметакрилата (ПММА). Однако, несмотря на множество способов совершенствования методов лечения и структуры ПММА, рецидив хронического остеомиелита наблюдается в 20-30 % случаев, а в 16,75 % лечение заканчивается ампутацией конечности [1]. Вместе с тем, такие ограничения как элюция только 10 % импрегнированного препарата, гидрофобность и бионертность материала, требующая повторного оперативного вмешательства по его удалению [4] и способствующая увеличению продолжительности лечения и дополнительной стресс-нагрузке на организм пациента [1], а также высокая температура полимеризации (до 120 ºС), вызывающая некроз костной ткани и ограничивающая спектр используемых препаратов, не позволяют рассматривать систему из ПММА как идеальную. В связи с чем в последнее время ведется поиск новых локальных транспортных систем, которые были бы лишены недостатков костного цемента. Предпочтения, в основном, отдаются биодеградируемым депо-матрицам, одной из которых является гидрогель [5].
Цель – в in vivo условиях изучить эффективность купирования хронического остеомиелита большеберцовой кости на модели кроликов полимерным гидрогелем, импрегнированным антибиотиком, и сравнить с ПММА.
МАТЕРИАЛЫ И МЕТОДЫ
In vivo исследование выполнено на 25 половозрелых кроликах породы Шиншилла 5-6 месячного возраста со средней массой 2608 ± 112 г. Все животные являлись самцами для исключения влияния половых различий на результаты исследования. До включения в настоящее исследование кролики подлежали осмотру ветеринаром и были признаны здоровыми. В течение 10 дней до начала эксперимента животным давали возможность акклиматизироваться. Кормление осуществляли 3 раза в сутки, подача воды была постоянной. В качестве подстила использовали опилки. Также большое внимание уделяли ежедневной чистоте помещения и клеток с целью предупреждения присоединения экзогенной инфекции.
Во всех случаях областью исследования была голень. Моделирование хронического остеомиелита производили в проксимальном отделе большеберцовой кости по ранее описанной методике [6]. Техника выполнения операции была одинаковой для всех кроликов. Для наркотизации животных использовали внутримышечное введение Золетила 100 и Медитина 0,1 % в дозировке 30 мг/кг и 0,5 мл/5 кг соответственно. В качестве инфекционного агента использовали лидирующий в этиологической структуре ортопедических инфекций штамм метициллинчувствительный Staphylococcus aureus (MSSA) [7, 8, 9], высокоактивный в отношении цефазолина, который был выделен из интраоперационных биоптатов пролеченных нами пациентов. После инфицирования кроликов выжидали 21 день, которого достаточно для развития хронической формы остеомиелита [6, 10]. После подтверждения диагноза приступали к этапу санации очага инфекции. Хирургическую санацию всем животным выполняли по одной и той же методике. Распределение кроликов по группам (опытная, сравнительная и контрольная) осуществляли рандомно. После этапа инфицирования и до конца исследования всех животных содержали в индивидуальных клетках в условиях вивария с 12-часовыми циклами освещения и темноты при температуре 20 ± 1 °С и влажностью воздуха 50-70 %.
В послеоперационном периоде, как на этапе инфицирования, так и санации, область раны обрабатывали 0,05 % раствором Хлоргексидина до ее полного заживления. Мониторинг локального статуса, веса и температуры тела животных и показателей крови (гемоглобин (HB), лейкоциты (WBC), С-реактивный белок (СРБ) и СОЭ) выполняли на 3, 7 сутки и далее с интервалом в 1 неделю до 21 суток – в случае этапа инфицирования и до 42 суток – в случае санационного этапа. Проводили микробиологическое исследование отделяемого раны (при его наличии) и биопсийного материала, взятого на этапе выведения животных. Рентгенологическое исследование выполняли на следующий день после операции, на 21 сутки этапа инфицирования и на 3, 15, 30 и 45 сутки этапа санации.
Длительность этапа санации составила 45 дней. Животных выводили этапно на 15, 30 и 45 сутки. Эвтаназию кроликам осуществляли под наркозом воздушной эмболизацией через ушную вену. После изъятия костно- и мягкотканного биопсийного материала, в том числе фрагментов сравниваемых депо-систем, для микробиологического исследования, кость помещали в 10 % раствор формалина и направляли в патологоанатомическую лабораторию для дальнейшего гистоморфометрического исследования. Микропрепараты исследовали в светооптическом микроскопе AxioLab A1 при увеличении от 100× до 400×.
Техника хирургической санации очага инфекции . В фиксированном положении животных на спине под общим наркозом, предварительно взяв посев отделяемого при наличии свища/раны, производили выбривание шерсти и дезинфекцию области оперативного вмешательства. После трехкратной обработки операционного поля растворами антисептиков осуществляли разрез кожи длиной 3 см по ходу старого послеоперационного рубца голени. Выполняли вскрытие гнойных затеков/карманов с эвакуацией содержимого при их наличии. После иссечения видоизмененных мягких тканей локализовали область дефекта, которую фрезой расширяли до размера 0,6 × 0,6 см и глубиной 4 мм. Далее несколько дистальнее от имевшегося дефекта просверливали дополнительное отверстие с такой же глубиной и размером 0,4 × 0,4 см с целью забора костного биоптата для гистологического подтверждения развития инфекции. После чего ложками выполняли санацию костномозгового канала с удалением гноя, мелких секвестров и грануляционной ткани. Интраоперационные биоптаты направляли в микробиологическую лабораторию. Канал обильно промывали 20 мл антисептического раствора и осуществляли гемостаз.
После смены перчаток, перестилания и дополнительной обработки операционного поля переходили к этапу имплантации интраоперационно изготовленных депо-систем на основе полимерного гидрогеля и ПММА, насыщенных 300 мг цефазолина, по ранее описанной методике [5]. Опытной группе (n = 11) в костномозговой канал с помощью шприца через катетер вводили 2 мл полимерного гидрогеля. Сравнительной группе (n = 11) устанавливали солитарный костный цемент до начала реакции полимеризации. В контрольной группе (n = 3), служащей для наблюдения, имплантация материала не производилась. Операцию завершали послойным ушиванием раны.
Морфометрическую оценку инфекционно-воспалительного процесса на гистологических препаратах осуществляли с помощью шкалы HOES (Histopathological Osteomyelitis Evaluation Score) [11], подразумевающей градуированную полуколичественную и аддитивную форму оценки критериев острого (А1-А3) и хронического (С1-С2) остеомиелита. Оценивались следующие критерии: A1 – остеонекроз, A2 – некроз мягких тканей, A3 – инфильтрат гранулоцитов, C1 – неогенез кости/фиброз и C2 – инфильтрат лимфоцитов/ма- крофагов. В зависимости от степени выраженности, определяемой количеством форменных элементов на единицу площади инфильтрата, каждому критерию присваивался балл от 0 до 3, где 0 – это отсутствие признаков воспаления, 3 – тяжелая степень выраженности. При сумме баллов А1-А3 ≥ 4 гистопатологическая картина соответствовала острому остеомиелиту; А1-А3 и С1-С2 ≥ 6 – обострению хронического остеомиелита; C1-C2 ≥ 4 – хроническому остеомиелиту; C1-C2 ≤ 4 баллов – стиханию хронического остеомиелита; C1-C2 ≤ 1 балла – отсутствию признаков остеомиелита. Измерение площади осуществляли c помощью морфометрической программы MegaMorph12.
Полученные данные статистически обработаны пакетом программ IBM SPSS Statistics 22 и SigmaPlot 11.0. Результаты определения веса животных и лабораторных показателей крови для опытной и сравнительной групп кроликов в контрольные дни исследования представлены как среднее ± стандартное отклонение (μ ± Sd). С целью выявления межгрупповых статистически значимых различий использован критерий Манна – Уитни. Достоверными считались значения при p < 0,05. В случае контрольной группы применяли описательную статистику.
Достоверность гистоморфометрических результатов определяли непараметрическим критерием Манна – Уитни и критерием множественного сравнения Краскела – Уоллиса. При обнаружении межгрупповых различий применяли однофакторный дисперсионный анализ с апостериорными сравнениями Тьюки. Значения считались достоверными при p < 0,05. Статистические данные представлены как медиана и интерквартильный диапазон (Me (25 %; 75 %)) в виде диаграмм размаха.
Экспериментальная работа была одобрена Этическим комитетом Ученого Совета ФГБУ «НМИЦ ТО им. Н.Н. Приорова» МЗ РФ и проведена согласно этическим нормам обращения с животными с соблюдением рекомендаций и требований Европейской конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 2006). Все манипуляции над животными проводили в соответствии с Хельсинкской декларацией о гуманном обращении с животными (2000 г.) и с приказом Минздравсоцразвития РФ № 708н от 23.08.2010 г. «Об утверждении правил лабораторной практики». Животные содержались в условиях, соответствующих стандартам, указанным в руководстве “The Guide for Care and Use of Laboratory Animals” (1996).
РЕЗУЛЬТАТЫ
К 21 суткам этапа инфицирования развитие свища в области послеоперационного рубца отмечено у 60 % кроликов (n = 15), абсцесса – у 12 % (n = 3), раны с густым гнойным отделяемым – у 16 % (n = 4), гиперемия и/или гипертермия кожных покровов – в 3 (12 %) случаях. У 44 % животных (n = 11) вышеуказанные симптомы сопровождались повышением температуры тела, которая к концу этапа инфицирования в среднем составила 41,7 ± 0,9 °С.
Все животные в период наблюдения были со сни- женным аппетитом, менее активны, в более чем половине случаев занимали вынужденное, щадящее конечность, положение, что вызвало гипотрофию мышц бедра и голени. Хромота на оперированную конечность при ходьбе отмечена у 22 (88 %) кроликов. Масса тела животных за этап инфицирования в среднем снизилась на 564 ± 113 г. Уровни маркеров воспаления в анализах крови были выше нормы. Данные результатов лабораторных показателей крови для каждой группы представлены в таблице 1.
Таблица 1
Лабораторные показатели крови в норме и на 21 сутки после инфицирования большеберцовой кости кроликов
|
Показатели крови |
Норма |
На 21 сутки после инфицирования (μ ± Sd) |
||
|
Опытная группа (n = 11) |
Сравнительная группа (n = 11) |
Контрольная группа (n = 3) |
||
|
Hb |
110-136 |
104,6 ± 6,5 |
107,4 ± 8,8 |
108,3 ± 10,6 |
|
WBC |
2,5-6,9 |
11,1 ± 1,8 |
10,5 ± 2,2 |
9,6 ± 1,9 |
|
СОЭ |
1-4 |
8,8 ± 3,4 |
8,5 ± 3,1 |
6,3 ± 2,1 |
|
СРБ |
0-1 |
41 ± 15,5 |
43 ± 16,3 |
36 ± 22,6 |
Рентгенологически к 21 суткам после инфицирования имелись признаки, присущие хроническому остеомиелиту: неоднородная структура костной ткани с чередованием очагов склероза и зон просветления (рис. 1, а), остеопороз, периостит различной степени выраженности (рис. 1, б, в), размытость контуров посттрепанационного дефекта и секвестрация кости, выявленная в 7 (28 %) случаях. Бактериологическое исследование отделяемого свища (n = 15) и интраоперационных биоптатов, изъятых у всех кроликов (n = 25) во время хирургической санации, верифицировал рост искомого штамма MSSA.
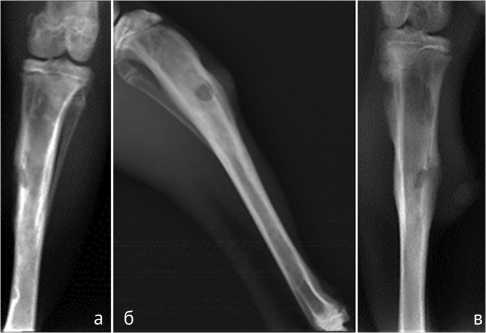
Рис. 1. Рентгенограммы голени кроликов на 21 сутки после инфицирования большеберцовой кости: а – неоднородная структура костной ткани; б – периостальная реакция и остеосклероз; в – свищ на вершине абсцесса
Гистологически в ретикулярной строме костного мозга и гаверсовых каналах кортикальной пластинки в умеренном и значительном количестве присутствовали липоциты (рис. 2, а), перегородки между которы- ми были утолщены и богаты фибробластоподобными клетками, нежными базофильными и оксифильными волокнами. Между последними выявляли в умеренном и значительном количестве клетки лимфоплазмоцитарного ряда (рис. 2, а). Поля пластинчатой кости в собственно костном мозге и некоторых балках губчатой кости не имели остеоцитов, лакуны на большом и малом протяжении пустовали. Расширенные гаверсовы каналы определяли в себе признаки пазушной резорбции и остеорепаративной регенерации в виде наслоений нового костного вещества с сохранными остеоцитами и необычными изгибами линий склеивания костных пластинок (рис. 2, б). При этом резорбирующийся костный матрикс на границе с воспалительным инфильтратом имел резко оксифильную каёмку, что опосредованно свидетельствовало о локальном закислении межуточного вещества и, соответственно, о продолжающемся инфекционно-воспалительном процессе.
В целом, результаты клинико-лабораторного, рентгенологического, микробиологического и гистологического исследования подтвердили развитие хронического остеомиелита большеберцовой кости кроликов к 21 суткам этапа инфицирования.
После хирургической санации очага в опытной группе (n = 11) во всех случаях заживление раны протекало без осложнений. Температура тела кроликов с имплантированным гидрогелем колебалась в пределах нормы (N = 37-39,5 ºC). В сравнительной группе (n = 11) к концу первой недели 6-ти (54,5 %) животным потребовалась системная антибактериальная терапия внутримышечным введением цефазолина в дозировке 30 мг/кг 3 раза в сутки, ввиду отсутствия регрессии клинических симптомов хронического остеомиелита.
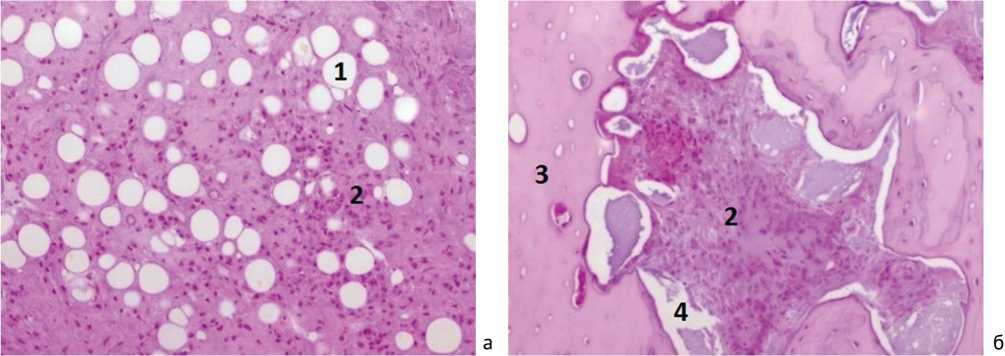
Рис. 2.: а – ретикулярная строма костного мозга с липоцитами (1), инфильтрация лимфоцитами и плазмоцитами (2); б – поля костного матрикса, лишенные остеоцитов (3). Пазушная резорбция кости (4). Инфильтрация костного мозга гаверсовых каналов лимфоцитами и плазмоцитами (2). Окраска гемотоксилином и эозином. ×200
К 3 неделе дозировка препарата была увеличена до 40 мг/кг у 3-х (27,3 %) кроликов без положительной динамики. Однако, несмотря на интенсивную терапию, в 2-х (18,2 %) случаях нам не удалось добиться полного купирования инфекции. В контрольной группе системная антибиотикотерапия оказалась неэффективной, поскольку на каждом контрольном сроке у животных сохранялись те или иные признаки воспаления. Температура тела к концу исследования в данной группе составила 40,7 ºС, что выше верхней границы нормы.
Межгрупповые статистические данные веса тела животных исследуемых групп в динамике представлены в таблице 2.
Таблица 2 Показатели веса кроликов каждой изучаемой группы после хирургической санации в контрольные дни исследования
|
День наблюдения |
Опытная группа (μ ± Sd) |
Сравнительная группа (μ ± Sd) |
Контрольная группа (μ) |
p value (критерий Манна Уитни)* |
|
3 |
2418 ± 110,7 |
2435 ± 126,3 |
2294 |
p = 0,870 |
|
7 |
2989 ± 139,9 |
2909 ± 140,9 |
2764 |
p = 0,279 |
|
14 |
3639 ± 213,5 |
3512 ± 200,7 |
3323 |
p = 0,324 |
|
21 |
4223 ± 263,5 |
4012 ± 274,8 |
3945 |
p = 0,123 |
|
28 |
4901 ± 280,8 |
4544 ± 306,7 |
4751 |
p = 0,006 |
|
35 |
5578 ± 263,1 |
5175 ± 324,2 |
5393 |
p = 0,005 |
|
42 |
6308 ± 152,3 |
5948 ± 283,3 |
6116 |
p = 0,000 |
* – статистическая достоверность указана для опытной и сравнительной групп кроликов.
Динамика лабораторных показателей крови для опытной и сравнительной групп в виде среднеарифметических значений со стандартным отклонением, а для контрольной группы – в виде среднеарифметических значений представлена в таблице 3. Статистические данные показателей крови в контрольные сроки исследования для опытной и сравнительной групп продемонстрированы в таблице 4.
Таблица 3 Динамика показателей крови в контрольные дни исследования у кроликов опытной, сравнительной и контрольной групп
|
День |
Показатели крови |
|||
|
HB |
WBC |
СОЭ |
СРБ |
|
|
N = 110-136 |
N = 2,5-6,9 |
N = 1-4 |
N = 0-1 |
|
|
Опытная группа (μ ± Sd) |
||||
|
3 |
115,2 ± 9,7 |
9,4 ± 1,1 |
4,6 ± 2,1 |
35,1 ± 5,7 |
|
7 |
117,1 ± 7,3 |
8,6 ± 1 |
3,6 ± 1,6 |
23,5 ± 10,1 |
|
14 |
122,2 ± 6,2 |
7,4 ± 1,5 |
3,5 ± 2,7 |
15,1 ± 8,7 |
|
21 |
124,2 ± 8,2 |
6,9 ± 2,8 |
2,5 ± 0,7 |
12,5 ± 12,6 |
|
28 |
129,6 ± 7,4 |
5,4 ± 2,3 |
3 ± 2,5 |
8,2 ± 7,7 |
|
35 |
128 ± 5,8 |
5,2 ± 3,2 |
1,8 ± 1 |
4,7 ± 4,1 |
|
42 |
129,7 ± 4,5 |
3,9 ± 1,5 |
1,7 ± 1,1 |
2,7 ± 4,1 |
|
Сравнительная группа (μ ± Sd) |
||||
|
3 |
115 ± 12,1 |
10,1 ± 1,9 |
5 ± 1,8 |
42 ± 11,6 |
|
7 |
116,1 ± 5,9 |
9,6 ± 1,8 |
4,1 ± 1,7 |
29 ± 13,1 |
|
14 |
117,2 ± 11,7 |
8,7 ± 1,7 |
3,8 ± 1,8 |
19,8 ± 15,5 |
|
21 |
119, ± 12,6 |
8,8 ± 2,4 |
3,3 ± 1,5 |
18,3 ± 8,1 |
|
28 |
121,8 ± 17,9 |
8,1 ± 3,5 |
3,6 ± 2,1 |
14,3 ± 5,5 |
|
35 |
120 ± 19,1 |
8,1 ± 3,6 |
3,4 ± 1,9 |
14,7 ± 10,1 |
|
42 |
119 ± 14,3 |
7,7 ± 4,5 |
3,1 ± 2,4 |
11,8 ± 9,4 |
|
Контрольная группа (μ) |
||||
|
3 |
121 |
9,03 |
4,7 |
37 |
|
7 |
116,3 |
8,6 |
4 |
20,7 |
|
14 |
121,7 |
8,1 |
4 |
17,7 |
|
21 |
118,5 |
8,2 |
2 |
11,5 |
|
28 |
126,5 |
9,2 |
2 |
11 |
|
35 |
132 |
6,8 |
2 |
19 |
|
42 |
128 |
7,9 |
4 |
24 |
Таблица 4
Статистические различия уровней маркеров воспаления у кроликов опытной и сравнительной групп (критерий Манна – Уитни)
|
День |
Показатели крови |
|||
|
HB |
WBC |
СОЭ |
СРБ |
|
|
3 |
0,478 |
0,478 |
0,748 |
0,116 |
|
7 |
0,478 |
0,151 |
0,652 |
0,519 |
|
14 |
0,606 |
0,040* |
0,332 |
0,562 |
|
21 |
0,297 |
0,024 |
0,340 |
0,040 |
|
28 |
0,436 |
0,040 |
0,258 |
0,063 |
|
35 |
0,209 |
0,053 |
0,097 |
0,011 |
|
42 |
0,053** |
0,011 |
0,383 |
0,011 |
* – статистически значимые различия (p < 0,05) для полимерного гидрогеля выделены жирным шрифтом; ** – статистические значения, где 0,05 < p < 1, выделены курсивом.
Рентгенологически в опытной группе не наблюдалось явных признаков прогрессирования хронического остеомиелита, посттрепанационные дефекты замещались равномерно, и к концу исследования отверстия практически полностью закрылись (рис. 3). В сравнительной группе на всех контрольных сроках в среднем отмечались признаки продолжающейся инфекции большеберцовой кости в виде периостита различной степени выраженности, поднадкостничных кистозных полостей, неоднородной структуры костной ткани, секвестрации и замедленной остеорепарации (рис. 4). В некоторых случаях наблюдалось распространение зоны остеосклероза до средней трети диафиза кости. Резорбция на границе «кость-цемент» прослеживалась на снимках уже с 15-х суток исследования. В контрольной группе наблюдалась такая же ситуация, разница заключалась в выраженной степени периостальных наслоений и остеосклерозирования всей толщи верхней трети большеберцовой кости с распространением на ее нижерасположенные сегменты (рис. 5).
Микробиологический анализ раневого отделяемого в опытной группе не показал роста микрофлоры. Отрицательные результаты получены и при бактериологическом исследовании биоптатов поэтапно выведенных кроликов. Полученный единичный положительный скудный рост MSSA из мягкотканного биоптата животного, выведенного из эксперимента на 30-е сутки после имплантации гидрогеля, расценен нами как контаминация вследствие нарушения техники забора материала и его переноса в пробирку. Так как ни на самом гидрогеле, взятом из костномозгового канала и с поверхности этого мягкотканного биоптата, ни в костной ткани и других участках мягкотканых структур, ни в исследовании мазка области всего оперативного вмешательства, искомый штамм не выявлен. В сравнительной группе рост MSSA верифицировался на каждом контрольном сроке как из раневого отделяемого (до 45,5 %), так и из образцов материалов животных, выведенных на 15-е сутки (9,1 %) и 45-е сутки (27,3 %). Стоит отметить, что в 1 (9,1 %) из 2 случаев к концу исследования рост MSSA на костном цементе обнаружен у кролика со стойкой ремиссией инфекции. В контрольной группе положительный рост штамма выявлен у всех кроликов, пока имелось раневое отделяемое, и из биоптатов животного, выведенного из эксперимента на 15-е сутки исследования. В случае кроликов, вы- веденных на 30-е и 45-е сутки, получить биопсийный материал из костномозгового канала большеберцовой кости не представлялось возможным ввиду перекрытия области отверстий массивными периостальными наслоениями и выраженным остеосклерозированием, а посев гнойного детрита, взятого к концу исследования из области, соответствующей проекции инфильтрата, не обнаружил роста микрофлоры.
Гистологически на 15-е сутки в опытной группе ретикулярная строма костного мозга была со слабыми признаками лимфоцитарной инфильтрации и с большим числом клеток макрофагального ряда. Обнаруживались активные остеорепаративные признаки в виде эндостальной и периостальной реакции с формированием ретикулофиброзной костной ткани с трабеку-ляризацией на кортикальной стенке, где находились посттрепанационные отверстия. Собственно гидрогель занимал обширную площадь, окруженную гигантскими резорбирующими его клетками инородных тел (ГКИТ) (рис. 6, а).
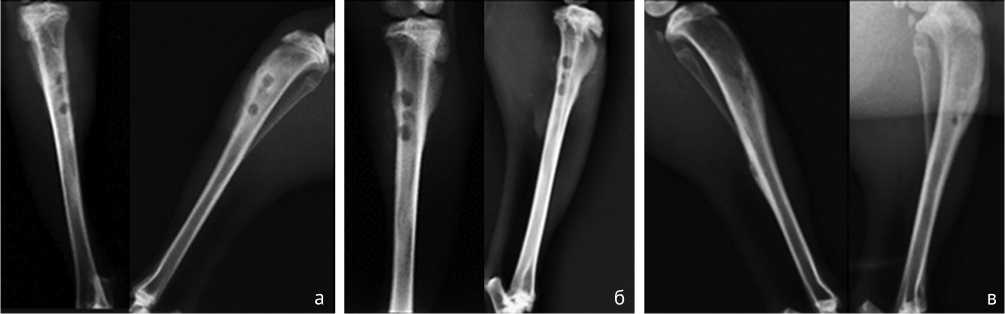
Рис. 3. Рентгеновские снимки костей голени животных опытной группы: а – на 15-е сутки выведения; б – на 30-е сутки выведения, в – на 45-е сутки выведения
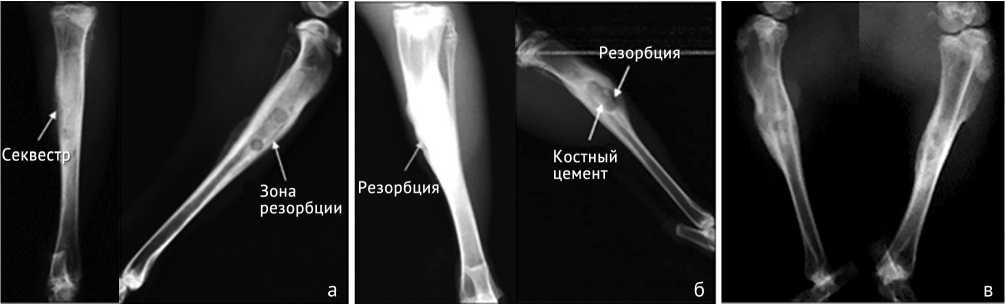
Рис. 4. Рентгеновские снимки костей голени животных сравнительной группы: а – на 15-е сутки выведения; б – на 30-е сутки выведения; в – на 45-е сутки выведения
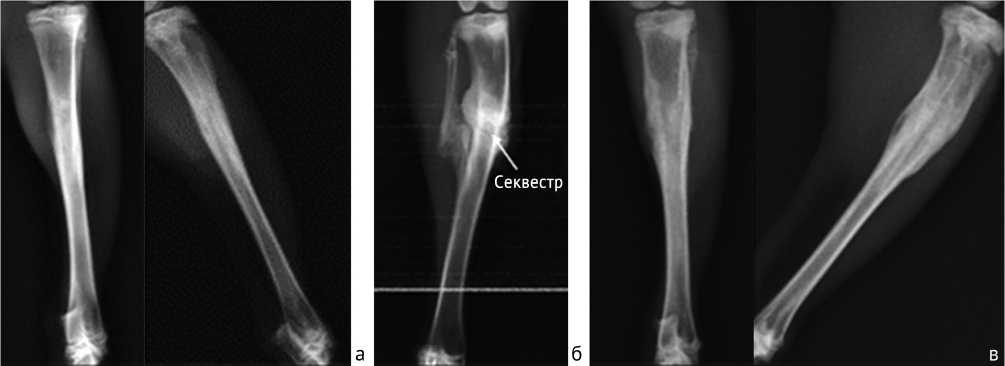
Рис. 5. Рентгеновские снимки костей голени животных контрольной группы: а – на 15-е сутки выведения; б – на 30-е сутки выведения, в – на 45-е сутки выведения
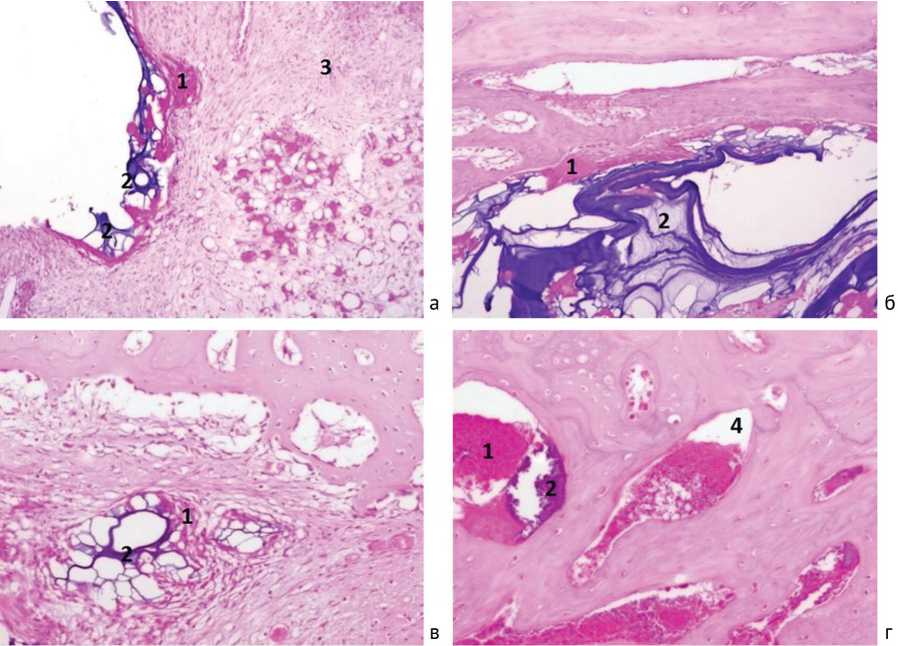
Рис. 6. Опытная группа: а, б – микропрепарат на 15-е сутки после имплантации гидрогеля. ГКИТ (1) резорбируют гидрогель (2). Слабая инфильтрация клетками лимфоцитарного ряда (3) ретикулярной стромы костного мозга. Окраска гематоксилином и эозином. ×200; в – на 30-е сутки. ГКИТ (1) резорбируют фрагменты гидрогеля (2); г – на 45-е сутки. ГКИТ (1) резорбируют остатки гидрогеля (2) внутри просвета гаверсовых каналов (4). Окраска гематоксилином и эозином. ×200
В сравнительной группе воспалительный инфильтрат, представленный значительным количеством лимфоцитов и плазмоцитов, занимал большой объем пространства, в том числе между отслоившимися частями/ гранулами цемента (рис. 7, а). Собственно репаративный остеогенез в сравнительной группе был менее выраженным и содержал меньший объем ретикулофи-брозной костной ткани.
На 30-е сутки в опытной группе отмечено значимое (р = 0,002) снижение воспаления. Клетки лимфоплазмоцитарного ряда определялись в единичных количествах. Объем гидрогеля к указанным суткам сократился, фрагменты его все еще продолжали резорбироваться ГКИТ (рис. 6, б). Отрицательной реакции в виде материал-ассоциированной резорбции костной ткани на присутствие полимерного гидрогеля не обнаружено. Вместе с тем в сравнительной группе, несмотря на стойкое клинико-лабораторное купирование хронического остеомиелита, гистологически не отмечено положительной динамики в снижении степени воспаления (рис. 7, б). Более того, на границе «кость-цемент» прослеживалась материал-ассоциированная резорбция новообразованной костной ткани.
К концу исследования у кроликов опытной группы воспалительный процесс практически полностью стих, обнаруживались лишь единичные плазмоциты и клетки макрофагального ряда. Новообразованная костная ткань в области посттрепанационных отверстий находилась на этапе ремоделирования, а ретикулофи-брозная костная ткань – на этапе дифференцировки в жировую ткань желтого костного мозга. Остаточные фрагменты гидрогеля, обнаруживаемые в просветах сформированных гаверсовых каналов, резорбировались ГКИТ (рис. 6, в). В сравнительной группе отмечены достоверные (р = 0,001) признаки обострения хронического остеомиелита, проявившиеся усугублением резорбции новообразованной костной ткани, более выраженной на границе с воспалительным инфильтратом (рис. 7, в). В области посттрепанационных отверстий ремоделирование костной ткани не наблюдалось. Площадь воспалительного инфильтрата, представленная значительным количеством полиморфноядерных нейтрофилов, достоверно (р = 0,001) увеличилась до такой степени, что заняла пространство не только вокруг и между полями цемента, но и весь просвет костномозгового канала. Также более половины поля зрения гистологического препарата занимали поля микроабсцессов (рис. 7, г).
В контрольной группе гистологически положительной динамики в купировании инфекционно-воспалительного процесса не наблюдалось ни на одном из контрольных периодов наблюдения (рис. 8, а, б). Гистологическая картина до санации очага инфекции и после нее была одинаковой. Отличием являлись высокая степень компактизации костного вещества кортикальной стенки с продолжающейся периостальной реакцией (рис. 8, в) и обнаружение множественных фокусов кровоизлияний, выявляемые к концу исследования не только в просвете суженного костномозгового канала, но и в кортикальной пластинке (рис. 8, г).
Данные результатов морфометрического исследования представлены в виде диаграмм размаха на рисунке 9.
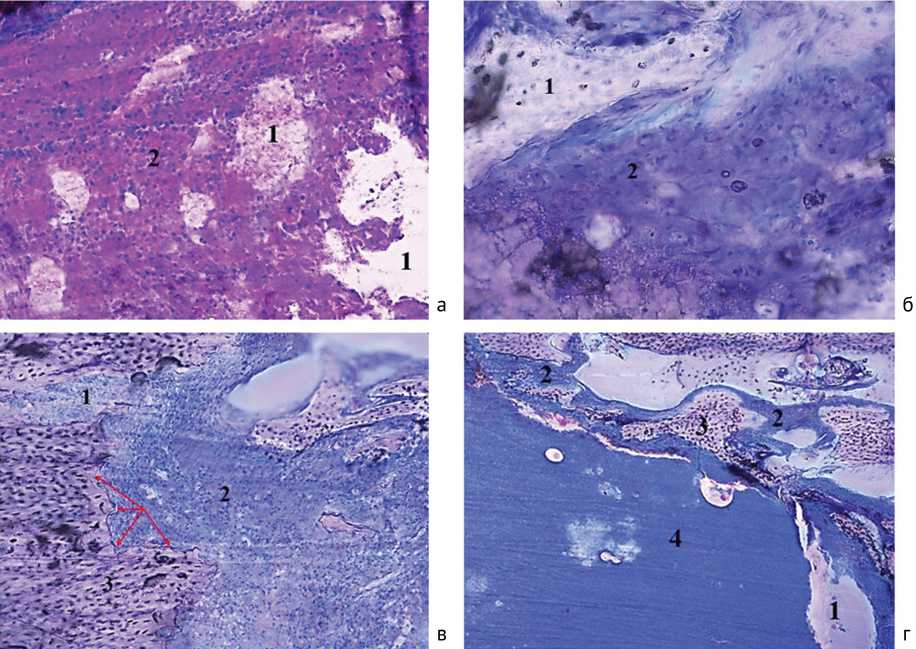
Рис. 7. Сравнительная группа: а – микропрепарат на 15-е сутки после санации (воспалительный инфильтрат из полиморфноядерных лейкоцитов (1) вокруг гранул ПММА (2), ×200); б – на 30-е сутки (гранула костного цемента (1) слоистой структуры с признаками фрагментации в окружении воспалительного инфильтрата (2); ×200); в – на 45-е сутки (резорбция костного вещества (3) на границе с воспалительным инфильтратом (2); ×200); г – на 45-е сутки (поля воспалительного инфильтрата (2) в костномозговом пространстве; микроабсцесс (4), ×50; окраска – небесный трихром)
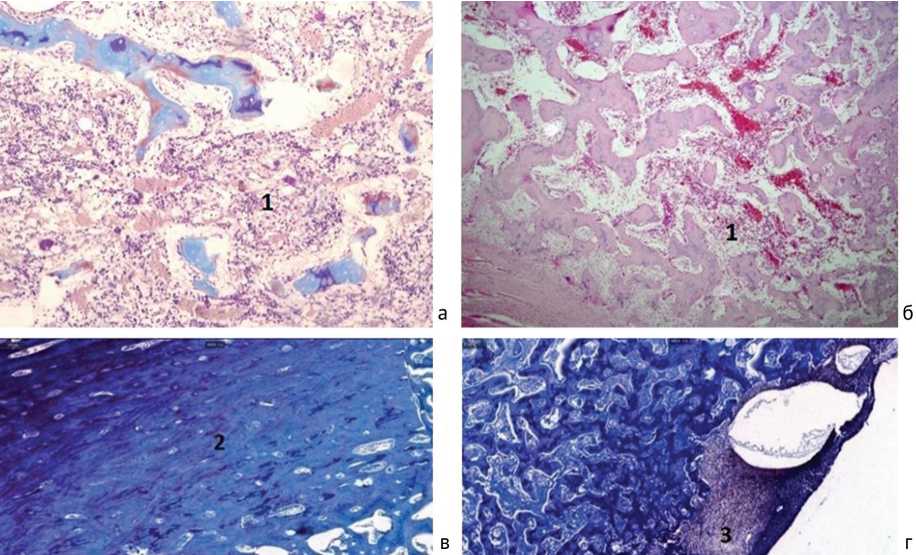
Рис. 8. Контрольная группа: а – микропрепарат кости животного на 15-е сутки после санации (фокусы лимфоплазмоцитарной инфильтрации (1) в просвете костномозгового канала; окраска гематоксилином и эозином, ×100); б – на 30-е сутки после санации (лимфоплазмоцитарный воспалительный инфильтрат (1) в ретикулярной строме костного мозга; окраска гематоксилином и эозином, ×50; в, г – на 45-е сутки после санации; высокая степень компактизации костного вещества (2) и фокус кровоизлияния в периостальной мозоли (3); окраска по Маллори)
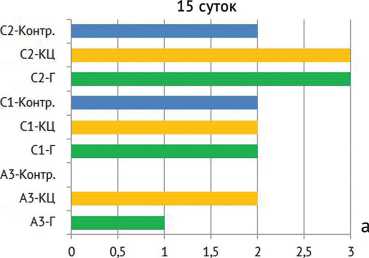
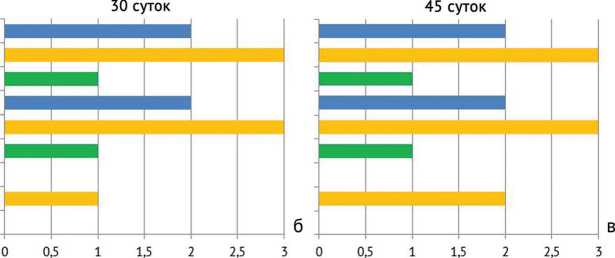
Рис. 9. Межгрупповые данные активности остеомиелита после санации через: а – 15 суток; б – 30 суток; в – 45 суток; (Г – гидрогель, КЦ – костный цемент, Контр. – контроль)
Активность остеомиелита (в баллах по Tiemann)
ОБСУЖДЕНИЕ
Как показал анализ in vivo эксперимента, в опытной группе локальная терапия, обеспечиваемая полимерным гидрогелем, во всех случаях способствовала своевременному заживлению послеоперационной раны голени. В сравнительной группе помимо местной терапии с 7-х суток и до конца исследования возникла потребность во вспомогательной системной антибиотикотера-пии по причине отсутствия регресса клинических симптомов воспаления. Однако, несмотря на усиленную системную терапию, в 2-х случаях нам так и не удалось добиться ремиссии инфекции. Лечение хронического остеомиелита только системной антибактериальной терапией неэффективно. Помимо всего, значимое (p = 0,006) увеличение массы тела животных с 28 суток (табл. 2) в опытной группе по сравнению со сравнительной группой косвенно свидетельствует о быстром послеоперационном восстановлении их общего состояния.
Анализ уровней маркеров воспаления показал существенное снижение WBC (p = 0,040) и СРБ (p = 0,040) в опытной группе со 2 и 3 недели исследования соответственно (табл. 4). В контрольной группе полученные к концу исследования значения показателей крови указывали на рецидив инфекции. В случае СОЭ и HB статистически межгрупповой достоверной разницы не выявлено (табл. 3 и 4). Несмотря на установленную нами достоверность в уровнях WBC и СРБ, не стоит оценивать эффективность лечения, ориентируясь только на лабораторные показатели крови, ввиду длительного колебания их значений без какой-либо определенной динамики. Foster et al. в своем исследовании тоже отмечают, что показатели крови у животных, на примере овец, не являются надежными критериями эффективности купирования инфекционного очага [12]. Вследствие чего показатели крови у животных необходимо рассматривать в совокупности с данными клинического, микробиологического, рентгенологического и гистологического исследования.
Если не учитывать единичный положительный случай, расцененный нами как контаминация, в опытной группе роста микрофлоры не обнаружено, что обусловлено высокими элюционно-антимикробными и гидрофильными свойствами гидрогеля [5]. В сравнительной группе штамм MSSA идентифицировался практически на каждом контрольном сроке. Обнаруже- ние роста микрофлоры на ПММА к 45-м суткам наблюдения у животного со стойко купированной инфекцией связана с предрасполагающей к адгезии микроорганизмов гидрофобной поверхностью небиодеградируемого ПММА, которая в последующем способствует развитию рецидива остеомиелита и приобретению микробами ан-тибиотикорезистентности. Полученные нами результаты относительно костного цемента в целом не противоречат выводам других авторов. К примеру, Ma et al. в своем исследовании сообщают о наличии жизнеспособных бактерий на поверхности спейсеров, эксплантированных у пациентов с купированной перипротезной инфекцией (ППИ). Было обнаружено, что 30,8 % образцов цемента имели высокий уровень копий бактериальной 16S рРНК, что свидетельствовало об оставшихся жизнеспособных микроорганизмах и послужило причиной рецидива ППИ в 10-20 % двухэтапной методики лечения [13]. В другой работе изучалась резистентность бактерий до и после имплантации спейсера с гентамицином у 33 пациентов с инфицированным тазобедренным суставом. До операции только 29 % бактерий имели резистентность к гентамицину, а после лечения костным цементом доля их возросла до 41 % [14]. George et al., сравнивая результаты пациентов до имплантации ПММА, насыщенным ванкомицином, и после, отмечают повышение МПК в 36 % случаев [15]. Другой in vivo эксперимент на крысах показал высокий процент (78 %) антибиотикорезистентных S. epidermidis в группе, где костный цемент, содержащий гентамицин, применялся в качестве профилактического средства [16].
Как показал анализ морфометрического исследования (рис. 9), во всех изучаемых группах имелись существенные отличия гистологической картины. Так, в опытной группе в сравнении с остальными группами наблюдалось достоверное (р = 0,002) эффективное купирование инфекционно-воспалительного процесса. К примеру, до санации очага суммарный результат С1 + С2 составил 4 балла, после имплантации гидрогеля сумма значимо снизилась до 2 баллов (рис. 9, в). При этом гистологически отмечались только единичные клетки лимфоцитов или плазмоцитов, что может быть обусловлено реакцией на присутствие инородного гидрогелевого материала, которая нивелируется после его полной резорбции. Собственно гидрогель не влиял на остеорепаративные процессы и не вызывал каких-либо токсических и отрицательных реакций в костной ткани. Как видно из рисунка 6 (а, г), с каждым контрольным сроком объем гидрогелевой матрицы уменьшался. В противовес опытной группе имплантация ПММА с течением времени вызывает достоверное (р = 0,001) обострение хронического остеомиелита (А3 + С1 + С2 = 8 – на 45 сутки против А3 + С1 + С2 = 4 – до санации очага), а в группе без установки депо-системы, но с системной антибиотикотерапи-ей и вовсе отсутствовала какая-либо динамика.
В целом, полученные нами гистоморфометриче-ские результаты согласуются с данными рентгенологического исследования.
Сравнение наших in vivo результатов с экспериментальными данными других исследований на модели животных сложно, в силу давности публикаций научных работ, посвященных изучению ПММА, и многих других обстоятельств (разные условия выполнения эксперимента, индукции хронического остеомиелита, сроков наблюдения и т.п.). Однако, в целом, выводы, сделанные нами касательно костного цемента и контрольной группы, не противоречат заключениям других авторов. К примеру, Mendel et al., сравнивая in vivo результаты антимикробной активности ПММА и коллагена, пришли к выводу, что данные матрицы приводят к отчетливому снижению числа бактерий, но полностью подавить инфекцию не способны [17]. Другими авторами выполнено сравнение результатов лечения хронического остеомиелита большеберцовой кости кроликов спейсер-ными бусами, содержащими тазоцин, и хирургической санации без имплантации материала. Рентгенологически и гистологически худший результат лечения показала контрольная группа без использования локальной депо-системы. Однако при этом в группе костного цемента в 5 (41,7 %) из 12 случаев обнаружено нарушение репаративного остеогенеза, из них в 25 % начало репа- ративной фазы отмечено к 14-й неделе после имплантации, в 16,7 % признаки репаративного остеогенеза вовсе отсутствовали [18]. Tuzuner et al. в своем исследовании показали, что костный цемент и кальций фосфат, нагруженные тейкопланином, в присутствии MRSA не способны предупредить развитие остеомиелита бедренной кости у крыс. Причем, гистологически и рентгенологически проявления остеомиелита были значительно выше в группе ПММА без антибиотика и ПММА с антибиотиком без биодеградируемого материала [19]. В другом эксперименте на модели крыс не обнаружили существенной разницы в терапевтическом эффекте лечения хронического остеомиелита при имплантации биоразлагаемой матрицы и ПММА, импрегнированных гентамицином [18]. Схожие результаты лечения получены и Shirtliff et al. при сравнении терапевтического эффекта ПММА и гидроксиапатита, импрегнированных ванкомицином [20].
Как выяснилось из исследования, имплантация ПММА со временем вызывает материал-ассоцииро-ванную резорбцию. Одной из причин может быть его биоинертность, которая способствует формированию фиброзного слоя на границе «кость-цемент», препятствующему прямому костному контакту имплантата [21]. Другой причиной расшатывания могут служить добавляемые в матрицу рентгеноконтрастные агенты (сульфат бария, диоксид циркония), инициирующие высвобождение провоспалительных цитокинов и, следовательно, остеолитическую реакцию тканей [22]. При этом сульфат бария обладает более высокими остеолитическими свойствами по сравнению с диоксидом циркония, характеризующимся больше абразивными свойствами [23]. Имплантация же полимерного гидрогеля не сопровождалась такой реакцией, что является еще одним из многочисленных преимуществ по сравнению с костным цементом.
ЗАКЛЮЧЕНИЕ
Результаты in vivo исследования продемонстрировали высокую эффективность полимерного гидрогеля, импрег-нированного антибиотиком, при лечении хронического остеомиелита по сравнению с ПММА. Было установлено, что имплантация гидрогеля способствует своевременному заживлению послеоперационной раны животных, значимому (p = 0,006) быстрому восстановлению их общего состояния после хирургического вмешательства, не вы- зывает прогрессирования рентгенологических признаков хронического остеомиелита и гистоморфометрически достоверно (р = 0,002) купирует инфекционно-воспалительный процесс без развития каких-либо токсических эффектов в костной ткани. А такие свойства материала как гидрофильность и биоразлагаемость значительно снижают риск адгезии микробов и формирования ими биопленок, что уменьшает вероятность обострения инфекции.
Список литературы In vivo эффективность полимерных гидрогелей, импрегнированных антибактериальным препаратом, при хроническом остеомиелите
- Афанасьев А.В., Божкова С.А., Артюх В.А. и др. Применение синтетических заменителей костной ткани при одноэтапном лечении пациентов с хроническим остеомиелитом. Гений ортопедии. 2021;27(2):232-236. doi: 10.18019/1028-4427-2021-27-2-232-236
- Дзюба Г.Г., Резник Л.Б., Ерофеев С.А., Одарченко Д.И. Эффективность использования локальных цементных армирующих антибактериальных имплантов в комплексе оперативного лечения больных хроническим остеомиелитом длинных костей. Хирургия. Журнал им. Н.И. Пирогова. 2016;(5):31-36. doi: 10.17116Лш-иг^а2016531-36
- Конев В.А., Божкова С.А., Трутников В.В. и др. Динамика тканевых изменений при одно- и двухэтапном лечении хронического остеомиелита с использованием биорезорбируемого материала, импрегнированного ванкомицином (сравнительное экспериментально-морфологическое исследование). Гены & Клетки. 2021;16(1):29-36. Лоп 10.23868/202104004
- Elhessy AH, Rivera JC, Shu HT, et al. Intramedullary Canal Injection of Vancomycin- and Tobramycin-loaded Calcium Sulfate: A Novel Technique for the Treatment of Chronic Intramedullary Osteomyelitis. Strategies Trauma Limb Reconstr. 2022;17(2):123-130. doi: 10.5005/jp-journals-10080-1554
- Цискарашвили А.В., Меликова Р.Э., Пхакадзе Т.Я. и др. In vitro исследование антимикробной активности матриц на основе гидрогеля, импрегнированных антибиотиками, в отношении ведущих микроорганизмов ортопедической инфекции. Гений ортопедии. 2022;28(6):794-802. doi: 10.18019/1028-4427-2022-28-6-794-802
- Конев В.А., Божкова С.А., Нетылько Г.И. и др. Способ моделирования локализованного метафизарного хронического остеомиелита у кролика. Патент РФ на изобретение № 2622209. 13.06.2017. Бюл. № 17. Доступно по: https://www.fips.ru/registers-doc-view/fips_servlet?DB =RUPAT&rn=2486&DocNumber=2622209&TypeFile=html. Ссылка активна на 01.08.2023.
- Цискарашвили А.В., Меликова Р.Э., Новожилова Е.А. Анализ шестилетнего мониторинга основных возбудителей перипротезной инфекции крупных суставов и их тенденция к резистентности. Гений ортопедии. 2022;28(2):179-188. doi: 10.18019/1028-4427-2022-28-2-179-188
- Tsai Y, Chang CH, Lin YC, et al. Different microbiological profiles between hip and knee prosthetic joint infections. J Orthop Surg (Hong Kong). 2019;27(2):2309499019847768. doi: 10.1177/2309499019847768
- Dudareva M, Hotchen AJ, Ferguson J, et al. The microbiology of chronic osteomyelitis: Changes over ten years. J Infect. 2019;79(3):189-198. doi: 10.1016/j.jinf.2019.07.006
- Beenken KE, Bradney L, Bellamy W, et al. Use of xylitol to enhance the therapeutic efficacy of polymethylmethacrylate-based antibiotic therapy in treatment of chronic osteomyelitis. Antimicrob Agents Chemother. 2012;56(11):5839-5844. doi: 10.1128/AAC.01127-12
- Tiemann A, Hofmann GO, Krukemeyer MG, et al. Histopathological Osteomyelitis Evaluation Score (HOES) - an innovative approach to histopathological diagnostics and scoring of osteomyelitis. GMS Interdiscip Plast Reconstr Surg DGPW. 2014;3:Doc08. doi: 10.3205/iprs000049
- Foster AL, Boot W, Stenger V, et al. Single-stage revision of MRSA orthopedic device-related infection in sheep with an antibiotic-loaded hydrogel. J Orthop Res. 2021;39(2):438-448. doi: 10.1002/jor.24949
- Ma D, Shanks RMQ, Davis CM 3rd, et al. Viable bacteria persist on antibiotic spacers following two-stage revision for periprosthetic joint infection. J Orthop Res. 2018~36(1):452-458. doi: 10.1002/jor.23611
- Neut D, de Groot EP, Kowalski RS, et al. Gentamicin-loaded bone cement with clindamycin or fusidic acid added: biofilm formation and antibiotic release. J Biomed Mater Res A. 2005;73(2):165-170. doi: 10.1002/jbm.a.30253
- Sabater-Martos M, Verdejo MA, Morata L, et al. Antimicrobials in polymethylmethacrylate: from prevention to prosthetic joint infection treatment: basic principles and risk of resistance. Arthroplasty. 2023;5(1):12. doi: 10.1186/s42836-023-00166-7
- Van Staden AD, Dicks LM. Calcium orthophosphate-based bone cements (CPCs): Applications, antibiotic release and alternatives to antibiotics. J Appl Biomater Funct Mater. 2012;10(1):2-11. doi: 10.5301/JABFM.2012.9279
- Mendel V, Simanowski HJ, Scholz HC, Heymann H. Therapy with gentamicin-PMMA beads, gentamicin-collagen sponge, and cefazolin for experimental osteomyelitis due to Staphylococcus aureus in rats. Arch Orthop Trauma Surg. 2005;125(6):363-368. doi: 10.1007/s00402-004-0774-2
- Börzsei L, Mintal T, Koos Z, et al. Examination of a novel, specified local antibiotic therapy through polymethylmethacrylate capsules in a rabbit osteomyelitis model. Chemotherapy. 2006;52(2):73-79. doi: 10.1159/000092371
- Tuzuner T, Sencan I, Ozdemir D, et al. In vivo evaluation of teicoplanin- and calcium sulfate-loaded PMMA bone cement in preventing implant-related osteomyelitis in rats. J Chemother. 2006;18(6):628-633. doi: 10.1179/joc.2006.18.6.628
- Shirtliff ME, Calhoun JH, Mader JT. Experimental osteomyelitis treatment with antibiotic-impregnated hydroxyapatite. Clin Orthop Relat Res. 2002;(401):239-247. doi: 10.1097/00003086-200208000-00027
- Sa Y, Yang F, Wang Y, et al. Modifications of Poly(Methyl Methacrylate) Cement for Application in Orthopedic Surgery. Adv Exp Med Biol. 2018;1078:119-134. doi: 10.1007/978-981-13-0950-2_7
- Giavaresi G, Bertazzoni Minelli E, Sartori M, et al. New PMMA-based composites for preparing spacer devices in prosthetic infections. J Mater Sci Mater Med. 2012;23(5):1247-1257. doi: 10.1007/s10856-012-4585-7
- Breusch SJ, Kühn KD. Knochenzemente auf Basis von Polymethylmethacrylat [Bone cements based on polymethylmethacrylate]. Orthopade. 2003;32(1):41-50. (In German) doi: 10.1007/s00132-002-0411-0


