Индекс фрагментации ДНК -маркер фертильности спермопродукции норок
Автор: Абрамов П.Н., Борунова С.М., Иолчиев Б.С.
Статья в выпуске: 4 т.244, 2020 года.
Бесплатный доступ
В ходе выполнения эксперимента была установлена прямая зависимость биологической полноценности спермы от белкового питания, а именно - отсутствие необходимого состава аминокислот в базовом рационе норок. Результаты исследования показывают, что в эякуляте самцов, получавших в рационе по 2 и 4 мл 15 % раствора белкового гидролизата по сравнению с контрольной группой, получавшей только основной рацион, содержание подвижных сперматозоидов больше на 17 и 15 % (p
Норка, сперма, гидролизат, дезоксирибонуклеиновая кислота, индекс фрагментации
Короткий адрес: https://sciup.org/142226083
IDR: 142226083 | УДК: 575:636.934.56 | DOI: 10.31588/2413-4201-1883-244-4-4-10
Текст научной статьи Индекс фрагментации ДНК -маркер фертильности спермопродукции норок
Успехи современной зооветеринарной практики в вопросах лечения бесплодия сельскохозяйственных самцов-прозводителей в комплексе с применением вспомогательных репродуктивных технологий определяют острую необходимость совершенствования методов ветеринарной лабораторной диагностики по установлению этиопатогенетических механизмов развития инфертильности.
Перевод животноводства на промышленную основу спровоцировал изменение условий содержания пушных зверей в условиях доместикации, лишая их привычной естественной среды обитания.
Известно, что современные индустриальные способы содержания животных (изменение функциональных нагрузок организма, адаптационные реакции на внешние раздражители, вызывающие стресс) негативно влияют на гомеостаз и продуктивность в целом.
В таких сложившихся условиях чаще всего страдает молодняк зверей из-за несовершенства физиологического состояния организма и снижения естественной резистентности, ведущей к снижению продуктивности в пушно-меховой отрасли.
Для увеличения пушно-меховой продуктивности требуется улучшение кормовой базы, за счет оптимизации структуры рациона, использования раз- личных доступных нетрадиционных кормовых добавок, улучшающих качество корма и оказывающих положительное влияние на физиологическое состояние организма.
В настоящее время широко интегрируется в отечественную кормоинду-стрию перспективное направление по применению гидролизатов животных белков в составе базового питания. Так, белковые добавки способны оказывать активное влияние на гомеостаз организма животных, на его физиологические функции, а также репродуктивные показатели [11]. Репродуктивная функция одна из важных функций организма, которая обладает мощным инструментом в обеспечении зачатия, рождения и выхаживания зрелого жизнеспособного потомства и является наиболее чувствительным маркером, точно отражающим любое отклонение от показателей нормы в организме и напрямую зависящим от полноценного кормления, которое занимает приоритетное значение в норководстве.
В соответствии с вышесказанным, цель нашего исследования состояла в определении роли белкового питания на репродуктивные функции самцов норок, путем введения белкового гидролизата в качестве кормовой добавки в их основной рацион. Кормление обеспечивает опти- мальную потребность организма в энергии, протеине, незаменимых аминокислотах, минеральных веществах, витаминах, необходимых для нормального протекания морфофизиологических, гормональных, биохимических, биофизических процессов сперматогенеза и овогенеза в репродуктивных органах любого вида животных. Морфофункциональное строение, целостность, активность половых клеток напрямую зависит от правильного баланса белков, жиров и углеводов в базовом питании, а также от аминокислотного состава рациона, поскольку дефицит какой либо одной аминокислоты (лимитирующей) в рационе может привести к частичному неусвоению всех остальных, возникновению дисбаланса гомеостаза организма, приводящего к различным цитоатипиям гамет в эякуляте, где атипичные структуры половых клеток представлены различными морфологическими аномалиями сперматозоидов и функциональными нарушениями отдельных структурных единиц.
Трофическое обеспечение гамет зависит от каскада биохимических реакций, синтеза и катаболизма нуклеопротеидов метаболического процесса. Нуклеопротеиды поступают в организм вместе с пищей и распадаются на белки, в дальнейшем на аминокислоты в тонком отделе кишечника, а блокировка или локальное нарушение какой–либо из фаз процесса метаболизма ведет к возникновению аномальных форм.
По данным Е.Е. Брагиной (2014), в последние годы к лабораторному критерию качества сперматозоидов относят оценку структурных нарушений хромосом – это не правильная упаковка и наличие разрывов нитей ДНК в головке спермия [2]. Уже известно, что сперматозоиды с фрагментацией ДНК могут повреждать яйцеклетку, в результате чего она теряет функциональность, эмбрион не образуется, протокол оплодотворения оканчивается неудачно. Если уровень фрагментации ДНК невысок, то в некоторых случаях молодая и здоровая яйцеклетка может восстановить структуру нуклеотидной цепочки из имеющихся нуклеотидных остатков в цитотоли клетки. Считается, что окислительный стресс сперматозоидов выражает- ся в повреждении свободными радикалами их мембран, белков и ДНК. В норме радикалы нейтрализуются антиоксидантами, но при метаболических нарушениях, при воспалительных процессах, иммунных расстройствах баланс гомеостаза нарушается, активных форм кислорода становится больше, и они начинают проявлять свое негативное влияние на те или иные органы.
Чаще всего этот процесс запускается на стадии мейоза в половых железах норок и продолжается до выхода сперматозоидов из их придатка, поэтому при снижении фертильности животного организма необходимо в базовый рацион животных вводить различного рода добавки, на основе аминокислот, для регулирования белкового, липидного и углеводного метаболизма.
Материал и методы исследований. Объектом исследования были самцы норки. Для проведения исследования было сформировано три группы: I и II группа -опытные, III контрольная, при этом в каждой группе – по семь голов самцов годовалого возраста. Животным первой и второй групп к основному рациону добавляли по 2 и 4 мл 15 % раствора белкового гидролизата, соответственно, в то время как контрольные аналоги находились на обычном рационе. Введение гидролизата опытным группам в рацион начинали за два месяца до начала гона и в период него. Белковый гидролизат, полученный нами в ЗАО «Биопрогресс» [1, 3], содержал в своем составе весь спектр незаменимых аминокислот, учитываемых в пушном звероводстве. Дозу гидролизата определяли из необходимой потребности животных в аминокислотах и по фактическому содержанию ЛНАК (лимитирующие аминокислоты) в рационе. Сбор спермы проводили из влагалища самок норок, после прерванного коитуса, с помощью пипетки. Активность сперматозоидов определяли с помощью пакет программы «AndroVision®». Для оценки морфологии сперматозоидов использовали набор реагентов SpermBlue и программное обеспечение Argus-CASA. Состояние ДНК в сперматозоидах изучали методом акридин-оранжевого теста (АО- тест) с использованием флуоресцентной микроскопии. Целостность акросом сперматозоидов изучали с помощью ДИФ-Квик окрашивания. Для статистического анализа полученных данных использовали пакет программы анализа данных программы IBM SPSS Statistics 23.0 («IBM Corp.», США).
Результаты исследований. Подвижность сперматозоидов в опытной и контрольной группе существенно отличались. В I и II опытных группах содержание подвижных сперматозоидов составило соответственно 62±1,6 и 61±0,9 в контрольной группе 53±1,9 % (Таблица 1). Между опытными группами по содержанию прогрессивно подвижных сперматозоидов ста- тистическое значимое различие не установлено. Первая опытная группа по данному показателю превосходила контрольной группу на 17 % (p≤0,01) и вторая на 15 % (p≤0,01). Анализ траектории подвижности активных сперматозоидов показывает, что движение сперматозоидов норок отличается по характеру движения. Сперматозоиды двигаются прогрессивно криволинейно.
В эякуляте контрольной группы доля сперматозоидов с непрогрессивным движением составила более 18 %, что в 1,9 больше по сравнению со второй опытной группой. Разница между опытными группами и контрольной группой оказалась статистическая достоверная при p≤0,001.
Таблица 1 – Качество спермы норок в зависимости от состава рациона
|
Показатель |
Группы |
||
|
I опытная |
II опытная |
Контрольная |
|
|
Содержание сперматозоидов, %: прогрессивно-подвижные |
62,0±1,6** |
61,0±0,9** |
53,0±1,9 |
|
непрогрессивно-подвижные |
11,4±0,6*** |
9,6±0,7*** |
18,3±0,3 |
|
Неподвижные |
26,6±1,4 |
29,4±1,6 |
28,7±0,8 |
|
Морфологические аномалии, % |
12,7±0,6** |
13,5±0,9** |
19,3±0,8 |
|
Индекс фрагментации ДНК, % |
2,0±0,1*** |
2,1 ±0,1*** |
30±0,8 |
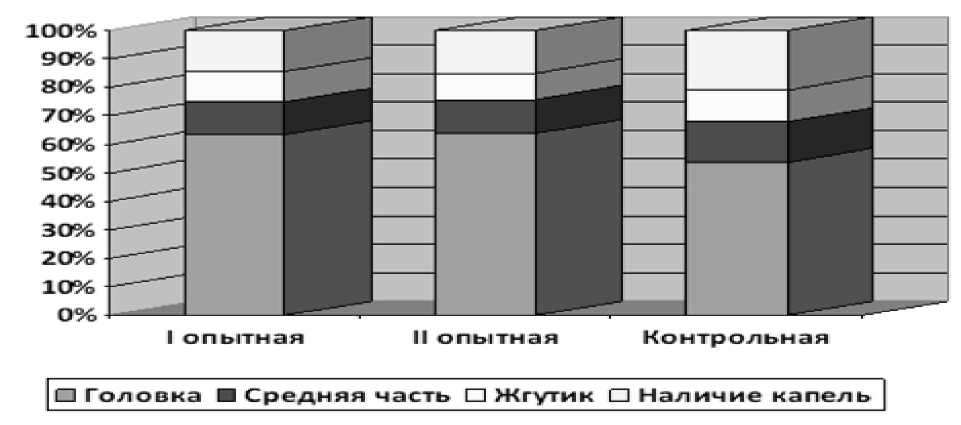
Рисунок 1 – Частота встречаемости патологии в отдельных сегментах сперматозоидов
Наивысшая частота аномалии морфологии в эякуляте наблюдалась в контрольной группе. Содержание сперматозоидов с различными морфологическими нарушениями в данной группе в среднем составило 19,3 % и в зависимости от индивидуальных особенностей самца варьиро- вало от 14 до 26 %.
Исследуемые группы отличались по частоте встречаемости аномалии отдельных сегментов сперматозоидов. При этом сохранялась общая закономерность, когда наиболее часто встречались патологии в головке и средней части сперматозоидов
(Рисунок 1).
В исследованиях, проведенных нами, были зафиксированы следующие патологические формы сперматозоидов норок: дефекты головок - присутствие образцов безъядерных, шаровидных и конусовидных форм. При этом в головках аномальных спермиев наблюдали изменение локализации акросомы и даже её отсутствие в контрольной группе. Дефекты шейки и средней части гамет в образцах были представлены сперматозоидами во всех экспериментальных группах, наличие спиралевидно сложенного жгутика в контрольной группе.
В 70 % образцах, полученных от самцов контрольной группы, встречались сперматозоиды с фрагментацией ядерной и митохондриальной ДНК. Индекс фрагментации ДНК в сперматозоидах самцов контрольной группы в среднем составил 30 %, у первой опытной группы в полученных эякулятах индекс фрагментации ДНК в среднем составил 2 %, во второй опытной группе 2,1 %. Разница между контрольной и опытными группами была статистически значимой при p<0,001. Часто встречалась фрагментация ДНК в хроматине сперматозоидов контрольной группы норок (Рисунок 2).
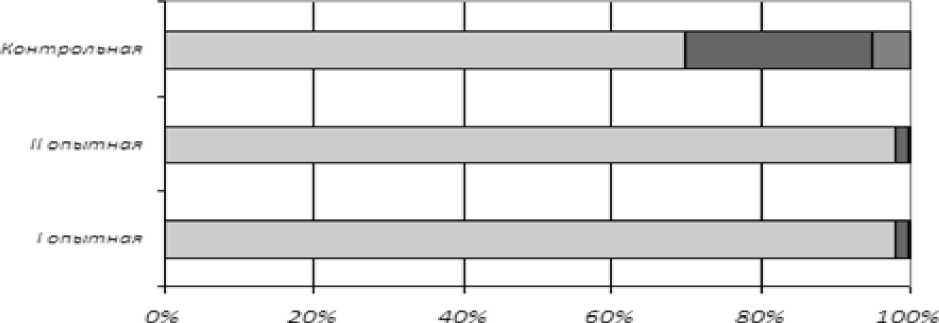
-
□ и ДНК ■ яДНК ■ вцДНК |
Рисунок 2 - Степень фрагментации ДНК в сперматозоидах иДНК - интактная ДНК; яДНК -ядерная ДНК; мДНК - митохондриальная ДНК
При исследовании образцов спер-мопродукции самцов-норок по показателю индекса фрагментации ДНК было зафиксировано следующее: образцы спермопро-дукции самцов–производителей контрольной группы имели структурные нарушения как в яДНК (головке сперматозоидов), так и в мДНК (средняя часть). Вероятно, это обстоятельство напрямую коррелирует с отсутствием недостаточного количества в базовом рационе аминокислот, участвующих в синтезе нуклеотидов и протаминов. В спермопродукции самцов-производителей норок опытной группы подобного рода деструктивные изменения не были обнаружены. Основную массу хроматина представляют белки гистоны. Гистоны - нуклеотидные белки, активно участвующие в переписывании информации с гена на информационную РНК, а также в репарации поврежденных локусов цепи ДНК; от плотности расположения гистонов в активно экспрессирующихся участках генома зависит и интенсивность экспрессии генов. Так, в норме хроматин зрелых сперматозоидов плотно упакован, чтобы защитить ДНК от потенциальных повреждающих воздействий во время транзита его по органам репродуктивной системы. Высокая плотность гистонов формирует «закрытую структуру» хроматина, что приводит к инактивации генов; если хроматин конденсирован, то гены находятся в инактивированном состоянии, если хроматин открыт (декондесирован) и активен, то это определяет активацию экс- прессии генов. В свою очередь, динамика состояния хроматина определяется и контролируются такими обратимыми процессами, как метилирование ДНК и модификация гистонов.
Сегодня уже известно, что «выключение» генов осуществляется при помощи метилирования ДНК (прикрепления к цитозиновым основаниям ДНК метильной группы СН 3 ). «Включение» происходит за счет ацетилирования гистонов (белков в составе хроматина, необходимых для сборки и упаковки ДНК); в результате плотного контакта ДНК и гистонов в хроматине половой клетки, происходит блокирование концевых участков «хвостов» ДНК (ограничивает свободу вращения концевых нитей), что препятствует специфическим ферментам доступ к определенным локусам ДНК при сканировании наследственной информации.
От того, как цепочка ДНК упаковывается в ядре половой клетки, зависит и количество того или иного белка, который синтезируется в клетке на нужды ее существования, а выявленные цитопатологии в половых клетках, при получении данных по проведенному эксперименту, яркое тому подтверждение. Это согласуется с данными зарубежной литературы Evenson D.P., Larson K.L., Jost L.K., (2002), Agarwal A., Said T.M. (2003), Erenpreiss J., Spano M., Erenpreisa J. (2006), Kempisty B., Depa-Martynow M., Lianeri M. (2007) [4, 7, 8, 9]. Возникновение цитопатологий в спермо-продукции животных характеризуется такими нарушениями как нарушение физической целостности молекулы ДНК в виде разрыва одной или обеих полинуклеотид-ных цепей (фрагментация); дефектов ядер-ных белков, препятствующих замене гистонов на протамины с последующим уплотнением ДНК; нарушением пространственной третичной структуры хроматина.
При движении спермия по половым путям самки (подвижность гаметы сохраняется в анаэробных условиях) включается альтернативный механизм катабализма – гликолиз, в ходе которого и формируются молекулы АТФ, тем самым поддерживается двигательная активность спермия. Активация подвижности сперматозоидов за- висит от циклического аденозинмонофосфата (АМФ), производного АТФ, который, будучи универсальным регулятором метаболических реакций, активизирует цАМФ – зависимую протеинкиназу. Протеинки-наза фосфорилирует белки, а каталитические субъединицы протеинкиназ способны пересекать ядерные мембраны и фосфорилировать ядерные белки – гистоны, тем самым, регулировать генную активность половых клеток.
Полученные данные в ходе проведения эксперимента по выявлению и обнаружению фрагментированных участков ДНК в спермопродукции норок контрольной группы, не получавших в базовом рационе белковый гидролизат, позволяют нам комментировать данную ситуацию с позиции недополучения ими соответствующего белкового питания, что и отражается в процессах фрагментации цепей ДНК спермиев.
Высокое содержание оксидантов в ее окружении приводит к мутациям в мДНК с частотой в 10-20 раз большей, чем в яДНК. При репликации образуется трехнитчатая мДНК (промежуточное звено), которая очень восприимчива к делециям [13, 14]. Точечные мутации и делеция фрагментов мДНК приводят к патологии митохондриальной дыхательной дисфункции, что является одной из причин патологий спермий [5, 10, 15]. Исследования ультраструктур сперматозоидов показывают, что мутация ДНК, а также другие повреждения митохондрий сперматозоидов сопровождаются снижением их активности [6, 11]. Полученные нами данные согласуются с данными других авторов.
Белковый гидролизат, а именно аминокислотный триплет – гистидин, треонин, триптофан, не только вероятно перезапустил метаболизм гомеостаза организма норок в целом, но и выступил в роли донора по образованию заменимых аминокислот и выравниванию их по количеству: так гистидин является донором глутаминовой кислоты, нарушение метаболизма гистидина в тканях животного отражается в снижении концентрации гистидина в эритроцитах, тем самым увеличивается его содержание в сыворотке крови. Иниции- руются эти процессы тем, что тормозится реакция дезаминирования и усиливается реакция декарбоксилирования, при этом образуется биологически активное вещество – гистамин – естественный ингибитор перекисного окисления липидов.
Введение гистидина позволяет ограничить образование маланового диальдигида в тканях, приводящего к разрушению митохондрий и угнетающего процесс окислительного фосфорилирования.
Триптофан вместе с лизином образует трипептид (лизин-триптофан-лизин), который исправляет ошибки, возникающие при удвоении ДНК и возникновении различных поломок (фрагментация) в ее нитях. При нехватке этой незаменимой аминокислоты происходит выпадение шерсти у животных и нарушатся функция половых желез.
Триплет незаменимых аминокислот белкового гидролизата, поступающий путем применения его в составе базового рациона опытных групп самцов норок, инициировал, по-видимому, работу необходимых ферментов, поддерживающих равновесие концентрации молекул АТФ в спер-мии.
Созданное биохимическое равновесие метаболических процессов спермия позволяет избежать потребности в диффузии его на большие расстояния по половым путям. Отсутствие аминокислотного обогащения в базовом рационе норок приводит к морфофункциональным отклонениям половых клеток, что может отражаться не только на количестве коитусов самцов–производителей, но и на развитии эмбрионов, а также на рождении здорового приплода
Заключение. Таким образом, результаты исследования показывают, что добавление в рацион самцов норок 2 мл 15 % раствора белкового гидролизата улучшает биологическую полноценность сперматозоидов, снижает индекс фрагментации ядерной и митохондриальной ДНК, снижает частоту встречаемости патологии сперматозоидов и улучшает их активность.
В результате исследований отмечено, что между первой опытной (самцы по- лучали основной рацион + 2 мл 15 % раствора белкового гидролизата) и второй опытной группами (основной рацион + 4 мл 15 % раствора белкового гидролизата) статистическое значимое различие не установлено, следовательно, экономически эффективно добавление в рацион 2 мл белкового гидролизата.
DNA FRAGMENTATION INDEX - A MARKER OF FERTILITY
Список литературы Индекс фрагментации ДНК -маркер фертильности спермопродукции норок
- Абрамов, П.Н. Разработка промышленного способа получения белкового гидролизата тушек норок / П.Н. Абрамов, Р.В. Рогов // Вопросы ветеринарии и ветеринарной биологии: Сборник научных трудов молодых ученых МГАВМиБ. -2011. - С. 121-123.
- Брагина, Е.Е. Протокол проведения спермиологического исследования / Е.Е. Брагина // Андрология и генитальная хирургия. - 2014. - № 1. - С. 15-24.
- Фролова, М.А. Получение промышленной партии белкового гидролизата из тушек норок и изучение его токсичности / М.А. Фролова, А.Я. Самуйленко, A. И. Албулов [и др.] // Известия Самарского научного центра РАН. - Самара. - 2011. - Т. 13. - № 5 (3). - С. 207-209.
- Agarwal, A. Role of sperm chromatin abnormalities and DNA damage in male infertility / A. Agarwal, T.M. Said // Hum Reprod Update. - 2003. - № 9 (4). P. 331-45.
- Amaral, A. Mitochondria functionality and sperm quality / A. Amaral, B. Lourenco, M. Marques [et. al] // Reproduction. - 2013. - Vol. 146 (5). - P. 163-174.
- Borunova, S.M. Astenozoospermiya u bykov-proizvoditeley / S.M. Borunova, B.S. Iolchiev, O.E. Badmaev [et. al] // Veteri-nariya, zootekhniya i biotekhnologiya. -2017. - № 11. - P. 57-64.
- Erenpreiss, J. Sperm chromatin structure and male fertility: biological and clinical aspects / J. Erenpreiss, M. Spano, J. Erenpreisa [et al.] // Asian J Androl. - 2006 - Vol. 8 (1). - P. 11-29.
- Evenson, D.P. Sperm chromatin structure assay: its clinical use for detecting sperm DNA fragmentation in male infertility and comparisons with other techniques / D.P. Evenson, K.L. Larson, L.K. Jost // J. Androl. - 2002. - Vol. 23. - P. 25-43.
- Kempisty, B. Evaluation of protamines 1 and 2 transcript contents in spermatozoa from asthenozoospermic men / B. Kempisty, M. Depa-Martynow, M. Lianeri [et al.] // Folia Histochem Cytobiol. - 2007. Vol. 45. - P.109-13.
- Kidun, K.A. Mitokhondrialnaya disfunktsiya spermatozoidov v patogenez epatospermiy priokislitelnomstresse (obzorliteratury) / K.A. Kidun, T.S. Ugolnik // Problemyzdorovya i ekologii. - 2013. -№ 2 (36). - P. 20-24.
- Pelliccione, F. Altered ultrastructure of mitochondrial membranes is strongly associated with unexplained asthenozoo-spermia / F. Pelliccione, A. Micillo, G. Cordeschi [et al.] // J. Fertility and Sterility. - 2011. - Vol. 95 (2). - P. 641-646.
- Rutherfurd-Markwick, K. Bioactive peptides derived from food / K. Rutherfurd-Markwick, P. Moughan // Journal of AOAC International. - 2005. - № 88 (3). -P. 955-966.
- Shamsi M.B., et al. Mitochondrial DNA mutations in etiopathogenesis of male infertility // Indian Journal of Urology. -2008. - Vol. 24 (2). - P. 150-154.
- Shu-Huei, K., Mitochondrial deoxyribonucleic acid 4977-bp deletion is associated with diminished fertility and motility of human sperm / K. Shu-Huei, Ch. Hsiang-Tai, W Yau-Huei // Biology of Reproduction. -1995. - Vol. 52 (4). - P. 729-736.
- St. John, J.C. The impact of mitochondrial genetics on male infertility / J.C. John, R.P. Jokhi, C.L. Barratt // Int. J. Androl. - 2005. - Vol. 28 (2). - P. 65-73.


