Индуцирование антиоксидантных ферментов в растениях гороха избытком хлористого аммония
Автор: Мурзаева С.В.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 2 т.2, 2000 года.
Бесплатный доступ
Исследовали действие хлористого аммония (10-6 10-2 М) на горох при добавлении в среду выращивания. Увеличение концентрации этой соли приводило к замедлению роста растений, уменьшению содержания белка и хлорофилла в листьях и снижению скорости синтеза АТФ в изолированных хлоропластах. При избытке аммония (2,5 x 10-2 M) и длительном действии меньших концентраций (10-6 -10-4 М) увеличивалась активность ферментов супероксиддисмутазы, каталазы и пероксидазы в листьях и корнях. Сравнение растворимых (цитозольных) и труднорастворимых (мембранных) белковых фракций, а также субклеточных структур, выделенных из проростков, показало активирование ферментов хлористым аммонием преимущественно в мембранных структурах ядрах, субчастицах, митохондриях и хлоропластах. Обсуждается активирование антиоксидантных ферментов в растениях гороха в связи с мембранотропным действием хлористого аммония. Сделан вывод об уси лении окислительной активности пероксидазы при токсичном избытке соли.
Короткий адрес: https://sciup.org/148197612
IDR: 148197612
Текст научной статьи Индуцирование антиоксидантных ферментов в растениях гороха избытком хлористого аммония
Институт экологии Волжского бассейна РАН, г. Тольятти
Исследовали действие хлористого аммония (10-6 -10-2 М) на горох при добавлении в среду выращивания. Увеличение концентрации этой соли приводило к замедлению роста растений, уменьшению содержания белка и хлорофилла в листьях и снижению скорости синтеза АТФ в изолированных хлоропластах. При избытке аммония (2,5 x 10-2 M) и длительном действии меньших концентраций (10-6 -10-4 М) увеличивалась активность ферментов супероксиддисмутазы, каталазы и пероксидазы в листьях и корнях. Сравнение растворимых (цитозольных) и труднорастворимых (мембранных) белковых фракций, а также субклеточных структур, выделенных из проростков, показало активирование ферментов хлористым аммонием преимущественно в мембранных структурах - ядрах, субчастицах, митохондриях и хлоропластах.
Обсуждается активирование антиоксидантных ферментов в растениях гороха в связи с мембранотропным действием хлористого аммония. Сделан вывод об усилении окислительной активности пероксидазы при токсичном избытке соли.
Загрязнение окружающей среды делает необходимым изучение трансформации вредных соединений (ксенобиотиков) в растениях, выявление первичных мишеней воздействия, метаболических и детоксикационных путей их в живой клетке. К настоящему времени накоплен достаточно обширный материал, показывающий неспецифическое действие любых ксенобиотиков на клетку, проявляющуюся в активировании перекисного окисления липидов (ПОЛ) в клеточных мембранах, образовании активных форм кислорода (АФК), индуцирующих свободно-радикальные механизмы и провоцирующих окислительные стрессы [1-2].
К АФК относят: очень токсичные - гидроксильный радикал (ОН,), гидроксид ион радикал (ОН") и супероксидрадикал (О2") и менее токсичные - гидроксид ион кислорода (НО2-) и перекись водорода (Н2О2) [3]. В живых клетках, в том числе и растительных, существуют механизмы противостоящие окислительному стрессу, так называемые антиоксидантные системы, включающие ферменты и низкомолекулярные соединения. Ключевыми ферментами можно рассматривать супе-роксиддисмутазу, каталазу и пероксидазу связанных последовательно механизмом каталитического действия. Супероксиддисмутаза (СОД), КФ 1.15.11, осуществляет дисмутацию супероксидного радикала до перекиси водорода и кислорода, каталаза (КАТ), КФ 1.11.1.6, разрушает перекись водорода на воду и кислород [4], а пероксидаза (ПО), КФ 1.11.1.7, окисляет широкий спектр восстановителей с участием Н,О, [5]. Совместное действие этих ферментов с низкомолекулярными антиоксидантами, такими как а- токоферол (витамин Е), восстановленный глутатион, аскорбат и др., обеспечивает защиту от АФК в живых организмах [6,7].
В литературе сообщается об активации ферментов - СОД и КАТ [8] или ПО [9-11] при увеличении адаптационных возможностей растений в различных неблагоприятных условиях, в том числе и при действии ксенобиотиков [12], однако не представлены данные об одновременной активации всех трех ферментов при действии токсичных концентраций загрязнителей. Сопоставление этих активностей в растениях в различных неблагоприятных условиях помогло бы разрешить вопрос об использовании их в биотестировании, который дискутируется в специальной литературе [13]. С другой стороны, активация СОД и ПО может указывать на развитие окислительного процесса, особенно в случае фермента пероксидазы. Каталитический механизм действия этого фермента не является однозначно антиоксидативным [10,14]. В последнее время ПО приписывают не только защитную роль от АФК, но и окислителя при детоксикации чужеродных соединений [15]. Нас этот вопрос заинтересовал в связи с выявлением первичных мишеней воздействия ксенобиотиков на растения и разработкой биохимических тестов на загрязнение окружающей среды.
С этой целью в настоящей работе исследовали активность СОД, КАТ и ПО в горохе при добавлении в среду выращивания хлористого аммония в широком диапазоне концентраций, включая токсические. Предстояло оценить изменения активности каждого фермента в разных частях растения - листьях и корнях, в субклеточных мембранных структурах и фракциях растворимых (цитозольных) и мембранных белков.
Методика
Горох (Pisum sativum L.) сорт "Неосыпа-ющийся" выращивали в почвенной или водной культуре на среде Чеснокова-Базыриной, при естественном освещении и температуре 22-27 ° С. Полив и смену среды гидропоники проводили два раза в неделю. Хлористый аммоний (10-6 -10-2 М) добавляли в среду (или в почву при поливе) в течение всей вегетации. Концентрация соли в каждом опыте различалась десятикратно, кроме того испытаны концентрации 2,5х10-3 и 2,5х10-2 М. Опыты с каждой концентрацией проводили в 2-х или 4-х кратной повторности. Растительный материал для выделения белков и субклеточных фракций отбирали через 1214, 27, 35 и 70 сут.
Выделение белковых фракций. Навеску растительного материала, 1-5 г, растирали в ступке с кварцевым песком в 50 мл среды, содержащей 0,8 М сахарозу 0,05 М Трис -HCl буфер, pH 8,2. Гомогенат фильтровали через четыре слоя капрона и центрифугировали 30 мин при 17000 g. В супернатанте, предварительно пропущенном через обеззоленный бумажный фильтр, определяли активность растворимых цитозольных ферментов. Труднорастворимые мембранные белки получали из осадка. Его обрабатывали охлажденным до -180 С абсолютным ацетоном (объемное отношение осадка к ацетону 1: 9), выдержи вали в холодильнике 2 ч, затем, после осаждения на центрифуге (режим указан выше), промывали охлажденным 80% ацетоном до полного удаления пигментов. После промывки осадок подсушивали (под феном), и из него экстрагировали мембранные белки 0,05 М Трис - HCl буфером, рН 8,2. Полученные грубые экстракты цитозольных и мембранных белков подвергали частичной очистке. Вначале их высаливали сульфатом аммония до 70 % насыщения, затем обессоливали на колонке с сефадексом g-25, уравновешенной 0,05 М Трис - НCl буфером, рН 8,2. Удержание белка в белковых фракциях определяли по методу Bradford [16].
Выделение субклеточных фракций. Хлоропласты получали из листьев, по методу West, Wischich [17]. Среда для выделения содержала: 0,4 М сахарозу 0,01 М MgCl2,0,01 М этилендиаминтетрацетат (ЭДТА) и 0,5 % бычий сывороточный альбумин (БСА) в 0,03 М Т рис- HCl буфере, рН 7,4. Среда для суспендирования хлоропластов: 0,4 М сахароза и 0,5 % БСА, рН 7,4.
Реакции фотофосфорилирования проводили в термостатируемой ячейке при 250С и освещении белым светом интенсивностью ФАР 50 Вт на м2. Количество синтезируемого АТФ определяли биолюминесцентным методом, согласно работе [18]. Реакционная среда для фотофосфорилирования: 4 мМ АДФ, 2 мМ KH 2 PO 4 , 2 мМ MgCl2, 0,17 мМ метилвиологен (МВ), 0,03 мМ Феназинметосульфат (ФМС), 0,05 мМ диурон (ДХММ), 20 мкг хлорофилла на 1,5 мл реакционной среды в 30 мМ Трис-HCl буфере рН 7,9.
Ядра и пластиды (объединенная фракция), а также митохондрии и микрочастицы выделяли из корней. Промытые корни (5 г) измельчали ножницами, а затем - в гомогенизаторе 30 сек при 1500 об/мин в 75мл среды, содержащей 0,3 М сахарозу, 0,015 М фосфатный и 0,02 М Трис -HCl буферы, рН 7,3. Гомогенат фильтровали через четыре слоя капрона и центрифугировали 30 мин при 15000 g, осаждая общую мембранную фракцию органелл и микрочастиц. Эту фракцию суспендировали в указанной выше среде, после чего осаждали дифференциальным центрифугированием ядра + пластиды (10
мин при 1300 g), затем митохондрии (10 мин при 8000 g) [19]. Оставшийся супернатант, содержащий пероксисомы и другие субклеточные структуры использовали как источник субчастиц [20]. Осажденные органеллы (ядра + пластиды, митохондрии) ресуспенди-ровали в среде, содержащей 0,3 М сахарозу и 0,05 М Трис-HCl буфер, рН 8,2. В суспензию выделенных органелл и в супернатант с субчастицами, а также к хлоропластам, добавляли Тритон Х-100 до конечной концентрации 0,1%, выдерживали 1 ч при 40С и определяли активности антиоксидантных ферментов в полученных экстрактах.
Определение активностей ферментов. Активность СОД определяли спектрофотометрически по ингибированию восстановления нитросинего тетразолия (по увеличению поглощения при 560 нм) в реакционной смеси с ФМС и НАДН [21]. За единицу активности фермента принято его количество, ингибирующее восстановление нитросинего тетразолия на 50 % , принятое за 1 относительную единицу в расчете на мг белка в пробе.
Активность КАТ определяли полярографическим методом с помощью электрода Кларка по скорости выделения кислорода при разложении Н2О2 [18]. Пероксидазную активность измеряли спектрофотометрически по скорости окисления бензидина перекисью водорода методом Бояркина [22]. За единицу активности этих ферментов принято их количество, разлагавшее 1 мкмоль Н2О2 в мин на мг белка в пробе.
В работе использовали реактивы отечественного производства марки Х.Ч. и О.С.Ч., кроме: БСА, НАДН и ЭДТА фирмы "Reanal"
(Венгрия), Тритон Х-100 фирмы "Merck" (ФРГ), Сефадекс g-25 средний и ФМС фирмы "Serva" (Швеция).
Результаты
Выращивание гороха в присутствии хлористого аммония в диапазоне испытанных концентраций 10-6-10-2 М показывало заметное влияние на рост и развитие растений в течение вегетационного периода. Действие меньших концентраций - 10-6-10-4 M, проявлялось в замедлении роста надземных частей и корней, которое отмечалось через 3-4 недели выращивания. По мере развития растений наблюдали утолщение главного осевого корня, скручивание и пожелтение листьев, опадание цветковых завязей. В водной культуре такие нарушения появлялись раньше, чем в почвенной.
Высокие концентрации NH 4 C1, 10-3-10-2 М, оказывали губительное действие на горох в первые недели выращивания. Двухнедельные проростки гороха, выращенные при указанных концентрациях аммония в водной культуре, отставали в росте в 1,5 - 3 раза и содержали меньше белка и хлорофилла в листьях, по сравнению с контрольным вариантом, табл.1. Надземная часть у таких растений желтела и погибала к концу третьей, а корни - к концу четвертой недели. В почвенной культуре растения гибли через 1,5-2 месяца.
Как оказалось, морфометрические повреждения в горохе, вызванные высокими концентрациями аммония, сопровождались усилением активностей антиоксидантных ферментов в листьях и корнях гороха. В табл.2.
Таблица 1. Влияние высоких концентраций NH 4 CI на рост гороха, содержание белка и хлорофилла в листьях
|
Концентрация NH4C1, М |
Высота побегов, см |
Содержание (мг на г сырой массы) белок хлорофилл |
|
|
0 |
20 ± 2 |
14 ± 2 |
1,1 ± 0,1 |
|
2,5x10-3 |
13 ± 2 |
12,5 ± 1,5 |
1,0 ± 0,2 |
|
2,5x10-2 |
6 ± 2 |
11,5 ± 2,5 |
0,3 ± 0,03 |
Примечание. Здесь и в табл.2,3 и 4 водная культура, возраст 14 сут. Представлены средние данные 4 опытов; ± стандартное отклонение от среднего,.
Таблица 2. Активность* антиоксидантных ферментов в горохе, выращенном при 2,5х10-2 М NH 4 CI
|
Ферменты |
Контроль (-NH 4 CI) |
Опыт (+NH4C1) |
|
Из листьев сод |
58 ± 6 |
178 ± 15 |
|
КАТ |
3,4 ± 0,4 |
4,2 ± 0,3 |
|
по |
400 ± 60 |
2700 ± 150 |
|
Из корней сод ** |
222 ± 32 |
337 ± 48 |
|
КАТ |
2,8 ± 0,3 |
5,0 ± 0,5 |
|
по ** |
1070 ± 150 |
15900 ± 230 |
Примечание. * Суммарная активность, цитозольных и мембранных белков частично очищенных, ** -в грубых неочищенных белковых фракциях. Активность ферментов здесь и в табл. 3, 4, 5: СОД -относительные ед., КАТ и ПО - мкмоль Н2О2/ (мин/ мг белка).
приведены данные по действию одной концентрации, другая, меньшая (2,5х10-3 М), вызывала подобные эффекты, но при более продолжительном выращивании (3-4 недели). Активности СОД и ПО, отмеченные в таблице знаком (**), были получены в неочищенных белковых фракциях из корней. Очистка, как правило, уменьшала активность указанных ферментов. Причиной тому могла быть неустойчивость ферментов при длительной процедуре выделения. Несмотря на варьирование активностей, действие аммония отчетливо проявлялось в активировании всех трех ферментов. В среднем, под влиянием NH 4 C1 в листьях увеличивалась активность СОД в 3; КАТ - в 1,2 и ПО - в 6,7 раз; в корнях, соответственно - в 1,5; 1,8 и 15 раз.
В некоторых опытах в корнях проростков активность ПО увеличивалась при высоких концентрациях аммония в 30 и более раз.
Концентрации NH 4 C1 10 " 6-10-4 M, тоже активировали ферменты, но в меньшей степени и при продолжительном воздействии. Подробные данные вегетационных опытов не приводятся, но отметим, что после 4-5 недель выращивания гороха в почвенной культуре активность СОД увеличивалась в среднем на 30-50 %, КАТ - на 10-30 %, ПО -на 50-80 %, причем, СОД больше активировалась в листьях, а ПО - в корнях. С возрастом и появлением внешних признаков повреждений растений активность СОД и ПО, в основном, увеличивалась, а каталазная активность, как правило, уменьшалась.
Таблица 3. Активность антиоксидантных ферментов в мембранных и цитозольных белковых фракциях, выделенных из гороха, выращенного при избытке хлористого аммония
|
Условия выращивания |
А К Т И В Н О С Т Ь |
|||||
|
сод |
КАТ |
по |
||||
|
м |
Ц |
м |
ц |
м |
ц |
|
|
Контроль 2,5х10-2 М NH 4 C1 |
В листьях |
|||||
|
46 158 |
11 18 |
2,1 2,4 |
1,3 2,2 |
40 100 |
200 400 |
|
|
Контроль 2,5х10-2 М NH 4 C1 |
В корнях |
|||||
|
172 287 |
50 50 |
1,9 3,7 |
0,9 1,3 |
3700 7400 |
7000 8500 |
|
Примечание. Активность ферментов в неочищенных белковых фракциях: м - мембранные, ц -цитозольные. Здесь и в табл. 4,5 представлены средние данные 2 -х опытов, стандартное отклонение ± 10-15%.
Таблица 4. Активность антиоксидантных ферментов в субклеточных структурах, выделенных из корней гороха, выращенного при избытке хлористого аммония
|
Субклеточные структуры |
СОД |
КАТ |
ПО |
|||
|
+ |
- |
+ |
- |
+ |
||
|
Ядра, пластиды |
0,1 |
1,5 |
0,04 |
0,4 |
240 |
470 |
|
Митохондрии |
0,6 |
2,4 |
0,1 |
0,2 |
50 |
90 |
|
Субчастицы |
3,3 |
8,7 |
0,2 |
1,2 |
500 |
1000 |
Примечание. Знаки: - или + указывают на отсутствие и добавление 2,5x10 '2 M NH 4 CI в среду выращивания гороха.
Локализацию воздействия аммония на растения можно было проследить по изменению активностей исследуемых ферментов в мембранных и цитозольных белковых фракциях, в табл.3 представлены такие данные. В контроле, в листьях и корнях гороха активности СОД и КАТ в мембранных белках были выше, чем в цитозольных. Пероксидазная активность в цитозоле, наоборот, превышала мембранную. Под влиянием NH 4 C1 активировались как мембранные, так и цитозольные ферменты, однако отношение - мембранные/ цитозольные, в целом растении возрастало для СОД в 2-2,9 раза (преимущественно в листьях), а ПО - в 1,3-1,7 раза (больше в корнях). Активность КАТ листьев сильнее увеличивалась в цитозоле, уменьшая отношение - мембранная/цитозольная активность, но в корнях оно увеличивалось в 1,4 раза. Таким образом, в горохе под влиянием NH 4 C1 мембранные ферменты, в основном, активировались сильнее, чем цитозольные, указывая на мембранотропное действие этой соли.
На субклеточных мембранных структурах, выделенных из корней гороха, это положение подтвердилось. В табл.4 показано, что во фракции объединяющей ядра и пластиды, активность СОД увеличивалась в 15, КАТ - в
10, ПО - в 2 раза; в митохондриях, соответственно - в 4; 2 и 2,5 раза; в субчастицах - в 2,6; 6 и 2 раза, по сравнению с контролем. Интересно отметить 10-15 - кратное увеличение активностей СОД и КАТ в общей фракции ядер и пластид. Не исключено, что оно обусловлено повышенной "атакой" этих органоидов, но возможен также индуцированный синтез защитных ферментов de novo, подобно тому, как это происходит с СОД и ПО в зараженных растительных тканях [10, 11,23].
Мембранотропное действие хлористого аммония подтверждалось также на мембранных структурах хлоропластов, выделенных из листьев гороха, табл.5. Функционально активные хлоропласты 2 класса [17], выделяли из гороха выращенного при 2,5x10-3 M NH 4 C1 (при концентрации соли на порядок больше, активные хлоропласты выделить не удалось). Как видно из таблицы хлоропласты растений, выращенных при подкормке хлористым аммонием активно синтезировали АТФ в присутствии экзогенных переносчиков электронов - МВ и ФМС, по сравнению с контрольными. В таких условиях, как известно, протекает псевдоциклический поток электронов, сопряженный с функционированием
Таблица 5. Влияние хлористого аммония на активность антиоксидантных ферментов и фотофосфорилирование в изолированных хлоропластах гороха
|
Условия опыта |
Активность, |
Синтез АТФ (мкмоль/ч мг хлорофилла) в присутствии |
|||
|
СОД |
КАТ |
ПО |
|||
|
МВ |
ФМС |
||||
|
Контроль 2,5x10-3M NH 4 C1 |
7 18 |
0,8 1,2 |
10 15 |
271 (93) 356 (95) |
518(123) 584 (123) |
Примечание. Водная культура, возраст 12 сут. В скобках указан синтез АТФ при добавлении в среду ДХММ. По фотофосфорилированию представлены средние данные 2 - х опытов, отклонение от среднего ± 3-5 %.
двух фотосистем, образованием АТФ и восстановлением кислорода до Н2О2 [18]. Доказательством такого потока электронов в модельных опытах с хлоропластами служит ингибирование его диуроном (ДХММ) [24], в данном случае происходило ингибирование синтеза АТФ, показанное в скобках. Активности всех трех ферментов в хлоропластах были повышены, по сравнению с контролем: СОД - в 2,6 , КАТ и ПО - в 1,5 раза. Заслуживает внимания тот факт, что СОД активировалась сильнее, чем два другие фермента, что свидетельствовало в пользу интенсивного образования супероксидного радикала кислорода. Можно думать, что индуцируемая аммонием, активация антиоксидантных ферментов в хлоропластах обеспечивала защиту тилакоидных мембран от окислительного разрушения. Возможная регуляция, по-видимо-му, способствовала стимулированию псевдо-циклического фотофосфорилирования, самого по себе, продуцирующего Н2О2 [18]. Оказалось, что эта защита уязвима при увеличении действующей концентрации соли на хлоропласты. Так, исследование псевдо-циклического транспорта электрона и фотофосфорилирования показало, что добавление 10-6-10-2М NH4C1 непосредственно в реакционную среду инкубации хлоропластов усиливает поглощение кислорода с МВ и ингибирует ФМС-зависимый синтез АТФ (рисунок А, Б). Очевидно, что при концентрациях NH4C1 больших, чем 10-3М, в хлоропластах наступало разобщение электронного транспорта от фотофосфорилирования, сопровождаемое усилением окислительной активности. Последнее, соответствует литературным данным, показывающим, что разобщение высокими концентрациями аммония приводит к нарушению структуры тилакоидных мембран [25, 26].
Обсуждение результатов
Выбор хлористого аммония в качестве токсического агента в нашей работе был не случаен. Во-первых, аммиак относится к числу приоритетных загрязнителей сельского хозяйства и заводов производства минераль-
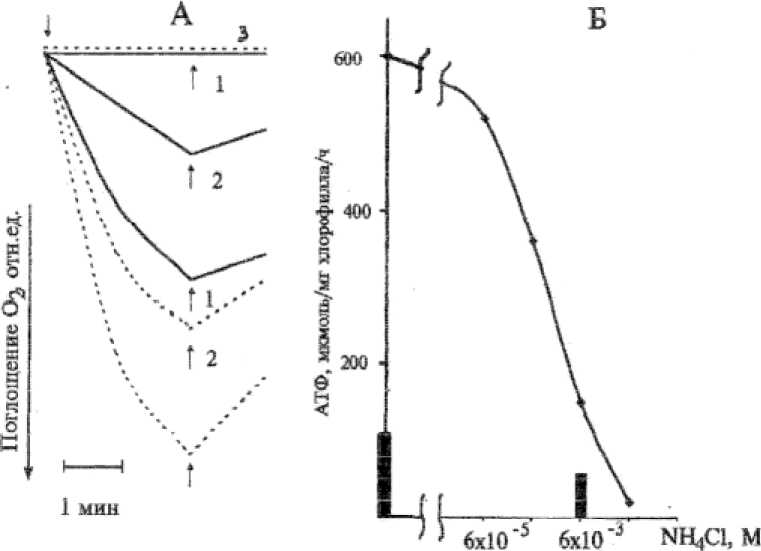
Рис. Влияние экзогенного NH4Cl на электронный транспорт и фотофосфорилирование в хлоропластах гороха.
А - Поглощение кислорода в присутствии МВ. 1 и 2 - горох выращен на почве в отсутствие и при подкормке NH4Cl, 10 -3 М, соответственно; прерывистые линии - то же, добавлен NH4Cl, 6х103 М в инкубационную среду хлоропластов; 3 - то же, что 1 и 2, добавлен ДХММ. Стрелками указано включение и выключение света.
Б - ФМС-зависимое фотофосфорилирование, столбиками отмечен уровень синтеза АТФ при добавлении ДХММ. Возраст гороха 27 сут.
ных удобрений в нашем регионе [27]. Во-вторых, механизм ингибирующего эффекта ионов аммония [10-2 М] на фотосинтез хорошо изучен [25, 26]. Как протонофор [28] он вызывает разобщение в энергетических мембранах. Исходя из того, что разобщение в мембранах сопряжено с инициированием ПОЛ, в регулировании которого принимают участие СОД, КАТ и ПО [14,29], нами было предположено изменение активностей антиоксидантных ферментов в растениях под влиянием ксенобиотка. Сопоставляя морфологические и биохимические изменения можно было идентифицировать мишени воздействия ксенобиотика по активностям ферментов, судить о регуляции и деструкции процесса по токсическому действию, а также выявить возможность биотестирования повреждений на биохимическом уровне.
Физиологические опыты показали, что постоянное и длительное введение в среду выращивания гороха даже невысоких концентраций хлористого аммония в пределах 10-610-4 M NH 4 C1 в течение вегетационного периода вызывали видимые нарушения в морфологии листьев и корней, несмотря на то, что аммонийный азот хорошо усваивается растениями. По-видимому, с течением времени в среде выращивания создается избыток его также как и при высоких концентрациях - 10-3-10-2 M, о чем свидетельствуют биохимические и морфологические нарушения, а также гибель растений.
Как и предполагалось, действие данной соли на горох изменяло активность антиоксидантных ферментов - СОД, КАТ и ПО. Это происходило в листьях и корнях, в мембранах и цитозоле клеток, было связано с концентрацией токсиканта и развивалось со временем. При кратковременном воздействии на горох повышенных концентраций хлористого аммония, все составляющие системы СОД-КАТ-ПО активировались значительно сильнее, чем при меньших концентрациях. Следует отметить соответствие усиления активности СОД в листьях и ПО во всем растении при появлении повреждений, связанных с длительным введением меньших концентраций соли в среду. Примечательно, что до наступления деструктивных процессов, приво дящих растения к гибели, антиоксидантная система: СОД-КАТ-ПО сильнее активировалась в мембранных структурах, об этом свидетельствует больший рост активностей в мембранных белковых фракциях, по сравнению с цитозольными и в субклеточных мембранных структурах ядрах, пластидах, митохондриях и хлоропластах. Эти данные подтверждали мембранотропное действие хлористого аммония и указывали на повышенное образование супероксидрадикала, поскольку СОД во всех мембранных структурах активировалась сильнее, чем КАТ и ПО. На примере функционально активных хлоропластов, можно было видеть, что регуляция ферментами метаболизма АФК, образуемых при действии мембранотропного агента, в значительной степени определялась концентрацией токсиканта. Следовательно, активирование ферментов СОД, КАТ и ПО в горохе под действием хлористого аммония в малых и высоких концентрациях на ранних этапах развития растений можно рассматривать как защиту мембран от окислительного повреждения, вызванного этой солью. На наш взгляд, лабильность антиоксидантной системы, выраженная в широкой вариабельности активностей каждого фермента в целом растении, указывают на регуляцию, поддерживающую нормальный метаболизм в растениях. Такое положение не противоречит литературным данным о регулирующей роли СОД, КАТ и ПО в ПОЛ [8, 14, 29], участии СОД в предотвращении мутаций [30], а ПО -в иммунитете растений [9-11].
Однако, существует и другой аспект, а именно высокое активирование ПО в горохе, ее цитозольной формы, особенно в корнях, где хлористый аммоний непосредственно ассимилируется [31]. ПО способна к окислительной детоксикации чужеродных соединений в цитоплазме клеток [10, 15], как цитохромом Р- 450 в микросомах [20]. Особенность ПО заключается в том, что проявляя оксидазную активность, она вовлекает молекулярный кислород в пероксидазный механизм и продуцирует супероксид (О2-), гидроксильный радикал (ОН-) и гидроперекиси [32], иными словами, обладает не только анти-, но и прооксидативными свойствами.
Есть мнение о том, что продукты пероксидазного окисления, такие как (ОН-) ингибируют СОД, КАТ и разрушают мембраны, тонопласт и плазмолемму растительных клеток [9-11, 23]. Исходя из сказанного, можно думать, что сильная активация пероксидазы под действием хлористого аммония связана не только с защитой мембран, но и с окислением NH 4 C1 как токсиканта. При этом следует иметь ввиду возможность окисления продуктов ассимилированного иона аммония - аминокислот, амидов и азотистых оснований, образуемых по пути аммония из корней в листья [31]. Все эти продукты могут служить субстратами в пероксидазно-оксидазных реакциях [5]. При оксидазном механизме пероксидаза может использовать ион C1- [32, 33], что тоже следует учитывать при воздействии хлористого аммония на растения. Предпосылкой таких событий являются химические процессы, развивающиеся при проникновении ионов аммония и хлора через мембраны - повышение рН внутри клеток и органелл [34], образование хлорированных гидроперекисей. Последние особенно способствуют инициированию свободнорадикальных реакций ПОЛ и пероксидазно-ок-сидазного механизма [5, 32, 35].
Таким образом, сильное увеличение пероксидазной активности в цитозоле, особенно в корнях, где ксенобиотик непосредственно контактирует с мембранами клеток, и сопутствующая активация СОД под влиянием NH4C1, указывают на возможное окисление хлористого аммония и его метаболизирующих продуктов в горохе. Это подтверждается и существенным активированием антиоксидантных ферментов в субчастицах, в которых присутствуют пероксисомы, микросомы и др. мембранные структуры, содержащие окислительные системы [15,20]. Мы предполагаем, что токсичный избыток хлористого аммония, подобно другим факторам [3, 35, 36], инициирует окислительный стресс, сопровождающийся стимуляцией ПОЛ, бесконтрольным образованием новых радикалов и цепей радикальных реакций, деструктивными процессами в мембранах, приводящими к их деградации и, в конечном итоге, к гибели растений. Одновременное активирование фермен тов СОД и ПО, при более сильном увеличении пероксидазной активности (в 10 и более раз), вероятно, может служить индикатором действия загрязняющих токсических веществ на растения, когда повреждения еще не видны, а биохимическая структура мембран нарушается и находится на критическом уровне.


