Индукция апоптоза клеток меланомы В16 при воздействии препарата фактора некроза опухолей альфа в составе вирусоподобных частиц in vitro
Автор: Vyazovaya Elena A., Lebedev Leonid R., Danilenko Elena D.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4 т.19, 2020 года.
Бесплатный доступ
Цель исследования - оценка противоопухолевой активности препарата, содержащего фактор некроза опухолей альфа (ФНО-альфа) и двуспиральную рибонуклеиновую кислоту (дсРНК) в составе молекулярной конструкции («вирусоподобной частицы») (ВПЧ-ФНО-альфа), на клетках меланомы B16-F10. Материал и методы. Анализ антипролиферативного действия ВПЧ-ФНО-альфа и его компонентов ФНО-альфа и дсРНК проводили с помощью МТТ-теста, апоптоз клеток меланомы оценивали методом проточной цитофлуориметрии с ФИТЦ-аннексином V. Результаты. Показано, что токсическое воздействие препарата, содержащего ФНО-альфа и дсРНК в составе вирусоподобных частиц, на клетки меланомы значительно превышает суммарный токсический эффект ФНО-альфа и дсРНК в отдельности (ЛД50 составляет, соответственно, для комплексного препарата 0,05 мкг/мл, ФНО-альфа -9,5 мкг/мл, дсРНК >20 мкг/мл). Заключение. Препарат, содержащий ФНО-альфа и дсРНК в молекулярной конструкции, может быть многообещающим терапевтическим средством для лечения злокачественных новообразований, включая меланому.
Фактор некроза опухолей альфа, двуспиральная рнк, вирусоподобная частица, впч-фно-альфа, апоптоз, антипролиферативное действие, меланома
Короткий адрес: https://sciup.org/140254445
IDR: 140254445 | УДК: 616-006.81:615.277.3:576.36]-092 | DOI: 10.21294/1814-4861-2020-19-4-99-104
Текст научной статьи Индукция апоптоза клеток меланомы В16 при воздействии препарата фактора некроза опухолей альфа в составе вирусоподобных частиц in vitro
Неконтролируемый рост и устойчивость к апоптозу являются двумя важнейшими признаками возникновения злокачественных новообразований (ЗНО), а также прогрессирования онкологического процесса. Следовательно, методы лечения, нацеленные на эти механизмы элиминации трансформированных клеток, могут быть идеальными способами лечения рака. Кроме того, индукция апоптоза может быть более действенной терапией по сравнению с ингибированием пролиферации, поскольку она способна полностью устранить опухолевые клетки. По мере накопления знаний о механизмах клеточной гибели появляются новые идеи и методы борьбы со злокачественными клетками. Комплексное воздействие на опухоль, обеспечивающее активацию противоопухолевого иммунного ответа и апоптоза клеток опухоли, – одно из перспективных направлений в современной онкологии [1].
Фактор некроза опухолей альфа (ФНО-альфа, TNF-alpha) в течение многих лет привлекает внимание исследователей, фармакологов и клиницистов как потенциальное противоопухолевое средство, что связано с его многофакторным воздействием на опухоль: избирательной способностью тормозить рост и вызывать лизис злокачественных клеток, вызывать геморрагический некроз опухолей, активировать иммунный противоопухолевый ответ [2]. Однако в ходе системного введения ФНО-альфа выявлены его нестабильность в кровеносном русле, широкий спектр побочных эффектов, а также недостаточная селективность накопления в опухолевых клетках [3].
Среди разнообразных методических приемов, которые используются в настоящее время для решения этого комплекса проблем, можно выделить подход, направленный на создание средств адресной доставки ФНО-альфа к клеткам-мишеням [4, 5]. Одной из таких разработок является оригинальная молекулярная конструкция для депонирования белка с целью защиты от протеаз и транспортировки к клеткам-мишеням [6]. Средство адресной доставки представляет собой так называемую вирусоподобную частицу (ВПЧ), ядро которой образовано двуспиральными РНК из дрожжей Sac-charomyces cerevisiae и окружено полисахаридной оболочкой с экспонированными на ее поверхности молекулами белка. Достоинство конструкции состоит в ее биодеградируемости и наличии биологической активности у всех ее компонентов.
Активным компонентом молекулярной конструкции, помимо рекомбинантного ФНО-альфа человека, является двуспиральная дрожжевая РНК.
Известно, что дсРНК способны усиливать продукцию интерферона (ИФН) 1 типа, который обладает свойством индуцировать апоптоз в нормальных и опухолевых клетках [7, 8]. Важно отметить, что в некоторых трансформированных клетках человека и мыши, включая клетки меланомы В16-F10, были обнаружены мРНК, необходимые для синтеза ИФН [9, 10].
Препарат ВПЧ-ФНО-альфа отличается повышенной по сравнению с ФНО-альфа противоопухолевой активностью, а также тропностью к ткани опухоли и коже [6, 11], что открывает интересные перспективы его применения для лечения злокачественных новообразований, включая меланому.
Целью исследования явилась оценка прямого токсического действия препарата ВПЧ-ФНО-альфа и его компонентов на клетки меланомы B16-F10.
Материал и методы
В работе использовали препараты производства ИМБТ ФБУН ГНЦ ВБ «Вектор»: двуспиральную РНК из дрожжей Saccharomyces cerevisiae, полученную по ранее описанной методике [12]; рекомбинантный человеческий фактор некроза опухоли альфа с активностью 8×107 МЕ/мг [13]; препарат ВПЧ-ФНО-альфа с концентрацией белка 0,16 мг/мл и специфической цитолитической активностью 1,9×107 МЕ/мг [6]. Клеточная линия мышиной меланомы В16 клон F10 получена из Российской коллекции клеточных культур Института цитологии РАН, г. Санкт-Петербург.
МТТ-тест
Токсическое (антипролиферативное) действие изучаемых препаратов оценивали с помощью МТТ-теста [14]. Клетки меланомы B16-F10 помещали по 104/лунку в 96-луночный микропланшет (TPP, Швейцария) в полной среде DMEM (Биолот) с 10 % эмбриональной телячьей сывороткой (HyClone, США) и 0,04 мг/мл гентамицина. Через сутки в лунки вносили ФНО-альфа, дсРНК или ВПЧ-ФНО-альфа в убывающих концентрациях, каждое разведение исследовали в 6 повторах, в контрольные лунки вносили физиологический раствор. Клетки инкубировали в СО2-инкубаторе (SHEL-LAB, США) при температуре 37 ºС в течение 72 ч, затем измеряли оптическую плотность восстановленного МТТ-реагента (Sigma – Aldrich) на ридере Multiskan EX (Thermo, Финляндия) при длине волны 540 нм. Поскольку восстановление 3-(4,5-диметилтиазолил-2)-2,5-дифенил тетразо-лиум бромида (МТТ) возможно только в метаболически активных клетках, оптическая плотность в каждой лунке планшета соответствовала коли- честву живых клеток, и по соотношению оптической плотности опытных и контрольных лунок рассчитывали процент живых клеток для каждого разведения исследуемых препаратов (индекс МТТ=О/К×100). Экспериментальные данные обрабатывали методами вариационной статистики с помощью пакета программ «Statgraphics, Vers.5.0». Для оценки значимости межгрупповых различий использовали U-критерий Манна – Уитни, критический уровень значимости при проверке статистических гипотез (р) принимали равным 0,05.
Метод изучения апоптоза опухолевых клеток
Анализ механизма цитотоксического действия препаратов проводили методом выявления специфического молекулярного маркера фосфа-тидилсерина на клеточной мембране гибнущих клеток-мишеней меланомы В16-F10 с помощью проточной цитофлуорометрии. Исследование проводили с помощью диагностического набора для цитофлуориметрической оценки апоптоза «FITC Annexin V Detection Kit 1» (BD Pharmingen, США). Для определения апоптотических изменений в плазматической мембране клетки меланомы помещали в 24-луночный планшет (TPP, Швейцария) по 106 клеток/лунку в объёме 1 мл полной среды, куда вносили растворы ВПЧ-ФНО-альфа, ФНО-альфа или дсРНК в конечных концентрациях, выбранных на основании МТТ-теста. Планшеты инкубировали в СО2-инкубаторе при температуре 37 °С в атмосфере с 5 % СО2 в течение 48 ч. Затем клетки снимали с подложки смесью трипсин-версен (ПанЭко), окрашивали согласно инструкции к диагностическому набору и проводили анализ на цитофлуориметре BD FACS Aria (BD Pharmingen, США) с помощью пакета программ BD FACS DiVa. Определяли соотношение количества клеток в раннем и позднем апоптозе, т.е. числа клеток, положительных по аннексину V и отрицательных по метке иодидом пропидия (PI) к клеткам, положительным по аннексину V и PI.
Статистическую обработку данных проводили с помощью пакета статистических программ «Statgraphics, Vers.5.0» (Statistical Graphic Сorp., USA). Рассчитывали групповые показатели суммарной статистики – среднюю арифметическую и ошибку средней. Для оценки значимости межгрупповых различий использовали U-критерий Манна – Уитни. Критический уровень значимости при проверке статистических гипотез (р) принимали равным 0,05.
Результаты исследования
Результаты исследования МТТ-анализ показал, что клеточная линия мышиной меланомы B16-F10 обладает высокой чувствительностью к препарату ВПЧ-ФНО-альфа. Около 70 % популяции клеток утрачивают жизнеспособность под действием препарата в концентрациях от 1,2 до 30,5 мкг/мл, и его эффект зависит от дозы (таблица).
В результате оценки антипролиферативного эффекта препаратов ФНО-альфа и дсРНК на клетках меланомы В16-F10 установлено, что ФНО-альфа проявляет умеренную токсичность по отношению к опухолевым клеткам (рис. 1), и даже его высокие концентрации (9–46 мкг/мл) снижали количество живых клеток в популяции не более чем на 50 %. ДсРНК в исследованных концентрациях была менее токсична для опухолевых клеток, чем ФНО-альфа: максимальное снижение числа живых клеток составило 40 % (4,5–22,5 мкг/мл). По уровню цитотоксичности смесь ФНО-альфа и дсРНК соответствовала показателям токсичности индивидуального ФНО-альфа (данные не приведены). Эффект препарата ВПЧ-ФНО-альфа на клетки В16-F10 значительно превышал суммарный токсический эффект ФНО-альфа и дсРНК в таблица/table
Жизнеспособность клеток в16-f10, инкубированных с вПЧ-ФНо-альфа, в сравнении с контрольными необработанными клетками
Viability of B16-f10 cells incubated with VLp-tnf-alpha in comparison with untreated control cells
|
№ разведения/ No. breeding |
Концентрация ВПЧ-ФНО-альфа, мкг/ мл/ VLP-TNF-alpha concentration, μg/ml |
Средняя оптическая плотность/ Optical Density |
Ошибка среднего/ Error of mean |
Индекс МТТ/ MTT indices |
|
1 |
30,5 |
0,208* |
0,016 |
29 % |
|
2 |
6,1 |
0,255* |
0,009 |
36 % |
|
3 |
1,2 |
0,220* |
0,022 |
33 % |
|
4 |
0,24 |
0,262* |
0,023 |
37 % |
|
5 |
0,049 |
0,359* |
0,017 |
50 % |
|
6 |
0,0097 |
0,336* |
0,016 |
47 % |
|
7 |
0,002 |
0,394* |
0,025 |
55 % |
|
8 |
0,0004 |
0,470* |
0,016 |
66 % |
|
9 |
0,000078 |
0,550* |
0,029 |
77 % |
|
10 |
контроль |
0,711 |
0,029 |
100 % |
Примечание: * – отличия статистически значимы по сравнению с контролем по U-критерию Манна – Уитни (р≤0,05).
Note: * – a significant difference with the control, р≤0.05 (according to the Mann – Whitney U-criterion).
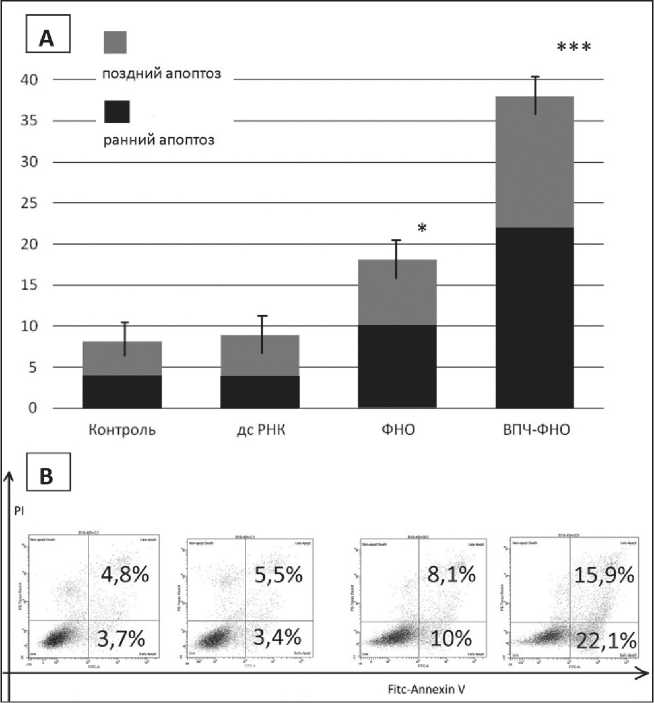
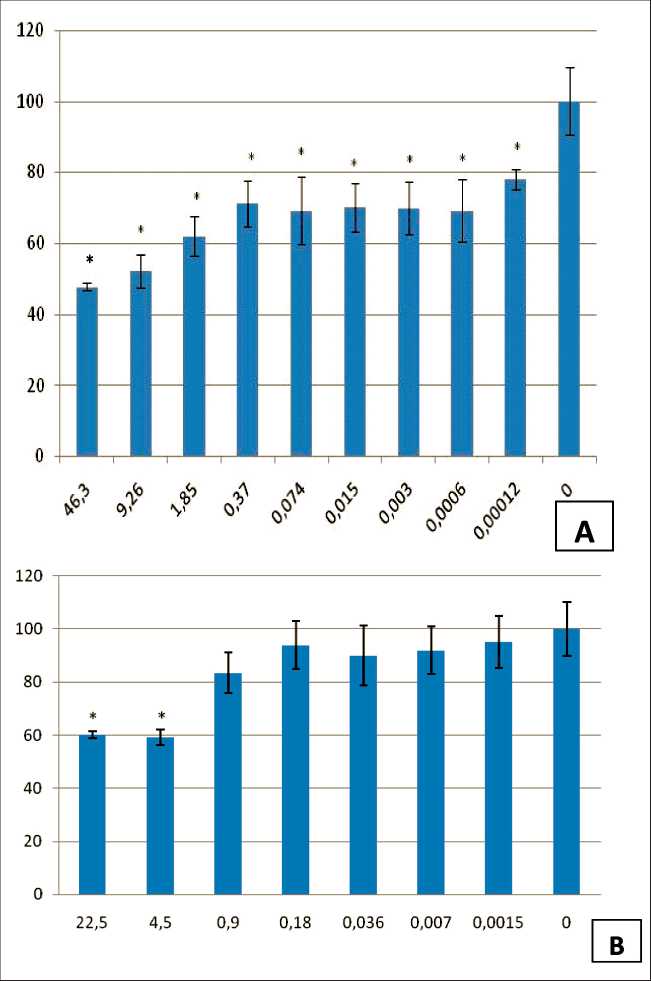
Рис. 1. Жизнеспособность клеток меланомы В16-F10 после инкубации в течение 72 ч с ФНО-альфа (А) и дсРНК (В) относительно показателя контрольных необработанных клеток. По оси абсцисс – концентрация препарата в культуральной среде, мкг/мл; по оси ординат – индексы МТТ, %. Примечание: * – отличия статистически значимы по сравнению с контролем (р≤0,05)
Fig. 1. Viability of B16-F10 melanoma cells after incubation (72 hrs) with TNF-alpha (A) and dsRNA (B) relative to the untreated control cells. The values on the abscissa indicate the drug concentration in the culture medium, µg/ml; the values on the ordinate – MTT indices, %.
Notes: * – significant difference from control (p≤0.05)
Рис. 2. Апоптоз клеток В16-F10 под действием ВПЧ-ФНО-альфа, дсРНК и ФНО-альфа, 48 ч инкубации, концентрация по ФНО-альфа и дсРНК 0,05 мкг/мл. Тест in vitro с аннексином-пропидий-иодидом, цитолуориметрия. (А):
По оси ординат – число клеток меланомы в разных фазах апоптоза, %; (B): По оси ординат – клетки, положительные по PI, по оси абсцисс – положительные по FITC-Annexin V.
В правом нижнем квадрате – число клеток на стадии раннего апоптоза, %; в правом верхнем квадрате – на стадии позднего апоптоза, %.
Примечание: * – отличия статистически значимы по сравнению с контролем (р≤0,05), *** – по сравнению с контролем и ФНО-альфа (р˂0,05)
Fig. 2. Apoptosis of B16-F10 cells induced by VLP-TNF-alpha, dsRNA, and TNF-alpha (48 hrs incubation). The concentration of TNF-alpha and dsRNA is 0.05 μg/ml. In vitro test with annexin-propidium iodide, cytofluorometry.
(A): The ordinate shows the number of melanoma cells in different phases of apoptosis, %;
(B): The ordinate presents PI positive cells, the abscissa – FITC-Annexin V positive cells. The right lower square indicates the number of cells at early apoptosis, %; the upper right square – the number of cells at late apoptosis, %. Notes: significant difference:
* – from control (p˂0.05); *** – from control and TNF-alpha (p<0.05)
отдельности или в смеси. Снижение количества клеток на 50 % относительно контроля достигается при концентрациях: для комплексного препарата 0,05 мкг/мл, ФНО-альфа – 9,5 мкг/мл, дсРНК >20 мкг/мл (рис. 1).
Исследование апоптотических изменений клеток меланомы В16-F10 методом проточной цитофлуориметрии показало, что при контакте с ФНО-альфа и ВПЧ-ФНО-альфа в дозе 0,05 мкг/мл через 48 ч культивирования, 18,1 % и 38 % клеток меланомы подвергались апоптозу (рис. 2); к 72 ч культивирования погибало уже 38,1 % и 64,5 % клеток соответственно. ДсРНК в исследованных концентрациях апоптогенных свойств не проявляла.
Обсуждение
Учитывая существующие в настоящее время проблемы терапии онкологических заболеваний, очевидно, что задача создания новых эффективных и безопасных противоопухолевых средств требует новых подходов. За последнее десятилетие был предложен ряд стратегий, учитывающих современные знания о противоопухолевом иммунитете. Один из подходов к созданию противоопухолевых препаратов нового поколения основан на конструировании средств адресной доставки цитокинов к клеткам опухоли [5, 6]. В ходе изучения противоопухолевых свойств ФНО-альфа в составе вирусоподобных частиц в экспериментах на мышах с трансплантированной карциномой Эрлиха был продемонстрирован высокий терапевтический по- тенциал этого препарата: рост опухоли снижался при использовании ФНО-альфа в составе ВПЧ в дозах, в 10–100 раз меньших, чем при введении ФНО-альфа [6]. Вероятно, присутствие дсРНК может вносить существенный вклад в торможение роста опухоли: на модели перевивной меланомы B16-F10 были получены аналогичные результаты (неопубликованные данные). В ходе недавних исследований было обнаружено повышение уровня экспрессии ряда интерферон-стимулированных генов в перитонеальных макрофагах мыши [7] и клетках меланомы [15] в ответ на введение дрожжевой дсРНК. В литературе есть сведения об участии ИФН разных типов (альфа, бета и гамма), 2’,5’-олигоаденилатсинтетазы и протеинкиназы R в ингибировании пролиферации клеток и индукции апоптоза [16].
Полученные нами данные показали, что препарат ВПЧ-ФНО-альфа отличался достоверно более высоким антипролиферативным и апоптогенным действием на клетки меланомы В16-F10 по сравнению как с ФНО-альфа и дсРНК, так и с их смесью. Это позволяет заключить, что эффекты ВПЧ-ФНО-альфа не являются результатом простого суммирования эффектов отдельных компонентов конструкции или их взаимного потенцирования, но базируются на более сложных механизмах. Возможно, это связано с биологическими свойствами других компонентов вирусоподобной частицы. Так, например, известно, что полисахариды клеточных стенок бактерий, такие как зимозан и пептидогликаны, способны связываться с рецепто- ром TLR2, который экспрессируется, в частности, меланоцитами и клетками меланомы [17]. Можно предположить, что полисахарид декстран оболочки вирусоподобной частицы способен взаимодействовать с TLR2 и модулировать эффект ФНО-альфа через запуск дополнительных сигнальных каскадов. С другой стороны, микрочастицы декстрана способны усиливать доставку синтетической дсРНК poly I:C к эндосомам клетки [18], что может приводить к повышению доступности внутриклеточных TLR3 для дсРНК и усилению сигнала с рецепторов клеточной мембраны. Несомненно то, что вопрос о механизмах синергидного эффекта компонентов молекулярной конструкции важен и требует дальнейшего внимательного изучения.
Список литературы Индукция апоптоза клеток меланомы В16 при воздействии препарата фактора некроза опухолей альфа в составе вирусоподобных частиц in vitro
- Bernardo A.R., Cosgaya J.M., Aranda A., Jimenez-Lara A.M. Synergy between RA and TLR3 promotes type I IFN-dependent apoptosis through upregulation of TRAIL pathway in breast cancer cells. Cell Death Dis. 2013 Jan 31; 4: e479. doi: 10.1038/cddis.2013.5.
- Кетлинский С.А., СимбирцевА.С. Цитокины. СПб., 2008. 552 с. [Ketlinsky S.A., Simbirtsev A.S. Cytokines. Saint Peterburg, 2008. 552 p. (in Russian)].
- Lienard D., Ewalenko P., Delmotte J.J., Renard N., Lejeune F.J. High-dose recombinant tumor necrosis factor alpha in combination with interferon gamma and melphalan in isolation perfusion of the limbs for melanoma and sarcoma. J Clin Oncol. 1992 Jan; 10(1): 52-60. doi: 10.1200/ JC0.1992.10.1.52.
- Чубенко В.А. Иммунотерапия на основе цитокинов (ИЛ-1, ИЛ-2, ТНФ, КСФ, Интерфероны). Практическая онкология. 2016; 17(2): 99-109. [Chubenko V.A. Immunotherapy is based on cytokines (IL-1, IL-2, FNO, CSF, IFN). Practical Oncology. 2016; 17(2): 99-109. (in Russian)]. doi: 10.31917/1702099.
- Xu G., Gu H, Hu B, Tong F., Liu D, Yu X., Zheng Y, Gu J. PEG-b-(PELG-g-PLL) nanoparticles as TNF-a nanocarriers: potential cerebral ischemia/reperfusion injury therapeutic applications. Int J Nanomedicine. 2017 Mar 23; 12: 2243-2254. doi: 10.2147/IJN.S130842.
- Масычева В.И., Лебедев Л.Р., Даниленко Е.Д., Сысоева Г.М., Гамалей С.Г.; ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора. Противоопухолевое средство на основе наночастицы, несущей рекомбинантный фактор некроза опухолей альфа. Патент № 2386447 РФ, МКП А61К 38/19. № 2008140246/15; Заявл. 13.10.08; Опубл. 20.04.10, Бюл. № 11. [Masycheva V.I.,LebedevL.R.,DanilenkoE.D., SysoevaG.M., GamaleyS.G.; State Scientific Center of Virology and Biotechnology «Vector». An antitumor agent based on a nanoparticle carrying a recombinant tumor necrosis factor alpha. Patent No 2386447 of the Russian Federation, MKP A61K 38/19. № 2008140246/15; Publ. 04.20.10. (in Russian)].
- Chawla-SarkarM., Leaman D.W., Borden E.C. Preferential induction of apoptosis by interferon (IFN)-beta compared with IFN-alpha2: correlation with TRAIL/Apo2L induction in melanoma cell lines. Clin Cancer Res. 2001 Jun; 7(6): 1821-31.
- Dai X., Zhang J., Arfuso F., Chinnathambi A, ZayedM.E., Alharbi S.A., Kumar A.P., AhnK.S., Sethi G. Targeting TNF-related apoptosis-inducing ligand (TRAIL) receptor by natural products as a potential therapeutic approach for cancer therapy. Exp Biol Med (Maywood). 2015 Jun; 240(6): 760-73. doi: 10.1177/1535370215579167.
- Gantier M.P., Williams B.R. The response of mammalian cells to double-stranded RNA. Cytokine Growth Factor Rev. 2007 Oct-Dec; 18(5-6): 363-71. doi: 10.1016/j.cytogfr.2007.06.016.
- Salaun B., Lebecque S., Matikainen S., Rimoldi D., Romero P. Toll-like receptor 3 expressed by melanoma cells as a target for therapy? Clin Cancer Res. 2007 Aug 1; 13(15 Pt 1): 456574. doi: 10.1158/1078-0432.CCR-07-0274.
- Гамалей С.Г., Даниленко Е.Д., Батенева А.В., Лебедев Л.Р., Масычева В.И. Фармакокинетика молекулярной конструкции для депонирования и транспортировки к клеткам-мишеням биологически активных веществ. Сибирский медицинский журнал. 2008; (3): 92-5. [Gamaley S.G., Danilenko E.D., BatenevaA.V., Lebedev L.R., Masycheva V.I. Pharmacokinetics of molecular construction for deposition and transportation of biologically active substances to target cells. Siberian Journal of Oncology. 2008; (3): 92-5. (in Russian)].
- Лебедев Л.Р., Аликин Ю.С., РосляковаЕ.Ю., Подгорный В.Ф., Дубинкина О.С., Азаев М.Ш. Выделение и очистка двуспиральной рибонуклеиновой кислоты из киллерного штамма дрожжей Saccha-romyces cerevisiae. Биофармацевтический журнал. 2014; 6(6): 32-8. [Lebedev L.R., Alikin Yu.S., Roslyakova E.Y., Podgorny V.F., Dubinki-na O.S., Azaev M.Sh. Isolation and purification of double stranded RNA from killer strain of yeast Saccharomyces cerevisiae. Russian Journal of Biopharmaceuticals. 2014; 6(6): 32-8. (in Russian)].
- Пустошилова Н.М., КилеваЕ.В., Денисова Л.Я., Шингарева Н.В., Коробко В.Г., Денисов Л.А., Масычева В.И., Сандахчиев Л.С., Калинин Ю.Т.; ФБУН «Государственный научный центр вирусологии и биотехнологии «Вектор» Роспотребнадзора. Способ получения рекомбинантного фактора некроза опухолей человека. Патент № 2144958 РФ, МКП C12N 15/28. № 97106895; Заявл. 23.04.97; Опубл. 27.01.00, Бюл. № 3. [Pustoshilova N.M., Kileva E.V., Denisova L.Ya., Shingareva N.V., Korobko V.G., Denisov L.A., Masycheva V.I., Sandak-hchiev L.S., Kalinin Yu .T.; State Scientific Center of Virology and Biotechnology «Vector». A method of producing a recombinant human tumor necrosis factor. Patent No. 2144958 ofthe Russian Federation, MCP C12N 15/28. № 97106895; Publ. 01.27.00. (in Russian)].
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods. 1983 Dec 16; 65(1-2): 55-63. doi: 10.1016/0022-1759(83)90303-4.
- Zhao Y., Liu H., Xu L., Guo B., Kalvakolanu D.V., Liu X., Hu J., Zhang D., Sun Y., Zhang L., Xu D., Zhao X. Synergistic Suppression of Melanoma Growth by a Combination of Natural dsRNA and Panaxadi-olsaponins. J Interferon Cytokine Res. 2018 Sep; 38(9): 378-387. doi: 10.1089/jir.2018.0037.
- Chawla-SarkarM., LindnerD.J., Liu Y.F., WilliamsB.R., Sen G.C., SilvermanR.H., BordenE.C. Apoptosis and interferons: role of interferon-stimulated genes as mediators of apoptosis. Apoptosis. 2003 Jun; 8(3): 237-49. doi: 10.1023/a:1023668705040.
- Coati I., Miotto S., Zanetti I., Alaibac M. Toll-like receptors and cutaneous melanoma. Oncol Lett. 2016; 12(5): 3655-3661. doi: 10.3892/ ol.2016.5166.
- Peine K.J., Bachelder E.M., Vangundy Z., Papenfuss T., Brack-man D.J., Gallovic M.D., Schully K., Pesce J., Keane-Myers A., Ainslie K.M. Efficient delivery of the toll-like receptor agonists polyinosinic:polycytidylic acid and CpG to macrophages by acetalated dextran microparticles. Mol Pharm. 2013 Aug 5; 10(8): 2849-57. doi: 10.1021/mp300643d.


