Индукция и репарация двунитевых разрывов ДНК в клетках линии V79 при длительном воздействии низкоинтенсивного Y-излучения
Автор: Озеров И.В., Бушманов А.Ю., Анчишкина Н.А., Гурьев Д.В., Пустовалова М.В., Сметанина Н.М., Архангельская Е.Ю., Воробьева Н.Ю., Осипов А.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Генетика
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
Цель: изучить закономерности изменений количества двунитевых разрывов (ДР) ДНК в клетках млекопитающих при длительном воздействии низкоинтенсивного у-излучения. Материал и методы. В работе использовали культуру фибробластов легкого китайского хомячка (линия V79). Облучение клеток у-лучами при мощности дозы 0,1 мГр/мин проводили на установке «Гамма-Панорама» (Cs-137). Для оценки изменений количества ДР ДНК использовали иммунофлуоресцентный анализ фокусов фосфорилированного гистона Н2АХ (у-Н2АХ). Частоту апоптотических клеток определяли методом «ДНК-гало». Для анализа продукции активных форм кислорода (АФК) использовали 5 (6) — хлорметил-2,7-дихлордигидрофлуоресцеиндиацетат. Результаты. Продемонстрировано, что при длительном низкоинтенсивном облучении клеток линии V79 в ранние сроки облучения (6-24 ч, дозы 3,6-14,4 сГр) наблюдается увеличение количества фокусов у-Н2АХ и продукции АФК, а в более поздние сроки (48-72 ч, дозы 28,8-43,2 сГр) снижение этих показателей практически до контрольного уровня. Статистически достоверных изменений доли апоптотических клеток при этом обнаружено не было. Заключение. Процессы, обусловливающие изменения количества ДР ДНК в клетках млекопитающих при длительном воздействии низкоинтенсивного у-излучения, по всей видимости, сопряжены с развитием оксидативного стресса и последующей активизацией антиоксидантных защитных систем клеток.
V-излучение, активные формы кислорода, апоптоз, двунитевые разрывы днк, клетки v79, низкая мощность дозы, фокусы v-h2ax
Короткий адрес: https://sciup.org/14917841
IDR: 14917841 | УДК: 577.2.043:539.1
Текст научной статьи Индукция и репарация двунитевых разрывов ДНК в клетках линии V79 при длительном воздействии низкоинтенсивного Y-излучения
-
1 Введение. Большая часть повреждений, возникающих в ДНК клеток после воздействия ионизирующего излучения (ИИ), существенно отличается по своей химической природе от эндогенных повреждений [1]. Важнейшей характеристикой радиационно-индуцированных повреждений ДНК является их сложность и кластеризация [2]. Среди повреждений ДНК, вызываемых ИИ, двунитевые разрывы (ДР) ДНК являются наиболее критическими для дальнейшей
Ответственный автор — Осипов Андреян Николаевич Адрес: 123182, г. Москва, ул. Живописная, 46.
Тел: +79154373245.
судьбы клетки. Предполагается, что именно ДР являются основным триггером, запускающим процессы клеточного отклика на воздействие ионизирующего излучения [3]. Репарация ДР происходит довольно медленно, в то время как ДР, не устраненные в ходе репарации ДНК, приводят к серьезным цитогенетическим нарушениям, гибели клеток, инактивации генов супрессоров опухолей или активации онкогенов [4]. Основные закономерности индукции и репарации ДР довольно хорошо изучены при остром, кратковременном воздействии ИИ в различных дозах [5]. Однако в реальных условиях живые организмы, как правило, подвергаются не острому, а длительному / хроническому воздействию ИИ. К сожалению, существующие в настоящее время экспериментальные данные об особенностях изменения количества ДР в клетках млекопитающих при длительном / хроническом воздействии ИИ немногочисленны и крайне противоречивы [6].
Цель работы : изучение закономерностей изменений количества ДР ДНК в клетках китайского хомяка линии V79 при длительном воздействии низкоинтенсивного γ-излучения.
Материал и методы. В работе использовали культуру фибробластов легкого китайского хомячка (линия V79). Клетки обладают довольно высокой адгезивной способностью к лабораторному пластику. Клетки культивировали в стандартной полной среде DMEM, содержащей 10% фетальной телячьей сыворотки, 1 % L-глютамина и антибиотики (пенициллин и стрептомицин) в условиях стандартного СО2-инкубатора при 37°C в атмосфере с 5%-м содержанием CO2.
Облучение клеток при мощности дозы 0,1 мГр/мин проводили на специально переоборудованной для облучения культур клеток облучательной установке «Гамма-Панорама» (источник γ-излучения Сs-137).
Для анализа фокусов γ-Н2АХ использовали методику, описанную в работе [7]. Коротко: клетки на покровных стеклах фиксировали параформальдегидом (2% в трис-буфере, рН 7,4), промывали трис-буфером, пермеабилизировали холодным (–20°С) метанолом в течение 1 мин и помещали на 20 мин в трис-буфер, содержащий 4% фетальной телячьей сыворотки и 0,1 % Тритон-Х100. Слайды инкубировали с моноклональными антителами к белку γ-Н2АХ (Anti-phospho-Histone H2A.X Rabbit Monoclonal, Merck-Millipore) при 4°С в течение ночи, после чего промывали и инкубировали со вторичными антителами, конъюгированными с флуорохромом (Goat anti-Rabbit IgG (H+L), FITC conjugate, Merck-Millipore), при комнатной температуре в течение 1 ч ДНК окрашивали флуоресцентным красителем DAPI (0,5 мкг/мл, 5 мин). Визуализацию, документирование и обработку иммунноцитохимических микроизображений осуществляли на люминесцентном микроскопе Ахioscop-40 FL (СаrlZeiss), оснащенным видеокамерой высокого разрешения АxioCamMRс 5 (CarlZeiss) с помощью программы AxioVision 4.8 (CarlZeiss). Подчитывали не менее 100 клеток на точку.
Частоту апоптотических клеток определяли методом «ДНК-гало» [8]. Принцип метода состоит в том, что низкомолекулярные фрагменты ДНК, образующиеся в процессе апоптотической межнуклеосомной деградации ДНК, легко диффундируют в гель агарозы, образуя характерное «гало» вокруг ядерной области клетки. Коротко: 10 мкл суспензии клеток (1 млн клеток/мл) смешивали со 100 мкл 0,5%-го раствора легкоплавкой агарозы (тип IV) в фосфатно-солевом буфере при температуре 37ºC и наносили на предварительно покрытые 1 %-м слоем нормоплавкой агарозы предметные стекла. Лизис клеток проводили в холодном (4°С) лизирующем буфере (2,5 M NaCl, 100 мМ EDTA, 20 мМ Tris-HCl, pH 10,0, 1 % Triton X-100) в течение 2 ч. После окраски слайдов флуоресцентным красителем SYBR Green I (Invitrogen) анализ уровня клеточной гибели осуществляли на люминесцентном микроскопе Ахioscop-40 FL (Саrl Zeiss), оснащенном видеокамерой высокого разрешения АxioCam MRс 5 (Carl Zeiss).
Для анализа продукции активных форм кислорода (АФК) в клетках использовали краситель
5(6)-хлорметил-2,7-дихлордигидрофлуоресцеиндиа цетат (Invitrogen), считающийся маркером внутриклеточных АФК [9]. Этот препарат легко проникает через клеточную мембрану, в клетке гидролизуется эстеразами и далее окисляется до флуоресцирующего соединения. Суспензию клеток (1 млн/мл) в фосфатносолевом буфере (рН 7,4) инкубировали с препаратом в течение 60 мин. Измерения интенсивности флуоресценции проводили на флуориметре с длиной волны возбуждения 488 нм и эмиссией 525–530 нм.
Статистическую обработку результатов всех измерений проводили с помощью программы Statistica 7.0. Результаты представлены как среднее трех независимых экспериментов ± стандартная ошибка. Для оценки достоверности отличий использовали t-критерий Стьюдента.
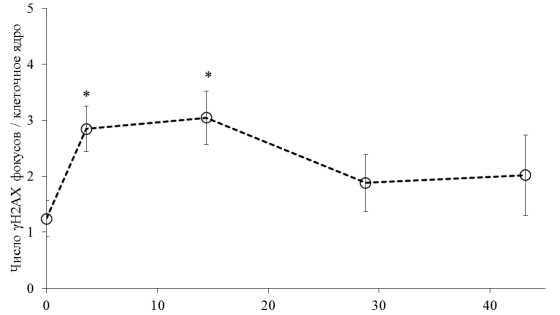
Результаты. Для оценки изменений количества ДР ДНК использовали иммунофлуоресцентный анализ фокусов фосфорилированного корового гистона Н2АX (γ-Н2АХ). Фосфорилирование Н2АХ осуществляется киназами АТМ, АТR и DNA-PK в ответ на образование ДР и свидетельствует о его распознавании [10]. При этом образуются динамические микроструктуры, содержащие тысячи копий γ-Н2АХ, получивших в литературе название «фокусы γ-Н2АХ» [11]. Полагают, что один фокус γ-Н2АХ соответствует одному ДР ДНК [12]. Ранее нами было показано, что через 30 мин после острого облучения количество фокусов γ-Н2АХ в клетках линии V79 линейно зависит от дозы облучения [7].
Предполагается, что «пороговой» дозой для индукции репарации ДР является доза в несколько сГр [13]. В связи с этим нами проведены исследования динамики изменений количества фокусов γ-Н2АХ в диапазоне доз 3,6–43,2 сГр при мощности дозы облучения 0,1 мГр/мин. Результаты исследований, представленные на рис. 1, свидетельствуют о том, что динамика изменений количества фокусов γ-Н2АХ при низкой мощности дозы существенно отличается от эффектов, наблюдаемых нами ранее на тех же клетках при облучении с высокой мощностью дозы (4000 мГр/мин) [7]. Если при облучении с высокой мощностью наблюдалось зависимое от дозы увеличение количества фокусов γ-Н2АХ, то при мощности дозы 0,1 мГр/мин характер изменений количества фокусов γ-Н2АХ необычен: в ранние сроки облучения (6–24 ч, дозы 3,6–14,4 сГр) наблюдается незначительное увеличение количества фокусов, в то время как увеличение времени и, соответственно, дозы облучения (48–72 ч, дозы 28,8–43,2 сГр) вызывало неожидан-
Доза, сГр
Рис. 1. Изменения количества фокусов γ-Н2АХ в клетках линии V79 при облучении с мощностью дозы γ-излучения 0,1 мГр/мин
П р и м еч а н и е : * — отличия от контроля достоверны, p<0,05
ное снижение количества фокусов γ-Н2АХ практически до контрольного уровня. Полученные результаты могут свидетельствовать в пользу гипотезы индуци-бельного характера репарации ДР в клетках млекопитающих при длительном воздействии низкоинтенсивного ионизирующего излучения.
Образование фокусов γ-Н2АХ происходит не только при индукции ДР повреждающими агентами, но и в процессе апоптоза. Показано, что киназа DNA-PK фосфорилирует гистон Н2АХ в процессе межнуклеосомной деградации хроматина [14]. В связи с этим было важно оценить возможный вклад апоптоза в индукции фокусов γ-Н2АХ при длительном низкоитенсивном облучении клеток. Результаты, представленные на рис. 2, показали, что при облучении клеток линии V79 при мощности дозы 0,1 мГр/ мин не отмечается увеличения доли апоптотических клеток в течение 72 ч облучения (рис. 2).
Другим процессом, индуцирующим образование фокусов γ-Н2АХ при длительном низкоинтенсивном облучении, является оксидативный стресс. Прямая индукция ДР при атаке ДНК свободными радикалами — довольно редкое событие, наблюдаемое при образовании близколежащих однонитевых разрывов (ОР) на противоположных нитях ДНК [9]. Известно, что соотношение ДР/ОР при атаке ДНК свободными радикалами составляет ~1/2000–1/3250, тогда как при воздействия ионизирующего излучения оно равно ~1/25. [9]. Однако ДР могут образовываться при коллапсе репликативных вилок, когда они достигают области однонитевого разрыва [10]. В результате фокусы γ-Н2АХ могут индуцироваться в клетках при повышенной продукции АФК. Действительно, результаты измерений продукции АФК в клетках линии V79, облученных при мощности дозы 0,1 мГр/мин, показывают, что характер изменений продукции АФК схож с изменением количества фокусов γ-Н2АХ в этих клетках (рис. 3).
Обсуждение. При анализе полученных нами результатов прежде всего обращает на себя внимание пороговость наблюдаемого эффекта. Снижение уровня ДР ДНК наблюдается после облучения в дозе ~15 сГр. Это наводит на мысль, что после достижения определенного количества ДР ДНК происходит активизация индуцибильных систем клеточного отклика на повреждения. Подобные результаты были получены нами ранее в экспериментах на мышах. Было показано, что при длительном воздействии низкоинтенсивного γ-излучения в дозах 14–43 сГр в начальные сроки облучения в клетках селезенки и лейкоцитах крови животных наблюдается незначительное увеличение количества ДР, после чего с увеличением продолжительности облучения и, соответственно, накопленной дозы, происходит неожиданное снижение их количества [6]. Результаты исследований Коллис и др. [15] свидетельствуют о том, что активация АТМ-киназы на повреждения ДНК и формирование фокусов γ-H2AX в клетках, облученных при низкой мощности дозы, значительно ниже, чем в клетках, подвергнутых облучению в эквивалентной дозе, но при высокой мощности дозы. Возможно, что активация систем клеточного отклика на повреждения ДНК при малом количестве ДР ДНК не происходит. Об индуцибильном характере отклика клеток на радиационно-индуцированные ДР ДНК свидетельствуют также результаты работы Грудзенски и др. [13]. Было показано, что первичные фибробласты человека не в состоянии репарировать ДР ДНК, возникающие в результате воздействия радиации в дозе
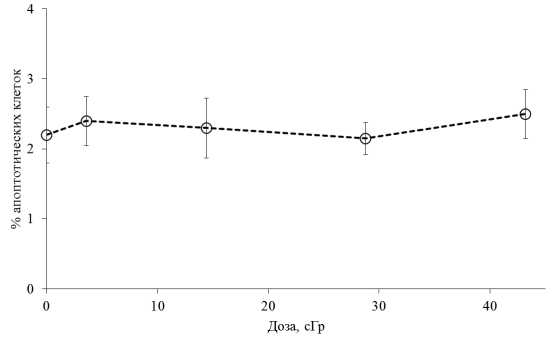
Рис. 2. Изменения доли апоптотических клеток в культуре клеток линии V79, облучаемой при мощности дозы 0,1 мГр/мин
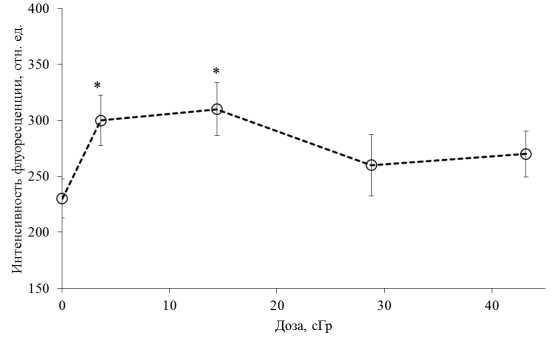
Рис. 3. Продукция активных форм кислорода в клетках линии V79 при облучении с мощностью дозы 0,1 мГр/мин П р и м еч а н и е : * — отличия от контроля достоверны, p<0,05
Заключение. Показано, что при облучении клеток китайского хомяка линии V79 с мощностью дозы 0,1 мГр/мин в ранние сроки облучения (6–24 ч, дозы 3,6–14.4 сГр) наблюдается увеличение количества фокусов γ-Н2АХ, а в более поздние сроки (48–72 ч, дозы 28,8–43,2 сГр) — снижение практически до контрольного уровня. Наблюдаемый эффект не сопровождается изменением доли апоптотических клеток, однако результаты измерений продукции АФК показывают, что их характер схож с изменением количества фокусов γ-Н2АХ в этих клетках. Сделано заключение о том, что процессы, обусловливающие изменения количества ДР ДНК в клетках млекопита- ющих при длительном воздействии низкоинтенсивного γ-излучения, по всей видимости, сопряжены с развитием оксидативного стресса и последующей активизацией антиоксидантных защитных систем клеток.
Список литературы Индукция и репарация двунитевых разрывов ДНК в клетках линии V79 при длительном воздействии низкоинтенсивного Y-излучения
- Jeggo P. A., Lobrich М. Contribution of DNA repair and cell cycle checkpoint arrest to the maintenance of genomic stability//DNA Repair (Amst). 2006. Vol. 5(9-10). P. 1192-1198
- Sutherland B.M., Bennett P. V., Sidorkina O., Laval J. Clustered damages and total lesions induced in DNA by ionizing radiation: oxidized bases and strand breaks//Biochemistry. 2000. Vol. 39 (27). P. 8026-8033
- Goodarzi A.A., Jeggo P., Lobrich M. The influence of heterochromatin on DNA double strand break repair: Getting the strong, silent type to relax//DNA Repair (Amst). 2010. Vol. 9 (12). P. 1273-1282
- Halazonetis T. D., Gorgoulis V G., Bartek J. An oncogene-induced DNA damage model for cancer development//Science. 2008. Vol. 319 (5868). P. 1352-1355
- Mladenov E., Iliakis G. Induction and repair of DNA double strand breaks: the increasing spectrum of non-homologous end joining pathways//Mutat. Res. 2011. Vol. 711 (1-2). P. 61-72
- Osipov A. N., Buleeva G., Arkhangelskaya E., Klokov D. In vivo y-irradiation low dose threshold for suppression of DNA double strand breaks below the spontaneous level in mouse blood and spleen cell.//Mutat. Res. 2013. Vol. 756 (1-2). P. 141-145
- Changes in the number of double-strand DNA breaks in Chinese hamster V79 cells exposed to y-radiation with different dose rates/K. V Kotenko, A.Y. Bushmanov, I. V Ozerov [et al.]//Int. J. Mol. Sci. 2013. Vol. 14, № 7. P. 13719-13726
- Singh N.P A simple method for accurate estimation of apoptotic cells//Exp. Cell Res. 2000. Vol. 256 (1) P. 328-337
- Osipov A.N., Lizunova E.Yu., Gur'ev D. V, Vorob'eva N.Yu. Genome Damage and Reactive Oxygen Species Production in the Progenies of Irradiated CHO-K1 Cells//Biophysics. 2011. Vol. 56, № 5. P. 931-935
- GammaH2AX foci analysis for monitoring DNA double-strand break repair: strengths, limitations and optimization/M. Lobrich, A. Shibata, A. Beucher [et al.]//Cell Cycle. 2010. Vol. 9 (4). P. 662-669
- A critical role for histone H2AX in recruitment of repair factors to nuclear foci after DNA damage/T.T. Paull, E. P. Rogakou, V Yamazaki [et al.]//Curr Biol. 2000. Vol. 10 (15). P. 886-895
- Sharma A., Singh K., Almasan A. Histone H2AX phosphorylation: a marker for DNA damage//Methods Mol. Biol. 2012. Vol. 920. P. 613-626
- Grudzenski S., Raths A., Conrad S., Rube C.E., Lobrich M. Inducible response required for repair of low-dose radiation damage in human fibroblasts//Proc. Natl. Acad.Sci. USA. 2010. Vol. 107 (32). P. 14205-14210
- DNA-PK phosphorylates histone H2AX during apoptotic DNA fragmentation in mammalian cells/B. Mukherjee, С Kessinger, J. Kobayashi [et al.]//DNA Repair (Amst). 2006. Vol. 5 (5). P. 575-590
- Evasion of early cellular response mechanisms following low level radiation-induced DNA damage/S. J. Collis, J.M. Schwaninger, A.J. Ntambi [et al.]//J. Biol. Chem. 2004. Vol. 279 (48). P. 49624-49632.


