Индукция непрямого органогенеза побегов сои Glycine max (L.) Merr. из сегментов стебля для применения в качестве эксплантов при агробактериальной трансформации
Автор: Варламова Н.В., Родионова М.А., Ефремова Л.Н., Харченко П.Н., Высоцкий Д.А., Халилуев М.Р.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Культуры in vitro
Статья в выпуске: 3 т.53, 2018 года.
Бесплатный доступ
Соя Glycine max (L.) Merr. - важнейшая продовольственная, техническая и кормовая культура. В настоящее время широкое распространение в мире получает выращивание генно-модифицированных растений сои с повышенной устойчивостью к гербицидам и вредителям, а также пониженным содержанием линоленовой кислоты по сравнению с сортами и гибридами традиционной селекции. Более 85 % трансгенных растений сои было получено методом агробактериальной трансформации. К настоящему времени разработаны протоколы агробактериальной трансформации сои посредством соматического эмбриогенеза, а также прямого или непрямого органогенеза. При этом в качестве эксплантов используют семядоли, семядольные узлы, сегменты гипокотиля и эпикотиля, незрелые и зрелые зародыши. Однако, несмотря на большое число известных протоколов, генетическая трансформация сои не стала еще рутинной процедурой, поскольку существенным образом зависит от особенностей конкретного генотипа. В доступной литературе данные об использовании сегментов стебля для генетической трансформации сои практически отсутствуют, хотя этот тип экспланта широко и эффективно применяют при получении большинства трансгенных растений из класса Dicotyledoneae...
Соя, культура in vitro, органогенез побегов, агробактериальная трансформация
Короткий адрес: https://sciup.org/142216554
IDR: 142216554 | УДК: 635.655:581.143.6:58.085 | DOI: 10.15389/agrobiology.2018.3.521rus
Текст научной статьи Индукция непрямого органогенеза побегов сои Glycine max (L.) Merr. из сегментов стебля для применения в качестве эксплантов при агробактериальной трансформации
Соя Glycine max (L.) Merr. — одна из важнейших продовольственных, технических и кормовых культур в мире. Семена сои содержат около 40 % сбалансированного по аминокислотному составу белка, 20 % жира, а также большое количество физиологически активных веществ — витаминов, макро- и микроэлементов, изофлавонов (1). По данным Продовольственной и сельскохозяйственной организации ООН (Food and Agriculture Organization, FAO), мировой валовый сбор соевых бобов в 2014 году соста-
Работа выполнена при частичной финансовой поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых в рамках проекта МК-9241.2016.11 и в рамках государственного задания ФАНО России ¹ АААА-А17-117091460013-5.
вил более 306,5 млн т при выращивании на территории 117,5 млн га, из которых на долю России приходилось около 0,8 % (2,3 млн т) с площади 1,9 млн га. При этом более 90 % посевных площадей сои в России сосредоточены в Дальневосточном, Центральном и Южном федеральных округах. Согласно Международной службе оценки применения агробиотехнологий (International Service for the Acquisition of Agri-biotech Applications, ISAAA), генно-модифицированные линии сои, имеющие повышенную устойчивость к гербицидам, вредителям, а также пониженное содержание линоленовой кислоты, в 2016 году выращивались на 78 % пахотных земель (91,4 млн га), занятых в мире под этой культурой (2).
Впервые о получении трансгенных растений сои еще в 1988 году сообщили две независимые группы исследователей (3, 4). К настоящему времени число публикаций по этой теме достаточно велико, однако, несмотря на обилие экспериментальных данных, получение стабильных трансгенных растений сои не стало рутинной процедурой, поскольку этот процесс зависит от наличия эффективных протоколов регенерации побегов в условиях in vitro и генетической трансформации. Более 85 % трансгенных растений сои получено методом агробактериальной трансформации (4-8). Для введения чужеродного генетического материала в геном сои также применяют прямые методы — биобаллистическую трансформацию (3, 9) и электропорацию протопластов (10). В последние годы широкое распространение получил метод генетической трансформации сои germline, при котором для введения экзогенной ДНК используют элементы генеративных органов растения (прорастающая пыльца, яйцеклетки, зародыши, семена) (11, 12). Каждый метод генетической трансформации имеет свои преимущества и недостатки. Для биобаллистической трансформации требуются дорогостоящие расходные материалы и оборудование. По сравнению с прямыми способами введения экзогенной ДНК Agrobacterium -опосредованный метод обладает рядом преимуществ: относительной простотой и дешевизной, высокой компетентностью клеток растений класса Dicotyledoneae к агробактериальному заражению, возможностью переноса больших фрагментов чужеродного генетического материала при низкоко-пийном характере их интеграции в геноме.
Индукция морфогенеза в культуре ткани сои — сложный процесс, регуляция которого осуществляется на клеточном, тканевом и организменном уровнях (13). Характер морфогенеза (соматический эмбриогенез или органогенез), а также его потенциал определяются генотипическими особенностями культуры, типом и физиологическим возрастом экспланта, составом питательной среды, физическими факторами и многим другим (14, 15). Так, в исследовании C. Zhang с соавт. (16) продемонстрирована функциональная роль транскрипционного фактора GmESR1 сои в регуляции генов, ответственных за реализацию регенерационного потенциала. Высказываются предположения, что различия в способности образовывать соматические эмбриоиды in vitro у генотипов сои, скорее всего, определяются неодинаковым содержанием эндогенных ауксинов в клетках и/или степенью чувствительности к этим гормонам (17, 18).
К настоящему времени разработаны протоколы агробактериальной трансформации сои с использованием соматического эмбриогенеза (19), хотя наиболее часто растения-регенеранты получают посредством прямого (7, 8, 20) или непрямого (4-6, 9, 17-19) органогенеза, используя различные типы эксплантов: семядоли (4, 17), сегменты гипокотиля (6, 15) и эпикотиля (21), семядольные и листовые узлы (7, 8, 15, 20), незрелые (9, 14, 18, 19) и зрелые (5, 14) зародыши. Принципиально важен для индукции про-522
цессов морфогенеза в культуре ткани сои подбор базового состава питательной среды, а также типа и концентрации регуляторов роста. Наиболее часто экспланты культивируют на средах, основу которых составляют макро- и микроэлементы в соответствии с прописью Мурасиге-Скуга (MS) (5-8, 17, 18) или Гамборга (4, 15), дополненных различными регуляторами роста — 6-бензиламинопурином (6-БАП) (4-6, 15, 20), тидиазуро-ном (8, 14), 2,4-дихлорфеноксиуксусной кислотой (2,4-Д) (9, 17, 18), 3-индолилуксусной кислотой (ИУК) (8). Доказано положительное влияние полиаминов (спермидина) (5), а также ингибиторов биосинтеза этилена (AgNO3) (15) на повышение частоты органогенеза побегов сои.
Судя по доступным научным публикациям, сегменты стебля сои для генетической трансформации практически не применяются, хотя такие экспланты эффективно используют при генетической модификации большинства растений класса Dicotyledoneae . Этот тип экспланта может существенно сократить объем работ по получению донорных проростков, что особенно актуально в случае ограниченного семенного материала.
В настоящем исследовании мы впервые на модели двух перспективных селекционных линий сои получили экспериментальные данные, подтвердившие способность сегментов стебля к органогенезу побегов в культуре in vitro, а также их использование в качестве эксплантов для генетической трансформации посредством Agrobacterium tumefaciens .
Нашей целью была разработка протокола соматического органогенеза побегов из сегментов стебля в культуре ткани сои и их применение в качестве эксплантов для получения трансгенных растений методом агробак-териальной трансформации.
Методика. Исходным растительным материалом служили семена сои Glycine max (L.) Merr. двух перспективных селекционных линий (1476 и 1477), полученных во Всероссийском НИИ зернобобовых и крупяных культур (Орловская обл., Россия). Семена поверхностно стерилизовали в течение 10 мин в 70 % этаноле, а затем в течение 20 мин в 40 % водном растворе гипохлорита натрия, после чего 3-4 раза промывали в стерильной дистиллированной воде и проращивали в культуральных сосудах с базовой питательной средой, основу которой составляли минеральные компоненты и витамины по прописи MS (22) с сахарозой (3 %) и агаром (0,8 %). У асептических донорных проростков на 12-14-е сут культивирования изолировали сегменты стебля длиной 1,0-1,5 см, которые помещали на базовую питательную среду MS с добавлением различных регуляторов роста для индукции морфогенеза: МS1 — 1 мг/л 6-БАП, 0,1 мг/л ИУК; МS2 — 1 мг/л 6-БАП, 0,5 мг/л 2,4-Д, 0,1 мг/л ИУК; МS 3 — 0,5 мг/л 6-БАП, 0,1 мг/л ИУК; МS4 — 0,5 мг/л 6-БАП, 0,5 мг/л 2,4-Д, 0,1 мг/л ИУК. Донорные проростки и экспланты культивировали в климакамере WLR-351H («Sanyo», Япония) при температуре 18-21 ° C, освещенности 4 клк и фотопериоде 16/8 ч (день/ночь). Пассирование на свежую питательную среду проводили каждые 14 сут. На 28-е и 42-е сут культивирования оценивали частоту органогенеза побегов для определения варианта питательной среды, обеспечивающего максимальный выход регенерантов. Частоту органогенеза, выраженную в процентах, определяли как отношение числа сегментов стебля, из которых происходило образование хотя бы одного регенерированного побега, к общему числу эксплантов. Каждый вариант питательной среды включал не менее 300 эксплантов, повторность 3-кратная.
Для агробактериальной трансформации использовали ранее полученную генетическую конструкцию pCambia1381Z-pro-SmAMP1-771 (23), Плазмиду pCambia1381Z-pro-SmAMP1-771 переносили в клетки A. tume- faciens супервирулентного штамма AGL0 методом электропорации (24).
Генетическую трансформацию растений проводили методом со-культивирования сегментов стебля с разбавленной суспензией агробактерии. Бактерии штамма AGL0, несущего генетическую конструкцию, выращивали на орбитальном шейкере-инкубаторе (180 об/мин) в течение 12 ч при 28 ° C в темноте в 20 мл неагаризованной среды Лурия-Бертани (LB) (25), дополненной соответствующими селективными антибиотиками — рифампицином («Sigma», США) и канамицином (ОАО «Биохимик», Россия) в концентрациях соответственно 25 и 50 мг/мл. Полученную агробактери-альную культуру разбавляли неагаризованной средой MS до OD 6 00 = 0,40,6. Оптическую плотность суспензии определяли на спектрофотометре NanoDrop 1000 («Thermo Scientific», США). Экспланты инкубировали в бактериальной суспензии в течение 40 мин, после чего подсушивали стерильными салфетками из фильтровальной бумаги и переносили в чашки Петри с агаризованной питательной средой MS. Сокультивирование эксплантов с агробактерией осуществляли в темноте при температуре 18 ° C в течение 48 ч. Обработанные сегменты стебля 5-6 раз промывали неага-ризованной средой MS с добавлением антибиотика тиментина (тикарцил-лин + клавулановая кислота) («SmithKline Beecham Pharmaceuticals», Великобритания) в концентрации 300 мг/л для элиминации агробактерии. Культивирование эксплантов осуществляли на питательной среде МS1, дополненной 300 мг/л тиментина и 1 мг/л гигромицина В («PhytoTech-nology Laboratories», США) для отбора устойчивых к селективному антибиотику побегов. В последующих пассажах постепенно увеличивали концентрацию селективного антибиотика до 10 мг/л. Трансгенный статус устойчивых к гигромицину B побегов сои подтверждали методом полимеразной цепной реакции (ПЦР).
Тотальную ДНК выделяли с помощью набора реагентов ДНК-Экстран-3 (ЗАО «Синтол», Россия) согласно инструкции производителя. Концентрацию ДНК определяли на спектрофотометре NanoDrop 1000. В качестве отрицательного и положительного контролей использовали соответственно препараты тотальной геномной ДНК, полученные из растений дикого типа, и плазмидную ДНК вектора pCambia1381Z-pro-SmAMP1-771. ПЦР для выявления генов hpt , uidA и virE2 проводили с использованием специфичных праймеров на амплификаторе MJ Miniтм Personal Thermal Cycler («Bio-Rad», США) в следующих режимах: общая денатурация в течение 3 мин при температуре 94 ° C; 35 циклов денатурации, отжига праймера и элонгации в течение 30 с (гены hpt и virE2 ) и 1,5 мин (ген uidA ) при температурах соответственно 94, 62 и 72 ° C; общая элонгация в течение 5 мин при температуре 72 ° C. Праймеры к последовательностям генов hpt и uidA подбирали с помощью программы VectorNTI («Thermo Fisher Scientific», США). Реакционная смесь для ПЦР объемом 25 мкл содержала 2,5 мкл 10½ ПЦР-буфера, 0,5 мкл 10 мМ смеси dNTPs, 1 мкл прямого и обратного праймеров с концентрацией каждого 10 пМ, 1 мкл Taq ДНК-полимеразы с активностью 5 IU/мкл, 17 мкл бидистиллированной воды и 2 мкл (∼ 60 нг) ДНК. Продукты амплификации разделяли в электрофорезной камере («Hoeffer», США) в 1 % агарозном геле с 1½ ТАЕ-буфером с добавлением бромистого этидия (ООО «Helicon», Россия). Амплифициро-ванные фрагменты визуализировали на трансиллюминаторе УВТ-1 (ЗАО «Биоком», Россия), их размеры оценивали с помощью маркера молекулярных масс Gene Ruler 1kb DNA Ladder («Fermentas», США).
Статистическую обработку результатов проводили с использованием параметрических критериев Стьюдента, Фишера и Дункана (α = 0,05). 524
До проведения двухфакторного дисперсионного анализа средние значения частоты органог е неза побегов были преобразованы с помощью функции угол-арксинус √ Х. Расчеты осуществляли с помощью статистической программы AGROS (версия 2.11).
Результаты. Одно из важнейших условий получения трансгенных растений — высокая способность культивируемых органов и тканей к органогенезу полноценных фертильных побегов. Следует учитывать, что при проведении агробактериальной трансформации морфогенетический потенциал культивируемых тканей вне зависимости от типа используемого экспланта существенно снижается. Причины этого — непосредственное заражение патогенным микроорганизмом, инсерция Т-ДНК в функционально значимые участки генома, ингибирующее действие селективных антибиотиков, длительное культивирование в условиях in vitro, а также ряд других стрессовых факторов, генерирующих образование избыточного количества активных форм кислорода (27, 28). В связи с этим первоначальная задача настоящего исследования состояла в разработке протокола органогенеза побегов из сегментов стебля используемых селекционных линий сои. Индукцию каллусо- и органогенеза осуществляли на 4 вариантах питательных сред, составленных по прописи MS и дополненных различными концентрациями 6-БАП в сочетании с ИУК (MS1, MS3) или ИУК и 2,4-Д (MS2, MS4). В результате на 8-10-е сут культивирования сегментов стебля обоих генотипов сои на всех питательных средах отмечали увеличение эксплантов в размере. К концу 1-го пассажа происходило образование каллусной ткани. Качественные характеристики формируемой каллусной ткани, а также место ее образования на экспланте существенным образом зависели от состава питательной среды. Так, при одновременном присутствии в составе питательной среды двух регуляторов роста класса ауксины вне зависимости от концентрации 6-БАП (MS2, MS4) происходило образование рыхлого светло-желтого каллуса на всей поверхности экспланта. Затем из клеток верхних слоев светло-желтого каллуса образовывался неморфогенный неструктурированный каллус белого цвета, который в процессе культивирования некротизировался. В то же время при культивировании сегментов стебля на питательных средах MS1 и MS3 формирование каллусной ткани происходило преимущественно на краях экспланта. Она имела желто-зеленый или светло-зеленый цвет и более плотную структуру (рис. 1, А). В каллусной ткани этого типа формировались меристематические очаги, из которых и происходил органогенез побегов (см. рис. 1, Б).
А Б

Рис. 2. Каллусообразование (А) и массовый органогенез побегов (Б) при культивировании сегментов стебля сои Glycine max (L.) Merr. линии 1476 на питательной среде Мурасиге-Скуга (MS 1 ) с добавлением 6-бензилами-нопурина (1 мг/л) в сочетании с 3-индолилуксусной кислотой (0,1 мг/л).
Двухфакторный дисперсионный анализ установил наличие существенных различий на 5 % уровне зна- чимости по показателю частоты органогенеза побегов между изученными генотипами и вариантами питательных сред. Кроме того, различия оказались существенными и для взаимодействия факторов генотип ½ вариант среды. Наибольшую частоту органогенеза побегов на
28-е и 42-е сут отмечали при культивировании сегментов стебля сои ли- нии 1476 на питательной среде MS1, содержащей 1 мг/л 6-БАП и 0,1 мг/л
1. Влияние генотипа и состава питательной среды на частоту органогенеза побегов из сегментов стебля сои Glycine max (L.) Merr.
ИУК. Частота органогенеза составила соответственно 44,1 и 51,2 % (табл. 1). Уменьшение концентрации 6-БАП в питательной среде (MS3) приводило к достоверному снижению частоты органогенеза побегов у этого генотипа. Кроме того, добавление в состав питательной среды ауксина 2,4-Д ингибировало процесс органогенеза побегов. Схожие результаты отмечали в отношении частоты органогенеза побегов у линии 1477, за исключением того, что этот генотип характеризовался крайне низкой способностью к морфогенезу in vitro. Так, частота органогенеза побегов на 42-е сут культивирования эксплантов на среде MS1 не превысила 27,0 %. Таким образом, в связи с низкой регенерационной способностью линии 1477 последующие эксперименты по агробак-териальной трансформации с использованием указанного генотипа представляются нецелесообразными.
В рамках настоящего исследования были проведены два независимых эксперимента по агробактериальной трансформации селекционной линии сои 1476. Использованная для этой цели генетическая конструкция pCambia1381Z-pro-SmAMP1-771 (23) в составе Т-ДНК несет селективный ген hpt , обусловливающий устойчивость к гигромицину В, а также репор-терный ген uidA , содержащий модифицированный интрон гена каталазы клещевины под контролем 5´-делеционного варианта -771 п.н. промотора pro-SmAMP1 из Stellaria media (L.) (рис. 2).

p3 5S

hpt
CaMV 35S
pro-SmAMP1-771
pA nos
Рис. 2. Схематическое изображение Т-ДНК генетической конструкции pCambia1381Z-pro-SmAMP1-771, использованной в опытах по агробактериальной трансформации сои Glycine max (L.) Merr.: RB, LB — соответственно правая и левая фланкирующие последовательности Т-ДНК, CaMV 35S и p35S — соответственно промотор и терминатор 35S РНК вируса мозаики цветной капусты, hpt — ген гигромицинфосфотрансферазы Escherichia coli , pro-SmAMP1-771 — 5´-делеционный вариант ( - 771 п.н.) промотора pro-SmAMP1 из Stellaria media , uid A — репор-терный ген β -глюкуронидазы, содержащий модифицированный интрон гена каталазы клещевины, pAnos — терминатор гена нопалинсинтазы (23).
Всего при сокультивировании с суспензией штамма A. tumefaciens AGL0, содержащего плазмиду pCambia1381Z-pro-SmAMP1-771, были инокулированы 200 эксплантов. Нами была применена стратегия постепенной адаптации эксплантов к селективному агенту, исключающая шок и массовую гибель (постепенное увеличение концентрации в селективной среде гигромицина B), которая была успешно использована при агробактери-альной трансформации томата (29). Несмотря на постепенное увеличение 526
концентрации гигромицина В в селективной среде MS1, в процессе культивирования происходила некротизация большей части сегментов стебля (75,5 %, или 151 эксплант). Кроме того, у части эксплантов (36, или 18,0 %) наблюдалась бактериальная контаминация. Некротизированные и контаминированные сегменты стебля были исключены из эксперимента. В результате в начале 3-го пассажа только у 13 эксплантов (6,5 %) отмечено формирование светло-зеленой каллусной ткани. С увеличением концентрации селективного агента в питательной среде отмечалось увеличение размеров каллусной ткани. В результате частота каллусообразования на селективной питательной среде с добавлением 10 мг/л гигромицина В составила 6,5 %. Однако только у 8 из этих 13 каллусных тканей (4,0 % от общего числа эксплантов), сформировавшихся на селективной питательной среде для индукции морфогенеза, наблюдалось образование плотных глобулярных меристематических очагов зеленого цвета, из которых впоследствии и происходил органогенез побегов. В итоге частота органогенеза устойчивых к гигромицину B побегов составила 4,0 %.
2. Нуклеотидные последовательности праймеров, использованных при ПЦР для подтверждения присутствия генов hpt , uidA и virE2 у устойчивых к гиг-ромицину В регенерантов сои Glycine max (L.) Merr. селекционной линии 1476, и ожидаемый размер ампликонов
|
Ген |
Нуклеотидная последовательность праймера (5´ → 3´) |
Размер ампликона, п.н. |
|
hpt |
F – TCTGATAGAGTTGGTCAAGACC R – CAAGGAATCGGTCAATACACTAC |
415 |
|
uidA |
F – ATCGCGAAAACTGTGGAATTGATC R – TTACCGCCAACGCGCAATATG |
1628 |
|
VirE2 (26) |
F – CGAATACATTCTCGTGCGTCAAACG R – TTTCGAGTCATGCATAATGCCTGAC |
600 |
|
Примеч |
а н и е. F, R — соответственно прямой и обратный праймеры. |
Для подтверждения трансгенного статуса независимых регенерантов, устойчивых к гигромицину B, провели ПЦР-анализ. При амплификации с использованием специфических праймеров (табл. 2) для последовательности селективного гена hpt фрагменты, соответствующие положительному контролю, были получены у 4 из 8 растений-регенерантов (рис. 3, А). Интеграция репортерного гена uidA была установлена у всех проанализированных образцов, содержащих ген hpt (см. рис. 3, Б). Также все препараты тотальной геномной ДНК у изученных образцов были проверены на отсутствие бактериального гена VirЕ2 с целью исключения ложноположительных результатов вследствие бактериальной контаминации (см. рис. 3, В). Таким образом, эффективность агробактериальной трансформации сегментов стебля сои линии 1476 при использовании генетической конструкцией pCambia1381Z-pro-SmAMP1-771 составила 2,0 %.
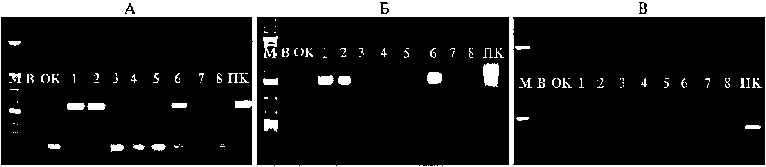
Рис. 3. Электрофореграммы продуктов ПЦР-амплификации генов hpt (A) , uidA (Б) и VirE2 (С) при анализе устойчивых к гигромицину В регенерантов сои Glycine max (L.) Merr. селекционной линии 1476: М — маркер молекулярной массы (Gene Ruler 1kb DNA Ladder, «Fermentas», США), В — вода, ОК — отрицательный контроль (тотальная геномная ДНК, выделенная из линии сои 1476), 1-8 — ДНК независимых регенерантов сои, устойчивых к гигромицину B, ПК — положительный контроль (плазмидная ДНК pCambia1381Z-pro-SmAMP1-771).
По результатам ПЦР-анализа установлено, что 50 % устойчивых к гигромицину B регенерантов оказались так называемыми ложными трансформантами (escapes) — растениями, приспособившимися к существованию на селективной среде с антибиотиком, но не содержащими в геноме чужеродную ДНК. В последние годы исследователи проявляют повышенный научный и практический интерес к этому явлению. В частности, ложные трансформанты льна-долгунца, выжившие под влиянием стрессовых факторов после агробактериальной трансформации, расширили спектр генетической изменчивости и послужили исходным материалом для создания генотипов с улучшенным сочетанием селекционных признаков (30).
Итак, в результате проведенных исследований было показано, что изученные селекционные линии сои (1476 и 1477) существенным образом различаются по способности к морфогенезу in vitro. Экспериментально подтверждено, что добавление ауксина 2,4-дихлорфеноксиуксусной кислоты приводило к ингибированию органогенеза побегов. Установлены типы и концентрации регуляторов роста, входящие в состав питательной среды Мурасиге-Скуга и обеспечивающие максимальный выход регенерантов, — 6-бензиламинопурин (1 мг/л) в сочетании с 3-индолилуксусной кислотой (0,1 мг/л). Для линии сои 1476 разработан эффективный протокол непрямого соматического органогенеза побегов из сегментов стебля с частотой более 50 %, который был использован в последующих экспериментах по генетической трансформации, осуществляемой штаммом Agrobacterium tu-mefaciens AGL0, содержащим плазмиду pCambia1381Z-pro-SmAMP1-771. В результате поэтапной селекции на питательной среде с возрастающими концентрациями гигромицина В (1-10 мг/л) были отобраны 8 независимых линий. Присутствие селективного ( hpt ) и маркерного ( uidA ) генов подтверждено у 4 независимых трансгенных линий методом ПЦР. Эффективность агробактериальной трансформации составила 2,0 %. Полученные результаты свидетельствуют об успешном применении и перспективности использования сегментов стебля в качестве эксплантов для генетической трансформации сои.
Список литературы Индукция непрямого органогенеза побегов сои Glycine max (L.) Merr. из сегментов стебля для применения в качестве эксплантов при агробактериальной трансформации
- Глухих М.А. Технологии производства продукции растениеводства в Зауралье и Западной Сибири. М., 2015.
- Global status of commercialized biotech/GM crops: 2016. ISAAA Brief №. 52. ISAAA, Ithaca, NY, 2016.
- Christou P., McCabe D.E., Swain W.F. Stable transformation of soybean callus by DNA-coated gold particles. Plant Physiol., 1988, 87(3): 671-674 ( ) DOI: 10.1104/pp.87.3.671
- Hinchee M.A., Connor-Ward D.V., Newell C.A., McDonell R.E., Sato S.J., Gasser C.S., Fishhoff D.A., Re D.B., Fraley R.T., Horsch R.B. Production of transgenic soybean plants using Agrobacterium-mediated DNA transfer. Nature Biotechnol., 1988, 6(8): 915-922 ( ) DOI: 10.1038/nbt0888-915
- Arun M., Chinnathambi A., Subramanyam K., Karthik S., Sivanandhan G., Theboral J., Alharbi S.А., Kim C.K., Ganapathi A. Involvement of exogenous polyamines enhances regeneration and Agrobacterium-mediated genetic transformation in half-seeds of soybean. 3 Biotech, 2016, 6(2): 148 ( ) DOI: 10.1007/s13205-016-0448-0
- Wang G., Xu Y. Hypocotyl-based Agrobacterium-mediated transformation of soybean (Glycine max) and application for RNA interference. Plant Cell Rep., 2008, 27(7): 1177-1184 ( ) DOI: 10.1007/s00299-008-0535-8
- Ефремова О.С., Дега Л.А., Нодельман Е.К., Шкрыль Ю.Н. Оценка трансгенных растений сои (Glycine max (L.) Merr.) на устойчивость к фитопатогенам. Масличные культуры. Научно-технический бюллетень Всероссийского научно-исследовательского института масличных культур, 2016, 4(168): 25-30.
- Hong H.P., Zhang H., Olhoft P., Hill S., Wiley H., Toren E., Hillebrand H., Jones T., Cheng M. Organogenic callus as the target for plant regeneration and transformation via Agrobacterium in soybean (Glycine max (L.) Merr.). In Vitro Cell. Dev. Biol.-Plant, 2007, 43(6): 558-568 ( ) DOI: 10.1007/s11627-007-9066-1
- Finer J.J. Generation of transgenic soybean (Glycine max) via particle bombardment of embryogenic cultures. Curr. Protoc. Plant Biol., 2016, 1: 592-603 ( ) DOI: 10.1002/cppb.20039
- Dhir S.K., Dhir S., Sturtevant A.P., Widholm J.M. Regeneration of transformed shoots from electroporated soybean (Glycine max (L.) Merr.) protoplasts. Plant Cell Reports, 1991, 10(2): 97-101 ( ) DOI: 10.1007/BF00236466
- Shou H., Palmer R.G., Wang K. Irreproducibility of the soybean pollen-tube pathway transformation procedure. Plant Mol. Biol. Rep., 2002, 20(4): 325-334 ( ) DOI: 10.1007/BF02772120
- Кершанская О.И. Генетическая инженерия сои для улучшения устойчивости к абиотическим стрессам. Eurasian Journal of Applied Biotechnology, 2013, 1: 34-40.
- Бутенко Р.Г. Биология клеток высших растений in vitro и биотехнологии на их основе. М., 1999.
- Franklin G., Carpenter L., Davis E., Reddy C.S., Al-Abed D., Abou Alaiwi W., Parani M., Smith B., Sairam R.V. Factors influencing regeneration of soybean from mature and immature cotyledons. Plant Growth Regul., 2004, 43(1): 73-79 ( ) DOI: 10.1023/B:GROW.0000038359.86756.18
- Raza G., Singh M.B., Bhalla P.L. In vitro plant regeneration from commercial cultivars of soybean. BioMed Research International, 2017, 2017: Article ID 7379693 ( ) DOI: 10.1155/2017/7379693
- Zhang C., Wu X., Zhang B., Chen Q., Liu M., Xin D., Qi Z., Li S., Ma Y., Wang L., Jin Y., Li W., Wu X., Su A.-Y. Functional analysis of the GmESR1 gene associated with soybean regeneration. PLoS ONE, 2017, 12(4): e0175656 ( ) DOI: 10.1371/journal.pone.0175656
- Tomlin E.S., Branch S.R., Chamberlain D., Gabe H., Wright M.S., Stewart C.N. Screening of soybean, Glycine max (L.) Merrill, lines for somatic embryo induction and maturation capability from immature cotyledons. In Vitro Cell. Dev. Biol.-Plant, 2002, 38(6): 543-548 ( ) DOI: 10.1079/IVP2002326
- Hiraga S., Minakawa H., Takahashi K., Takahashi R., Hajika M., Harada K., Ohtsubo N. Evaluation of somatic embryogenesis from immature cotyledons of Japanese soybean cultivars. Plant Biotechnology, 2007, 24(4): 435-440 ( ) DOI: 10.5511/plantbiotechnology.24.435
- Ko T.-S., Korban S.S. Enhancing the frequency of somatic embryogenesis following Agrobacterium-mediated transformation of immature cotyledons of soybean In Vitro Cell. Dev. Biol.-Plant, 2004, 40(6): 552-558 ( ) DOI: 10.1079/IVP2004566
- Olhoft P., Flagel L., Donovan C., Somers D. Efficient soybean transformation using hygromycin B selection in the cotyledonary-node method. Planta, 2003, 216(5): 723-735 ( ) DOI: 10.1007/s00425-002-0922-2
- Wright M.S., Williams M.W., Pierson, P.E., Carnes M.G. Initiation and propagation of Glycine max L. Merr.: Plants from tissue-cultured epicotyls. Plant Cell Tiss. Organ Cult., 1987, 8(1): 83-90 ( ) DOI: 10.1007/BF00040735
- Murashige T., Skoog F. A revised medium for rapid growth and bioassays with tobacco tissue culture. Physiologia Plantarum, 1962, 15: 473-497 ( ) DOI: 10.1111/j.1399-3054.1962.tb08052.x
- Высоцкий Д.А., Стрельникова С.Р., Ефремова Л.Н., Ветчинкина Е.М., Бабаков А.В., Комахин Р.А. Структурно-функциональный анализ нового растительного промотора pro-SmAMP1 из Stellaria media. Физиология растений, 2016, 63(5): 705-715 ( ) DOI: 10.7868/S0015330316050183
- Weigel D., Glazebrook J. Transformation of Agrobacterium using electroporation. Cold Spring Harb. Protoc., 2006, 7: pdb.prot4665 ( ) DOI: 10.1101/pdb.prot4665
- Bertani G. Studies on lysogenesis. I. The mode of phage liberation by lysogenic Escherichia coli. J. Bacteriol., 1951, 62: 293-300.
- Komakhin R.A., Komakhina V.V., Milyukova N.A., Goldenkova-Pavlova I.V., Fadina O.A., Zhuchenko A.A. Transgenic tomato plants expressing recA and NLS-recA-licBM3 genes as a model for studying meiotic recombination. Russ. J. Genet., 2010, 46(12): 1635-1644 ( ) DOI: 10.1134/S1022795410120069
- Enikeev A.G., Kopytina T.V., Maximova L.A., Nurminskaya Yu.V., Shafikova T.N., Rusaleva T.M., Fedoseeva I.V., Shvetsov S.G. Physiological consequences of genetic transformation: result of target gene expression or stress reaction? Journal of Stress Physiology & Biochemistry, 2015, 11(2): 64-72.
- Cassells A.C., Curry R.F. Oxidative stress and physiological, epigenetic and genetic variability in plant tissue culture: implications for micropropagators and genetic engineers. Plant Cell Tiss. Organ Cult., 2001, 64(2-3): 145-157 ( ) DOI: 10.1023/A:1010692104861
- Халилуев М.Р., Харченко П.Н., Долгов С.В. Генетическая трансформация томата (Solanum lycopersicum L.) генами защитных хитин-связывающих белков и антимикробных пептидов. Известия ТСХА, 2010, 6: 75-83.
- Ushchapovskii I.V., Lemesh V.V., Bogdanova M.V., Guzenko E.V. Particularity of breeding and perspectives on the use of molecular genetic methods in flax (Linum usitatissimum L.) genetics and breeding research (review). Sel’skokhozyaistvennaya biologiya , 2016, 51(5): 602-616 ( ) DOI: 10.15389/agrobiology.2016.5.602eng


