Инфекционные осложнения после реконструктивных оперативных вмешательств у больных раком молочной железы
Автор: Григорьевская Злата Валерьевна, Доколин Роман Михайлович, Терещенко Инна Васильевна, Соболевский Владимир Анатольевич, Дмитриева Наталья Владимировна, Винникова Валерия Дмитриевна, Вершинская Валентина Алексеевна, Петухова Ирина Николаевна, Багирова Наталия Сергеевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.20, 2021 года.
Бесплатный доступ
Актуальность. В настоящее время в мире нет единого мнения в отношении тактики ведения пациенток с раком молочной железы с имплант-ассоциированными инфекциями. В одних исследованиях однозначно рекомендованы их удаление и хирургическая санация c последующей антибактериальной терапией, в других - отдается предпочтение длительной антимикробной терапии (не менее 1 мес), при этом эффективность консервативного подхода достигает 36-73 %. Клинический случай. Пациентке 43 лет, страдающей BRCA1-положительным раком правой молочной железы T2N0M0 (инвазивная карцинома неспецифического типа G3, ER - 8, PgR - 0, Her-2/Neu - 0, Ki67 (%) - менее 20 %), были выполнены радикальная кожесохранная мастэктомия справа с одномоментной реконструкцией имплантом и профилактическая подкожная мастэктомия слева с одномоментной реконструкцией имплантом. На 21-е сут после операции развилась инфекция в области импланта левой молочной железы. Результаты. Пациентке эмпирически была назначена терапия цефепимом. При микробиологическом исследовании пунктата был выявлен возбудитель инфекции - метициллин-резистентный золотистый стафилококк (MRSA) в количестве 1*105 КОЕ/мл. К терапии был добавлен даптомицин 6 мг/кг/сут. Через 8 нед пациентка была переведена на пероральный моксифлоксацин 400 мг 1 раз в сут, который получала еще 3 нед. На фоне лечения был получен полный эффект. Больная без признаков инфекции в течение 3 лет. Заключение. Длительная этиотропная антибактериальная терапия с использованием даптомицина с переходом на пероральный моксифлоксацин позволила получить стойкий клинический эффект и своевременно провести адъювантное противоопухолевое лечение.
Рак молочной железы, кожесохранная мастэктомия с реконструкцией, имплант-ассоциированная инфекция, метициллин-резистентный золотистый стафилококк, антибактериальная терапия, даптомицин, моксифлоксацин
Короткий адрес: https://sciup.org/140254498
IDR: 140254498 | УДК: 618.19-006 | DOI: 10.21294/1814-4861-2021-20-3-151-157
Текст научной статьи Инфекционные осложнения после реконструктивных оперативных вмешательств у больных раком молочной железы
Рак молочной железы занимает лидирующую позицию в структуре онкологической заболеваемости у женщин (21,1 %) [1, 2]. Оперативные вмешательства в объеме радикальной мастэктомии зачастую приводят к необратимым психологическим проблемам, социальной дезадаптации. Решением проблемы является выполнение реконструктивных оперативных вмешательств, однако риск инфекционных осложнений в этом случае выше такового при обычных операциях по поводу рака молочной железы [3–7]. В настоящий момент в мире не существует единого мнения в отношении тактики ведения пациентов с инфицированными имплантами (эндопротезами). В одних исследованиях однозначно рекомендованы их удаление и хирургическая санация c последующей антибактериальной терапией, в других – отдается предпочтение консервативному лечению [8–10]. В этом случае показана длительная антибактериальная терапия (не менее 1 мес), а эффективность консервативного подхода составляет 36–73 % [10].
Клиническое наблюдение
Представляем клиническое наблюдение удачного консервативного лечения инфекции области импланта у 43-летней больной раком молочной железы. Из анамнеза: в апреле 2017 г. пациентка самостоятельно обнаружила у себя узловое образование в правой молочной железе. В онкологическом диспансере по месту жительства выполнена core-биопсия этого образования. Гистологически – инвазивная карцинома молочной железы неспецифического типа G3. Заключение иммуногистохимического исследования – ER – 8, PgR – 0, Her-2/Neu – 0, Ki67 – менее 20 %.
При осмотре в НМИЦ онкологии им. Н.Н. Блохина МЗ РФ выявлено, что кожа, соски, ареолы обеих молочных желез не изменены, в ткани правой молочной железы, в верхне-наружном квадранте пальпируется плотное узловое образование с нечеткими контурами, неправильной формы, безболезненное, размерами 2,5×2,5 см, кожа над ним не изменена (рис. 1). В ткани левой молочной железы узловые образования не пальпируются. В правой аксиллярной области пальпируется 1 лимфоузел до 0,8 см в диаметре, плотный, смещаемый, безболезненный. Над- и подключичные лимфоузлы справа и слева не пальпируются.
При маммографии: правая молочная железа не деформирована, кожа в верхнем квадранте втянута, сосок и ареола не изменены, IV тип плотности ткани молочной железы (более 75 % фиброзно-железистой ткани). На границе верхних квадрантов (передний отдел) определяется гиперденсное образование неправильной формы со скрытым контуром. Размеры образования составляют 2,5×2,1 см. При УЗИ молочных желез справа визуализируется гипоэхогенное образование с тяжистым контуром размером 2,0×1,7 см и единичными сосудами. Злокачественных кальцинатов нет. Левая молочная железа – не деформирована. Кожа, сосок и ареола не изменены. IV тип плотности ткани молочной железы (более 75 % фиброзножелезистой ткани). Образований в ткани левой молочной железы не выявлено. Злокачественных кальцинатов нет. В регионарных зонах, в правой аксиллярной области визуализируются лимфоузлы с широким гипоэхогенным ободком до 0,9 см. В правой подключичной области – лимфоузлы до 0,7 см (гиперплазия?). В других регионарных зонах патологически измененные лимфоузлы не визуализируются. Изменения в правой молочной железе по шкале BI-RADS соответствуют категории BI-RADS 6. По данным УЗИ брюшной полости и малого таза, рентгенографии легких, скениро-вания костей скелета признаков диссеминации опухолевого процесса не выявлено.
Установлен диагноз: Рак правой молочной железы T2N0M0 IIa стадии. Кроме того, при молекулярно-генетическом исследовании обнаружена мутация в гене BRCA-1. На консилиуме с заведующим отделением пластической хирургии решено выполнить хирургическое лечение в объеме радикальной кожесохранной мастэктомии справа с одномоментной реконструкцией имплантом «Polytech (REF 20736-315)» 315 ml и торакодорзальным лоскутом с кожной площадкой, а также в связи с данными молекулярно-генетического исследования целесообразно выполнить профилактическую подкожную мастэктомию слева с реконструкцией имлантом «Polytech (REF 20736315)» 315 ml.
Поскольку оперативное вмешательство относилось к категории «чистых», проводилась стандартная антибиотикопрофилактика ам-пициллином/сульбактамом. Послеоперационный период протекал гладко, и в первые 3 нед после вмешательства осложнений не отмечалось. Послеоперационные раны зажили первичным натяжением, швы сняты на 14-е сут (рис. 2).
После выписки рекомендована адъювантная химиотерапия по схеме: доксорубицин 60 мг/м2 + + циклофосфан 600 мг/м2 внутривенно капельно каждые 3 нед – 3 курса; паклитаксел 175 мг/м2 внутривенно капельно (в течение 3 ч) каждые 3 нед – 3 курса. В дальнейшем рекомендована эндокрино-терапия тамоксифеном 20 мг в сут ежедневно в течение 2 лет с последующим переходом на длительный прием ингибиторов ароматазы.
На 21-е сут после операции появились жалобы на лихорадку до 38,4 °С, озноб, болезненность левой молочной железы. При осмотре левая молочная железа отечна, гиперемирована (рис. 3), резко болезненна при пальпации. Область послеоперационного шва после профилактической мастэктомии без явных признаков воспаления. При УЗИ отмечался слой жидкости вокруг импланта до 3 см, воспалительная инфильтрация ткани железы. При пункции получено 140 мл мутного воспалительного экссудата, который отправлен на микробиологическое исследование.
Пациентке незамедлительно была начата эмпирическая антибактериальная терапия препаратами широкого спектра действия – цефепимом в дозе 2 г 2 раза в день внутривенно струйно в комбинации с метронидазолом 500 мг 3 раза в день внутривенно капельно. Каждый день больную осматривал лечащий врач и каждые 2 сут осуществлялись пункции зоны воспалительной инфильтрации.
Через 3 сут получены результаты микробиологического исследования (рис. 4). В посеве пун-
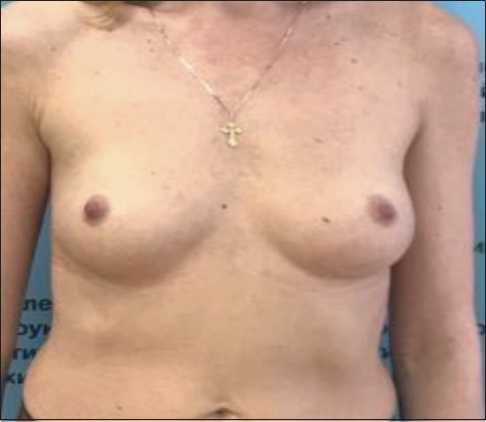
Рис. 1. Пациентка в процессе обследования (до оперативного вмешательства) Fig. 1. Before surgery
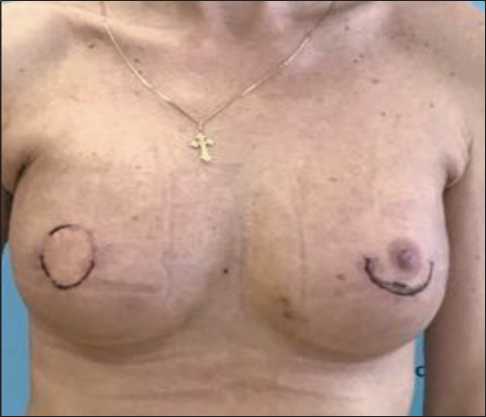
Рис. 2. Пациентка на 14-е сут послеоперационного периода Fig. 2. 14 days after surgery
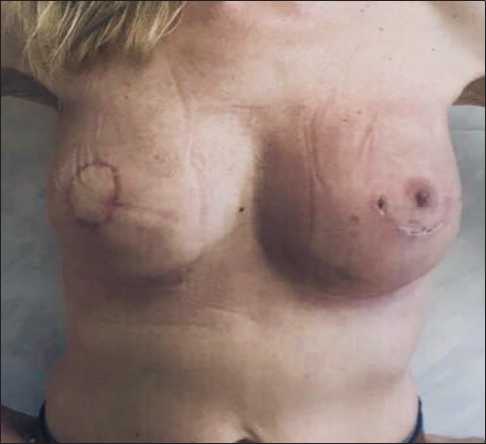
Рис. 3. Пациентка на 21-е сут послеоперационного периода. Инфекция в области импланта в левой молочной железе
Fig. 3. 21 days after surgery. Implant-associated infection of the left breast ктата выявлен рост метициллин-резистентного золотистого стафилококка (Methicillin-resistant Staphylococcus aureus, MRSA) в количестве 1×105 КОЕ (диагностический титр). Идентификация микроорганизма и определение чувствительности к антибиотикам производились с помощью масс-спектрометра Maldi-Tof (Brucker, Германия) и автоматического анализатора MicroScan WalkAway (CША). Оценка результатов чувствительности микроорганизмов к антибиотикам производилась согласно стандартам EUCAST (таблица).
На фоне проводимого лечения цефепимом и метронидазолом состояние несколько улучшилось: не отмечалось ознобов в вечернее время, наблюдалась тенденция к снижению гипертермии, однако сохранялась субфебрильная температура в вечернее время. Учитывая данные антибиотикограммы, решено добавить к проводимой терапии даптомицин в дозе 6 мг/кг в сут. Метронидазол отменен. Через 3 сут после дополнительного назначения даптоми-цина отмечена выраженная положительная динамика в виде полной нормализации температуры, уменьшения отека железы и болевого синдрома. С целью сохранения импланта решено продолжить данную терапию в течение 2 мес. Длительность терапии определялась характером инфекции, наличием импланта и необходимостью проведения противоопухолевого лечения. Каждые 3 сут больная осматривалась лечащим врачом. Каждые 4–5 дней выполнялся общий и биохимический анализы крови. Каждые 2 нед проводили УЗИ молочных желез. На фоне лечения изменялся характер экссудата: он становился более светлым и прозрачным, а объем пунктата постепенно уменьшался.
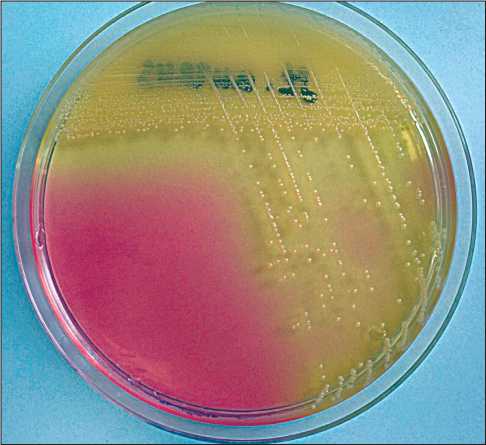
Рис. 4. Колонии Staphylococcus aureus на маннит-солевом агаре. Ферментация маннита с изменением цвета среды вокруг колоний с бледно-розового на желтый цвет характерна для золотистого стафилококка
Figure 4. Staphylococcus aureus colonies on mannitol salt agar. Fermentation of mannitol changing the color of the medium around the colonies from pale pink to yellow is characteristic of Staphylococcus aureus
Таблица/table
Чувствительность штамма метициллин-резистентного стафилококка (MRsa) к антибиотикам the susceptibility of methicillin-resistant Staphylococcus aureus strain (MRsa) to antimicrobials
Антибиотик Staphylococcus aureus
|
Амоксициллин/ клавулановая кислота |
R≤4/2 |
|
Ампициллин/сульбактам |
R≤8/4 |
|
Ванкомицин |
S 1 |
|
Гентамицин |
S≤1 |
|
Даптомицин |
S 0,5 |
|
Клиндамицин |
S≤0,25 |
|
Левофлоксацин |
S≤0,5 |
|
Линезолид |
S 2 |
|
Моксифлоксацин |
S≤0,5 |
|
Оксациллин |
R>2 |
|
Рифампицин |
S≤1 |
|
Цефокситин, скрининг |
MRS>4 |
|
Тетрациклин |
S≤1 |
|
Триметоприм/сульфаметоксазол |
S≤0,5/9,5 |
|
Хинупристин/дальфопристин |
S≤0,25 |
|
Цефазолин |
R 16 |
|
Ципрофлоксан |
S≤1 |
|
Эритромицин |
S≤0,25 |
Примечание: Staphylococcus aureus 1×105 КОЕ/мл. Результат микробиологического исследования – рост есть.
Note: Staphylococcus aureus 1×105 CFU/ml. Microbiological study shows the tumor growth.
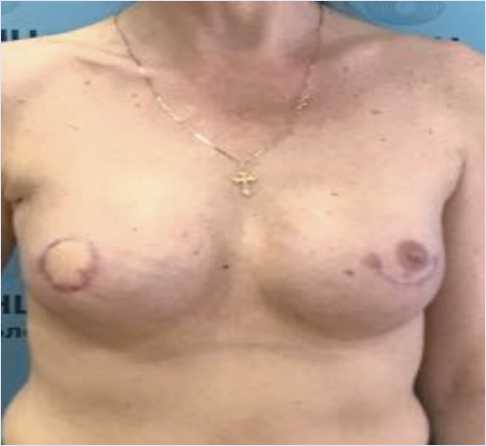
Рис. 5. Пациентка через 2 мес от начала терапии даптомици-ном и цефепимом
Fig. 5. 2 months before starting daptomycin and cefepime therapy
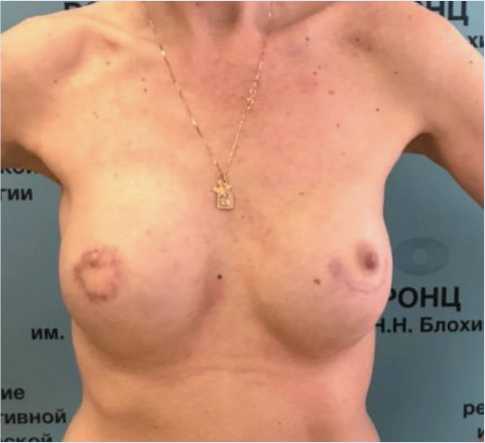
Рис. 6. Пациентка спустя 3 года после проведенного лечения по поводу имплант-асcоциированной инфекции левой молочной железы
Fig. 6. 3 years after treatment for implant-associated infection of the left breast
Через 2 мес от начала антибиотикотерапии клинически отмечена выраженная положительная динамика. При осмотре молочных желез признаков инфекции нет (рис. 5). Общие и биохимические анализы крови без особенностей. При УЗИ не выявлено признаков воспалительной инфильтрации в области реконструированных молочных желез и ранее описанной области воспаления. Побочных эффектов проводимой терапии не отмечалось. Тем не менее в связи с наличием имплантов (факторы риска инфекции) и высоким риском рецидива инфекции принято решение продолжить антибактериальную терапию. Однако сочли целесообразным провести деэскалацию терапии в виде отмены парентеральной терапии даптомицином и цефепимом с переходом на пероральный прием моксифлоксацина 400 мг 1 раз в сут в течение 3 нед. Больная осматривалась еженедельно с оценкой общего и биохимического анализов крови.
Спустя 3 нед случай повторно обсужден на консилиуме. Пациентка чувствовала себя хорошо, не отмечалось признаков инфекции в области реконструированных молочных желез и побочных эффектов лечения. Решено отменить антибактериальную терапию и рекомендовать плановое на- блюдение с контрольным обследованием каждые полгода с оценкой анализов крови и УЗИ. При этом признаков рецидива опухоли и рецидива инфекции не отмечалось. При очередном осмотре через 3 года после лечения: молочные железы мягкие, безболезненные, отека, признаков инфекции нет (рис. 6). При УЗИ-контроле ткань левой молочной железы без воспалительной инфильтрации, жидкости вокруг импланта нет.
Список литературы Инфекционные осложнения после реконструктивных оперативных вмешательств у больных раком молочной железы
- Каприн А.Д, Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2017 году (заболеваемость и смертность). М., 2018. 250 с
- Летягин В.П. Опухоли молочных желез. Маммология. 2005; 1: 14-22
- Зикиряходжаев А.Д., Соболевский В.А., Чистяков С.С., Гребенникова О.П., Крохина О.В., Анурова О.А., Искендеров Р.М., Азимова Р.Б., Шоуа А.Н. Реконструктивная хирургия и реабилитация больных раком молочной железы. РМЖ. Приложение. Онкология. 2011; 2: 42
- Григорьевская З.В., Петухова И.Н., Дьякова С.А., Дмитриева Н.В. Эпидемиология внутрибольничных инфекций в онкологическом стационаре. Сибирский онкологический журнал. 2016; 15(3): 62-66. DOI: 10.21294/1814-4861-2016-15-3-62-66
- Григорьевская З.В., Петухова И.Н., Багирова Н.С., Шильникова И.И., Терещенко И.В., Григорьевский Е.Д., Дмитриева Н.В. Нозокомиальные инфекции у онкологических больных: проблема нарастающей резистентности грамотрицательных микроорганизмов. Сибирский онкологический журнал. 2017; 16(1): 91-97. DOI: 10.21294/1814-48612017-16-1-91-97
- Jagsi R., Jiang J., Momoh A.O., Alderman A., Giordano S.H., Buchholz T.A., Pierce L.J., Kronowitz S.J., Smith B.D. Complications After Mastectomy and Immediate Breast Reconstruction for Breast Cancer: A Claims-Based Analysis. Ann Surg. 2016 Feb; 263(2): 219-27. 10.1097/ SLA.0000000000001177. DOI: 10.1097/SLA.0000000000001177
- Franchelli S., Pesce M., Baldelli I., Marchese A., Santi P., De Maria A. Analysis of clinical management of infected breast implants and of factors associated to successful breast pocket salvage in infections occurring after breast reconstruction. Int J Infect Dis. 2018 Jun; 71: 67-72. DOI: 10.1016/j.ijid.2018.03.019
- Boustany A.N., Elmaraghi S., Agochukwu N., Cloyd B., Dugan A.J., Rinker B. A breast prosthesis infection update: Two-year incidence, risk factors and management at single institution. Indian J Plast Surg. 2018; 51(1): 7-14. DOI: 10.4103/ijps.IJPS_215_17
- Ota D., Fukuuchi A., Iwahira Y., Kato T., Takeuchi M., Okamoto J., Nishi T. Identification of complications in mastectomy with immediate reconstruction using tissue expanders and permanent implants for Breast Cancer patients. Breast Cancer. 2016 May; 23(3): 400-6. 10.1007/ s12282-014-0577-4. DOI: 10.1007/s12282-014-0577-4
- Viola G.M., Selber J.C., Crosby M., Raad I.I.,Butler C.E., Villa M.T,. Kronowitz S.J., Clemens M.W., Garvey P., Yang W., Baumann D.P. Salvaging the Infected Breast Tissue Expander: A Standardized Multidisciplinary Approach. Plast Reconstr Surg Glob Open. 2016 Jun 10; 4(6): e732. DOI: 10.1097/GOX.0000000000000676


