Ингибирующая активность специфических лигандов на различные сайты связывания гликогенфосфорилазы
Автор: Чепляева Н.И., Воробьев Е.С.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Фармакология токсикология
Статья в выпуске: 4 (48), 2015 года.
Бесплатный доступ
Проведено сравнительное исследование активности ингибиторов различных сайтов гликогенфосфорилазы: каталитического сайта, DAB (IC50 - 49,41 мкМ); пуринового сайта, кофеин (IC50 - 720 мкМ) и кверцетина (IC50 - 15,69 мкМ); индолкарбоксамидного сайта, СР-316819 (IC50 - 1,24 мкМ). Помимо этого, выявлено, что ингибиторы двух различных сайтов связывания СР-316819 и кофеин, оказывают синергетический эффект, как в низких, так и в высоких концентрациях.
Сахарный диабет 2-го типа, гликогенфосфорилаза, ингибиторы гликогенфосфорилазы, каталитический сайт, пуриновый сайт, аллостерический амф сайт, индол-связывающий сайт
Короткий адрес: https://sciup.org/142149144
IDR: 142149144 | УДК: 615.31:615.252.349.7
Текст научной статьи Ингибирующая активность специфических лигандов на различные сайты связывания гликогенфосфорилазы
Сахарный диабет (СД) 2-го типа представляет собой заболевание с нарушением углеводного обмена, проявляющийся инсулиноре-зистентностью, нарушением функции поджелудочной железы и повышением продукции глюкозы печенью [2]. Центральную роль в гомеостазе глюкозы выполняет печень, заключающаяся в способности печени контролировать продукцию глюкозы печенью (ПГП) [1]. Повышение продукции глюкозы печенью является одним из ведущих факторов в патогенезе СД и требует дополнительной фармакологической коррекции. Один из основных метаболических процессов, сопровождающихся повышенной ПГП при СД 2-го типа является гликогенолиз. Гликогенфосфори-лаза (ГФ) – ключевой регуляторный фермент в процессе распада гликогена до глюкозы [5, 11].
ГФ является димерным ферментом состоящим из двух субъединиц, каталитически активной формой ГФа и каталитически не активной формой ГФb [10].
У данного фермента существует несколько сайтов связывания для фармакологических лигандов: каталитический сайт; аллостерический сайт АМФ; кофеин-связывающий ингибирующий сайт (связывает пуриновые нуклеозиды); сайт хранения гликогена; индолкарбоксиамидный аллостерический сайт; сайт связывания с бензимидазолами [8, 15].
В результате исследований были выявлены группы соединений и их производные, имеющие ГФ ингибирующую активность к определенному сайту связывания. Например, ингибиторы каталитического сайта представлены соединениями на основе глюкозы [14]. Основными представителями ингибиторами кофеин-связывающего сайта являются пурины, флавоноиды, индирубины, а также кофеин [9], а индолкарбоксиамидного сайта – производные индола [12].
* Исследование выполнено за счет гранта Российского научного фонда (проект № 14-25-00139).
ГФ на данный момент является одной из мишеней для создания новой группы препаратов в терапии СД 2-го типа.
ЦЕЛЬ РАБОТЫ
Апробировать тест системы и сравнить ингибиторы ГФ, выстраивающиеся в различные сайты связывания.
МЕТОДИКА ИССЛЕДОВАНИЯ
В работе были использованы следующие соединения: CP-316819 (Sigma США), кверцетин (Sigma США), 1,4-дидеокси-1,4-имино-D-арабини-тола гидрохлорид (DAB) (Sigma США) и кофеин (Sigma США). Данные вещества были исследованы в диапазона концентрация от 10-4 до 10-7. Для оценки ГФ ингибиторной активности in vitro 100 мкл 50 мМ HEPES буфера с pH 7,2 содержащего 100 мМ хлорид калия, 2,5 мМ хлорид магния, 0,5 мМ глюкозо-1-фосфата (Sigma, США), 1 мг/мл гликогена, преинкубировали с мышечной гликогенфосфорилазой α кролика (Sigma, США) и исследуемыми соединениями при 30 °С 30 минут. После преинкубации количество высвобожденного неорганического фосфата измеряли через 20 минут после добавления 150 мкл 1 М раствора HCl, содержащего 10 мг/мл молибдата аммония и 0,38 мг/мл малахитового зеленого. Развитие окрашивания оценивали при 630 нм, используя прибор для считывания планшетов (Infinite M200, Tecan, Австрия) [17].
Для определения ингибирующей концентрации (IC50) соединения в 14 % ДМСО добавляли в реакционную смесь, при этом в контрольную смесь без ингибитора вносили ДМСО в аналогичной концентрации.
Статистическую обработку данных проводили с использованием U-критерий Манна– Уитни с использованием пакета программ Graphit 4.0.15 (Erithacus Software, Ltd, UK).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Ингибирование гликогенолиза является одним из перспективных фармакологических подходов в терапии СД 2-го типа. ГФ снижает распад гликогена и повышает продукцию глюкозы печенью, а также воздействует на один из основных патогенетических факторов, что позволяет корректировать гипергликемию и не приводит к гипогликемии [3, 4]. В данной работе было проведено исследование соединений ингибиторов ГФ, связывающихся с различными сайтами, кофеин, кверцетин, CP-316819, DAB. Активность данных соединений описана во многих литературных источниках [6, 13], однако изучали их с использованием различных методологических подходов. При выполнении данной работы все соединения исследовались в одной тест системе.
в
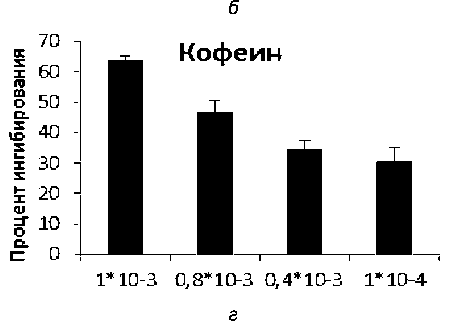
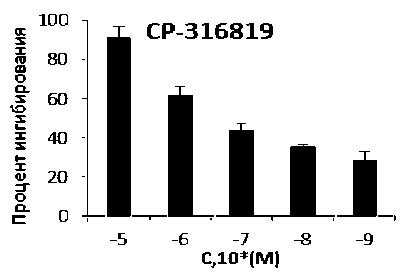
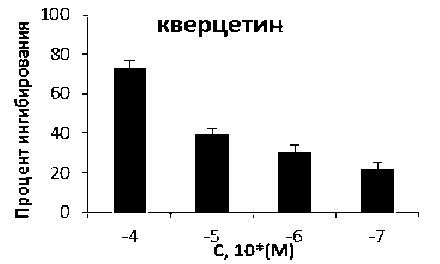
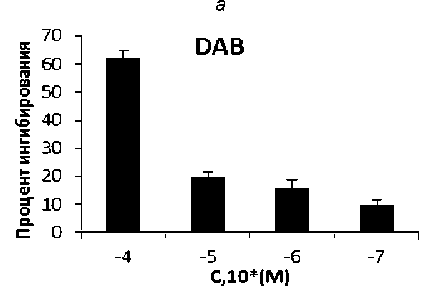
Рис. 1. ГФ ингибирующая активность: а – CP-316819, б – кверцетина, в – DAB, г – кофеина
Одними из перспективных соединений являются производные индол-2-карбоксамидов, ингибиторы индолкарбоксамидного сайта связывания ГФ. Представитель данного класса – CP-316819, который, по литературным данным, снижал уровень глюкозы у мышей с СД 2-го типа, при этом не вызывая гипогликемию, в то же время не влияло на уровень глюкозы у интактных животных. В результате нашего исследования CP-316819 имел IC50 1,24 мкМ (0,37–4,16 мкМ, 95 % C.I.) (рис. 1 а ), что согласуется с ранее полученными результатами (рис. 1) [3].
Помимо этого в нашей работе проверялась ингибирующая активность соединений пуринового сайта связывания, взаимодействие лигандов в данном сайте обуславливается образованием π – π между остатком ароматической боковой цепи Фен 285, 280s петлей и Тир613 [9]. Кофеин является физиологическим лигандом данного сайта, однако демонстрирует низкую афинность к сайту связывания и поэтому активен в милимолярных концентрациях, так IC50 составила 720 мкМ (560–920 мкМ, 95 % C.I.) (рис. 1 г ). Также, по литературным данным, известно, что у ряда флавоноидов выявлена
ГФ ингибирующая активность [17], в том числе и у кверцетина IC50 = 15,69 мкМ (8,12–30,30 мкМ, 95 % C.I.) (рис. 1 б ). Ингибиторы каталитического сайта представлены рядом соединений на основе глюкозы, это связано с контролем метаболизма гликогена глюкозой. Найден ряд ингибиторов среди класса иминосахара, представителем которых является DAB [4].
Данное соединение тормозит гликогенолиз путем прямого ингибирования ГФ. В нашем исследовании DAB продемонстрировало активность и имело IC50 = 49,41 мкМ (31,27–78,07 мкМ, 95 % C.I.) (рис. 1 в ).
В литературе представлены данные синергетического взаимодействия кофеина и соединения W1807, в результате которых было доказано совместное действие двух лигандов [16], поэтому представляет интерес исследовать комбинированные эффекты ингибиторов различных сайтов. В связи с этим следующим этапом данного исследования была проверка на совместное блокирование ГФ физиологическим лигандом пурин связывающего сайта, кофеином и одним из наиболее активных ингибиторов индолкарбоксамидного сайта CP-316819 (рис. 2).
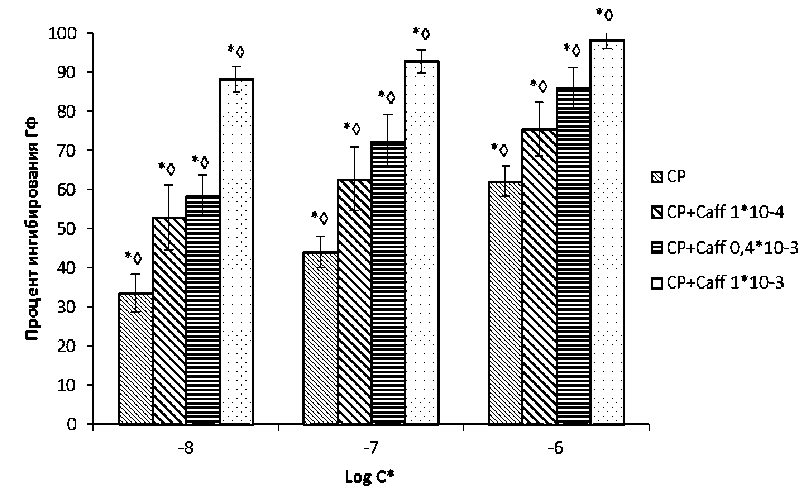
Рис. 2. Синергетический эффект соединений СР-316819 и кофеина:
С* – концентрация (М);
* данные достоверны по отношению к контролю, U-критерий Манна–Уитни (p < 0,05);
◊ данные достоверны по отношению к показателям препарата сравнения, U-критерий Манна–Уитни (p < 0,05)
В результате изучения совместного влияния двух лигандов на различные сайты фермента выявлен синергетический эффект. При добавлении физиологического лиганда кофеина к ингибитору CP-316819 наблюдалось повышение ингибирующей активности, как видно из рис. 2, которое фиксировалось в диапазоне концентраций от 10-8 до 10-6. Так, при сочетании концентраций СР-316919 (1·10-6 М) и кофеина (1·10-3 М) достигался максимальный эффект (98,15 ± 3,23) %.
Помимо этого, суммация активностей ингибиторов сохранялась и в более низких концентрациях. Данный вид исследований ингибиторов ГФ актуален, так как в дальнейшем это позволит комбинировать различные соединения, для достижения максимального эффекта, и воздействие на различные сайты ГФ одновременно повысит эффективность данного класса антидиабетических препаратов и снизить дозировки веществ.
ЗАКЛЮЧЕНИЕ
В результате данной работы было проведено изучение активности ингибиторов ГФ CP-316819, DAB, кофеин и кверцетин. Во второй части исследования показана суммация действия двух ингибиторов различных сайтов связывания в дальнейшем, что позволит уменьшать концентрации веществ для создания новых антидиабетических средств.
Список литературы Ингибирующая активность специфических лигандов на различные сайты связывания гликогенфосфорилазы
- Аметов А. С. Сахарный диабет 2 типа. Проблемы и решения. -ГЭОТАР-Медиа, 2014. -1032 с.
- Балаболкин М. И. Диабетология. -М.: Медицина, 2000.
- Чепляева Н. И., Кузнецова В. А., Спасов А. А. и др.//ВНМЖ. -2014. -Т. 43, № 3. -С. 21-24.
- Andersen B., Westergaard N.//Biochemical. Society. -2002. -Vol. 367. -P. 443-450.
- Hayes J. M., Kantsadi A. L., Leonidas D. D.//Phytochem Rev. -2014. -Vol. 13. -P. 471-498.
- Henderson L C.//BSc (Hons). -2007. -P. 269.
- Jakobs S., Fridrich D., Hofem S., et al.//Mol. Nat. Food Res. -2006. -Vol. 50 -P. 50-57.
- Krimm I., Lancelin J-M., Praly J-P.//J. Med. Chem. -2012. -Vol. 55. -P. 1287-1295.
- Madsen N. B., Shechosky S., Fletterick R. J.//Biochemistry. -1983. -Vol. 22. -P. 4460-4465.
- Newgard C. B., Hwang P. K., Fletterick R. J.//Crit. Rev. Biochem. Mol. Biol. -1989. -Vol. 24. -P. 69-99.
- Oikonomakos N. G.//Curr. Prot. Pept. Sci. -2002. -Vol. 3. -P. 561-586.
- Poucher S. M., Freeman S., Loxham S. J., et al.//Br. J. Pharmacol. -2007. -Vol. 152. -P. 1239-1247.
- Schweikes S. S., Loughlin W. A, Brown C. L., et al.//Journal f Peptide Science. -2009. -Vol. 15. -P. 442-450.
- Somsak L., Kovacs L., Toth M., et al.//J. Med. Chem. -2001. -Vol. 44. -P. 2843-2848.
- Sprang S. R., Withers S. G, Goldsmith E. J., et al.//Science. -1991. -Vol. 254. -P. 1367-1371.
- Tsitsanou K. E., Skamnaki V. T., Oikonomakos N. G.//Archives of Biochemistry and Biophysics. -2000. -Vol. 384. -№. 2. -P. 245-254.
- Yu L. J., Chen Y., Treadway J. L.//J. Pharmacol. Exp. Ther. -2006. -Vol. 317, № 3. -P. 1230-1237.


