Ингибиторы протеасомы в лечении больных множественной миеломой высокого цитогенетического риска
Автор: Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Передовая статья
Статья в выпуске: 2 т.19, 2023 года.
Бесплатный доступ
В последние годы был достигнут значительный прогресс в улучшении выживаемости без прогрессирования (PFS) и качества жизни пациентов с множественной миеломой (MM). Это стало возможным благодаря внедрению в клиническую практику новых препаратов, которые были разработаны на основе мультиомных молекулярно-генетических исследований при ММ. Результаты этих исследований также позволили оценить генетическую гетерогенность опухолевых клеток при ММ. Было показано, что пациенты с ММ могут иметь совершенно разные спектры обнаруженных генетических дефектов в опухоли. Высокая гетерогенность множественной миеломы является одной из основных причин различий в эффективности лекарственных препаратов. Выявленные мутации del(17p), t(4;14), t(14;16), t(14;20), gain 1q или p53 считаются факторами высокого риска при множественной миеломе. В настоящем обзоре всесторонне обсуждается значение некоторых хромосомных аберраций в стратификации риска пациентов с ММ. В нем описываются наиболее распространенные аберрации, а также те, которые связаны с высоким и низким риском раннего прогрессирования ММ и уже были включены в различные международные прогностические шкалы. В статье анализируется эффективность ингибиторов протеасомы при высоком риске множественной миеломы. В частности, приведены результаты многоцентровых клинических исследований эффективности иксазомиба в комбинации с леналидомидом, помалидомидом, дексаметазоном. Представлены данные пациентов с MM из исследований TOURMALINE-MM1/-MM2/-MM3/-MM4 по оценке преимущества иксазомиба плюс леналидомид-дексаметазон (Rd) против плацебо-Rd (TOURMALINE-MM1/-MM2) или иксазомиба против плацебо (TOURMALINE-MM3/-MM4) при высоком риске. Терапия иксазомибом обратила внимание на отчетливое увеличение медианы выживаемости без прогрессии у пациентов с цитогенетическими аномалиями высокого риска и цитогенетическими нарушениями сверхвысокого риска по сравнению с подгруппами стандартного риска.
Иксазомиб, рецидивы/рефрактерные формы множественной миеломы, беспрогрессивная выживаемость, высокий риск, стандартный риск
Короткий адрес: https://sciup.org/170199855
IDR: 170199855
Текст научной статьи Ингибиторы протеасомы в лечении больных множественной миеломой высокого цитогенетического риска
За последние два десятилетия терапевтические стратегии множественной миеломы (ММ) значительно продвинулись. Это стало возможным благодаря внедрению в клиническую практику новых препаратов, в частности ингибиторов протеасомы, которые были разработаны на основе мультиомных молекулярно-генетических исследований. Результаты этих исследований также позволили оценить генетическую гетерогенность опухолевых клеток при ММ, что позволило выявить типы и распространенность однонуклеотидных вариаций, структурных хромосомных аберраций и аномальных копий хромосом в геноме злокачественных плазматических клеток [13]. Не подлежит сомнению то, что ингибиторы про-теасомы стали краеугольным камнем терапии ММ [4]. Их применение, причем до прогрессии, привело к улучшению долгосрочных результатов по сравнению с терапией фиксированной длительности [5-7]. Однако, несмотря на достигнутые явно позитивные результаты, исходы пациентов с ММ зависят от ряда прогностических факторов, включая цитогенетический риск. Действительно, выживаемость пациентов с определенными цитогенетическими аномалиями, как правило, остается низкой [2,8].
ММ характеризуется выраженной геномной гетерогенностью, обусловленной множеством численных и структурных изменений хромосом, которые играют ключевую роль в онкогенезе, приводя к генному дисбалансу, изменению структуры и функции генов и впоследствии – к нарушению регуляции клеточного цикла и дифференцировки клеток.
Первичными событиями являются транслокации хромосом с участием локуса тяжелой цепи иммуноглобулина (IgH) и гипердиплоидии с несколькими копиями нечетных хромосом. Частота перестроек с вовлечением локуса гена IgH/14q32 от 40 до 50%. Участвующими партнерскими хромосомами/ло-кусами являются: 4p16 (FGFR3/MMSET) (12-15%), 11q13 (CCND1) (15-20%), 16q23 (MAF) (3%), 6p21 (CCND3) (<5%) и 20q11 (MAFB) (1%) [3].
Транслокации t(11;14)(q13;q32), t(6;14)(р21;q32) рассматриваются в качестве факторов стандартного риска, при которых медиана общей продолжительности жизни больных составляет 8-10 лет [9], тогда как t(4;14)(р16;q32), t(14;16) (q32;q23), t(14;20) (q32;q12) являются факторами неблагоприятного прогноза ММ. Медиана общей продолжительности жизни этих больных варьирует от 14,4 до 30,1 мес. [10].
Цитогенетические аномалии, существенно ухудшающие прогноз ММ, (t(4;14), del(17/17p), t(14;16), t(14;20), негипердиплоидия и цепь (1q)), в 2016 году включены Международной рабочей группой по изучению миеломы (IMWG) в определение высокого риска [11]. Транслокация t(4;14) приводит к дерегуляции рецептора фактора роста фибробластов 3 (FGFR3) и домена SET миеломы (MMSET) [12]. Поскольку FGFR3 не экспрессируется у одной трети пациентов с t(4;14), геном-мишенью, скорее всего, является MMSET [13]. Транслокация t(4;14) связана с ухудшением беспрогрессивной и общей выживаемости (PFS/OS) [14]. Использование высокодозной терапии и аутологичной трансплантации гемопоэтических стволовых клеток (АутоТГСК) значимо снижает негативное влияние t(4;14) и увеличивает выживаемость пациентов [15].
Транслокация t(14;16) нарушает регуляцию протоонкогена c-MAF и прогнозирует плохой исход ММ [16]. Однако в одном из крупных исследований IFM неблагоприятного воздействия t(14;16) на прогноз ММ не выявлено, возможно, потому, что 60 % пациентов, вошедших в это исследование, получали тандемную АутоТГСК, что, кстати, указывает на пользу тандемной трансплантации у этой категории больных [17]. Транслокация t(14;20) приводит к дисрегу-ляции онкогена MAFB, что также ухудшает прогноз множественной миеломы [18].
Транслокация t(11;14) участвует в регуляции ци-клина D1 и ее выявление свидетельствует о благоприятном прогнозе ММ [14] Эта транслокация связана с экспрессией CD20 и лимфоплазмоцитарной морфологией. Гипердиплоидия, которая обнаруживается в ∼50 % случаев впервые выявленной множественной миеломы, связана с улучшением PFS/OS [12] В исследовании MRC IX сосуществующая гипер-диплоидия не повлияла на течение множественной миеломы [19]. В целом t(6;14), t(11;14), gain(5q) и гипердиплоидия указывают на стандартный риск множественной миеломы.
Среди вторичных, появляющихся в ходе опухолевой трансформации, перестроек хромосом при ММ наиболее часто выявляются делеция локуса 13q14/ моносомия 13 (-13/13q-), амплификация локуса 1q21 (amp1q21), делеция 17р13 c потерей гена ТР53 (del17p13/TP53) и транслокация с вовлечением локуса гена cMYC/8q24 (t(8q24)/ cMYC) [20].
Амплификация 1q21 является одним из наиболее распространенных хромосомных нарушений при ММ и связана с прогрессирующим течением заболевания. Амплификация 1q21 часто обнаруживается с del(1p32), что ухудшает негативное влияние на прогноз [21].
Моносомия 13, или делеция локуса 13q14, встречается примерно в 45% случаев и длительное время считалась фактором неблагоприятного прогноза. Однако разработка новых лекарственных препаратов изменила ситуацию. Было установлено, что неблагоприятное воздействие del(13q) наблюдается только в случае одновременного выявления del(17p) и t(4;14), в то время как единственное хромосомное нарушение в группе больных, получающих современные таргетные препараты, она не ухудшает выживаемость больных ММ [22,23].
Пациенты с ≥3 копиями 1q имеют худший исход лечения, отражающий действие таких генов, как CKS1B. В целом комбинации c ≥3 хромосомными на- рушениями относят к ультра- (сверх) высокому риску с выживаемостью <2 лет [24].
Транслокации t(4;14), t(14;16), t(14;20) и del(17/17p) и любой негипердиплоидный кариотип свидетельствуют о высоком цитогенетическом риске ММ независимо от лечения. В современной модели стратификации риска при ММ учитываются показатели ISS, неблагоприятные хромосомные аномалии и высокая активность ЛДГ [25,26]. Хромосомные нарушения могут отличаться в первом и более позднем рецидиве из-за клональной эволюции, которая может повлиять на эффективность лечения. Например, амплификация 1q21 и делеция 1p чаще выявляется у больных с рецидивов, чем у вновь диагностированных пациентов.
Высокая гетерогенность ММ является одной из основных причин различий в эффективности лекарственных препаратов. Пациенты с ММ могут иметь совершенно разные спектры обнаруженных генетических дефектов в опухоли.
Среди врачей существует общий консенсус в отношении того, что лечение ингибиторами протеа-сомы приносит пользу пациентам с цитогенетическими аномалиями высокого риска. Действительно, установлено, что бортезомиб, похоже, улучшает негативное прогностическое воздействие t(4;14) [27]. В IFM-2005-01, при использовании протокола борте-зомиб/дексаметазон, наблюдались более высокие показатели ответа и общей выживаемости (OS) по сравнению с триплетом винкристин/доксоруби-цин/дексаметазон (VAD). В другом исследовании эта комбинация привела к улучшению бессобытий-ной и общей выживаемости пациентов с t(4;14), но не улучшила результаты лечения больных с del(17p) (4-летняя OS = 50 % против 79 %). В то же время, в крупном исследовании HOVON65/GMMG-HD4 индукционная и поддерживающая терапия на основе бортезомиба показали улучшенный исход для пациентов с del(17p) в сравнении с группой больных, получавших терапию без включения бортезомиба (медиана PFS = 26 против 12 мес., P = 0,024); 3-летняя OS = 69 % против 17 %, (P = 0,028).
По результатам многофакторного анализа установлено, что бортезомиб-содержащие режимы терапии существенно снижают негативное влияние del(17p13) на беспрогрессивную выживаемость (PFS) (P <0,0001) и OS (P <0,0001) больных ММ, в то время как режимы терапии без бортезомиба не оказывали статистически значимого влияния на PFS (P = 0,28) или OS (P = 0,2) [28]. Напротив, в исследовании GEM 2005 индукционная терапия по схеме бортезомиб/талидомид/дексаметазон (VTD) с последующей АутоТГСК и поддерживающей терапией бортезомибом не улучшила общую выживаемость при высоком риске [29]. Между тем, группа GIMEMA сравнила эффективность двух схем – VTD и TD (бортезомиб/дексаметазон ± талидомид). Все больные, участвовавшие в этом, исследовании, по- лучали ту или иную программу в индукции с последующей тандемной АутоТГСК и консолидацией. В подгруппе больных с t(4;14) OS составила 69 % vs 37 % в пользу VTD против 74 % vs 63 % без t(4;14) и/или del(17p) [30]. И, наконец, метаанализ 4 рандомизированных клинических исследований показал, что посттрансплантационный полный + близкий к полному ответ среди больных, получавших бортезо-миб, был сходным при высоком (del(17p) + t(4;14)) и стандартном цитогенетическом риске [31].
Что касается лечения пожилых пациентов с ММ, то по результатам исследования VISTA, комбинация MP + бортезомиб (VMP) не оказала никакого влияния на общую выживаемость при высоком риске в сравнении со стандартным риском (OS = 56 % vs 71 %) [32]. Более того, по данным клинического исследования Pethema, в котором сопоставлялась эффективность VMP (бортезомиб/мелфалан/преднизо-лон) с VPT (бортезомиб/преднизолон/талидомид) с последующей поддерживающей терапией борте-зомибом или талидомидом, при высоком риске PFS и OS были короче, чем при стандартном риске [33].
Таким образом, представленные данные по влиянию бортезомиба на хромосомные аномалии высокого риска разноречивы. Тем не менее существуют убедительные доказательства тому, что бортезомиб в группе пациентов, подходящих для АутоТГСК, частично преодолевает неблагоприятное воздействие t(4;14) и, возможно, del(17p). У пациентов, не являющихся кандидатами на АутоТГСК, подобного эффекта при выявлении t(4;14) в сочетании с del(17p) не наблюдается.
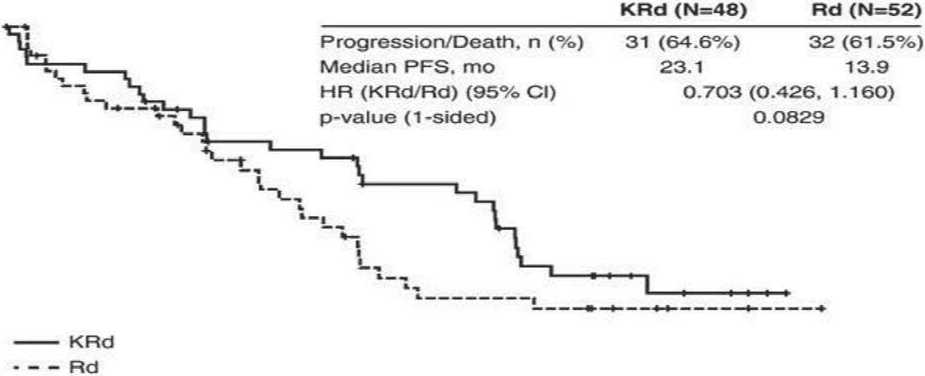
Карфилзомиб в монорежиме не улучшал PFS/OS у больных с рецидивами/рефрактерными формами ММ (РРММ) с t(4;14) или del(17p) [34]. Однако при применении карфилзомиба в комбинации с помали-домидом и дексаметазоном PFS и OS при высоком и стандартном риске у больных РРММ были сходными [35]. Показательным является исследование фазы III ASPIRE, по результатам которого выживаемость без прогрессии (PFS) при РРММ значительно улучшилась в группе пациентов, получавших карфилзо-миб/леналидомид/дексаметазон (KRd) по сравнению с леналидомидом и дексаметазоном (Rd) [36]. Из 417 пациентов, с известным цитогенетическим статусом риска, 100 пациентов (24 %) были классифицированы как высокий риск (KRd, n = 48; Rd, n = 52), а 317 (76 %) – стандартный риск (KRd, n = 147; Rd, n = 170). При высоком цитогенетическом риске лечение по схеме KRd увеличило медиану PFS на 9 мес. по сравнению с лечением Rd. У пациентов со стандартным цитогенетическим риском прибавка PFS, в группе KRd в сравнении с Rd, составила 10 мес. (рисунок 1).
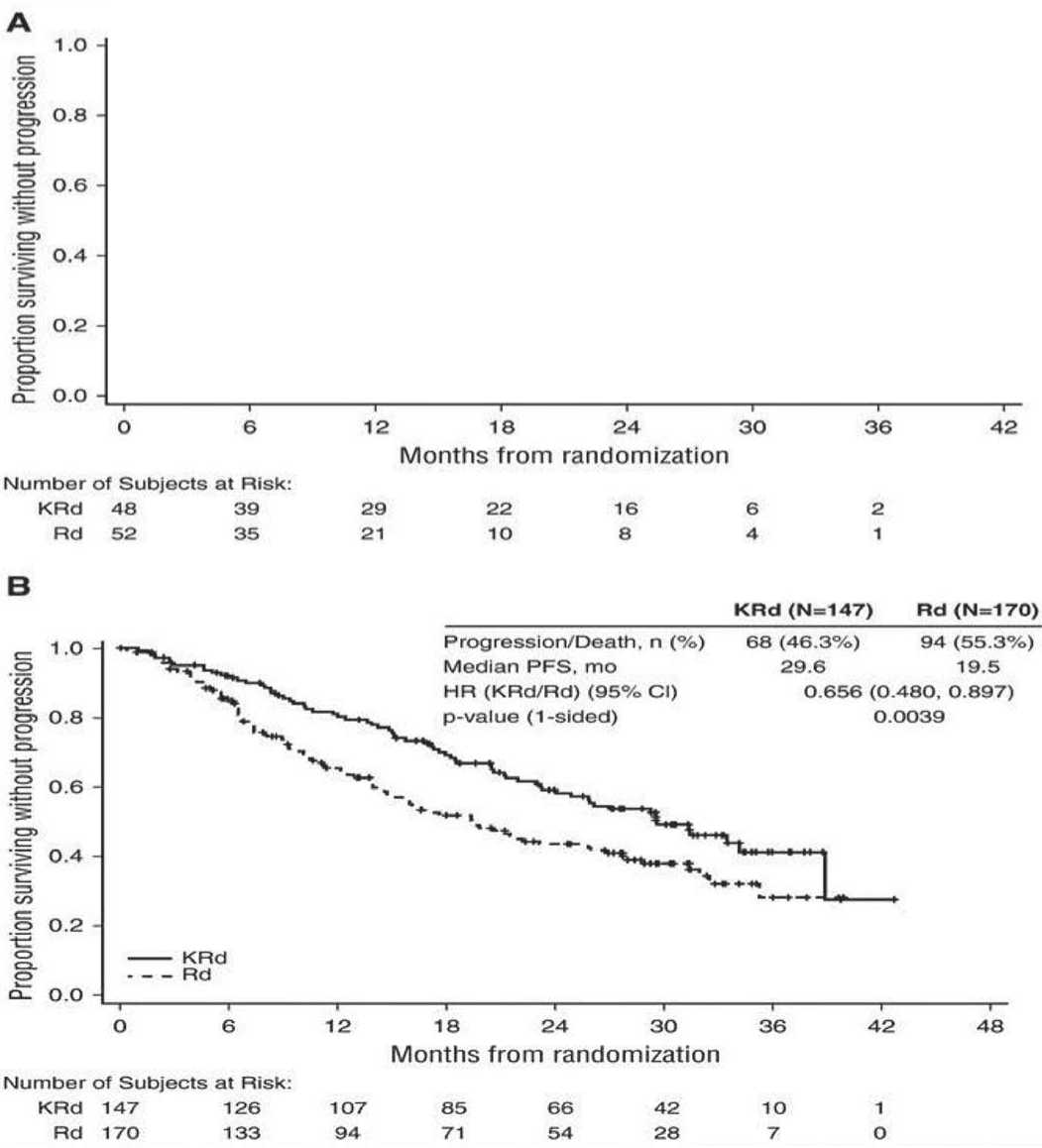
Рис. 1. Оценка Каплана-Мейера PFS по статусу цитогенетического риска на базовом уровне. (A) Пациенты в подгруппе высокого риска (верхняя кривая при использовании KRd, нижняя – Rd). (B) Пациенты в подгруппе стандартного риска (верхняя кривая при использовании KRd, нижняя – Rd). Примечание. По вертикали – беспрогрессивная выживаемость, по горизонтали – месяцы от рандомизации.
Эффективность пероральной терапии на основе иксазомиба против плацебо при высоком риске продемонстрирована в ряде исследований фазы III [3741].
В клиническом исследовании TOURMALINE-MM1 участвовали пациенты с рецидивирующей, рефрактерной или рецидивирующей и рефрактерной множественной миеломой (РРММ) с высоким цитогенетическим риском. Пациенты, получавшие иксазомиб плюс леналидомид-дексаметазон (Ixa-Rd), имели аналогичную выживаемость без прогрессирования (PFS) с цитогенетикой стандартного риска по сравнению с пациентами, получившими плацебо-Rd [37]. Медианы PFS в группах высокого и стандартного риска (21,4 мес. и 20,6 мес.) мало различались. У пациентов с del(17p) и с изолированной t(4;14) или t(14;16) наблюдалось сходное преимущество Ixa-Rd vs placebo-Rd в отношении PFS. Медиана выживаемости без прогрессирования в подгруппе пациентов с del(17p) на иксазомибе превысила таковую в группе плацебо на 1 год и составила 21,4 мес. vs 9,7 мес. соответственно (отношение рисков HR = 0,60), а в подгруппе пациентов с t(4;14) без del(17p) или t(14;16) без del(17p) – практически на 6 мес. (18,5 месяца и 12,0 мес., HR = 0,65). Преимущество в отношении PFS в группе Ixa-Rd по сравнению с placebo-Rd было устойчивым при анализе различных пороговых значений для положительных результатов del(17p) и t(4;14). То есть, добавление иксазомиба к Rd существенно нивелировало повышенный риск, создаваемый неблагоприятными цитогенетическими аномалиями. Наряду с беспрогрессивной выживаемостью, пациенты с высоким, а также сверхвысоким цитогенетическим риском продемонстрировали преимущества Ixa-Rd по сравнению с плацебо-Rd по результатам финального анализа общей выживаемости (HR <1) [38].
Аналогичным образом, в исследовании TOURMALINE-MM2 было показано, что пациенты с впервые диагностированной множественной миеломой (ВДMM) с цитогенетикой высокого риска, получавших Ixa-Rd, имели лучшие показатели PFS по сравнению с плацебо-Rd [39]. Так, в группе больных ММ на Ixa-Rd или placebo-Rd при высоком цитогенетическом риске медиана PFS (mPFS) составила 23,8 против 18,0 месяцев (HR = 0,690; P = 0,019) соответственно.
В последнее время иксазомиб стал успешно применяться в поддерживающей терапии, и эксперты NCCN рекомендуют его как молодым, так и пожилым пациентам с ММ, особенно в группе высокого риска [NCCN Clinical Practice Guidelines in Oncology. Multiple Myeloma. Version 4.2022 — December 14, 2021]. Установлено, что иксазомиб эффективно работает в поддерживающей терапии при высоком цитогенетическом риске. Так, в клиническом исследовании TOURMALINE-MM3 выявлено что среди больных с высоким цитогенетическим риском, применение иксазомиба в поддерживающей терапии как после аутологичной трансплантации гемопоэтических клеток (АутоТГСК), так и терапии, не содержащей АутоТГСК, отдаленные результаты гораздо лучше по сравнению с плацебо [40] и TOURMALINE-MM4 [41]. В исследовании, в группе пациентов с высоким цитогенетическим риском, доля пациентов, достигших 24 мес. PFS, была численно выше в группе икса-зомиба по сравнению с группой плацебо (оценка Каплана-Мейера 46 % по сравнению с 24 %). Обращало на себя внимание важное для практической медицины обстоятельство, а именно, беспрогрессивная выживаемость увеличилась на фоне поддерживающей терапии иксазомибом по сравнению с группой плацебо как у пациентов, ранее не получавших ингибиторы протеасом (p = 0,038), так и у пациентов, получавших их (p = 0,011) [41].
Определение определенных цитогенетических аномалий позволяет выявить пациентов высокого риска, но не все пациенты с высоким риском демонстрируют одинаковый ответ на терапию, и эффективность доступных вариантов лечения варьируется в зависимости от наличия конкретных цитогенетических аномалий [11]. Поэтому подходы к лечению должны основываться на оценке индивидуальных цитогенетических маркеров [43]. В настоящее время клинические испытания, оценивающие реакцию на ММ-терапию с учетом конкретных цитогенетический аномалий, ограничены [43,44], поэтому эксперты IMWG заявили, что анализ цитогенетических подгрупп в клинических исследованиях, сравнивающих различные методы лечения – важная цель [11].
Весьма важным представляется анализ эффективности иксазомиба с учетом индивидуальных цитогенетических маркеров по результатам четырех клинических исследований TOURMALINE (TOURMALINE-MM1, -MM2, -MM3 и -MM4), проведенный Wee-Joo Chung et al. [45]. Авторы оценили связь между PFS и индивидуальным цитогенетическим риском, причем попытались выяснить, получают ли такие пациенты с ММ пользу от терапии на основе иксазомиба [45]. Наряду с данными четырех рандомизированных плацебо-контролируемых испытаний фазы III, в анализ были включены результаты двух лечебных вмешательств. В TOURMALINE-MM1 (NCT01564537), -MM2 (NCT01850524), -MM3 (NCT02181413) и -MM4 (NCT02312258) участвовали взрослые пациенты зарегистрированные в 147, 157, 167 и 187 медицинских центрах из 26, 8, 30 и 34 стран соответственно [37,39-41]. Оцениваемые пациенты были разделены на подгруппы с учетом выявления одной или нескольких цитогенетических аномалий. Обнаружение del(17p) и/или t(4;14) и/или t(14;16) было классифицировано как «высокий риск», а пациенты с аномалиями высокого риска ≥1 и/или amp1q21 были классифицированы как «сверхвысокий риск». При отсутствии этих ге- нетических аномалий доступных для тестирования, больных относили к группе стандартного риска. Если цитогенетические аномалии были не известны, не определены или отсутствовали, пациент считался неклассифицируемым. Всего в анализ было включено 2247 пациентов, при этом у 497 (22 %) больных выявлены аномалии, характерные для высокого риска, а у 1750 (78 %) – стандартного риска (таблица 1). Из них 270 из 497 (54 %) пациентов и 958 из 1750 (55 %) пациентов получили терапию на основе иксазомиба в подгруппах высокого риска и стандартных рисков соответственно (таблица 1). Расширенная цитогенетика высокого риска (цитогенетические аномалии высокого риска и/или amp1q21) можно было оценить в общей сложности у 2098 пациентов (таблица 1). Из них 555 из 1143 (49 %) пациентов, получавших терапию на основе икса-зомиба, и 479 из 955 (50 %) пациентов, получавших терапию на основе плацебо, имели цитогенетические аномалии высокого риска ≥1 и/или amp1q21 и были классифицированы как сверхвысокий (расширенный) риск (таблица 1). Соответственно 588 (51 %) и 476 (50 %) пациентов, получавших иксазо-миб- и плацебо-терапию, были классифицированы как стандартный риск. Медиана последующего наблюдения в объединенном анализе составила 25,6 месяца (12,7, 54,6, 29,7 и 21,3 месяца в TOURMALINE-
MM1, TOURMALINE-MM2, TOURMALINE-MM3 и TOURMALINE-MM4 соответственно).
Таблица 1
|
Больные, n (%) |
del(17p), t(4;14) и t(14;16) (n=2247) |
del(17p), t(4;14) t(14;16) и amp1q21 (n=2098) |
||||||
|
Иксазомиб-содержащие (n=1228) |
Плацебо-содержащие (n=1019) |
Иксазомиб-содержащие (n=1143) |
Плацебо-содержащие (n=955) |
|||||
|
Высокий риск |
Стандартный риск* |
Высокий риск |
Стандартный риск* |
Сверхвысокий риск |
Стандартный риск* |
Cверх-высокий риск |
Стандартный риск* |
|
|
TOURMAL INE-MM1 |
75 |
200 |
62 |
216 |
155 |
122 |
154 |
126 |
|
TOURMAL INE-MM2 |
60 |
231 |
63 |
234 |
134 |
164 |
146 |
153 |
|
TOURMAL INE-MM3 |
61 |
252 |
54 |
152 |
116 |
154 |
88 |
89 |
|
TOURMAL INE-MM4 |
74 |
275 |
48 |
190 |
150 |
148 |
91 |
108 |
|
Всего |
270 (22) |
958 (78) |
227 (22) |
792 (78) |
555 (49) |
588 (51) |
479 (50) |
476 (50) |
Характеристика больных с учетом цитогенетического риска и программ лечения
Примечание. * - В группу стандартного риска вошли пациенты с неклассифицируемым риском (комплементарный стандартный риск).
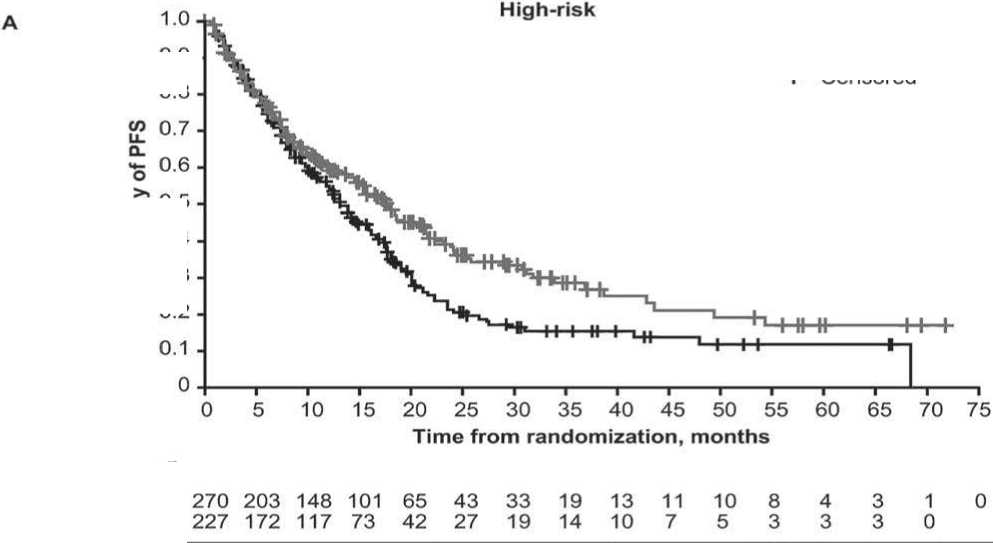
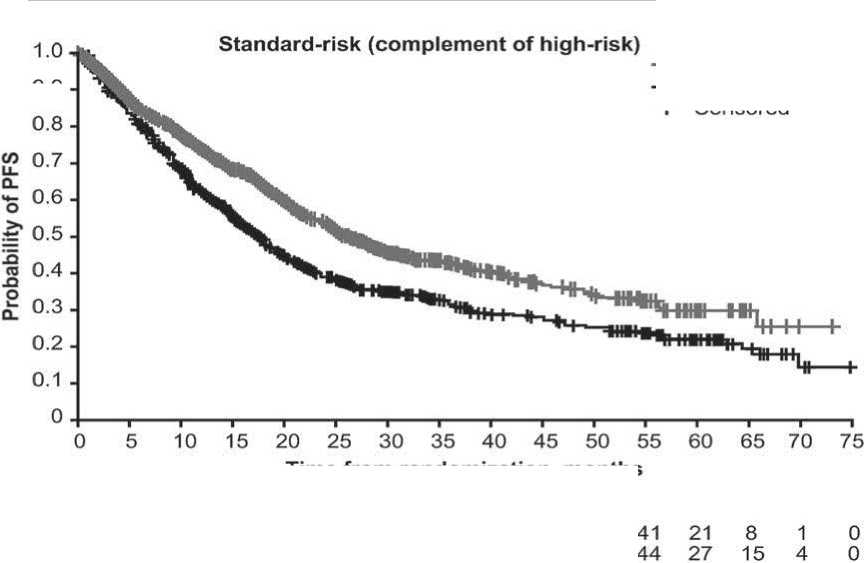
Установлено, что в подгруппах пациентов высокого риска с иксазомиб- и плацебо-терапией, mPFS составила 17,8 против 13,2 мес. (HR = 0,74, CI 95 %: 0,59–0,93; p = 0,0086) Для пациентов подгруппы стандартного риска медиана PFS была выше и составила 26,3 против 17,6 мес. соответственно (HR=
0,70, 95 % CI: 0,62–0,80; p = 0,0001) (рис. 2А и 2B). В подгруппах сверхвысокого риска медиана PFS составила 18,1 мес. для пациентов, получавших терапию на основе иксазомиба и 14,1 мес. – плацебо-режим (HR= 0,75, 95 % CI: 0,64–0,87; p = 0,0002).
— Ixazomib-based
— Placebo-based
+ Censored
0.4
0.3
Patients at risk, n
Ixazomib-based
Placebo-based re n о
0.9 -
0.8
0.5
0.2
|
Events |
Median PFS, months |
HR (95% Cl) |
Log-rank p value |
||
|
Patients |
Ixazomib-based |
150 |
17.8 |
0.74 |
0.0086 |
|
Placebo-based |
156 |
13.2 |
(0.59-0.93) |
||
В
— Ixazomib-based
— Placebo-based
+ Censored
Patients at risk, n
Ixazomib-based
Placebo-based
Time from randomization, months
359 265 171 118 84 66 56
217 163 120 96 76 69 60
0.9
|
Events |
Median PFS, months |
HR (95% Cl) |
Log-rank p value |
||
|
Patients |
Ixazomib-based |
428 |
26.3 |
0.7 |
0.0001 |
|
Placebo-based |
450 |
17.6 |
(0.62-0.80) |
||
Рис. 2. Беспрогрессивная выживаемость по Kaplan–Meier у больных ММ высокого и стандартного риска, получавших иксазомиб-содержащие (Ixazomib-based) или плацебо-содержащие (placebobased) схемы терапии. A - высокий риск (High-risk), B – стандартный риск (комплементарный – Standart-risk- (complement of high-risk)). CI – доверительный интервал, HR – отношение шансов, PFS – беспрогрессивная выживаемость.
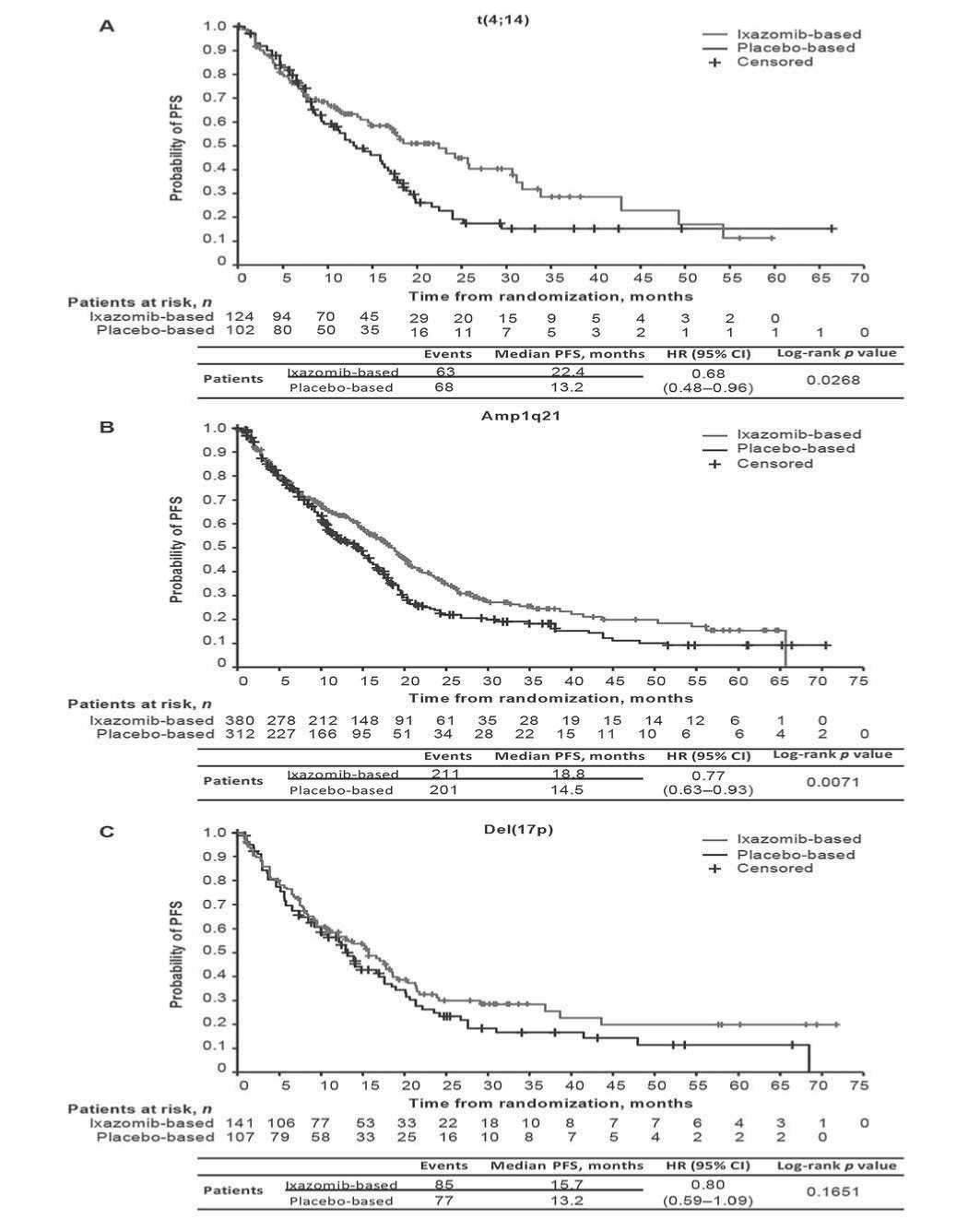
Рис. 3. Беспрогрессивная выживаемость по Kaplan–Meier у больных ММ с учетом специфических цитогенетических аномалий, получавших терапию на основе иксазомиба vs placebo. A - t(4;14), B -amp1q21, C - del(17p). CI - доверительный интервал, HR - отношение шансов, PFS – выживаемость свободная от прогрессии.
Далее была проанализирована беспрогрессивная выживаемость с учетом индивидуальных цитогенетических факторов риска. У пациентов с t(4;14) медиана PFS, при использовании иксазомиба против плацебо, составила 22,4 мес. против 13,2 мес. (HR = 0,68, 95% CI: 0,48–0,96; p = 0,0268 (рисунок 3A), а для пациентов с amp1q21 – 18,8 мес. против 14,5 мес. (HR= 0,77, 95 % CI: 0,63–0,93; p = 0,0071) (рис. 3B). Наиболее низкие, но сходные значения беспро-грессивной выживаемости зарегистрированы среди пациентов основной и контрольной подгруппах с del(17p). Медиана PFS больных с иксазомиб- и плацебо-терапией составила 15,7 и 13,2 мес. (HR = 0,80, 95 % CI: 0,59–1,09; p = 0,1651 (рис. 3C).
Таким образом, наиболее отчетливо положительное воздействие иксазомиб по сравнению с плацебо оказывает на t(4;14) (разница по медиане PFS более 9 мес.), промежуточное – на amp1q21 (разница более 4 мес.) и умеренное на del(17p) (разница 2,5 мес.).
Чтобы оценить влияние del(17p) на исходы независимо от лечения, проанализировали PFS в соответствии с наличием del(17p) и стандартного риска у пациентов, получивших только плацебо-терапию. Медиана PFS составила 17,6 против 13,2 мес. (HR = 0,69, 95 % CI: 0,54–0,88; p = 0,0023), то есть разница 4,4 мес. Для анализа у пациентов с t(14;16) было только 11 событий у 16 пациентов, получающих терапию на основе иксазомиба, и 14 событий у 23 пациентов, получающих плацебо-терапию; медиана PFS составила 11,4 и 15,9 мес. соответственно (HR= 1,21; 95 % CI: 0,55-2,69; p = 0,634).
Был проведен анализ чувствительности PFS; отношение рисков в группах с иксазомиб- и плацебо-терапией составило 0,71 (95 % CI: 0,57–0,89; p = 0,0033) и 0,68 (95 % CI: 0,59–0,77; p = 0,0001) для пациентов с цитогенетическими аномалиями высокого риска. Сходные значения получены для пациентов в подгруппе сверхвысокого риска (HR = 0,70, 95 % CI: 0,60–0,82; p = 0,0001) и стандартного риска (HR=0,67 (95 % CI: 0,55–0,80; p = 0,0001). У пациентов с del(17p), t(4;14) и amp1q21 HR для PFS пациентов на терапии иксазомибом и плацебо составляло 0,75, 0,67 и 0,72.
Кроме того, был проведен анализ беспрогрес-сивной выживаемости больных с цитогенетическими аномалиями высокого риска, находящихся на комбинированной терапии Ixa-Rd (TOURMALINE-MM1 и TOURMALINE-MM2) по сравнению с монорежимом иксазомиба в поддерживающей терапии (TOURMALINE-MM3 и TOURMALINE-MM4). У пациентов с цитогенетическими аномалиями высокого риска отношение шансов для PFS с иксазо-миб- и плацебо-терапией в TOURMALINE-MM1 и TOURMALINE-MM2 (комбинация Ixa-Rd) составило 0,64 (95 % CI: 0,46-0,89; p = 0,007). В TOURMALINE-MM3 и TOURMALINE-MM4 (поддерживающая терапия иксазомибом), HR составило 0,83 (95% CI: 0,61-1,13; p = 0,2456). Медиана PFS для пациентов, получающих иксазомиб в комбинации с Rd против поддерживающей терапии иксазомибом, составила 21,4 против 14,8 мес. (рисунок 4). Для пациентов, получающих плацебо-режимы, медиана PFS составила 12,9 против 13,2 мес. для комбинированной и одноагентной терапии. Для пациентов в подгруппе стандартного риска HR для PFS с иксазомиб- и плацебо в исследованиях TOURMALINE-MM1 и TOURMALINE-MM2 составило 0,74 (95 % CI: 0,6–0,9; p = 0,0029), а в TOURMALINE-MM3 и TOURMALINE-MM4 – 0,62 (95 % CI: 0,52–0,74; p <0,0001).
В целом в когортах больных, получавших триплет Ixa-Rd, по сравнению с одноагентной терапией в поддержке, медиана PFS составила 35,3 против 24,1 мес., а для пациентов, получающих соответствующий плацебо-режим, медиана PFS равнялась 19,4 против 14,7 мес. соответственно.
Таким образом, анализ четырех исследований фазы III TOURMALINE продемонстрировал преимущество PFS при терапии на основе иксазомиба независимо от наличия специфических неблагоприятных цитогенетических аномалий у пациентов с ММ. Терапия на основе иксазомиба продлила медиану беспрогрессивной выживаемости по сравнению с плацебо-терапией для пациентов с высоким риском. Причем обнаружено сходство между подгруппами пациентов с высоким риском (HR= 0,74) и сверхвысоким риском (HR = 0,75) и соответствующими дополнительными подгруппами стандартного риска (HR = 0,70 и 0,71). Подчеркнем, что в TOURMALINE-MM1 медиана PFS при применении иксазомиба в сочетании с Rd увеличилась до аналогичного уровня пациентов со стандартным цитогенетическим риском, т.е., по сути, иксазомиб преодолел высокий риск, что существенно улучшило прогноз для пациентов с РРММ с цитогенетикой высокого риска [48]. Кроме того, значимое увеличение общей выживаемости наблюдалось у пациентов с высоким и сверхвысоким цитогенетическим риском, получавших иксазомиб в сочетании с Rd [38].
С практической точки зрения, важным представляется то, что в подгрупповом анализе специфических цитогенетических аномалий было продемонстрировано бо́льшее преимущество PFS при терапии иксазомибом для пациентов с цитогенетическими аномалиями t(4;14) и amp1q21. Однако в целом иксазомиб в сочетании с Rd или в качестве поддерживающей терапии не отменяет негативного воздействия цитогенетических аномалий высокого риска, что согласуется с ранее сообщенными результатами применения иксазомиба у пациентов с впервые выявленной ММ, не подлежащих Ау-тоТГСК (TOURMALINE-MM2) [39]), у пациентов, получающих иксазомиб в поддерживающей терапии (TOURMALINE-MM3 [40] и TOURMALINE-MM4 [41]), и результатами реальной клинической практики [46,47].
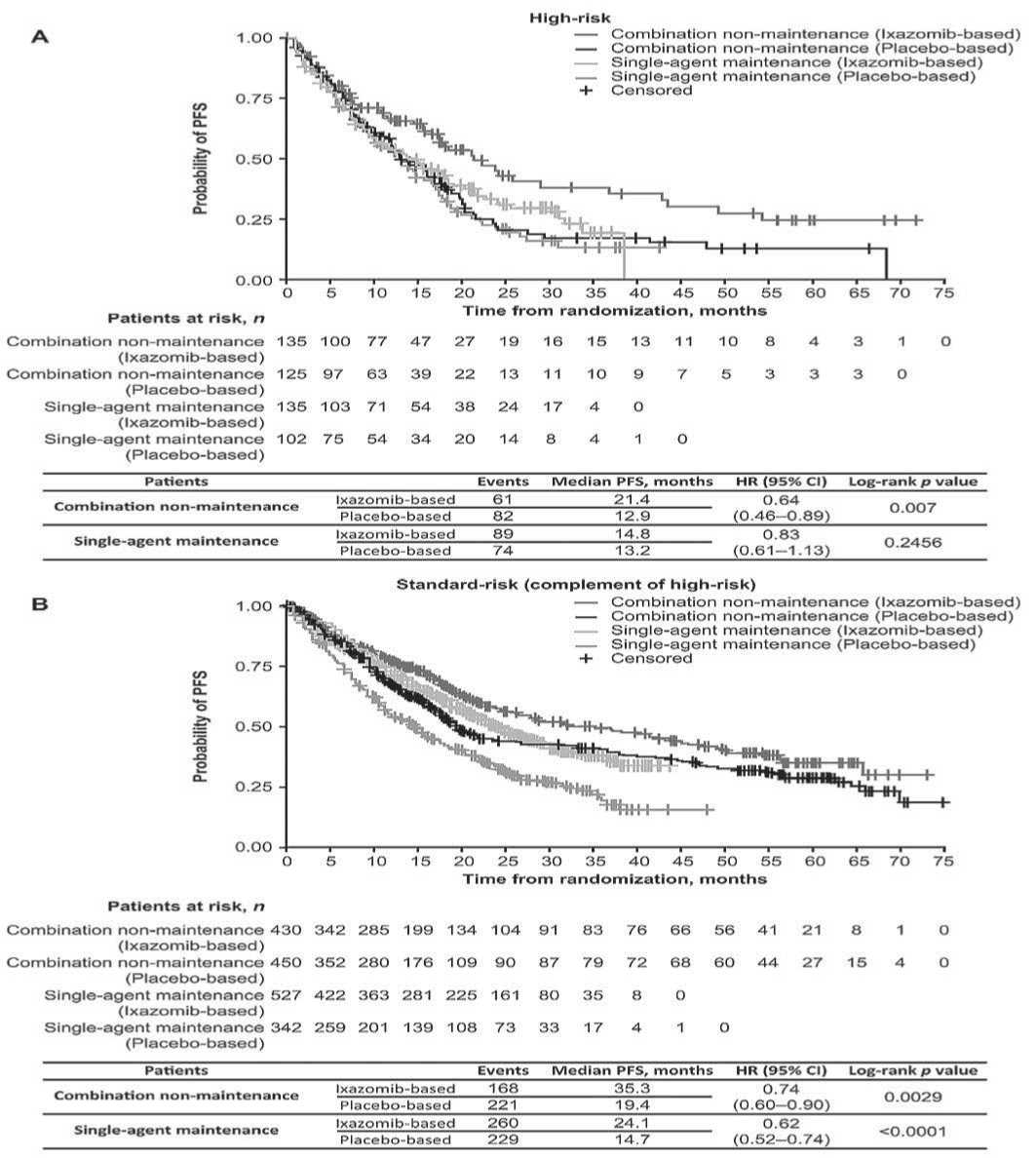
Рис. 4. Оценка беспрогрессивной выживаемости (PFS) по Kaplan–Meier для группы больных высокого или стандартного риска, получавших иксазомиб- или плацебо терапию.
Примечание. A – высокий цитогенетический риск, B – стандартный риск (комплементарный). CI – конфиденциальный интервал, HR – отношение рисков, PFS – беспрогрессивная выживаемость. Combination non-maintenance (Ixazomib-based) – комбинированная не поддерживающая терапия (иксазомиб-содержащая); Combination non-maintenance (Placebo-based) – комбинированная не поддерживающая терапия (плацебо-содержащая); Single-agent maintenance (Ixazomib-based) – один агент в поддерживающей терапии (иксазомиб); Single-agent maintenance (Placebo-based) – один агент в поддерживающей терапии (плацебо)
Объединенный анализ, представленный выше, включал в себя два исследования, оценивающих эффективность иксазомиба в монорежиме (TOURMALINE-MM3 и TOUR- MALINE-MM4), и два исследования, в которых пациенты получали триплет Ixa-Rd (TOURMALINE-MM1 и TOURMALINE-MM2). Применение триплетов, возможно, повлияло на способность иксазомиба значимо понизить негативное воздействие высокого риска. Было отмечено, что у пациентов с аномалиями высокого риска mPFS в группе пациентов с иксазомибом в сочетании с Rd выше, чем плацебо в сочетании с Rd (HR = 0,64), и чем только иксазомиб против плацебо (HR = 0,83). Напротив, у пациентов со стандартными цитогенетическими аномалиями преимущество PFS наблюдалось как с комбинированным лечением (Ixa-Rd), так и с монорежимом иксазомиба, но отношение рисков для PFS больных с Ixa-Rd против плацебо-Rd было выше (HR = 0,74), чем отношение рисков для монорежима иксазомиба против плацебо (HR = 0,62) [45].
Эти результаты подтверждают выводы TOURMALINE-MM1 о том, что иксазомиб в сочетании с Rd эффективнее у пациентов с цитогенетическими аномалиями высокого риска и может улучшить прогноз этих пациентов [48]. Дальнейшие анализы в подгруппах высокого риска и сверхвысокого риска в соответствии с конкретными цитогенетическими аномалиями вывили преимущество PFS в группах иксазомиб-содержащих режимов терапии больных с t(4;14) (HR = 0,68), amp1q21 (HR = 0,77) и del(17p) (HR = 0,80). Иксазомиб против плацебо-содержащей терапии увеличил медиану PFS у пациентов с t(4;14) и amp1q21 на 9,2 и 4,3 мес. соответственно. Терапия на основе иксазомиба продлила медиану PFS на 2,5 месяца у пациентов с del(17p). Более отчетливое увеличение беспрогрессивной выживаемости, наблюдаемое у пациентов с t(4;14) и amp1q21, свидетельствует о том, что улучшение исходов в подгруппах высокого риска было в первую очередь обусловлено различиями PFS у пациентов с этими более частыми цитогенетическими аномалиями. Число пациентов в подгруппе t(14;16) было небольшим, и выводы, основанные на относительном вкладе этой цитогенетической аномалии в PFS, сделаны быть не могут.
Еще одно короткое, но привлекающее интерес исследование, опубликовано в 2021 г. Szudy-Szczyrek A. et al. [49]. Девять пациентов в возрасте 52-82 лет, получивших иксазомиб (схема Ixa-Rd) по программе раннего доступа, были включены в исследование. Все пациенты соответствовали критериям РРММ и имели высокий риск (t(4:14), t(14:16), del17p или +1q21). Медиана продолжительности терапии ик-сазомибом составила 12 месяцев. Один пациент с множественными цитогенетическими аберрациями и экстрамедуллярной плазмоцитомой умер из-за прогрессирования после двух месяцев лечения. У оставшихся пациентов был достигнут объективный ответ на лечение, и в четырех случаях он был квалифицирован как очень хороший частичный ответ. Наблюдаемые побочные эффекты включали нейтропению, инфекции и отек (в трех случаях 3 степень). Восемь пациентов продолжают лечение, в двух случаях было принято решение о снижении дозы леналидомида. Эти результаты также свидетельствуют о потенциально высокой эффективности и хорошем профиле безопасности Ixa-Rd-терапии у пациентов с РРММ и неблагоприятной цитогенетикой.
К настоящему времени уже получены данные по эффективному использованию иксазомиба не только с леналидомидом, но с циклофосфамидом, помалидомидом, антиCD38. Так, Krishnan A. et al. опубликовали результаты исследования фазы I/II, в котором оценивалась эффективность иксазомиба в сочетании с помалидомидом у больных с рециди-вами/рефрактерными формами ММ. В это исследование вошли больные с цитогенетическими аномалиями высокого риска (амплификация 1q, del17p, t(4,14) + ampl 1q). Частота общего ответа и контроль над опухолевым процессом достигнуты у 50 % (95 % CI: 21,1-78,9) и 92 % (95 % CI: 61,5-99,8) больных соответственно. У 17 % больных (95 % CI: 2,1-48,4) зарегистрирован очень хороший частичный ответ [50].
Мы хотим обратить внимание на то, что результаты клинических исследований зачастую не совпадают с результатами реальной клинической практики [51]. Однако на сегодняшний день имеются неопровержимые доказательства тому, что в реальных условиях Ixa-Rd может быть предпочтительным вариантом для длительного лечения, например, ослабленных пациентов, пациентов с сопутствующими сердечно-сосудистыми заболеваниями, с кардиальной токсичностью, связанной с применением кардиотоксических препаратов. А как иксазомиб работает в группе больных высокого риска?
Этому посвящен ряд работ, в которых представлены результаты оценки эффективности иксазо-миба, в том числе, при высоком риске, в реальной клинической практике. Так, в исследовании Sokol J. et al. тестирована эффективность триплета Iха-Rd (иксазомиб+леналидомид+дексаметазон). Большинство пациентов имели рецидив заболевания и высокий риск по шкале ISS: 18 (17 %), 29 (27 %) и 59 (56 %) соответственно ISS I, ISS II и ISS III. Авторы обращают внимание на пациентов стандартного и высокого цитогенетического риска. Медиана PFS у пациентов со стандартным риском составила 39 мес. (95 % CI: 25,8–52,2), а при высоком риске 31 мес. (95 % CI: 29,0–33,0), то есть существенных различий не обнаружено [52]. Эти данные подтверждаются результатами израильского регистрационного исследования [47]. В общей сложности в исследовании участвовали 78 пациентов. Шестьдесят четыре процента получили иксазомиб во 2-й линии, 19 % – в 3-й линии, 89 % пациентов ранее получали бортезомиб,
Ixa-Rd и иммуномодуляторы; 48 % больных имели высокий цитогенетический риск (t(4:14), t(14:16), del17p) или промежуточный (+1q21). Большинство пациентов получали иксазомиб в сочетании с леналидомидом и дексаметазоном. Согласно опубликованным результатам, не было обнаружено никакого влияния аномалий высокого риска на PFS. Авторы заключают, что комбинации на основе иксазомиба являются эффективными и безопасными режимами у пациентов с РРMM в реальных условиях, независимо от цитогенетического риска, сопоставимыми с данными клинических испытаний.
Таким образом, представленные в этом обзоре результаты клинических исследований и реальной клинической практики подтверждают эффективность и безопасность иксазомиба у пациентов с ММ, которые имеют цитогенетические аномалии высокого риска. Другие ингибиторы протеасомы не оказывают подобного воздействия на высокий цитогенетический риск. Утверждать, что иксазомиб преодолевает высокий риск пока нет оснований, необходимы дальнейшие исследования. Однако врач, выявив цитогенетические аномалии, характерные для высокого риска, должен взвесить все «за» и «против» применения того или иного препарата и принять решение. На наш взгляд, о чем мы уже писали ранее [53], иксазомиб – это тот препарат, который поможет такому пациенту. Длительная терапия больных ММ – длительная выживаемость, вполне удовлетворительное качество жизни. В этой связи необходимо отметить, что карфилзомиб и борте-зомиб вводятся парентерально, что может оказать влияние на комплаентность пациентов (причины различные – возраст, семейные обстоятельства, отказ от госпитализации и д.). Одно из преимуществ иксазомиба – пероральная форма. Назначение икса-зомиба внутрь позволяет проводить менее частые посещения больницы или поликлинического отделения во время непрерывной/длительной терапии. Кроме того, при использовании карфилзомиба обращается внимание на возможность кардиальных и почечных нежелательных явлений, а при использовании бортезомиба – периферической нейропатии [54,55], что гораздо реже наблюдается при терапии иксазомибом. Профиль безопасности иксазомиба хорошо зарекомендовал себя как в целом, так и среди больных с цитогенетикой высокого риска.
Заключение
В последние годы был достигнут значительный прогресс в улучшении выживаемости без прогрессирования и качества жизни пациентов с множественной миеломой, в том числе высокого риска. Терапия иксазомибом обратила внимание на отчетливое увеличение медианы выживаемости без прогрессии у пациентов с цитогенетическими аномалиями высокого риска и цитогенетическими нарушениями сверхвысокого риска по сравнению с подгруппами стандартного риска. Иксазомиб в сочетании с Rd или в монорежиме в поддерживающей терапии полностью не преодолевает негативное воздействие цитогенетических аномалий высокого риска на течение ММ. Тем не менее, обращают на себя внимание различия в критериях включения пациентов в четырех основных клинических исследованиях (TOURMALINE-MM1, TOURMALINE-MM2, TOURMALINE-MM3 и TOURMALINE-MM4), что, возможно, усложнило интерпретацию полученных данных. Однако в целом результаты объединенного анализа этих четырех исследований показывают, что терапия на основе иксазомиба является жизнеспособным вариантом лечения пациентов с ММ, которые имеют цитогенетические аномалии высокого риска и сверхвысокого риска. Результаты клинических исследований и реальной клинической практики показывают, что пероральные иксазомиб-содержащие режимы терапии могут обеспечить существенное пролонгирование беспрогрессивной выживаемости пациентов с t(4;14) и amp1q21. Икса-зомиб эффективен как в комбинированных схемах, так и в монорежиме.
Список литературы Ингибиторы протеасомы в лечении больных множественной миеломой высокого цитогенетического риска
- Du J., Zhuang J. Major advances in the treatment of multiple myeloma in American Society of Hematology annual meeting 2020. // Chronic Dis Transl. - Med. – 2021. – Vol. 7. – P 220-226.
- Rajkumar S.V. Multiple myeloma: 2020 update on diagnosis, risk-stratification and management. // Am J Hematol. – 2020. – Vol. 95. – P. 548–567.
- Munshi N.C., Avet-Loiseau H. Genomics in multiple myeloma. // Clin Cancer Res. – 2011. – Vol. 17, N 6. – P. 1234–1242.
- Kumar S.K., Callander N.S., Adekola K. et al. Multiple Myeloma, Version 3.2021, NCCN Clinical Practice Guidelines in Oncology. // J Natl Compr Canc Netw. – 2020. – Vol. 18. – P. 1685-1717.
- Бессмельцев С.С., Карягина Е.В., Стельмашенко Л.В. и др. Бортезомиб (Велкейд) в комбинации с дексаметазоном в лечении рефрактерных/рецидивирующих форм множественной миеломы. Результаты заключительного анализа// Клиническая Онкогематология. – 2009. – Т. 2, №3. – С. 236-244.
- Jimenez-Zepeda V.H., Duggan P., Neri P., Tay J., Bahlis N.J. Bortezomib-containing regimens (BCR) for the treatment of non-transplant eligible multiple myeloma. // Ann Hematol. – 2017. – Vol. 96. – P. 431–439.
- Palumbo A., Gay F., Cavallo F. et al. Continuous therapy versus fixed duration of therapy in patients with newly diagnosed multiple myeloma. // J Clin Oncol. – 2015. – Vol. 33. – P. 3459–3466.
- Jurczyszyn A., Charliń ski G., Suska A., Vesole D.H. The importance of cytogenetic and molecular aberrations in multiple myeloma. // Acta Haematol Vol. – 2021. – Vol. 52. – P. 361–370.
- Nahi H., Sutlu T., Jansson M. et al. Clinical impact of chromosomal aberrations in multiple myeloma. // J Intern Med. – 2010. – Vol. 269, N 2. – P. 137-147.
- Ross F.M., Chiecchio L., Dagrada G. et al. The t(14;20) is a poor prognostic factor in myeloma but is associated with long term stable disease in MGUS. // Haematologica. – 2010. – Vol. 95, N 7. – P. 1221-1225.
- Sonneveld P., Avet-Loiseau H., Lonial S. et al. Treatment of multiple myeloma with high-risk cytogenetics: a consensus of the International Myeloma Working Group. //Blood. – 2016. – Vol. 127. – P. 2955–2962.
- Neben K., Jauch A., Bertsch U. et al. Combining information regarding chromosomal aberrations t(4;14) and del(17p13) with the International Staging System classification allows stratification of myeloma patients undergoing autologous stem cell transplantation. // Haematologica. – 2010. – Vol. 95, N 7. – P. 1150–1157.
- Fonseca R., Blood E., Rue M. et al. Clinical and biologic implications of recurrent genomic aberrations in myeloma. // Blood. – 2003. – Vol. 101, N 11. - P. 4569–4575.
- Gertz M.A., Lacy M.Q., Dispenzieri A. et al. Clinical implications of t(11;14)(q13;q32), t(4;14)(p16.3;q32), and -17p13 in myeloma patients treated with high-dose therapy. // Blood. – 2005. – P. 106, N 8. – P. 2837–2840.
- Moreau P., Attal M., Garban F. et al. Heterogeneity of t(4;14) in multiple myeloma. Long-term follow-up of 100 cases treated with tandem transplantation in IFM99 trials. // Leukemia. – 2007. – Vol. 21, N 9. – P. 2020–2024.
- Avet-Loiseau H., Malard F., Campion L. et al. Intergroupe Francophone du Myélome. Translocation t(14;16) and multiple myeloma: is it really an independent prognostic factor? // Blood. – 2011. – Vol. 117, N 6. – P. 2009–2011.
- Boyd K.D., Ross F.M., Chiecchio L. et al. NCRI Haematology Oncology Studies Group. A novel prognostic model in myeloma based on co-segregating adverse FISH lesions and the ISS: analysis of patients treated in the MRC Myeloma IX trial. // Leukemia. – 2012. – Vol. 26, N 2. – P. 349–355.
- Narita T., Inagaki A., Kobayashi T. et al. t(14;16)-positive multiple myeloma shows negativity for CD56 expression and unfavorable outcome even in the era of novel drugs. // Blood Cancer J. – 2015. – Vol. 5. – P. e285.
- Pawlyn C., Melchor L., Murison A. et al. Coexistent hyperdiploidy does not abrogate poor prognosis in myeloma with adverse cytogenetics and may precede IGH translocations. // Blood. – 2015. – Vol. 125, N 5. – P. 831–840.
- Morgan G.J., Walker B.A., Davies F.E. The genetic architecture of multiple myeloma. Nature Reviews Cancer. // 2012. – Vol. 12, N 5. – P. 335-348.
- Hebraud B., Magrangeas F., Cleynen A. et al. Role of additional chromosomal changes in the prognostic value of t(4;14) and del(17p) in multiple myeloma: the IFM experience. // Blood. – 2015. – Vol. 125, N 13. – P. 2095–2100.
- Chiecchio L., Protheroe R.K., Ibrahim A.H. et al. Deletion of chromosome 13 detected by conventional cytogenetics is a critical prognostic factor in myeloma. // Leukemia. - 2006. – Vol. 20, N 9. – P. 1610–1617.
- Avet-Loiseau H., Attal M., Moreau P. et al. Genetic abnormalities and survival in multiple myeloma: the experience of the Intergroupe Francophone du Myélome. // Blood. – 2007. – Vol. 109, N 8. – P. 3489–3495.
- Zhan F., Colla S., Wu X. et al. CKS1B, overexpressed in aggressive disease, regulates multiple myeloma growth and survival through SKP2- and p27Kip1-dependent and -independent mechanisms. // Blood. – 2007. – Vol. 109, N 11. – P. 4995–5001.
- Бессмельцев С.С. Множественная миелома: диагностика и терапия (часть 1). // Вестник гематологии. – 2022. – №2. – С. 4- 26.
- Boyd K.D., Ross F.M., Chiecchio L. et al. NCRI Haematology Oncology Studies Group. A novel prognostic model in myeloma based on co-segregating adverse FISH lesions and the ISS: analysis of patients treated in the MRC Myeloma IX trial. // Leukemia. – 2012. – Vol. 26, N 2. – P. 349–355.
- Sonneveld P., Schmidt-Wolf I.G., van der Holt B. et al. Bortezomib induction and maintenance treatment in patients with newly diagnosed multiple myeloma: results of the randomized phase III HOVON-65/ GMMG-HD4 trial. // J Clin Oncol. – 2012. – Vol. 30, N 24. – P. 2946–2955.
- Neben K., Lokhorst H.M., Jauch A. et al. Administration of bortezomib before and after autologous stem cell transplantation improves outcome in multiple myeloma patients with deletion 17p. // Blood. – 2012. – Vol. 119, N 4. – P. 940–948.
- Rosiñol L., Oriol A., Teruel A.I. et al. Programa para el Estudio y la Terapéutica de las Hemopatías Malignas/Grupo Español de Mieloma (PETHEMA/GEM) group. Superiority of bortezomib, thalidomide, and dexamethasone (VTD) as induction pretransplantation therapy in multiple myeloma: a randomized phase 3 PETHEMA/GEM study. // Blood. – 2012. – Vol. 120, N 8. – P. 1589–1596.
- Cavo M., Tacchetti P., Patriarca F. et al. GIMEMA Italian Myeloma Network. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem-cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study. // Lancet. – 2010. – Vol. 376, N 9758. – P. – P. 2075–2085.
- Sonneveld P., Goldschmidt H., Rosiñol L. et al. Bortezomib-based versus nonbortezomib-based induction treatment before autologous stem-cell transplantation in patients with previously untreated multiple myeloma: a meta-analysis of phase III randomized, controlled trials. // J Clin Oncol. – 2013. – Vol. 31, N 26. – P. 3279–3287.
- San Miguel J.F., Schlag R., Khuageva N.K. et al. VISTA Trial Investigators. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma. // N Engl J Med. // 2008. – Vol. 359, N 9. – P. 906–917.
- Mateos M.V., Gutiérrez N.C., Martín-Ramos M.L. et al. Outcome according to cytogenetic abnormalities and DNA ploidy in myeloma patients receiving short induction with weekly bortezomib followed by maintenance. // Blood. – 2011. – Vol. 118, N 17. – P. 4547–4553.
- Jakubowiak A.J., Siegel D.S., Martin T. et al. Treatment outcomes in patients with relapsed and refractory multiple myeloma and high-risk cytogenetics receiving single-agent carfilzomib in the PX-171-003-A1 study. // Leukemia. – 2013. – Vol. 27, N 12. – P. 2351–2356.
- Shah J.J., Stadtmauer E.A., Abonour R. et al. Carfilzomib, pomalidomide, and dexamethasone for relapsed or refractory myeloma. // Blood. – 2015. – Vol. 126, N 20. – P. 2284–2290.
- Hervé Avet-Loiseau, Rafael Fonseca, David Siegel et al. Carfilzomib significantly improves the progression-free survival of high-risk patients in multiple myeloma// Blood. – 2016. – 128, N 9. – P. 1174-1180.
- Moreau P., Masszi T., Grzasko N., Bahlis N.J. et al. Oral ixazomib, lenalidomide, and dexamethasone for multiple myeloma. // N Engl J Med. – 2016. – Vol. 374. – P. 1621–1634.
- Richardson P.G., Kumar S.K., Masszi T. et al. Final overall survival analysis of the TOURMALINE-MM1 phase III trial of ixazomib, lenalidomide, and dexamethasone in patients with relapsed or refractory multiple myeloma. // J Clin Oncol. – 2021. – Vol. 39. – P. 2430–2442.
- Facon T., Venner C.P., Bahlis N.J. et al. Oral ixazomib, lenalidomide, and dexamethasone for transplant-ineligible patients with newly diagnosed multiple myeloma. // Blood. – 2021. – Vol. 137. – P. 3616–3628.
- Dimopoulos M.A., Gay F., Schjesvold F. et al. Oral ixazomib maintenance following autologous stem cell transplantation (TOURMALINE-MM3): a double-blind, randomised, placebo-controlled phase 3 trial. // Lancet. – 2019. – Vol. 393. – P. 253–264.
- Dimopoulos M.A., Spicka I., Quach H. et al. Ixazomib as postinduction maintenance for patients with newly diagnosed multiple myeloma not undergoing autologous stem cell transplantation: the phase III TOURMALINE- MM4 trial. // J Clin Oncol. – 2020. – Vol. 38. – P. 4030–4041.
- NCCN Clinical Practice Guidelines in Oncology. Multiple Myeloma. Version 4.2022 — December 14, 2021.
- Goldman-Mazur S., Vesole D.H., Jurczyszyn A. Clinical implications of cytogenetic and molecular aberrations in multiple myeloma. // Acta Haematol Pol. – 2021. – Vol. 52. – P. 18–28.
- Abdallah N., Rajkumar S.V., Greipp P. et al. Cytogenetic abnormalities in multiple myeloma: association with disease characteristics and treatment response. // Blood Cancer J. – 2020. – Vol. 10. – P. 82.
- Wee-Joo Chng, Sagar Lonial, Gareth J. Morgan et al. A pooled analysis of outcomes according to cytogenetic abnormalities in patients receiving ixazomib- vs placebo-based therapy for multiple myeloma // Blood Cancer Journal. – 2023. – Vol. 13. – P. 14; https://doi.org/10.1038/s41408-022-00768-5.
- Li J., Bao L., Xia Z., Wang S. et al. Ixazomib-based frontline therapy in patients with newly diagnosed multiple myeloma in real-life practice showed comparable efficacy and safety profile with those reported in clinical trial: a multicenter study. // Ann Hematol. – 2020. – Vol. 99. – P. 2589-2598.
- Cohen Y.C., Magen H., Lavi N. et al. Ixazomib-based regimens for relapsed/refractory multiple myeloma: are realworld data compatible with clinical trial outcomes? A multisite Israeli registry study. // Ann Hematol. – 2020. – Vol. 99. – P. 1273-1281.
- Avet-Loiseau H., Bahlis N.J., Chng W.J. et al. Ixazomib significantly prolongs progression-free survival in high-risk relapsed/refractory myeloma patients. // Blood. – 2017. – Vol. 130. – P. 2610-2618.
- Szudy-Szczyrek A., Chocholska S., Bachanek-Vitura O. et al. Efficacy of ixazomib-lenalidomide-dexamethasone in high-molecular-risk relapsed/refractory multiple myeloma - case series and literature review// Ann Agric Environ Med. – 2022. – Vol. 29, N 1. – P. 103-109.
- Krishnan A., Prashant Kapoor P., Palmer J.M. et al. Phase I/II trial of the oral regimen ixazomib, pomalidomide, and dexamethasone in relapsed/refractory multiple myeloma// Leukemia. – 2018. – Vol. 32. – P. 1567–1574.
- Richardson P.G., San Miguel J.F., Moreau P. et al. Interpreting clinical trial data in multiple myeloma: translating findings to the real-world setting. //Blood Cancer J. – Vol. 2018. – Vol. 8. – P. 109.
- Sokol J., Guman T., Chudej J. et al. Ixazomib, lenalidomide, and dexamethasone combination in “real-world” clinical practice in patients with relapsed/refractory multiple myeloma// Annals of Hematology https://doi.org/10.1007/s00277-021-04663-0.
- Бессмельцев С.С. Иксазомиб в лечении больных множественной миеломой// Вестник гематологии. – 2023. – Т. XIX, № 2. – С.
- Dimopoulos M.A., Roussou M., Gavriatopoulou M. et al. Cardiac and renal complications of carfilzomib in patients with multiple myeloma.// Blood Adv. – 2017. – Vol. 1. – P. 449–454.
- Бессмельцев С.С., Карягина Е.В., Стельмашенко Л.В. и др. Частота, характеристика и методы лечения периферической нейропатии у больных множественной миеломой, получающих бортезомиб (велкейд)//Онкогематология. – 2008. – №3. – С. 52-62.


