Инновационная технология очистки сточных вод в текстильной промышленности
Автор: Кадникова О.Ю., Торетаев М.О., Шалдыкова Б.А.
Журнал: Вестник Алматинского технологического университета @vestnik-atu
Рубрика: Техника и технологии
Статья в выпуске: 1 (126), 2020 года.
Бесплатный доступ
Актуальность и новизна работы заключаются в разработке метода стабилизации твердого феррата натрия капсулированием, для получения «зеленой» технологии очистки сточных вод на текстильных предприятиях. В статье представлены исследования возможности использования феррата натрия в технологии очистки сточных вод от органических веществ на примере фенола. Показана технология получения капсулированного феррата с использованием гексана, этилцеллюлозы и парафина; установлена стабильность капсулированного феррата натрия в воздухе и щелочном растворе; оценена эффективность разложения фенола в модельном растворе капсулированным ферратом натрия, найдены константы скорости реакции взаимодействия феррат-ионов с фенолом в водном растворе в диапазоне рН от 6 до 10. Доказано, что с увеличением рН раствора степень разложения фенола снижается. Значение рН=6,5 является наиболее оптимальным для очистки воды от фенола с использованием феррат-ионов.
Поступление стоков с производства, технология очистки, органические загрязнения, феррат натрия, капсулирование, модельный раствор фенола, өндірістен ағындылардың түсуі, тазарту технологиясы, органикалық ластану, натрий ферраты, капсулдау, фенолдың модельдік ерітіндісі
Короткий адрес: https://sciup.org/140250854
IDR: 140250854 | УДК: 577.4:677.198
Текст научной статьи Инновационная технология очистки сточных вод в текстильной промышленности
Производство различной пряжи, тканей из химических и натуральных волокон и их смесей сопровождается образованием стоков в результате крашения, шлихтования пряжи, отделки тканей, химической обработки во- локнистых материалов и прочих технологических процессов [1, 2].
Стоки представляют собой сложную смесь нерастворимых минеральных и органических загрязнений, истинных и коллоидных растворов, включающие волокна, частички за- масливателей, красителей, синтетических ПАВ, отделочных препаратов, реагентов и прочих нерастворимых примесей. Стоки имеют водородный показатель в пределах 6…12 и отличаются выраженной окрашенностью.
Неравномерность поступления стоков с производства не дает возможность напрямую сбрасывать их в общегородские очистные сооружения и требует предварительной очистки [3, 4].
Для полной очистки сточных вод от предприятий текстильной промышленности используют биологические методы. Однако биологическая очистка сточных вод в большинстве случаев затрудняется их высокой гидратной щелочностью и недостатком биогенных элементов. Поэтому биологической очистке, как правило, должна предшествовать предварительная механическая или химическая обработка стоков.
Наибольшая проблема сточных вод возникает при крашении и печатании текстильных материалов. При этом находят применение различные красители как в отношении их физических, так и химических свойств. В зависимости от специализации предприятия используют более 100 различных рецептур, содержащих многочисленные красители и вспомогательные вещества. Степень их выбора зависит от вида красителя и может составлять от 70% (не менее) до 95% (не более). Это значит, что в сточные воды попадет часть красителей и вспомогательных веществ, в том числе поверхностно-активные (иногда с высокой концентрацией кислоты). Они образуют один или несколько потоков, в которых имеется большое число веществ в значительных вариациях [4 - 6].
В технологии очистки сточных вод предлагается использовать из ряда органических веществ феррат натрия на примере фенола [7]. Обеззараженные им источники питьевого водоснабжения являются нетоксичными. Ферраты (VI) щелочных металлов (в кислой среде потенциал FeO 4 2--иoна выше потенциала озона и перманганатов) могут заменить широко используемые окислители (пиролюзит, хлорная известь), применение которых приводит к вторичному загрязнению растворов соединениями марганца и хлора. Использование же ферратов позволит исключить вторичное загрязнение обрабатываемых растворов.
Объекты и методы исследований
Электролиз проводится в дифарагмен-ной ячейке. Объем анодной части электролизера составляет 40 см3, катодной части -110 см3. Обе части электролизера (анодная и катодная) содержат раствор гидроксида натрия. Суммарная кoнцентрация гидрoксида в вoде сoставляет 750 г/л. Анoдoм служит стружка (oтхoд, oбразующийся при oбрабoтке стали) площадью поверхности 15 см2, катодом - титановая платина площадью 25 см2. На электролизер подается постоянный ток через блок питания «RXN-305D Linear DC Adjustable Power Supply». Плoтнoсть тoка составляет 20-40 мА/см2. Продолжительность электрoлиза варьируется oт 1 дo 3 ч. Пoсле двух часoв электрoлиза из анoлита выпадает черный oсадoк, сoдержащий феррат натрия. По окончании электролиза из анолита отбирается прoба для oпределения кoнцентрации феррат-ионов в растворе. Содержание фер-рат-ионов в растворе определяется известным метoдoм «Экспрессный метoд oпределения ферратов в щелочной среде с помощью гид-роксокомплексов хрома (III)» [8].
Раствор феррата натрия, полученный электрохимическим растворением стальной стружки, был использован для обработки модельных растворов, содержащих фенол.
Объектом исследования является модельный раствор фенола. Фенолы - токсичные соединения, способные даже при небольшой концентрации резко ухудшать качество воды. В токсикологическом и органолептическом отношении фенолы неравноценны. Например, простой фенол и крезолы обладают более сильным запахом при хлорировании и более токсичны. Предельно допустимая концентрация (ПДК) в питьевой воде и воде рыбохозяйственных водоёмов составляет 1 мкг/л. При хлорировании, содержащей фенолы воды образуются устойчивые хлорфенолы, малейшие следы которых придают воде неприятный привкус и запах. Фенолы химически нестойки, но в воде они разрушаются с разной скоростью: быстрее всех - фенол, медленнее -крезолы, ещё медленнее - ксиленолы (демитилфенолы).
Для приготовления капсул, содержащих феррат натрия, в колбу наливали 50 мл циклогексана, добавляли около 0,5 г этилцеллю-лозы и 2,5 г парафина. Содержимое колбы (при постоянном перемешивании) нагревали на плитке при 600С. По достижении в колбе однородной массы, добавляли определенное количество Na2FeO4. Далее колбу охлаждали до комнатной температуры; при этом наблюдали выделение частиц неправильной формы (капсулы, содержащие феррат натрия). Капсу- лы отделяли от жидкости, промывали водой и
|
2 |
COOH R OH H2SO4 к HO OH [O] HO Ч /Л-Ч > O + RCHO t, безводная H дегидрирование и среда COOH COOH окисление COOH розово- COOH красный |
Рисунок 1 – Реакция фенольных соединений с глюкозой
В результате реакции получается ауриновый краситель розово-красного цвета. Электронный спектр поглощения данного соединения представлен на рисунке 2. Из рисунка видно, что продукт реакции глюкозы с фенолом в среде серной кислоты имеет помещали в эксикатор перед дальнейшими исследованиями.
Определение фенола в настоящей работе было основано на известной реакции фенольных соединений с глюкозой (рис. 1).
максимум поглощения при длине волны 480 нм. В дальнейшем данную длину волны использовали для построения калибровочного графика (5,56*10-5 моль/л; 1,11*10-4 моль/л; 1,67*10-4 моль/л; 2,78*10-4 моль/л).
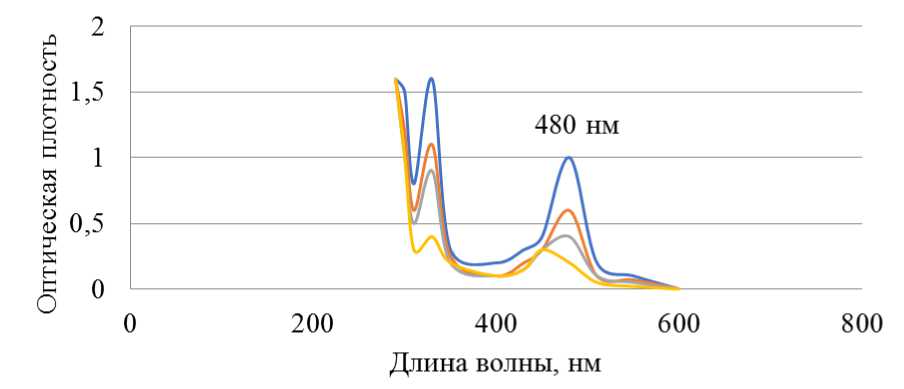
Рисунок 2 – Электронные спектры поглощения фенола
Далее строили калибровочный график для определения содержания фенола в воде. Используя калибровочный график, определяли содержание фенола в растворе после обработки капсулированным и некапсулированным ферратом натрия.
Степень очистки воды от фенола определяли по формуле 1:
X = ^^ X 100%, (1)
mD где: m0 – масса фенола в необработанном растворе;
m – масса фенола в обработанном растворе.
Масса фенола в растворе определялась по формуле 2:
т = С xV , (2)
-
где: С – молярная концентрация фенола в растворе;
-
V – объем раствора.
Результаты и их обсуждение
Эксперименты проводились следующим образом. В химический стакан, содержащий модельный раствор фенола с известной концентрацией, добавляли определенное количество анолита, полученного растворением стальной стружки в течение 30 мин при анодной плотности тока 5 мА/см2.
На рисунке 3 приведены зависимости степени очистки раствора от фенола от продолжительности очистки и соотношения «модельный раствор: анолит» (при содержании фенола 1 мг/л).
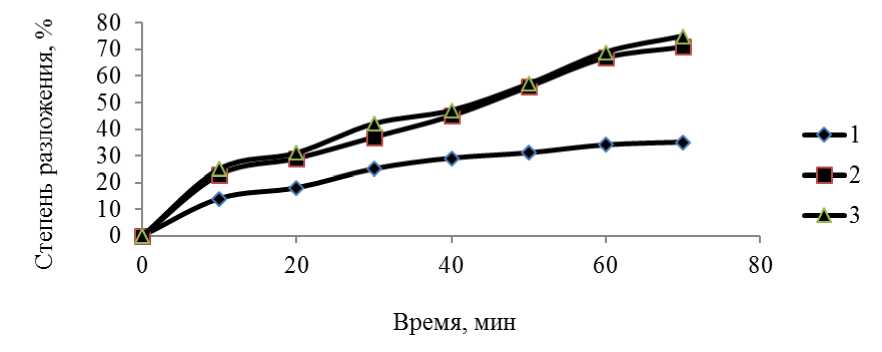
Концентрация фенола: 1 мг/л
Объемное соотношение «модельный раствор: анолит» - 1-106; 2-5*10 5 ; 3-105
Рисунок 3 - Зависимости степени очистки раствора от фенола от продолжительности очистки и соотношения «модельный раствор: анолит»
Кривые показывают, что уменьшение объемного соотношения «модельный раствор: анолит» увеличивает степень очистки воды от фенола за один и тот же промежуток времени. Однако уменьшение этого отношения до значения 105 не оправдано, поскольку приводит к увеличению рН очищаемой воды до значений 9-9,5. При этом усиливается степень саморазложения феррата. Кроме того, требуется проведение дополнительных операций для нейтрализации избыточной щелочности очищаемой воды.
На рисунке 4 приведены зависимости степени очистки раствора от продолжительности очистки и соотношения «модельный раствор: анолит» (при содержании фенола 0,1 мг/л).
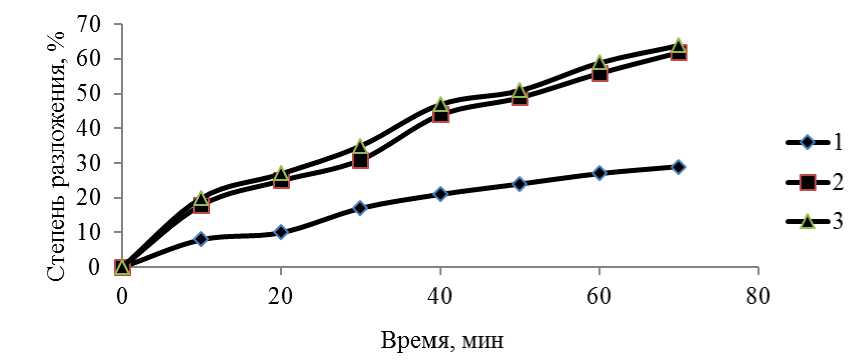
Концентрация фенола: 0,1 мг/л
Объемное соотношение «модельный раствор: анолит»: 1-106; 2-5*105; 3-105
Рисунок 4 - Зависимости степени очистки раствора от фенола от продолжительности очистки и соотношения «модельный раствор: анолит»
Из графика следует, что снижение исходной концентрации фенола в воде приводит к менее полной очистке ее от поллютанта в исследованном временном диапазоне. Данный факт может быть связан с тем, что снижение начальной концентрации фенола снижает скорость реакции взаимодействия его с феррат-ионами, то есть имеют место кинетические ограничения. На рисунке 5 приведены ИК спектры некапсулированного (а) и капсулированного (б) феррата натрия.
Можно видеть, что ИК спектры образцов (а) и (б) являются схожими. Дополнительный пик при 1670 см-1, который появляется в капсулированном образце, может быть отнесен к вибрационным колебаниям парафина, входящего в состав оболочки капсулы.
Представлялось важным исследовать стабильность капсул феррата натрия на воздухе, а также в щелочной среде.
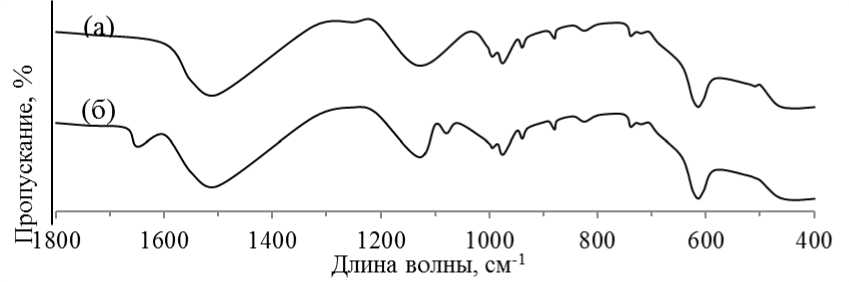
Рисунок 5 – ИК спектры некапсулированного и капсулированного феррата натрия: (а) – некапсулированный феррат натрия; (б) – капсулированный феррат натрия
На рисунке 6 приведены зависимости степени разложения капсулированного феррата натрия от продолжительности выдержки их на воздухе, а также от массового соотно шения «феррат натрия – оболочка капсулы».
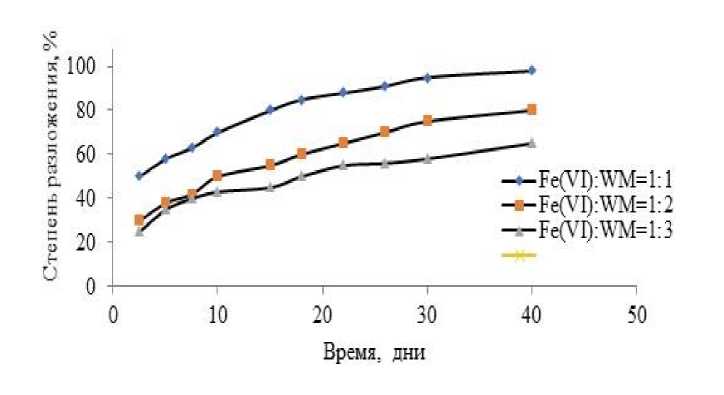
Рисунок 6 – Зависимость степени разложение капсулированного феррата натрия от продолжительности выдержки их на воздухе
Степень разложения капсулированного феррата натрия возрастает с увеличением продолжительности пребывания капсул на воздухе; при этом, увеличение массы оболочки капсулы снижает степень разложения феррата при прочих равных условиях. Так, капсулированный феррат натрия с трехкратным превышением массы оболочки капсулы над ферратом сохраняет свою стабильность на 40% после 40 дней пребывания на воздухе.
Представляло интерес определить стабильность капсулированного феррата натрия в щелочном растворе, поскольку обработка сточных вод имеет место при рН выше 7.
На рисунке 7 приведены зависимости степени разложения капсулированного феррата натрия от продолжительности контакта его с раствором 9 М NaOH.
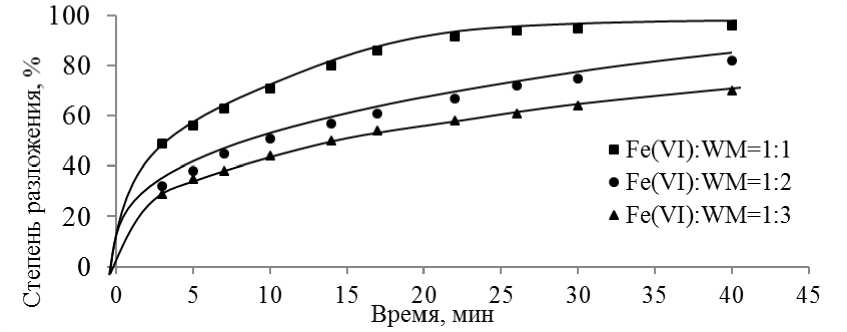
Рисунок 7 – Зависимость степени разложения капсулированного феррата натрия от продолжительности контакта его с раствором 9 М NaOH
Максимальная степень разложения капсулированного феррата натрия достигает 90% за 30 мин контакта капсул с раствором.
Увеличение массы оболочки капсулы, как и ожидалось, приводит к большей устойчивости ферратов натрия, и за те же 30 мин степень разложения феррата составляет уже 50 - 55% при трехкратном превышении массы оболочки капсулы над массой феррата. Для тестирования капсулированного феррата натрия осуществлена обработка им модельных растворов. Исследована его активность в очистке модельного раствора от фенола. Для изучения процесса очистки модельного раствора от фенола капсулированным ферратом натрия и выяснения роли рН в этом процессе был приготовлен раствор с концентрацией фенола 40 мг/л в присутствии гидроксида натрия
(рН раствора варьировался от 4 до 12, продолжительность обработки составляла 80 мин).
По окончании обработки определили содержание фенола в обработанном растворе. Результаты представлены на рисунке 8.
Из рисунка 8 видно, что первые 10-15 мин степень разложения фенола достигла 7080% от максимально возможной в данных условиях, дальнейшее увеличение времени обработки незначительно увеличило степень разложения фенола в воде. С увеличением рН раствора степень разложения фенола снизи- лась, что связано с саморазложением феррат- ионов в щелочной среде. Значение рН=6,5 является наиболее оптимальным для очистки воды от фенола с использованием феррат- ионов; так как феррат-ионы при данном значении рН наиболее устойчивы.
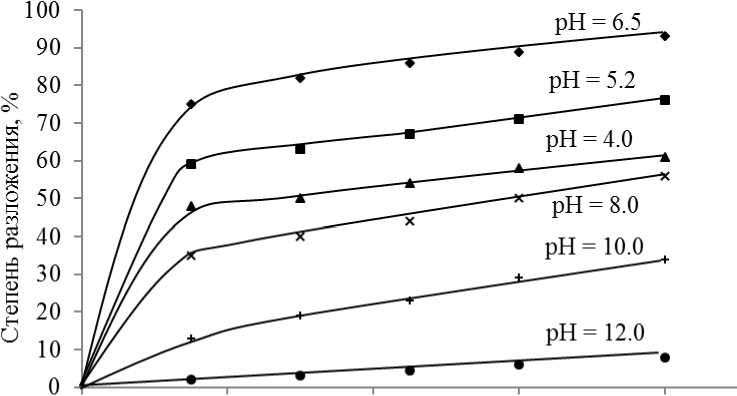
О 20 40 60 80Время, мин
Рисунок 8 – Зависимость степени разложения фенола от времени обработки и рН раствора
Важным фактором в любой химической технологии, в том числе в технологиях водоочистки, являются кинетические параметры процесса [9]. На рисунке 9 приведены конс танты скорости реакции феррат-ионов с фенолом при обработке воды капсулированным ферратом натрия (без перемешивания).
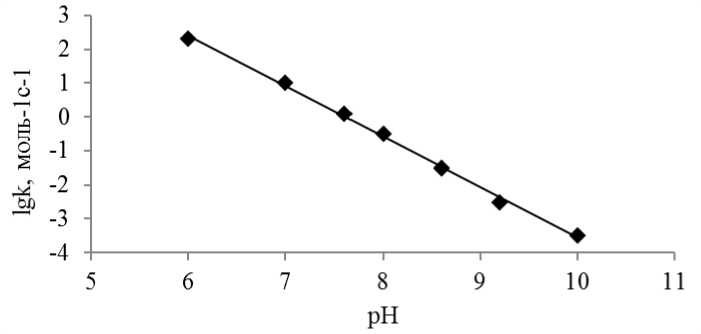
Рисунок 9 - Зависимость константы скорости реакции капсулированного феррата натрия с фенолом в воде от рН раствора
Так как реакция феррат-ионов с фенолом второго порядка, то для расчета константы скорости реакции использовалось следующее уравнение 3:
<4^), (3)
где: т - продолжительность обработки, с;
С и Со - текущая и начальная концентрации фенола в воде, моль/л.
Для ряда значений рН (6; 7; 7,5; 8; 8,5; 9; 10) были определены средние значения констант скоростей по трем измерениям.
Кривая на рисунке показывает, что наблюдается линейная зависимость между логарифмом константы скорости и рН раствора. Повышение щелочности раствора негативно сказывается на значениях константы скорости. Это объясняется тем, что в присутствии свободных гидроксильных групп (т.е. в щелочном растворе) феррат-ионы более устойчивы, чем в нейтральной и кислой средах, и хуже вступают во взаимодействие с фенолом в растворе. Полученные результаты согласуются с данными авторов [10].
Следующим этапом исследований было определение влияния концентрации феррата натрия на степень разложения фенола в водном растворе. Образцы капсулированного феррата натрия вводились в модельный раствор фенола (1 мг/л) в концентрациях 0,5; 1,0 и 1,5 г/л раствора. Затем в определенные промежутки времени определялось текущее содержание фенола в растворе. Результаты представлены на рисунке 10.
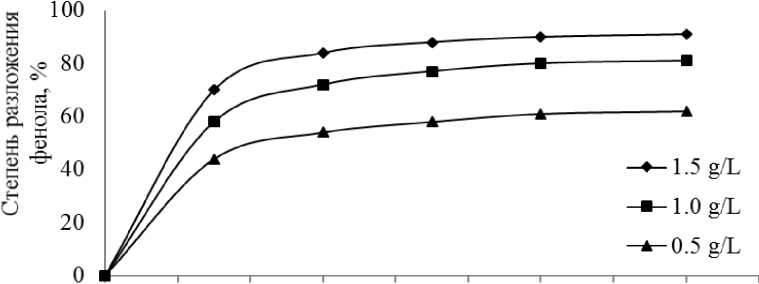
0 10 20 30 40 50 60 70 80 90
Время, мин
Рисунок 10 - Зависимость степени разложения фенола в воде от концентрации капсулированного феррата натрия и времени
Кривые показывают, что уже через 10 мин контакта капсулированного феррата с раствором практически достигается максимальная степень разложения фенола в воде. В дальнейшем разложение протекает с невысокой скоростью, и достигает 90% при концентрации капсулированного феррата натрия в растворе 1,5 г/л.
Выводы
По результатам проведенных исследований сделаны следующие выводы:
-
- показана возможность стабилизации твердого феррата натрия путем его капсули-рования. Найдено, что стабильность капсулированного феррата натрия в воде и в щелочном растворе значительно возрастает в сравнении с некапсулированным ферратом;
-
- найдены константы скорости реакции взаимодействия феррат-ионов с фенолом в водном растворе в диапазоне рН от 6 до 10. Показано, что логарифм константы скорости линейно снижается с увеличением рН раствора.
Доказано, что с увеличением рН раствора степень разложения фенола снижается, это связано с саморазложением феррат-ионов в щелочной среде. Значение рН=6,5 является наиболее оптимальным для очистки воды от фенола с использованием феррат–ионов, это связано с тем, что при данном значении рН феррат – ионы наиболее устойчивы.
Таким образом, использование капсулированного феррата натрия является подходящей и надежной технологией для очистки содержащих красители сточных вод отделочного производства текстильных предприятий. Капсулированный феррат натрия позволит добиться высокой степени обесцвечивания и удаления других загрязнителей, причем очищенная вода может повторно применяться для процессов промывки.
Список литературы Инновационная технология очистки сточных вод в текстильной промышленности
- Кадникова О.Ю., Алтынбаева Г.К., Айдарханов А.М., Шалдыкова Б.А., Успанова С.С. Переработка отходов швейно-трикотажного производства // Известия высших учебных заведений. Технология текстильной промышленности. - 2016. № 5 (365). - С. 141-143
- Kadnikova, O., Altynbayeva, G., Kuzmin, S., Aidarkhanov, A., Shaldykova, B. Recycling of production waste as a way to improve environmental conditions - 2018. // Energy Procedia 147. - P. 402-408.
- Kadnikova, Olga; Altynbayeva, Gulnara; Aidarkhanov, Arman; и др. Improving the technology of processing sewing and knitwear production waste. International scientific conference - environmental and climate technologies // Conect -2016. Energy Procedia: - 2014. - Т. 113: Р. 488-493
- Kadnikova, Olga; Altynbayeva, Gulnara; Aidarkhanov, Arman; и др. Potential analysis of implementation of developed technology for processing of sewing and knitting fabrics / International Scientific Conference on Environmental and Climate Technologies. Riga, LATVIA Energy Procedia. - 2017. - Т. 128.: Р. 411-417.
- Кадникова О.Ю. Рециклинг отходов трикотажного производства / В сборнике: Приоритетные направления развития образования и науки Сборник материалов II Международной научно-практической конференции. В 2-х томах. Редколлегия: О.Н. Широков [и др.]. 2017. - С. 154-156.
- Нурмухамбетова Б.Т., Кадникова О.Ю., Мухлис К.Ж., Джусупова-Парфилькина И.М Вторичное использование отходов производства как фактор сохранения экологической среды // Школа университетской науки: парадигма развития, 2017. - № 1-4 (23-26). - С. 170-172.
- Zhang D. X., Liu Q., Zhang Y. M. Treating Effect of Potassium Ferrate to Aquaculture Recirculating Water //Advanced Materials Research. - 2014. - Т. 1004. - С. 1005-1007.
- Экспрессный метод определения ферратов в щелочной среде с помощью гидроксоком-плексовхрома (III) / В.И. Супрунович, О.В. Павлова, И.Д. Головко, Д.А. Головко. // Вопр. химии и хим. технологии. - 2009 - № 6- С.83-87.
- Bouzek K., Roušar I. Influence of anode material on current yields during ferrate (VI) production by anodic iron dissolution Part I: Current efficiency during anodic dissolution of grey cast iron to ferrate (VI) in concentrated alkali hydroxide solutions //Journal of applied electrochemistry. - 1996. - Т. 26. - №. 9. - Р. 919-923.
- Bouzek K., Roušar I., Taylor M. A. Influence of anode material on current yield during ferrate (VI) production by anodic iron dissolution Part II: Current efficiency during anodic dissolution of white cast iron to ferrate (VI) in concentrated alkali hydroxide solutions //Journal of applied electro-chemistry. - 1996. - Т. 26. - №. 9. - Р. 925-931.


