Инновационные стратегии снижения риска развития полиорганной недостаточности тяжелого сепсиса при хирургической инфекции у детей
Автор: Котляров А.Н., Чуриков В.В., Абушкин И.А.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Проблемы здравоохранения
Статья в выпуске: 1 т.13, 2013 года.
Бесплатный доступ
Исследования проведены у 242 детей с хирургическим сепсисом в возрасте от 1 месяца до 14 лет. В возрасте до 3 лет было 154 (63,6 %) и от 4 до 14 лет - 88 (36,4 %). С сепсисом наблюдали 80 (33,0 %), тяжелым сепсисом - 141 (58,3 %) и септическим шоком - 21 (8,7 %). Сепсис чаще диагностировали в группе до 3 лет 50 (39 %), тяжелый сепсис - в группе от 4 до 14 лет (70,5 %). Септический шок в младшей возрастной группе отмечен у 15 (9,7 %), против 6 (6,8 %) у детей в возрасте от 4 до 14 лет. Первым и наиболее часто повреждаемым органом при сепсисе у детей являются легкие (86,4 %), дисфункция других органов в 100 % случаев реализуется на фоне острого повреждения легких. В самом распространенном виде последовательность формирования синдрома MODS при сепсисе следующая: респираторная - сердечно-сосудистая -энцефалопатия - печеночная - почечная - иммунологическая - гематологическая дисфункции. Уровень прокальцитонина, уменьшение количества циркулирующих моноцитов, экспрессирующих активационный маркер HLA-DR+, адекватно отражает выраженность воспалительной реакции, позволяет безотлагательно назначить адекватную стартовую терапию и провести объективный мониторинг на всем периоде госпитализации.
Дети, хирургическая инфекция, сепсис
Короткий адрес: https://sciup.org/147153081
IDR: 147153081 | УДК: 616.94-053.31
Текст научной статьи Инновационные стратегии снижения риска развития полиорганной недостаточности тяжелого сепсиса при хирургической инфекции у детей
В течение последнего десятилетия достигнуты значительные успехи в изучении патофизиологических изменений в организме при критических состояниях, а также в лечении больных с синдромом мультиорганной дисфункции [3, 6, 8]. В начале 90-х годов была разработана и внедрена в клиническую практику новая концепция мультиорган-ной дисфункции (MODS) при критических ситуациях, в основе которой лежит понятие синдрома системной воспалительной реакции (SIRS), как неспецифического ответа организма на повреждающее действие, в том числе и на инфекцию [10, 11–16].
Сегодня мы понимаем под MODS тяжелую неспецифическую стресс-реакцию организма, недостаточность двух или более функциональных систем, универсальное поражение всех органов и тканей организма агрессивными медиаторами критического состояния с временным преобладанием симптомов той или иной органной недостаточности – легочной, сердечной, почечной и т. д. [1, 4, 5, 7, 9, 17]. Основной особенностью MODS является неудержимость развития повреждения органа или системы до такой глубины, после достижения которой приходится констатировать неспособность органа функционировать в интересах поддержания жизненно важных функций вообще и сохранения своей структуры в частности [20, 21].
Часто данные традиционных методов диагностики септических осложнений свидетельствуют об уже тяжелом сепсисе с развитием полиорганной недостаточности и связанного с ним целого комп- лекса глубоких функциональных и морфологических изменений в организме, что делает крайне проблематичным успех терапии и является причиной летальности [2, 18, 19]. Очевидно, что своевременная хирургическая санация очага и адекватная антибиотикотерапия и являются базовыми методами лечения больных с инфекций и сепсисом [22]. Но по-прежнему окончательно не решены такие задачи, как ранняя диагностика, оценка тяжести течения инфекционного процесса, а также мониторинг эффективности лечения тяжелого сепсиса.
Цель исследования . Мониторинг септического состояния пациентов с гнойной хирургической инфекцией с использованием маркера раннего воспаления прокальцитонинового теста и CD-типирования клеток иммунной системы. Определить последовательность формирования MODS.
Методы исследования. Клинический контроль за состоянием больных проводили по общепринятым критериям. Для объективной оценки функционального состояния органов и систем наряду с клиническими широко применялись современные методы исследования – рентгенография, ультразвуковое исследование, эндоскопия, компьютерная томография и МРТ. Для оценки системы кровообращения и транспорта кислорода осуществлялся мониторинг центральной гемодинамики (ударный индекс – УИ, сердечный индекс – СИ), общее периферическое сопротивление сосудов – ОПСС, отношение ранней и поздней волны трансмитрального кровотока исследовалось эхокардиографиче- ским методом на аппарате «Аloka SSD-650» с допплеровским пульсовым и физиологическим блоками. Для оценки мозгового кровообращения использовался метод транскраниальной допплерографии. Периферическая гемодинамика (АД, ЧСС), электрокардиография и сатурация регистрировались непрерывно на мониторе фирмы «Hellige» SMK-211. Артериовенозный коэффициент определяли на газоанализаторе ABL 550.
Для более адекватной оценки тяжести течения инфекционного процесса при поступлении пациента и в динамике исследовали уровень прокальцитонина (ПКТ) и определяли экспрессию CD14+HLA-DR+рецепторов моноцитов с использованием метода проточной цитометрии.
Результаты. В клинических условиях выделяли следующие фазы течения генерализованной хирургической инфекции: сепсис – появление 3–4 симптомов общей реакции на очаг воспаления (инфекционный SIRS) в сочетании с мультиор-ганной дисфункцией (MODS1), тяжелый сепсис сочетающийся с мультиорганными дисфукциями (MODS2, MODS3 и более) и нарушением тканевой перфузии, септический шок – тяжелый сепсис в сочетании с полиорганной недостаточностью и гипотензией (рис. 1).
В исследование были включены 242 ребенка с хирургическим сепсисом в возрасте от 1 месяца до 14 лет. В возрасте до 3 лет было 154 (63,6 %) и от 4 до 14 лет – 88 (36,4 %). С сепсисом наблюдали 80 (33,0 %), тяжелым сепсисом – 141 (58,3 %) и септическим шоком – 21 (8,7 %). Сепсис чаще диагностировали в группе до 3 лет 50 (39 %), тяжелый сепсис – в группе от 4 до 14 лет (70,5 %). Септиче- ский шок в младшей возрастной группе отмечен у 15 (9,7 %), против 6 (6,8 %) у детей в возрасте от 4 до 14 лет (см. рис. 1).
У большей части больных очаг инфекции был локализован в костях и суставах – 150 (62,0 %), легких/средостении – 61 (25,2 %) и коже/мягких тканях – 31 (12,8 %). В возрасте до 3 лет в большинстве случаев отмечено поражение костей и суставов (51,1 %) и легких – (32,8 %), напротив, в группе детей от 4 до 14 лет инфект выявлен в костях и суставах (80,7 %) и лишь у 11 (12,5 %) в легких и средостении, и у 6 (6,8 %) в мягких тканях (табл. 1).
Динамика течения генерализованной хирургической инфекции в значительной степени определяется ее тяжестью, которая в свою очередь, является результирующей от степени нарушения функционирования различных органов и систем, интенсивности «реакции защиты» в отдельных ее периодах и фазах.
Для включения в разработку больных с сепсисом мы ориентировались, как отмечалось ранее, не только на наличие 3 и более симптомов SIRS с подтверждением местного очага инфекции, органной дисфункции, c дополнительной оценкой иммунного статуса, но и на наличие хотя бы одного из нижеперечисленных признаков органной дисфункции (гипоперфузия, нарушение ментального статуса, олигурия, гипоксемия, лактоацидоз, удлинение более 5 секунд симптома «белого пятна», нитевидный пульс).
Состояние системной гемодинамики можно было квалифицировать как гипокинетический синдром. Оно сопровождалось снижением СИ и
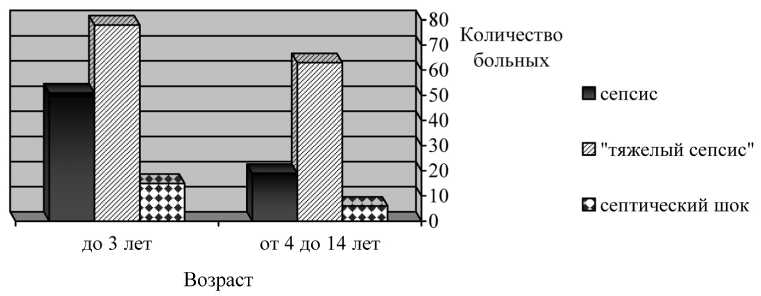
Рис. 1. Распределение больных с хирургическим сепсисом в зависимости от возраста
Таблица 1
Частота развития хирургического сепсиса у детей в зависимости от возраста и локализации очага инфекции
|
Локализация инфекта |
Возраст |
|||||
|
до 3 лет |
от 4 до 14 лет |
|||||
|
Сепсис |
Тяжелый сепсис |
Септический шок |
Сепсис |
Тяжелый сепсис |
Септический шок |
|
|
Кости/суставы |
36 (23,3 %) |
34 (22,0 %) |
9 (5,8 %) |
12 (13,6 %) |
53 (60,3 %) |
6 (6,8 %) |
|
Легкие/средостение |
15 (9,7 %) |
31 (20,1 %) |
4 (2,5%) |
5 (5,7 %) |
6 (6,8 %) |
– |
|
Кожа/мягкие ткани |
10 (6,4 %) |
13 (8,4 %) |
2 (1,2 %) |
2 (2,3 %) |
4 (4,5 %) |
— |
|
Итого |
61 (39,6 %) |
78 (50,7 %) |
15 (9,7 %) |
19 (21,6 %) |
63 (71,6 %) |
6 (6,8 %) |
Таблица 2
Частота синдромов системной органной дисфункции у детей с хирургическим сепсисом
|
Синдром системной органной дисфункции |
Возраст |
Итого, % |
|||||
|
до 3 лет |
от 4 до 14 лет |
||||||
|
Сепсис |
Т/сепсис |
С/шок |
Сепсис |
Т/сепсис |
С/шок |
||
|
Респираторная |
38 |
79 |
15 |
18 |
53 |
6 |
86,4 |
|
Энцефалопатия |
24 |
72 |
15 |
7 |
16 |
5 |
57,4 |
|
Кардиоваскулярная |
12 |
67 |
15 |
14 |
52 |
6 |
68,6 |
|
Печеночная |
3 |
11 |
9 |
1 |
5 |
3 |
13,2 |
|
Почечная |
1 |
5 |
7 |
3 |
23 |
2 |
16,9 |
|
Гематологическая |
17 |
51 |
13 |
6 |
35 |
6 |
52,9 |
|
Иммунологическая |
22 |
43 |
13 |
20 |
39 |
6 |
76,7 |
|
Нарушение функции ЖКТ |
18 |
4 |
41 |
16 |
9 |
3 |
37,6 |
Таблица 3
Распределение детей с хирургическим сепсисом в зависимости от числа MODS и критериев SIRS
|
MODS (число систем) |
Возраст |
|||||
|
до 3 лет |
от 4 до 14 лет |
|||||
|
SIRS2 |
SIRS3 |
SIRS4 |
SIRS2 |
SIRS3 |
SIRS4 |
|
|
MODS1 |
10 (6,5 %) |
32 (20,8 %) |
19 (12,3 %) |
5 (6,4 %) |
9 (1,5 %) |
5 (6,4 %) |
|
MODS2 |
6 (3,9 %) |
18 (11,7 %) |
20 (13,0 %) |
5 (6,4 %) |
4 (5,1 %) |
22 (28,2 %) |
|
MODS3 |
3 (1,9 %) |
13 (8,5 %) |
18 (11,7 %) |
3 (3,8 %) |
9 (11,5 %) |
20 (25,6 %) |
|
MODS более 3 |
– |
5 (3,2 %) |
10 (6,5 %) |
– |
2 (2,5 %) |
4 (5,1 %) |
УИ в среднем на 43 и 48 % соответственно и нарастанием ОПСС на 47 %. У больных сепсисом выявлялась циркуляторная гипоксия, характеризующаяся значимым снижением артериовенозного градиента О 2 в среднем на 60 %. Отмечалось снижение показателей церебральной гемодинамики, что и обусловило возникновение церебральной недостаточности.
Инфекционно-токсическое поражение внутренних органов (ЦНС, сердце, легкие, печень, почки, ЖКТ и др.) приводило к развитию органной дисфункции. Наиболее тяжелое течение процесса наблюдалось при поражении ЦНС, миокарда и легких.
Проведенное исследование показало, что у детей системная органная дисфункция (MODS) чаще встречалась при остром гематогенном остеомиелите – 140 (57,9 %), осложнениях острой деструктивной пневмонии – 76 (31,4 %), нагноительных заболеваниях мягких тканей – 26 (10,7 %). Наиболее часто сепсис с органной дисфункцией развивался у детей в возрасте до 3 лет – 154 (63,6 %).
Первым органом/системой – мишенью по частоте поражения были легкие (табл. 2). Синдром острого легочного поражения отмечен в 86,4 % случаев. Важной особенностью хирургического сепсиса с органной недостаточностью у детей являлась кардиоваскулярная (68,6 %) и ЦНС (57,4 %) дисфункции на фоне миокардита, перикардита и эндокардита. Дисфункция двух и более органов реализовывалась, как правило, на фоне респираторной и кардиоваскулярной недостаточности и поражении ЦНС. В 76,7 и 52,9 % случаев сепсис манифестировал с иммунологической и гематоло- гической дисфункциями, нарушением функции ЖКТ (37,6 %). Почечная и печеночная дисфункции диагностированы у 16,9 и 13,2 % пациентов.
Установлена корреляционная (r = 0,81) зависимость формирования мультиорганной дисфункции от количества критериев синдрома воспалительного ответа (табл. 3).
Для большинства больных (66,9 %) характерным являлось сочетание различных патологических синдромов. Типичные сочетания синдромов органной недостаточности демонстрирует рис. 2.
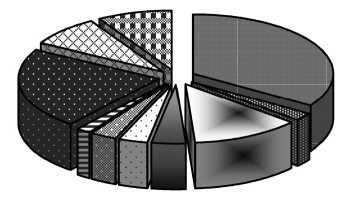
□ РД + энцефалапатия
В РД + печеночная дисфункция
В ССД । РД + энцефалопатия
-
□ РД + энцефалопатия + печеночная дисфункция
-
□ ССД + РД + почечная дисфункция
-
□ РД + энцефалопатия + почечная дисфункция
ВРД + почечная дисфункция + печеночная дисфункция
-
■ 4 и более синдрома, в т. ч.:
П шок + РД + энцефалопатия + почечная дисфункция
ЕЗ прочие
Рис. 2. Сочетание синдромов органной дисфункции при сепсисе у детей
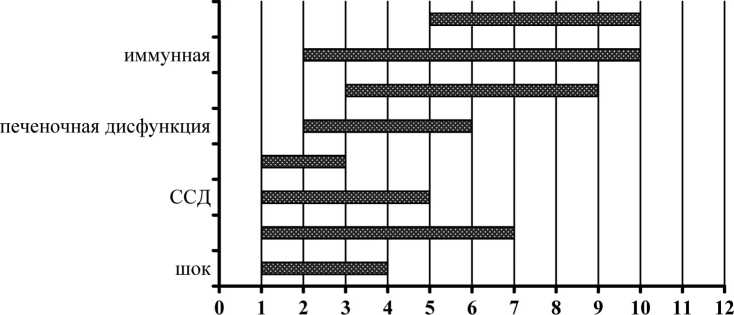
Обсуждение. Определив средние сроки появления данных синдромов на основе последовательности возникновения недостаточности органов, мы представили общую схему формирования синдрома МОDS при сепсисе у детей (рис. 3).
Наиболее распространенный вариант формирования синдрома МОDS выглядит следующим образом: респираторная – сердечно-сосудистая – энцефалопатия – печеночная – почечная – иммунологическая – гематологическая дисфункции. В то же время в зависимости от локализации первичного очага инфекции и возраста ребенка схемы развития МОDS следующие – при первичном поражении легких: респираторная – сердечно-сосудистая – энцефалопатия – печеночная – почечная дисфункция – иммунологическая – гематологическая дисфункции; при остеомиелите – шок – респираторная – сердечно-сосудистая – энцефалопатия – печеночная – почечная – иммунологическая – гематологическая дисфункции (для всех возрастов); при поражении мягких тканей – печеночная – почечная – иммунологическая – гематологическая дисфункции.
Несомненно, что вид органной недостаточности, число поражаемых систем и характер их комбинаций способны влиять на исход сепсиса. В этой связи нами была проанализирована летальность в зависимости от вида органной недостаточности и их сочетаний. При этом установлено, что главным фактором, определяющим исход болезни, является число повреждаемых систем. Значительно ухудшал состояние пациентов и прогноз заболевания – присоединение септического шока.
Определение уровня прокальцитонина служило одним из маркеров выраженности бактериального процесса. Уровень данного биомаркера оказался выше диагностического у 84 % пациентов, что соответствовало клиническим проявлениям органной дисфункции. По полученным данным уровень ПКТ до 2 нг/мл зарегистрирован у 60,2 %, что свидетельствовало скорее о течении локальных инфекционных процессов, нежели генерализованных. Тем не менее, из этой общей группы у 73,7 % пациентов уровень ПКТ превышал порог в 2 нг/мл, составляя в среднем 3,1 (3,0–4,2), при этом вероятность генерализации инфекционного процесса резко повышалась. Уровень ПКТ, превышающий порог в 5 нг/мл, зафиксирован у 66,5 %, при этом его уровень достигал в среднем 9,7 нг/мл. Анализ данных пациентов с высокими и низкими показателями ПКТ позволил выявить достоверные различия как среди клинических параметров пациентов, так и среди результатов лабораторного обследования. Высокий уровень данного маркера был обусловлен прогрессированием инфекции и развитием полиорганной недостаточности.
С целью выявления новых маркеров хирургического сепсиса у 17 пациентов с сепсисом (основная группа) и 14 детей (группа контроля) с синдромом системной воспалительной реакции (SIRS) было проведено CD-типирование клеток иммунной системы. При оценке субпопуляций лимфоцитов периферической крови у больных с сепсисом выявлено повышение абсолютных величин Т-лимфоцитов (CD3-CD19+), абсолютного содержания активированных лимфоцитов (CD3+HLA-DR+). В популяции TNK-клеток наблюдали снижение как их процентного, так и абсолютных значений, кроме того происходило падение суммарного значения Т-клеток (Т-хелперы + Т-цитотоксические) относительно других лимфоцитов. Наиболее значимые изменения происходили со стороны анти-генпредставляющей функции моноцитов, выражающиеся снижением на них экспрессии HLA-DR+ рецепторов до 26,2 ± 1,99 % против 89,0 ± 1,91 % в группе контроля. При сравнении рецепторов лимфоцитов и моноцитов у детей с SIRS отмечено повышенное значение как абсолютного, так и относительного их количества (CD45+CD14+), HLA-DR+. Со стороны фагоцитарной функции отмечены на-
Дни
Рис. 3. Динамика формирования синдромов органной дисфункции при сепсисе у детей
рушения в виде снижения фагоцитоза и фагоцитарного числа у септических больных и повышение активности фагоцитоза у пациентов с SIRS.
Заключение
-
1. Первым и наиболее часто повреждаемым органом при сепсисе у детей являются легкие (86,4 %), дисфункция других органов в 100 % случаев реализуется на фоне острого повреждения легких, в самом распространенном виде последовательность формирования синдрома MODS при сепсисе следующая – респираторная дисфункция – сердечнососудистая – энцефалопатия – печеночная – почечная – иммунологическая – гематологическая дисфункции.
-
2. Особенностью мультиорганной дисфункции у детей является высокая частота возникновения дисфункции ЦНС (57,4 %).
-
3. Программа интенсивной терапии сепсиса должна строиться с учетом тяжести состояния ребенка, структуры MODS и закономерностей развития синдромов органной недостаточности в зависимости от локализации первичного и вторичных очагов инфекции и возраста больного.
-
4. Тест на прокальцитонин в сопоставлении с температурной, гемодинамической и лейкоцитарной реакцией позволяет представить количественную характеристику выраженности системной воспалительной реакции и является предиктором синдрома полиорганной недостаточности у детей с хирургической инфекцией.
-
5. При сепсисе нарушается способность моноцитов к презентации антигенов, связанная с уменьшением относительного количества циркулирующих моноцитов, экспрессирующих активационный маркер HLA-DR+ до ≤ 30 %, что позволяет установить диагноз сепсиса на ранних стадиях его развития.
Список литературы Инновационные стратегии снижения риска развития полиорганной недостаточности тяжелого сепсиса при хирургической инфекции у детей
- Альес, В.Ф. Этиология, эпидемиология и классификация сепсиса у детей/В. Ф. Альес, П.И. Миронов, А.П. Шадчнев//Анестезиология и реаниматология. -2002. -№ 1. -С. 63-66.
- Белобородова, Н.В. Мониторинг бактериальной интоксикации по уровню микробных метаболитов/Н.В. Белобородова, А.Н. Осипов, А.Ю. Оленин//Восьмая ежегодная Московская конференция «Гнойно-септические заболевания у детей» с участием регионов России и стран СНГ 7-8 июня 2012 г., г. Москва: сб. публикаций. -М., 2012.-С. 44-54.
- Гринев, М.В. Хирургический сепсис/М.В. Гринев, М.И. Громов, В.Е. Комраков. -СПб., 2001.315 с.
- Исаков Ю. Ф. Сепсис у детей/Ю. Ф Исаков, Н.В. Белобородова. -М.: Изд. Мокеев, 2001.368 с.
- Миронов, П.И. Патогенез синдрома мультиорганной дисфункции при хирургическом сепсисе у детей и интенсивная терапия/П.И. Миронов//Дет. хирургия. -2000. -№ 2. -С. 31-35.
- Самсыгина, Г.А. Дискуссионные вопросы классификации, диагностики и лечения сепсиса в педиатрии/Г.А. Самсыгина//Педиатрия. -2003. -№ 3. -С. 35-45.
- Шабалов, П.П. Сепсис новорожденных/П. П. Шабалов, Д. О. Иванова, Н. Н. Шабалова//Новости фармакотерапии. Педиатрия. -2000. -Вып. 1.-№ 7. -С. 62-69.
- American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis//Chest. -1992. -Vol. 14, № 7. -P. 401-404.
- American College of Chest Physicians/Society of Critical Care Medicine Consensus Conference: Defmitions for sepsis and organ failure and guidelines for the of innovative therapies in sepsis; R.C. Bone, R.A. Balk, F.B. Cerra et al.//Crit. Care Med. -1992. -Vol. 20, № 6. -P. 864-874.
- Balk, R. Severe sepsis and septic shock. Definitions, Epidemiology and Clinical Manifestations/R. Balk//Crit. Care Med. -2000. -Vol. 16. -№ 2. -P. 214-226.
- Baue, A.E. Multiple organ failure, multiple organ dysfunction syndrome, and systemic inflammatory responce syndrome -Why no magic bullets?/A.E. Baue//Arch. Surg. -1997. -Vol. 132. -P. 703-707.
- Bone, R.C. Sepsis, the sepsis syndrome, multiorgan failure: a plain for comparadle definitions/R.C. Bone//Ann. Intern. Med. -1991. -Vol. 114, № 4. -P. 332-333.
- Bone, R.C. Why sepsis trials fail/R.C. Bone//JAMA. -1996. -Vol. 276. -P. 565-566.
- Cerra, F.B. Infection the inflammatory response and multiple organ dysfunction/F.B. Cerra//Surgical Infectionus Lisease/ed. R.L. Simmons. -New York: Аppeton and Lange, 1995. -P. 387-400.
- Ertel, W. Multiple organ failure/W. Ertel//Annals of surgery. -1991. -Vol. 214, № 2. -P. 141-148.
- Llewelyn, M. Diagnosis of infection in sepsis/M. Liewelyn, J. Cohen//Intens. Care Med. -2001. -Vol. 27 (suppl. 1). -P.10-32.
- Matot, I. Definition of sepsis/I. Matot, C.L. Sprung//Intens. Care Med. -2001. -Vol. 27 (suppl. 1). -P. 3-9.
- Pierrakos, C. Sepsis biomarkers: а review/C. Pierrakos, J. Vincent//Crit. Care Med. -2011. -Р. 14-15.
- Predictors mortality in stroke patients admitted to an intensive care unit/G. Rordorf, W. Koroshetz, J. Efird et al.//Crit. Care Med. -2000. -Vol. 28. -P. 1301-1305.
- TPIC II Group of Investigators. International study of theprevalence and outcomes of infections care units/J.L. Vincent, J. Rello, J. Marshall et al.//JAMA. -2009. -Vol. 302, № 21. -P. 2323-2329.
- Ytadley, S. Infections and the inflammatory response in acute respiratory distress' syndrome/S. Ytadley, T.E. Tolley, G. U. Meduri//Chest. -1997. -Vol. 111. -Р. 1306-1321.
- Zimmerman, J. Prognostic systems in intensive care: How to interpret an observed mortality that is higner than expected?/J. Zimmerman, D. Wagner//Crit. Care Med. -2000. -Vol. 28, № 4. -P. 258-258.


