Инновационный подход к хирургическому лечению ранних стадий рака молочной железы
Автор: Столяров С.А., Королева И.А., Трусова Л.А.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 2, 2025 года.
Бесплатный доступ
Органосохраняющие операции при раке молочной железы продолжают оставаться основным методом лечения на ранних стадиях заболевания. Несмотря на уменьшение объема удаления тканей, по сравнению с мастэктомией, в послеоперационном периоде могут возникать осложнения, такие как гематомы, серомы, инфекции с образованием абсцессов и некроз кожного лоскута. Все это затрудняет заживление послеоперационной раны. Цель. Улучшение хирургического метода лечения рака молочной железы на ранних стадиях. Материалы и методы. Были проанализированы данные 210 женщин с раком молочной железы стадий 0–I B. Пациенты были разделены на основную и контрольную группы. В основной группе проводилось хирургическое лечение по разработанному методу, в то время как в контрольной группе применялись стандартные клинические рекомендации. Результаты. Анализ хирургических результатов показал, что у 1,9 % пациентов основной группы был зафиксирован воспалительный инфильтрат в области послеоперационной раны, еще у 1,9 % отмечено развитие серомы. В тоже время при использовании классической хирургической техники частота возникновения осложнений в ранний послеоперационный период достигала 27,6 %. Выводы. Разработанный метод резекции молочной железы с лим-фодиссекцией продемонстрировал снижение частоты ранних послеоперационных осложнений.
Рак молочной железы, течение раневого процесса, послеоперационные осложнения
Короткий адрес: https://sciup.org/14132986
IDR: 14132986 | УДК: 617-089.844 | DOI: 10.34014/2227-1848-2025-2-55-66
Текст научной статьи Инновационный подход к хирургическому лечению ранних стадий рака молочной железы
Введение. Рак молочной железы (РМЖ) является одной из частых патологий, встречающихся у женщин детородного возраста, и занимает лидирующие позиции в структуре онкологической заболеваемости и смертности женского населения [1]. При выявлении опухоли на ранних стадиях хирургический метод лечения является приоритетным. Однако, даже несмотря на наличие новейшей аппаратуры и правильность оказания оперативного пособия, у пациенток в раннем и позднем послеоперационном периоде наблюдаются раневые осложнения. Так, длительное использование дренажа может приводить к инфицированию раны и некрозу кожного лоскута. Удаление дренажной трубки в ранний послеоперационный период может стать причиной длительно существующей серомы и нагноения раны [2, 3]. Развитие послеоперационных осложнений в свою очередь приводит к отсрочке начала адъювантной терапии, долгому периоду восстановления и увеличению сроков нахождения пациента в стационаре, ухудшению психологического и физического здоровья. По этой причине мониторинг послеоперационного периода, прогнозирование развития осложнений являются актуальными для данной категории больных.
Одним из объективных методов контроля состояния раны, который позволяет верифицировать развитие сером и абсцессов, является ультразвуковое исследование [3–5]. Минусом данного метода является констатация появившихся проблем без возможности прогнозирования.
Исследователями велись поиски других методов наблюдения за течением заживления раны (высокочастотная доплеровская ультра-соно-графия, термография, реовазография, радиотермометрия, электромиография, лазерная доплеровская флоуметрия) [5–7]. Так, группа ученых, занимающихся лечением ожоговых ран, выяснила, что те участки кожи, которые на тепловизоре были отображены как «холодные», заживали дольше и хуже [8–10]. Кроме того, выявлено, что показатель микроциркуляции также напрямую связан с заживлением раны [11–14].
В ходе исследования был разработан способ прогнозирования развития послеоперационных осложнений у пациенток с раком молочной железы на ранних стадиях, основанный на локальной термометрии и оценке микроциркуляции.
Цель исследования. Улучшение хирургического лечения первичнооперабельного рака молочной железы.
Материалы и методы. В исследовании приняли участие 210 пациенток, госпитализированных в отделение опухолей молочной железы № 1 с сентября 2020 г. по февраль 2023 г.
Критериями включения явились верифицированный диагноз РМЖ 0–IB стадий, отсутствие декомпенсации сопутствующих соматических заболеваний, наличие информированного добровольного согласия.
Критериями исключения стали наличие у пациентов РМЖ IIA–IV стадий, первичномножественных опухолей, декомпенсация сопутствующих соматических заболеваний, инъекционная наркомания.
Все пациентки по были разделены на две группы:
-
1. Основная группа – пациентки, которым было выполнено хирургическое лечение в объ-
- еме радикальной резекции молочной железы с применением разработанного доступа (n=105).
-
2. Контрольная группа – пациентки, которым было выполнено лечение согласно общепринятым клиническим рекомендациям (n=105).
Формирование групп осуществлялось методом простого рандоми-зированного отбора (простая случайная выборка). Участники были сопоставимы по возрасту, полу, сопутствующим заболеваниям, стадии основного заболевания, молекулярно-биологическому типу опухоли. Молекулярные подтипы РМЖ были определены в соответствии с классификацией, представленной в клинических рекомендациях «Рак молочной железы» Минздрава России 2020 г. [15].
Перед госпитализацией в стационар женщины проходили стандартный комплекс обследований амбулаторно.
Для оценки микроциркуляции и локальной температуры в зоне поражения молочной железы и аксиллярной области на стороне поражения использовались комплекс «ЛАКК-М» (рис. 1) и тепловизионный аппаратно-программный комплекс «ТЦР-Мед» с программой «ИК МЕД» (рис. 2). На данную методику получен патент [16].

Рис. 1. Лазерный анализатор «ЛАКК-М»
Fig. 1. LAKK-M laser analyzer
Рис. 2. Тепловизионный аппаратно-программный комплекс «ТЦР-Мед»
Fig. 2. Thermal imaging hardware and software complex "TCR-Med"
Пациентам контрольной группы были выполнены радикальная резекция молочной железы и биопсия сигнального лимфатического узла согласно традиционной методике.
Пациентам основной группы исследования операция выполнялась с применением разработанного доступа. Первым этапом двумя эллипсовидными разрезами рассекается кожа пораженной молочной железы до фасции большой грудной мышцы. Иссекается ткань молочной железы с опухолевым узлом. Вторым этапом разрез кожи продлевается до 6 см к аксиллярной области по краю большой грудной мышцы (отметка 2 на рис. 3), опускается к задней поверхности подмышечной ямки под углом 45° на протяжении 3 см (отметка 3 на рис. 3), а затем направляется к краю широчайшей мышцы спины (отметка 4 на рис. 3). Кожа и подкожная клетчатка отсепа-ровываются и отводятся кверху (отметка 5 на рис. 3). В ходе операции осуществляется изоляция вены axillaris, за которой следует диссекция жировой ткани с помощью тупфера до выявления поверхностных вен, включая латеральную грудную и торакоэпигастраль-ную. Для обеспечения полной видимости всех анатомических структур подмышечной впадины устанавливается ретрактор под малую грудную мышцу и проводится растяжение тканей у латерального края разреза. Поверхностные вены подвергаются перевязке и пересечению. Межреберно-плечевые нервы остаются нетронутыми в целях сохранения чувствительной иннервации медиальной части плеча. Лимфадено-диссекция начинается с экстирпации лимфатических узлов, находящихся под малой грудной мышцей. Важно сохранить сосудисто-нервный пучок, входящий в большую грудную мышцу с латеральной стороны, чтобы предотвратить ее атрофию. Отделение жировой ткани производится тупым способом с использованием туп-фера. По завершении диссекции жировой клетчатки и железистой ткани производится лим-фодиссекия. Устанавливается дренажная трубка, рана ушивается послойно узловыми швами. На данную методику получен патент [17].
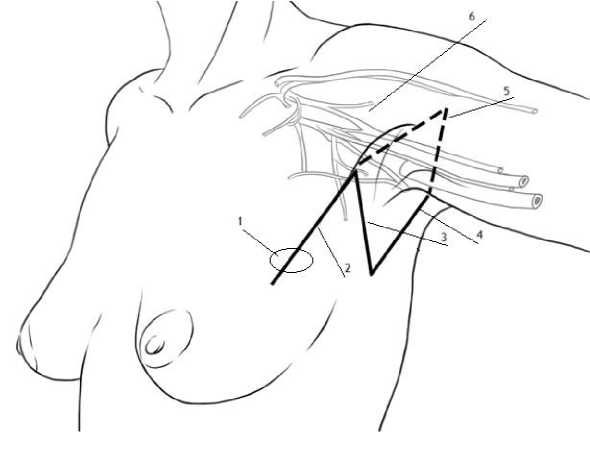
Рис. 3. Способ проведения органосохраняющей операции при раке молочной железы с локализацией опухоли в верхнем наружном квадранте: 1 – опухоль молочной железы, 2 – первая линия разреза, 3 – вторая линия разреза, 4 – третья линия разреза, 5 – отведение кожно-подкожного слоя, 6 – сосудисто-нервный пучок подмышечной ямки
Fig. 3. Method of organ-preserving surgery for breast cancer with tumor localization in the upper outer quadrant (1 – breast tumor, 2 – first incision line, 3 – second incision line, 4 – third incision line, 5 – abduction of the subcutaneous layer, 6 – neurovascular bundle of the axillary fossa)
Таблица 1
Table 1
The stage of the disease in the comparison groups
|
Стадия The TNM stage |
Основная группа, n=105 Main group, n=105 |
Контрольная группа, n=105 Control group, n=105 |
||
|
n Frequency |
% |
n Frequency |
% |
|
|
0 (TisN0M0) Stage 0 (TisN0M0) |
5 |
4,8 |
7 |
6,8 |
|
I А (pT1N0M0) Stage I А (pT1N0M0) |
40 |
38,1 |
36 |
34,3 |
|
I B (T0N1miM0) Stage I B (T0N1miM0) |
27 |
25,7 |
30 |
28,5 |
|
I B (T1N1miM0) Stage I B (T1N1miM0) |
33 |
31,4 |
32 |
30,5 |
|
Всего Total |
105 |
100 |
105 |
100 |
Таблица 2
Table 2
Distribution of concomitant diseases in comparison groups
Результаты и обсуждение. Возраст пациентов на момент постановки диагноза варьировал от 23 до 72 лет (медиана – 40 лет; среднее значение – 41,46 года, стандартное отклонение – 9,81). Все пациенты были рас-
пределены по стадиям основного заболевания согласно классификации злокачественных опухолей TNM; стадирование проводилось согласно клиническим рекомендациям (табл. 1).
Характеристика пациентов по стадиям основного заболевания
Пациенты основной и контрольной групп были сопоставимы по стадиям основного заболевания.
ственно. У пациентов обеих групп в качестве сопутствующей патологии наблюдалось такое заболевание, как варикозная болезнь вен нижних конечностей: в основной группе – у 44 чел., в контрольной – у 42 чел. Облитерирующий атеросклероз аорты зарегистрирован у 22 пациентов в каждой группе. Также в обеих группах выявлено ожирение I и II степени. Кроме того, у 26 участников основной группы и 25 участников контрольной группы диагностирована грыжа пищеводного отверстия диафрагмы. Все сопутствующие заболевания находились вне обострения. Статистический анализ не выявил значимых различий между группами (табл. 2).
Характеристика пациентов по сопутствующим заболеваниям
Всем пациентам выполнялось иммуногистохимическое исследование для определения рецепторного статуса заболевания (ER, PR, HER2, Ki-67).
Результаты показали, что люминальный А-подтип встречался у 23 (22 %) женщин основной группы и 21 (20 %) женщин контроль-
ной группы, люминальный В (HER2-позитив-ный) – у 21 (20 %) и 22 (21 %) чел., люминальный В (HER2-негативный) – у 22 (21 %) и 21 (20 %) чел., тройной негативный рак – у 19 (18 %) и 19 (18 %) чел., нелюминальный (HER2-позитивный) – у 20 (19 %) и 22 (21 %) пациенток соответственно (табл. 3).
Таблица 3
Table 3
Molecular biological subtypes of tumors in comparison groups
|
Молекулярный подтип опухоли Molecular tumor subtype |
Основная группа, n=105 Main group, n=105 |
Контрольная группа, n=105 Control group, n=105 |
||
|
n Frequency |
% |
n Frequency |
% |
|
|
Люминальный А Luminal A |
23 |
22 |
21 |
20 |
|
Люминальный В (HER2-негативный) luminal B, HER2-negative |
22 |
21 |
21 |
20 |
|
Люминальный В (HER2-позитивный) Luminal B, HER2-positive |
21 |
20 |
22 |
21 |
|
Тройной негативный фенотип Triple negative phenotype |
19 |
18 |
19 |
18 |
|
Нелюминальный (HER2-позитивный) Non-luminal (HER2-positive) |
20 |
19 |
22 |
21 |
Молекулярно-биологические подтипы опухолей в группах пациентов
Пациенты основной и контрольной групп были сопоставимы по молекулярным подтипам опухоли.
Для межгруппового сравнения течения раневого процесса после оперативного лечения применялся способ прогнозирования развития раневых осложнений, основанный на измерении локальной температуры и анализе показателей микроциркуляции.
Оценка микроциркуляции производилась в процессе ежедневных перевязок в разные сроки госпитализации. За нормальные принимали значения, равные 17,5–27,1 перф. ед.; они сопровождали благоприятное течение раневого
процесса без раневых осложнений. В результате исследования было установлено соответствие между степенью отклонения значений показателя микроциркуляции и заживлением послеоперационной раны. При значении показателя микроциркуляции от 7,0 до 17,4 перф. ед. отмечались воспалительные изменения в области послеоперационной раны; при выявлении значений менее 6,9 перф. ед. имели место усиление лимфостаза, рост отека верхней конечности со стороны оперативного вмешательства. при значениях выше 27,1 перф. ед. – увеличение количества геморрагического отделяемого из раны (табл. 4).
Таблица 4
Table 4
Wound condition and microcirculation parameters at the surgical site
|
Показатель микроциркуляции, перф. ед. Microcirculation parameters, perf. units |
Состояние раны Wound condition |
|
17,5–27,1 |
Раневые осложнения отсутствовали, фазы раневого процесса протекали гладко. No wound complications; smooth phases of the wound healing process |
|
8,5–17,4 |
Наблюдались воспалительные изменения в ране, эпителиза-ция укладывалась в сроки нормального заживления. Inflammatory changes in the wound; epithelialization within the normal wound healing period |
|
7,0–8,4 |
Сроки заживления раны затягивались. Наблюдалось увеличение срока госпитализации пациента. Delayed wound healing. Increased hospitalization period |
|
<6,9 |
Наблюдалось скопление отделения лимфотической жидкости в месте выполнения лимфодиссекции. Accumulation of lymphatic fluid at the site of lymph node dissection |
Во время ежедневного мониторинга было установлено, что показатель микроциркуляции в контрольной группе увеличивался с третьих суток госпитализации на 2,1±1,5 перф. ед. В месте операции отмечались боли, гиперемия и гипертермия кожных покровов.
Пациентки обеих групп также проходили ультразвуковое исследование мягких тканей
операционного поля, которое обнаруживало гипо- и изоэхогенную зону с нечеткими неровными контурами, неоднородную по структуре.
Виды раневых осложнений, показатели микроциркуляции и локальной термометрии представлены в табл. 5.
Таблица 5
Table 5
Соотношение показателей микроциркуляции и локальной термометрии при различных осложнениях
Ratio of microcirculation and local thermometry parameters in comparison groups
При анализе интраоперацинной кровопотери было установлено, что у пациентов контрольной группы средний объем кровопотери составил 52,32 мл, в то время как у пациентов основной группы – 41,43 мл. Среднее снижение кровопотери при втором типе операции составило 22,92 %.
Осложнения после хирургического вмешательства классифицировались как ранние и поздние. Негативные явления, обнаружившиеся в первые семь дней после операции, относились к категории ранних осложнений. В контрольной группе на 2-е сут послеоперационного периода
было выявлено 2 случая подкожных гематом в месте операции (1,5×1,5 см и 2,0×1,0 см). В основной группе подобных осложнений не было. Также у 12 пациенток контрольной группы наблюдался воспалительный инфильтрат в ак-силлярной области (в 1 случае размеры инфильтрата составили более 4 см, разрешение протекало медленно, несмотря на антибактериальную терапию и местное лечение). В основной группе инфильтрат имел место только у 2 чел. (табл. 6). Серома мягких тканей в области операционной раны в основной группе наблюдалась у 2 пациентов, а в контрольной – у 15 чел.
|
Показатель Parameter |
Основная группа, n=105 Main group, n=105 |
Контрольная группа, n=105 Control group, n=105 |
Уровень значимости различий (p) Significance level (р) |
|
Воспалительный инфильтрат в месте операции Surgical site infiltration |
|||
|
Локальная температура, °С Local temperature, °С |
38,5–38,9 |
38,7–39.1 |
0,000010 |
|
Микроциркуляция, перф. ед. Microcirculation, perf. unit |
14,2–16,5 |
14,1–16,7 |
0,0010 |
|
Серома мягких тканей в области операционной раны Soft tissue seroma in the surgical wound site |
|||
|
Локальная температура, °С Local temperature, °С |
37,9–39,1 |
37,6–38,1 |
0,0010 |
|
Микроциркуляция, перф. ед. Microcirculation, perf. unit |
14,0–15,4 |
14,1–15,6 |
0,0010 |
Таблица 6
Table 6
|
Осложнение Complications |
Основная группа, n (%) Main group, n (%) |
Контрольная группа, n (%) Control group, n (%) |
|
Гематома операционной раны Surgical wound hematoma |
0 (0,00) |
2 (1,9) |
|
Воспалительный инфильтрат в области послеоперационной раны Inflammatory infiltration in the postoperative wound |
2 (1,9) |
12 (11,4) |
|
Серома мягких тканей в области операционной раны Soft tissues seroma in the surgical wound |
2 (1,9) |
15 (14,2) |
|
Всего Total |
4 (3,8) |
29 (27,6) |


