Инструментальные особенности дифференциальной диагностики метаболически ассоциированной и неалкогольной жировой болезней печени
Автор: Венидиктова Д. Ю., Борсуков А. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
С учетом отсутствия единого мнения между различными научными группами о природе и единстве патоморфологического субстрата заболеваний неалкогольной (НАЖБП) и метаболически ассоциированной жировой болезни печени (МАЖБП) возникает необходимость поиска новых инструментальных методов их дифференциальной диагностики для разработки корректной тактики лечения и мониторинга.Цель: оценить возможности использования комплексного применения инструментальных методов диагностики для дифференциальной диагностики МАЖБП и НАЖБП.Материал и методы. В исследовании приняли участие 94 пациента многопрофильного стационара с наличием сочетания ультразвуковых признаков стеатоза печени в В-режиме. В рамках двух этапов диагностического обследования использованы клинико-лабораторно-инструментальные методы, в том числе блок ультразвуковой диагностики (оценка толщины висцерального жира, количественная стеатометрия печени, двухмерная эластография сдвиговых волн печени), двухэнергетическая рентгеновская абсорбциометрия (ДРА) в режиме «Все тело». В контрольную группу вошли 78 пациентов без признаков стеатоза печени по данным ультразвукового исследования (УЗИ) в В-режиме.Результаты. Все пациенты были разделены на группы с учетом наличия у них признаков метаболического синдрома (МС), с последующим распределением на условные группы пациентов с НАЖБП и МАЖБП с выделением основных признаков обоих заболеваний. МС выявлен у 24 женщины (29,27%), 18 мужчин (21,95%). У 53 пациентов (64,63%) количественно подтвердилось наличие стеатоза печени, из них у 39 пациентов обнаружены избыточная масса жира или ожирение (47,56%).Заключение. Определены показатели инструментальной оценки метаболического статуса, комплексный диагностический алгоритм, позволяющие проводить дифференциальную диагностику между НАЖБП и МАЖБП с количественной оценкой стеатоза печени.
Сердце, ишемия, реперфузия, эритропоэтин
Короткий адрес: https://sciup.org/149142835
IDR: 149142835 | УДК: 616.36-003.826:616-008.9]-072-079.4 | DOI: 10.29001/2073-8552-2023-38-2-209-217
Текст научной статьи Инструментальные особенности дифференциальной диагностики метаболически ассоциированной и неалкогольной жировой болезней печени
Жировая болезнь печени – патология, которая на протяжении долгого времени (начиная с XVI в.) фигурировала в работах врачей и ученых как социально значимое заболевание. Благодаря изучению исторических аспектов становится возможным построение рациональной последовательности действий в условиях функционирования современной клинической практики, направленной как на поиск новых и совершенствование имеющихся методов диагностики, так и на лечение данного заболевания у определенных групп пациентов.
Еще в 1543 г. А. Везалий впервые допустил мысль о взаимосвязи между увеличением размера печени и склонностью пациентов к «пьянству и обжорству», в 1980 г. был введен термин «неалкогольный стеатогепатит», и только в 2020 г. на мировом уровне научным сообществом был поднят вопрос о корректности терминологии и важности построения различий между основными патогенетическими факторами развития и клиническими проявлениями жировой болезни печени [1, 2]. Данный международный консенсус среди экспертов утвердил термин «Метаболически ассоциированная жировая болезнь печени» (МАЖБП), косвенно поставив вопрос о синонимичности терминов неалкогольная жировая болезнь печени (НАЖБП) и МАЖБП и возможности замены устаревшего термина НАЖБП.
Однако за прошедшие два года появились исследования, которые обосновывают важность проведения границы между двумя этими патологиями и терминами соответственно, что также подтверждается наличием новых клинических рекомендаций [3, 4]. Так, если НАЖБП явля- ется «негативным диагнозом» (диагнозом исключения): отсутствие в анамнезе приема алкоголя сверх установленной относительно безопасной нормы, лекарственных препаратов, провоцирующих развитие стеатоза печени (тамоксифен, метотрексат и др.), отсутствие вирусной этиологии гепатита, отсутствие генетических заболеваний, метаболических нарушений, то МАЖБП рассматривается как «позитивный диагноз» (диагноз включения): наличие избыточной массы тела или ожирения, сахарного диабета (СД), как минимум двух факторов риска развития метаболического синдрома (МС) [5].
Говоря о принципиальности различия между двумя обозначенными нозологиями, следует упомянуть о необходимости акцентирования внимания именно на системности и многофакторности патогенеза поражения печени для последующей персонализации как направления, так и объема лечебно-диагностической помощи с учетом различных вариантов МАЖБП-коморбидности. При этом распространенность клинико-морфологической формы стеатогепатита в данной группе значительно повышается – если в общей популяции распространенность стеатоза печени еще в 2013 г. составляла 20–30%, а стеатогепати-та 2–5%, то в группе пациентов с ожирением этот уровень увеличивается до 60–95% и 15–55% соответственно, а в группе пациентов с СД 2-го типа – до 60–80% и 20–80% соответственно [6]. Предполагается, что разделение представленных понятий будет способствовать снижению заболеваемости на 25% с учетом большего внимания к сопутствующей патологии [7]. Для этого необходимо уделять отдельное внимание вопросам избыточной массы тела и ожирения для предотвращения накопления жира в гепатоцитах с последующим запуском каскада воспалительных и метаболических изменений [8–11].
Существует стандартная программа инструментальной диагностики жировой болезни печени: ультразвуковое исследование (УЗИ) – мультиспиральная компьютерная томография (МСКТ) – магнитно-резонансная томография (МРТ) – биопсия печени, имеется неинвазивная скрининг-система биоимпедансометрии печени. В настоящий момент актуальное значение приобретает ультразвуковая стеатометрия, двухэнергетическая рентгеновская абсорбциометрия (ДРА) в режиме «Все тело», протонная магнитно-резонансная спектроскопия, цветовой колорайзинг печени при МСКТ.
В настоящее время имеется необходимость поиска новых комплексных диагностических алгоритмов, позволяющих на ранних этапах не только дифференцировать НАЖБП и МАЖБП, но также количественно определить стеатоз печени, наличие воспалительных, фиброзных изменений, выявить наличие факторов риска развития МС.
Цель исследования: оценить возможности использования комплексного применения инструментальных методов для дифференциальной диагностики МАЖБП и НАЖБП.
Материал и методы
На клинической базе Проблемной научно-исследовательской лаборатории «Диагностические исследования и малоинвазивные технологии» ФГБОУ ВО «Смоленский государственный медицинский университет» Министерства здравоохранения Российской Федерации – ОГБУЗ «Клиническая больница № 1» в период 2021–2022 гг. проведено исследование с участием 94 пациентов много- профильного стационара (отделения: гастроэнтерологическое, хирургическое, пульмонологическое, неврологическое), из них 49 мужчин (52,13%), 45 женщин (47,87%) в возрасте от 18 до 65 лет, европеоидной расы. Критерий включения: наличие сочетания ультразвуковых признаков стеатоза печени в В-режиме (повышение эхогенности, снижение звукопроводимости). Критерии исключения: вирусные гепатиты, поражение печени алкогольной, лекарственной этиологии.
В контрольную группу включены пациенты многопрофильного стационара ( n = 78) без ультразвуковых признаков (В-режим) стеатоза печени, из них 38 мужчин (48,71%), 40 женщин (51,28%) в возрасте от 18 до 65 лет, европеоидной расы. Контрольная группа в полном составе проходила 1-й и 2-й этапы обследования с последующей проверкой гипотезы об отсутствии у них НАЖБП или МАЖБП. Исследование включало в себя два этапа (рис. 1).
-
1-й этап. Клинико-лабораторный. Сбор жалоб, анамнеза жизни и заболевания, ответов на опросники (CAGE, AUDIT), общие анализы крови и мочи, биохимический анализ крови [12, 13].
На основании 1-го этапа 12 пациентов были исключены из исследования: 9 пациентов с наиболее вероятной алкогольной этиологией жировой болезни печени (9,57%), 2 пациента с подтвержденным вирусным гепатитом С (2,13%), 1 пациент с приемом тамоксифена в анамнезе (1,06%). 82 пациента (40 мужчин (48,78%), 42 женщины (51,22%)) отправлены на 2-й этап исследования.
-
2-й этап. Клинико-лабораторно-инструментальное обследование по единому диагностическому алгоритму:
-
2.1. Физикальное обследование пациента с измерением объема талии (ОТ) (см), окружности бедер (ОБ) (см), вычислением соотношения ОТ/ОБ [14], определение уровня артериального давления (АД) (мм рт. ст.).
-
2.2. Лабораторные методы обследования (липи-дограмма с определением уровня триглицеридов (ТГ) липопротеидов высокой плотности (ЛПВП), липопротеидов низкой плотности (ЛПНП) и С-реактивный белок (СРБ)).
-
2.3. УЗИ было выполнено на оборудовании разных фирм-производителей и разного уровня экспертности для снижения уровня субъективизма за счет аппаратозависимых факторов – БИОСС Ангиодин-Соно/П-Ультра (Россия), конвексный датчик 3,5 МГц, Mindray Resona 7 (Китай), конвексный датчик 5 МГц и TELEMED, MLS (Литва), конвексный датчик 3,5 МГц:
Б. УЗ-оценка коэффициента затухания ультразвуковой волны (дБ/см) в печени (количественная ультразвуковая стеатометрия) с последующем определением выраженности стеатоза печени (S0 – стеатоз отсутствует; S1 – минимально выраженный стеатоз; S2 – умеренно выраженный стеатоз; S3 – максимально выраженный стеатоз) [17].
о

2 этап
2 stage анамнеза Collection of complaints,
Основная группа Main group
Проверка гипотезы об отсутствии НАЖБП и МАЖБП Testing the hypothesis of the absence of NAFLD and MAFLD
о
Опросники Questionnaires (CAGE, AUDIT)
Л Общий анализ^ крови и мочи General analysis of
V_ blood, urine J
Б/х анализ крови Blood chemistry
ОТ, ОБ, ОТ/ОБ Waist, hips, W/H
АД
Blood pressure
Липидограмма Lipidogram
СРБ C-reactive protein
УЗД Ultrasound
^ДРА «Все тело» Dual energy x-ray absorbtiometry
4 "Whole Body"
Разделение на НАЖБП и МАЖБП MAFLD and NAFLD differentiation
Рис. 1. Схема дизайна исследования (подробное описание в тексте)
Примечание: ОТ – объем талии, ОБ – объем бедер, АД – артериальное давление, СРБ – С-реактивный белок, УЗД – ультразвуковая диагностика, ДРА – двухэнергетическая рентгеновская абсорбциометрия, НАЖБП – неалкогольная ассоциированная жировая болезнь печени, МАЖБП – метаболически ассоциированная жировая болезнь печени.
Fig. 1. Study design (detailed description in the text)
Note: W/H – waist, hips, MAFLD – metabolically associated fatty liver disease, NAFLD - non-alcoholic associated fatty liver disease.
-
В. Двумерная ультразвуковая эластография сдвиговых волн (2D-SWE) печени с определением жесткости (кПа) и последующим соотнесением со стадией фиброза печени по шкале METAVIR (F0–F4, где F0 оценивался как отсутствие фиброза, F1 – клинически незначимый фиброз, F2 – клинически значимый фиброз печени, F3 – выраженный фиброз печени, F4 – цирроз печени) c учетом данных Европейских рекомендаций по эластографии печени 2017 г. [18].
-
2. 4. ДРА в режиме «Все тело», оборудование Stratos DR (Франция) с оценкой показателей: общий вес тела (кг), индекса массы тела (ИМТ) (кг/м2), индекса массы жира (ИМЖ) (кг/м2), скорость метаболизма (ккал/день), общее количество жировой ткани (%), процентное соотношение жира в андроидной и гиноидной областях, площадь висцеральной и подкожной жировой ткани (см2), их масса (кг), объем (см3), соотношение ПЖТ и ВЖТ (структура абдоминального ожирения) [19]. Технические характеристики исследования: разрешение по осям Х и Y – 2 мм, напряжение 90 кВ, сила тока 0,1 мА, скорость движения – 280 мм/c.
Биопсия печени с последующим гистологическим исследованием по шкале SAF пациентам не проводилась с учетом инвазивности процедуры, низкой комплаентно-сти пациентов, возможности возникновения осложнений, превышения размера потенциального риска над потенциальной пользой, доказанной рядом научных групп, высокой корреляции с показателями ДРА в режиме «Все тело», количественной ультразвуковой стеатометрии [20]. HOMA-индекс (как показатель инсулинорезистентно- сти) не оценивался в связи с отсутствием его применения в рутинной клинической практике.
Статистический анализ был проведен с использованием программ Microsoft Office Excel 2017. Количественные данные представлены средними значениями и стандартными отклонениями, mean ± SD . Категориальные показатели представлены абсолютными ( n ) и относительными (в %) частотами встречаемости. Для оценки статистической значимости различий количественных показателей в основной и контрольной группах использовались t -критерий и критерий Манна – Уитни. Категориальные показатели сравнивались по χ 2 -критерию Пирсона. Были исследованы различия количественных показателей: ОТ/ОБ, ИМЖ, процент жировой массы, соотношение андроидной и гиноидной жировой массы, толщина висцерального жира, коэффициент затухания ультразвуковой волны в тканях, жесткость печени по данным ультразвуковой эла-стографии. Пороговый уровень значимости при проверке статистических гипотез составлял p = 0,05.
Результаты и обсуждение
После двух этапов диагностического клинико-лабораторно-инструментального исследования все пациенты были разделены на группы с учетом наличия у них признаков МС, с последующим распределением на условные группы пациентов с НАЖБП и МАЖБП с выделением основных признаков обоих заболеваний. Доля пациентов разного пола от общего числа пациентов в основной исследуемой группе с учетом основных критериев МС представлена в таблице 1.
Таблица 1. Распределение критериев метаболического синдрома среди пациентов исследуемой группы
Table 1. Distribution of metabolic syndrome criteria among patients of the study group
|
Критерий / Criteria |
Мужчины ( n /%) / Men ( n /%) |
Женщины ( n /%) / Women ( n /%) |
|
Основной / Main |
||
|
ОТ > 94 см у мужчин и > 80 см у женщин Waist > 94 cm in men > 80 cm in women |
21/25,61 |
28/34,15 |
|
Дополнительные / Additional |
||
|
АД > 140/90 мм рт. ст. BP > 140/90 мм рт. ст. |
19/23,17 |
27/32,93 |
|
ТГ > 1,7 ммоль/л TG > 1,7 mmol/l |
17/20,73 |
24/29,27 |
|
ЛПВП < 1,0 ммоль/л у мужчин и < 1,2 ммоль/л у женщин HDL < 1,0 mmol/l in men < 1,2 mmol/l in women |
16/19,51 |
24/29,27 |
|
ЛПНП > 3,0 ммоль/л LDL > 3,0 mmol/l |
18/21,95 |
23/28,05 |
|
Глюкоза плазмы натощак 6,1–7,0 ммоль/л Fasting glucose 6,1–7,0 mmol/l |
18/21,95 |
24/29,27 |
Примечание: критерии МС согласно клиническим рекомендациям по ведению больных с МС 2013 года (утверждены Российским медицинским обществом по артериальной гипертензии и профильной комиссией по кардиологии). Наличие основного и как минимум двух дополнительных критериев свидетельствует о наличии у пациента МС. ОТ – объем талии, АД – артериальное давление, ТГ – триглицериды, ЛПВП – липопротеиды высокой плотности, ЛПНП – липопротеиды низкой плотности.
Note: MS criteria according to the 2013 clinical guidelines for the management of patients with MS (approved by the Russian Medical Society for Arterial Hypertension and the profile commission on cardiology). The presence of the main and at least two additional criteria indicates the presence of MS in the patient. BP – Blood pressure, TG – triglycerides, HDL – high density lipoproteins, LDL – low density lipoproteins.
В рамках исследования по комбинации основного и как минимум двух дополнительных диагностических критериев МС был выявлен у 42 пациентов (51,22%), из них у 24 женщин (29,27%), 18 мужчин (21,95%). Общий вид комплекса блока УЗИ представлен на рисунке 2.
Распределение пациентов основной исследуемой группы с учетом их пола и толщины висцерального жира (мм) по данным УЗИ в В-режиме по описанной методике представлено на рисунке 3А, с учетом выраженности стеатоза печени (дБ/см) по данным количественной ультразвуковой стеатометрии с оценкой коэффициента затухания ультразвуковой волны в ткани – на рисунке 3Б.
Так, у части пациентов ( n = 13; 30,95%) с нормальной массой жира по данным ДРА ( n = 42; 100%) в режиме «Все тело» был выявлен стеатоз печени 1-й степени (2,2–2,49 дБ/cм). В этой подгруппе пациентов не было обнаружено признаков МС, что позволило отнести их в группу пациентов с НАЖБП.
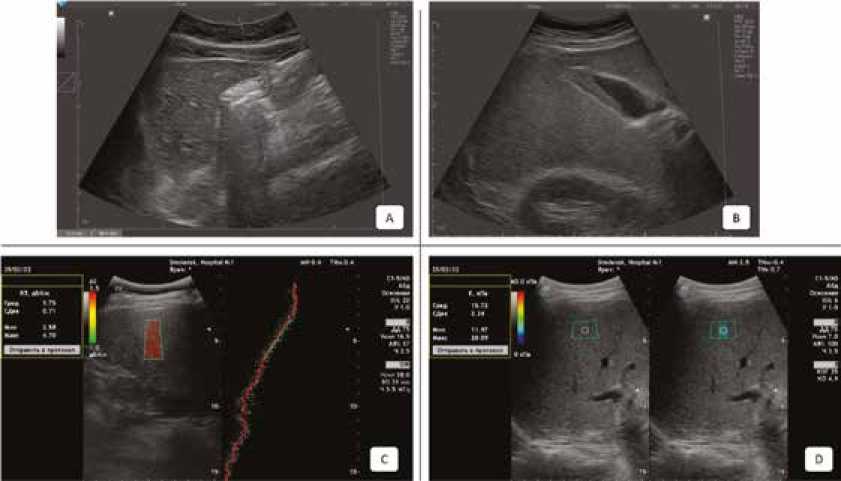
Рис. 2. Пример проведенного обследования в рамках блока ультразвуковой диагностики: А – ультразвуковая оценка печени в В-режиме (эхогенность повышена, звукопроводимость снижена), B – ультразвуковая оценка толщины висцерального жира (мм, висцеральное ожирение), C – количественная ультразвуковая стеатометрия печени c оценкой коэффициента затухания (3,75 ± 0,71 дБ/см – S3 – выраженный стеатоз печени), D – двумерная ультразвуковая эластография сдвиговых волн печени 2D-SWE (15,72 ± 2,24 кПа – F4 – цирроз печени)
Fig. 2. An example of a survey performed within the framework of an ultrasound diagnostics unit: A – ultrasound assessment of the liver in B-mode (echogenicity is increased, sound conductivity is reduced), B – US assessment of visceral fat thickness (mm, visceral obesity), C – quantitative ultrasound steatometry of the liver with an assessment of the attenuation coefficient (3.75 ± 0.71 dB/cm – S3 – pronounced liver steatosis), D – two-dimensional ultrasound elastography of shear waves of the liver 2D-SWE (15.72 ± 2.24 kPa – F4 – cirrhosis of the liver)
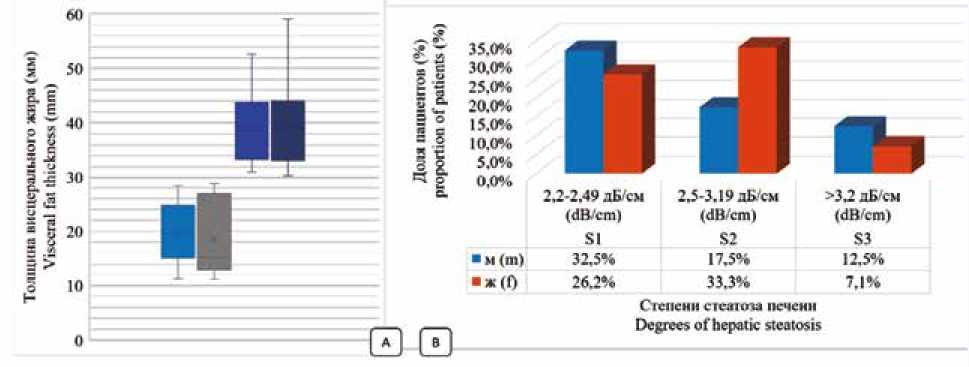
Рис. 3. Распределение пациентов основной исследуемой группы по результатам ультразвукового исследования: А – по толщине висцерального жира (мм), B – по выраженности стеатоза печени (дБ/см)
Fig. 3. Distribution of patients of the main study according to the results of ultrasound examination: A – by the thickness of visceral fat (mm), B – according to the severity of liver steatosis (dB/cm)
Из 40 мужчин основной исследуемой группы у 25 (62,5%) по данным количественной ультразвуковой сте-атометрии обнаружен стеатоз печени. Из 42 женщин основной исследуемой группы у 28 (66,6%) по данным количественной ультразвуковой стеатометрии обнаружен стеатоз печени.
Таким образом, комплексное УЗИ более чувствительно по сравнение с УЗИ в В-режима изолированно.
По данным биохимического анализа крови у 13 пациентов основной исследуемой группы (15,85%) обнаружено повышение уровня печеночных ферментов (АЛТ, АСТ) выше пороговых значений, что позволяет отнести этих пациентов в группу на стадии стеатогепатита.
По данным двумерной ультразвуковой эластографии сдвиговых волн у 6 пациентов (7,32%) выявлен фиброз печени F1–F2, у 2 пациентов (2,44) – фиброз печени F3. Цирроз печени по данным ультразвуковой эластографии обнаружен не был.
Толщина ВЖТ (мм), оцененная при использовании ДРА в режиме «Все тело», имеет прямую пропорциональную связь со степенью стеатоза печени по данным количественной ультразвуковой стеатометрии.
Методика ручной разметки жировой ткани после автоматического оконтуривания для корректного расчета структуры абдоминального жира при выполнении ДРА в режиме «Все тело» представлена на рисунке 4.
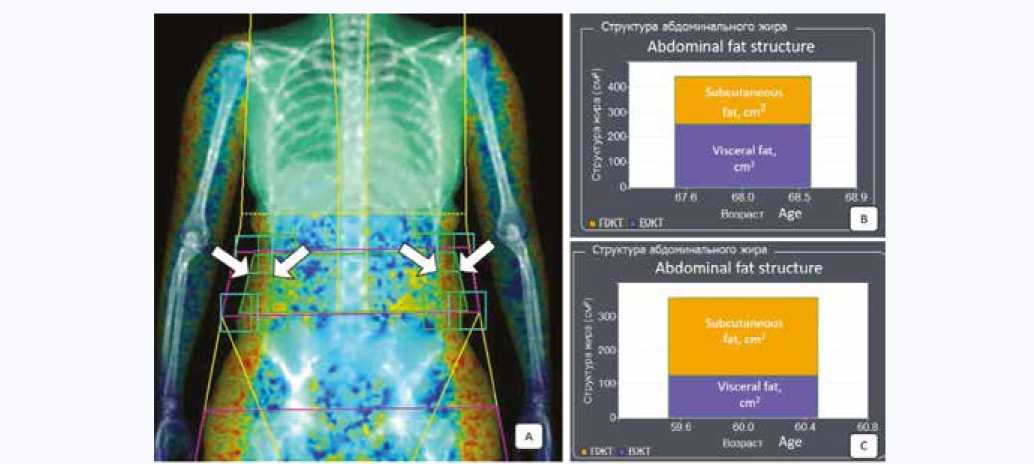
Рис. 4. Оценка структуры абдоминального жира при двухэнергетической рентгеновской абсорбциометрии в режиме «Все тело»: А – стрелками указаны корректные трапециевидные боксы (зеленого цвета) ручной разметки подкожной жировой ткани, B – структура абдоминального жира (см2) с преобладанием висцеральной жировой ткани (ВЖТ), C – структура абдоминального жира (см2) с преобладанием подкожной жировой ткани (ПЖТ) Fig. 4. Assessment of the abdominal fat structure using dual-energy X-ray absorptiometry in the “Whole body” mode: A – the arrows indicate the correct trapezoid boxes (green) for manual marking of subcutaneous adipose tissue, B – the structure of abdominal fat (cm2) with a predominance of visceral adipose tissue (VAT), C – the structure of abdominal fat (cm2) with a predominance of subcutaneous adipose tissue (SAT)
Распределение пациентов исследуемой группы с уче- минального жира в каждой из групп с учетом ИМЖ пред-том ИМЖ и доля висцерального жира в структуре абдо- ставлено на рисунке 5.
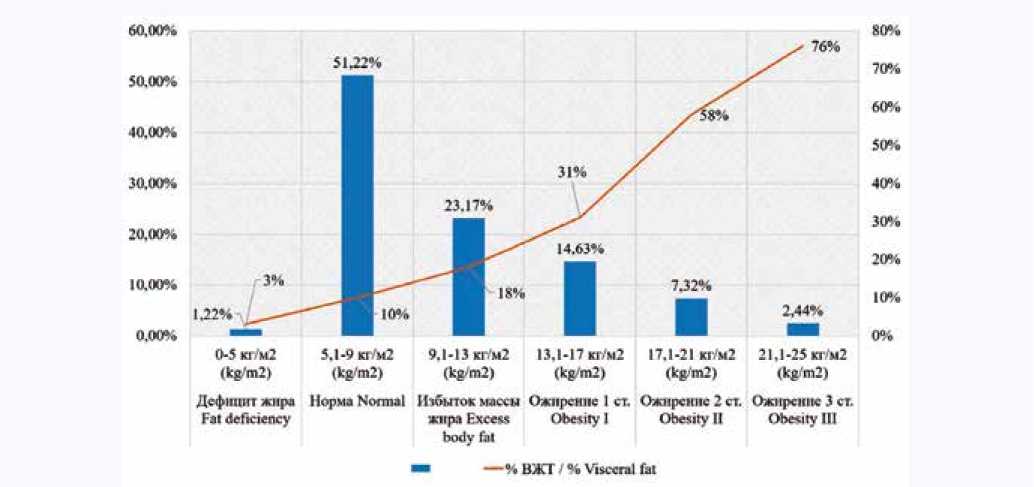
Рис. 5. Распределение пациентов исследуемой группы с учетом индекса массы жира и доля висцеральной жировой ткани в общей структуре абдоминального жира
Fig. 5. Distribution of patients of the study group according the fat mass index and the proportion of visceral adipose tissue in the overall structure of abdominal fat
Так, доля ВЖТ увеличивается с ростом ИМЖ преимущественно у пациентов мужского пола, исключение составили женщины в возрасте старше 40 лет. Итого у 53 пациентов (64,63%) количественно подтвердилось наличие стеатоза печени, из них у 39 пациентов обнаружены избыточная масса жира или ожирение (47,56%). У
8 (9,76%) пациентов площадь ВЖТ превышала ПЖТ, что позволяет отнести этих пациентов в группу высокого риска развития осложнений коморбидной патологии.
Таким образом, при использовании комплексного диагностического алгоритма возможна дифференциальная диагностика между НАЖБП и МАЖБП (табл. 2).
Таблица 2. Инструментальные диагностические признаки неалкогольной и метаболически ассоциированной жировой болезни печени
Table 2. Instrumental diagnostic features of non-alcoholic and metabolically associated fatty liver disease
|
Метод исследования The diagnostic method |
НАЖБП NAFLD |
МАЖБП MAFLD |
|
Ультразвуковая оценка толщины висцерального жира, мм Ultrasound evaluation of visceral fat thickness, mm |
< 30 |
> 30 |
|
Количественная ультразвуковая стеатометрия печени c оценкой коэффициента затухания, дБ/см* Quantitative ultrasound steatometry with evaluation of attenuation parameter, dB/cm |
2,2–2,49 (S1) 2,5–3,19 (S2) > 3,2 (S3) |
|
|
Двумерная ультразвуковая эластография сдвиговых волн печени 2D-SWE, кПа 2D ultrasound shear wave elastography, kPa |
< 7,0 (F0 – F1) 7,1–8,0 (F2) 8,0–10,1 (F3) > 10,1–11,7 (F4) |
|
|
ДРА в режиме «Все тело» DXA in “Whole body” mode |
Нет изменений в структуре абдоминального жира No changes in abdominal fat structure |
Есть изменения в структуре абдоминального жира Changes in abdominal fat structure |
Примечание: установленные оптимизированные пороговые значения показателей количественной ультразвуковой стеатометрии печени определены в рамках выполненной диссертации на соискание ученой степени кандидата медицинских наук Венидиктовой Д.Ю. (2022 г.). НАЖБП – неалкогольная жировая болезнь печени, МАЖБП – метаболически ассоциированная жировая болезнь печени, ДРА – двух-энергетическая рентгеновская абсорбциометрия.
Note: the established optimized threshold values for indicators of quantitative ultrasound steatometry of the liver were determined in the framework of the completed dissertation for the degree of Candidate of Medical Sciences Venidiktova D.Yu. (2022). NAFLD – non-alcoholic fatty liver disease, MAFLD – metabolically associated fatty liver disease, DXA – dual-energy X-ray absorbtiometry.
Заключение
Пациенты с признаками стеатоза печени имеют различные показатели инструментальной оценки метаболического статуса, что позволяет говорить о возможности разделения единой нозологии на подгруппы – НАЖБП и МАЖБП. Для МАЖБП характерна толщина ВЖТ более 30 мм, андроидный тип ожирения, наличие изменений в структуре абдоминального жира (преобладание площади ВЖТ над ПЖТ).
Для дифференциальной диагностики НАЖБП и МАЖБП может быть использован комплексный диагностический алгоритм с включением ультразвуковой оценки висцерального жира, ДРА в режиме «Все тело».
Количественная ультразвуковая стеатометрия и эластометрия печени с последующим определением стеатоза и фиброза печени в совокупности с оценкой уровня печеночных ферментов позволяют составить полную картину о состоянии печеночной паренхимы с учетом воспалительной активности.
Ограничения
Проведенное исследование являлось одноцентровым. Для подтверждения возможности рекомендации представленного комплекса инструментальной диагностики для использования в широкой научной и клинической практике необходимо исследование с большим количеством пациентов.
Список литературы Инструментальные особенности дифференциальной диагностики метаболически ассоциированной и неалкогольной жировой болезней печени
- Eslam M., Newsome P.N., Sarin S.K., Anstee Q.M., Targher G., Romero-Gomez M. et al. A new definition for metabolic associated fatty liver disease: an international expert consensus statement. J. Hepatol. 2020;73(1):202209. https://doi.org/10.1016/j.jhep.2020.03.039.
- Yasser F., Waked I., Bollipo S., Gomaa A., Ajlouni Y., Attia D. What’s in a name? Renaming “NAFLD” to “MAFLD”. Liver International. 2020;40(6):1254-1261. https://doi.org/10.1111/liv.14478.
- Lin S., Huang J., Wang M., Kumar R., Liu Y., Liu S. et al. Comparison of MAFLD and NAFLD diagnostic criteria in real. Liver international. 2020;40(9):2082-2089. https://doi.org/10.1111/liv.14548.
- Лазебник Л.Б., Голованова Е.В., Туркина С.В., Райхельсон К.Л., Оковитый С.В., Драпкина О.М. и др. Неалкогольная жировая болезнь печени у взрослых: клиника, диагностика, лечение. Рекомендации для терапевтов, третья версия. Экспериментальная и клиническая гастроэнтерология. 2021;185(1):4-52. https://doi.org/10.31146/1682-8658-ecg-185-1-4-52.
- Devi J., Raees A., Butt A.S. Redefining non-alcoholic fatty liver disease to metabolic associated fatty liver disease: Is this plausible? World Journal of Hepatology. 2022;14(1):158-167. https://doi.org/10.4254/wjh.v14.i1.158.
- Bhala N., Ibrahim K.J.R., Bugianesi E. Epidemiology and natural history of patients with NAFLD. Current pharmaceutical design. 2013;19(29):5169-5176. https://doi.org/10.2174/13816128113199990336.
- Nguyen V.H., Le M.H., Cheung R.C., Nguyen M.H. Differential clinical characteristics and mortality outcomes in persons with NAFLD and/or MAFLD. Clin. Gastroenterol. Hepatol. 2021;19(10):2172-2181. https://doi.org/10.1016/j.cgh.2021.05.029.
- Popov V.B., Aytaman A., Alemán J.O. Obesity: The forgotten pandemic. Am. J. Gastroenterol. 2022;117(1):7-10. https://doi.org/10.14309/ajg.0000000000001553.
- Dhurandhar N.V. What is obesity? International Journal of Obesity.2022;46:1081-1082. https://doi.org/10.1038/s41366-022-01088-1.
- Smith K.B., Smith M.S. Obesity statistics. Primary care: clinics in office practice. 2016;43(1):121-135. https://doi.org/10.1016/j.pop.2015.10.001.
- Lim S., Kim J., Tarhger G. Links between metabolic syndrome and metabolic dysfunction-associated fatty liver disease. Trends Endocrinol. Metab. 2021;32(7):500-514. https://doi.org/10.1016/j.tem.2021.04.008.
- Тарасова Л.В. Обзор методов лабораторной диагностики, применяемых при неалкогольной жировой болезни печени (НАЖБП) и алкогольной болезни печени (АБП) на современном этапе. Экспериментальная и клиническая гастроэнтерология. 2019;4(164):72-77. https://doi.org/10.31146/1682-8658-ecg-164-4-72-77.
- Буеверов А.О. Многоликий стеатогепатит. Клинические перспективы гастроэнтерологии, гепатологии: научно-практический журнал для клиницистов. 2012;3:3-9.
- Fahed G., Aoun L., Zerdan M.B., Allam S., Zerdan M.B., Bouferraa Y. Metabolic syndrome: Updates on pathophysiology and management in 2021. Int. J. Mol. Sci. 2022;23(2):786. https://doi.org/10.3390/ijms23020786.
- Pimanov S., Bondarenko V., Makarenko E. Visceral fat in different locations assessed by ultrasound: correlation with computed tomography and cut-off values in patients with metabolic syndrome. Clinical Obesity. 2020;10(6):e12404. https://doi.org/10.1111/cob.12404.
- Завадовская В.Д., Сусляева Н.М., Завьялова Н.Г., Шульга О.С., Кравец Е.Б., Бородулина А.Ю., авторы. Способ ультразвуковой диагностики висцерального ожирения. Российская Федерация. Патент на изобретение № 2407440 С1. Опубликован: 27.12.2010; бюл. 36.
- Борсуков А.В., Венидиктова Д.Ю. Оценка сравнительной эффективности методов инструментальной диагностики стеатоза печени у пациентов с метаболическим синдромом. Практическая медицина. 2018;16(2):16-21.
- Борсуков А.В., Морозова Т.Г. Комплексная эластография в дифференциальной диагностике диффузных заболеваний печени. Ученые записки Орловского государственного университета. 2015;4:378-383.
- Самойлов А.С., Жолинский А.В., Рылова Н.В., Величко М.Н., Большаков И.В., Бодров А.В. и др. Современные методы анализа композиционного состава тела. Практическая медицина. 2022;20(1):21-26. https://doi.org/10.32000/2072-1757-2022-1-21-26.
- Falck-Ytter Y. The risks of percutaneous liver biopsy. Journal of Hepatology. 2001;33(1):764. https://doi.org/10.1053/jhep.2001.0103303le01.


