Инсулиноподобные факторы роста и связывающие их белки в патогенезе рака эндометрия
Автор: Бочкарева Н.В., Кондакова И.В., Коломиец Л.А., Чернышова А.Л.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 (27), 2008 года.
Бесплатный доступ
В обзоре представлены данные об инсулиноподобных факторах роста (ИФР) и связывающих их белках, которые регулируют биодоступность ИФР-1 и ИФР-П. Показана связь этих факторов роста с пролиферацией, апоптозом и выживаемостью клеток. ИФР-1,-П, их рецептор и ИФР-связывающие белки играют важную роль в регуляции миграции и подвижности опухолевых клеток. Регуляция экспрессии ИФР и связывающих их белков в эндометрии осуществляется эстрогенами и прогестероном. Оценено значение ИФР, их рецептора и ИФР-связывающих белков в патогенезе рака эндометрия.
Инсулиноподобные факторы роста и связывающие их белки, пролиферация, апоптоз, клеточная подвижность, рак эндометрия
Короткий адрес: https://sciup.org/14054871
IDR: 14054871 | УДК: 618.14-006.6+616-002.18-091.818
Текст научной статьи Инсулиноподобные факторы роста и связывающие их белки в патогенезе рака эндометрия
Инсулиноподобные факторы роста (ИФР) и их рецептор: связь с пролиферацией, апоптозом и выживаемостью клеток. Белки, связывающие инсулиноподобные факторы роста, их значение в регуляции биодоступности ИФР-I и ИФР-II.
В настоящее время сформировано понятие о сигнальном пути, в который входят инсулиноподобные факторы роста (ИФР), – ИФР-I и ИФР-II и рецептор ИФР I типа. Тканевая регуляция работы этой сигнальной системы осуществляется 6 белками, связывающими инсулиноподобные факторы роста (IGFBPs) [12]. ИФР представляют собой группу факторов роста, которые структурно похожи на инсулин. Сами по себе пептиды гомологичны до 65 %. ИФР-I и ИФР-II имеют соответственно 43 % и 41 % гомологии с инсулином. Основным источником ИФР в организме человека является печень, но эти пептиды также синтезируются в большинстве тканей организма. Оба фактора в крови человека циркулируют в виде белкового комплекса, состоящего из IGFBP-3, молекулы ИФР-I или ИФР-II и кислото-лабильной субъединицы, только около 5–6 % ИФР остаются в свободной форме (табл. 1). У взрослых уровень обоих ИФР остается относительно стабильным и не изменяется в течение дня [1]. ИФР-I и ИФР-II являются мощными митогенными факторами для клеток многих злокачественных опухолей, в т.ч. для рака эндометрия, кроме того, они оказывают антиапоптотический эффект [31]. Показана возможность продукции ИФР злокачественными опухолями.
Рецептор ИФР I типа (IGF-IR) – член семейства рецепторных тирозинкиназ, состоит из двух α-субъединиц и двух β-субъединиц. При связывании ИФР с экстрацеллюлярной α-субъединицей IGF-IR происходит активация киназного домена рецептора с последующим фосфорилированием тирозиновых остатков, что, в свою очередь, ведет к рекрутированию в область β-субъединиц адапторных молекул, таких как субстраты инсулинового рецептора 1 и 2. В результате активируются множественные пути, включающие сигнальный путь с вовлечением митоген-активируемой протеинкиназы и фосфатидилинозито-3-киназный путь, которые ведут к стимуляции клеточной пролиферации, подавлению апоптоза в клетках, увеличению клеточной подвижности и другим эффектам (рис. 1) [39]. Было показано, что ген инсулинового рецептора типа B локализуется в хромосоме 19, в то время как ген для рецептора ИФР-I идентифицирован на дистальном участке длинного плеча хромосомы 15. Таким образом, два рецептора являются продуктом различных генов и, соответственно, регулируются различными регуляторными системами [1]. На фетальных и опухолевых клетках выявлен так называемый инсулиновый рецептор типа A. Показано, что ИФР-II практически с одинаковой аффинностью связывается как с классическим IGF-IR, так и с инсулиновым рецептором типа А [14].
В дополнение к связыванию с IGF-IR на клеточной мембране ИФР также с высокой аффиностью связываются с шестью протеинами (табл. 1). IGFBPs обнаружены в широком спектре биологических жидкостей: в сыворотке крови, в амниотической, цереброспинальной, семенной, фолликулярной жидкостях, а также в культуральных клеточных линиях [1, 22]. Важнейшей функцией всех IGFBPs является ограничение эффектов ИФР путем связывания с ними вблизи мембраны в экстраклеточном матриксе. Так, IGFBP-6, который в значительно большей степени связывает ИФР-II по сравнению с ИФР-I, ингибирует ИФР-II, индуцируемую, но не базальную пролиферацию, адгезию и способность к формированию колоний в клетках колоректального рака [27]. Как ранее было показано, некоторые посттрансляционные модификации IGFBPs, такие как фосфорилирование, протеолиз и полимеризация, существенно изменяют их функции и, в первую очередь, влияют на способность связывать ИФР [34].
В физиологических концентрациях ИФР-I и ИФР-II защищают многие типы клеток в экспериментах in vitro от различных проапоптотиче-ских стимулов, включая экспозицию этопозида, сверхэкспрессию c-myc, полное удаление факторов роста из инкубационной среды, ультрафиолетовое облучение, активацию Fas-рецептора. В экспериментах in vivo сниженная экспрессия
Таблица
|
Название белка |
Функции |
Модификация действия |
|
IGFBP-1 |
Связывает ИФР, стимулирует ИФР-независимую клеточную подвижность |
Дефосфорилирование, полимеризация тканевой трансглутаминазой |
|
IGFBP-2 |
Преимущественно связывает ИФР-II |
Протеиназы неизвестны |
|
IGFBP-3 |
Основной транспортный белок для ИФР-I и ИФР-II в сыворотке крови, секретируется многими клетками связывает ИФР |
Протеолиз сериновыми протеиназами, катепсинами, метриксными металлопротеиназами |
|
IGFBP-4 |
Связывает ИФР |
Протеолиз PAPP-A |
|
IGFBP-5 |
Связывает ИФР, стимулирует ИФР-независимую клеточную подвижность |
Протеолиз PAPP-A, связывание с белками экстра-клеточного матрикса |
|
IGFBP-6 |
Преимущественно связывает ИФР-II |
Пострансляционные модификации неизвестны |
Примечание: PAPP-A – белок плазмы крови, ассоциированный с беременностью
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2008. №3 (27)
Белки, связывающие инсулиноподобные факторы роста
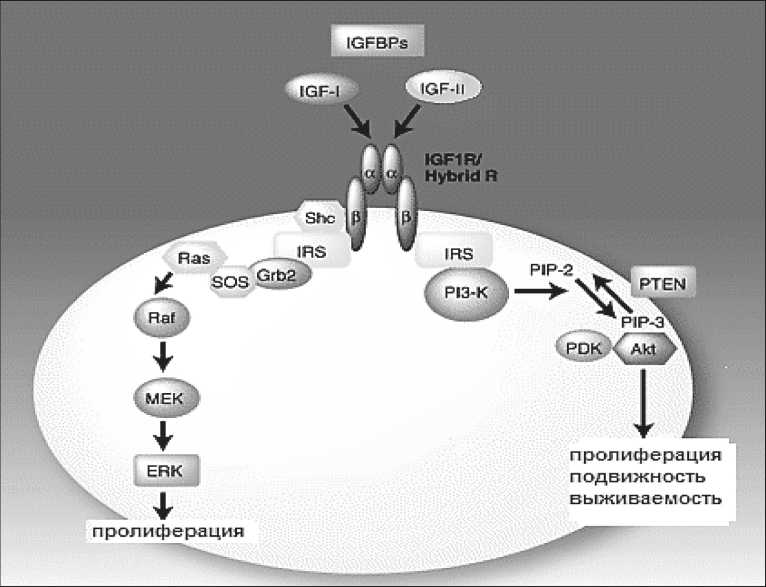
Рис. 1. ИФР-опосредованный сигнальный путь.
Примечание: IGF-1R – ИФР- рецептор I типа; IGF-I и IGF-II – инсулиноподобные факторы роста – лиганды IGF-1R; IGFBs – протеины, связывающие ИФР и регулирующие их биодоступность;
IRS – внутриклеточные cубстраты инсулинового рецептора, Ras, Raf, MEK и ERK – компоненты митоген-активируемого протеинкиназного сигнального пути;
PI3-K – фосфатидилинозитол-3 киназа; PIP-2 – фосфатидилинозитолдифосфат; PIP-3 – фосфатидилинозитолтрифосфат; PDK – фосфонозитидзависимая киназа;
Akt – компонент PI3-K/Akt сигнального пути; PTEN – внутриклеточная фосфатаза;
ген-супрессор, регулирует активность PI3-K/Akt сигнального пути как ИФР-I, так и ИФР-II ассоциировалась с активацией апоптоза. Например, использование антисмысловой олигонуклеотидной последовательности к мРНК ИФР-II значительно снижает пролиферацию клеток панкреатической карциномы и индуцирует апоптоз [9]. В исследованиях было показано, что при связывании ИФР со своим рецептором в ряде клеток ингибируется активация эффекторных каспаз-3 и -7 на этапе их процессирования [36]. Кроме того, выявлена активация экспрессии мРНК IGFBP-3 при экспозиции ДНК-повреждающих факторов в клетках рака молочной железы, экспрессирующих дикий, но не мутантный тип р53 [9].
Выявлено, что ИФР-I и ИФР-II защищают клетки колоректальной карциномы человека HT29-D4 от апоптоза, индуцированного фактором некроза опухолей альфа. В дальнейших исследованиях было показано, что предотвращение цитокин-индуцированного апоптоза – это процесс, не зависимый от молекул клеточной адгезии, и включает активацию ядерного фактора NF-κB, важнейшего фактора выживаемости клеток [16]. Следует отметить, что большинство данных о роли ИФР-опосредованного сигнального пути в процессах пролиферации, апоптоза и выживаемости получены на клеточных культурах и некоторых клеточных опухолевых линиях. В то же время отсутствуют аналогичные данные в отношении нетрансформированных и трансформированных тканей, что представляет значительный интерес.
ИФР-I,-II, их рецептор и ИФР-связы-вающие белки в регуляции миграции и подвижности опухолевых клеток.
Верхние этажи сигнальных путей, активируемые связыванием рецепторов ростовых факторов со своими лигандами, ответственны за стимуляцию не только размножения, но и движения клеток. Активация G-белков семейства Ras и фосфатидилинозит-3-киназы (PI3K), находящихся на пересечении сигнальных путей от многих рецепторов, ведет к повышению активности как МАP-киназ – ключевых регуляторов клеточного цикла, так и малых ГТФаз семейства Rho, играющих центральную роль в реорганизации цитоскелета и регуляции движения клеток [3].
Возрастание миграционной активности опухолевых клеток происходит в процессе образования метастазов. Ряд авторов считают, что опухолевая инвазия является по своей сути нерегулируемой клеточной подвижностью [23]. Большинство данных о роли IGF-IR в процессах адгезии, миграции и метастазирования получены на примере клеток рака молочной железы.
Рецептор ИФР I типа (IGF-IR) – член семейства рецепторных тирозинкиназ. Хотя ингибирование IGF-IR сигнального пути существенно ограничивает рост клеток рака молочной железы in vitro и in vivo, очень низкий уровень IGF-IR в этих клетках ассоциирован с высоким риском метастазирования и неблагоприятным клиническим прогнозом. Кроме того, показано, что сверхэкспрессия IGF-IR на клетках рака молочной железы сокращает их потребность в эстрогенах для пролиферации, повышает их выживаемость и тем не менее ограничивает их подвижность и рассеивание, способствуя E-кадгерин-опосредованной клеточной адгезии [20].
На клеточной линии MCF-7 (клетки высокодифференцированного рака молочной железы с низкометастатическим и низкоинвазивным фенотипом) была показана важная роль IGF-IR в клеточной адгезии и подвижности [31]. Клетки MCF-7 трансфецировали антисмысловой олиго-нуклеотидной последовательностью к IGF-IR, что приводило к уменьшению экспрессии IGF-IR примерно на 50 %. Используя тесты для функциональной оценки подвижности, прилипания и агрегации, было выявлено 3-кратное повышение миграционной активности клеток, практически полная потеря способности к прилипанию и снижение клеточной агрегации. Функциональные изменения сопровождались снижением экспрессии E-кадгерина на 50 %, повышением уровня р120 протеина на 80 % в цитозоле опухолевых клеток и значительным снижением уровня р120 в Е-кадгерин-катенин-р120 комплексе. Эти изменения сопровождались существенным нарушением в соотношении факторов, ответственных за миграцию клеток, выявлено 2-кратное повышение в активности Rac1 и Сdс42 и снижение – Rho [31].
Таким образом, доказано, что не связанный с лигандом IGF-IR необходим для формирования функционально активного и стабильного кадгерин-катенинового комплекса. Формирование данного комплекса приводит к полноценному межклеточному контакту и повышенной адгезии клеток. Е-кадгерин-опосредованный клеточный контакт приводит к секвестрации β-катенина и р120 протеина в связывающий регион, что обеспечивает прочное межклеточное взаимодействие, что, в свою очередь, предотвращает клеточную миграцию. Снижение экспрессии IGF-IR приводит к снижению количества кадгерин-катениновых комплексов и изменению их конформации. Как следствие происходит перераспределение β-катенина и р120 протеина в цитозоль опухолевых клеток, что ведет к дифференциальной активации белков – членов семейства Rho, повышению подвижности клеток и, как следствие, к метастазированию.
Сами ИФР являются для большинства клеток мощными факторами миграции и стимулируют клеточную подвижность [12, 13]. Предполагают, что активация IGF-IR посредством связывания со своими лигандами (ИФР-I, ИФР-II) и дальнейшее повышение клеточной подвижности объясняются, по-видимому, выходом IGF-IR из кадгеринового комплекса [5]. В связи с этим повышается роль белков, связывающих ИФР на дорецепторном уровне. Так, было показано, что IGFBP-1 в высокометастатической клеточной линии рака молочной железы MDA-231BO снижал клеточную подвижность, индуцированную ИФР-I [38]. Однако ранее было показано, что сами IGFBP-1 и IGFBP-2 благодаря наличию в своей структуре интегринсвязывающего мотива (интегрины участвуют в передаче внеклеточных сигналов до элементов цитоскелета) в отсутствие ИФР стимулируют клеточную подвижность [12]. IGFBP-5 также стимулирует ИФР-независимую миграцию мезангиальных клеток и формирование в них филоподий (морфогенетические изменения, присущие движущимся клеткам) [8]. Таким образом, все компоненты ИФР-зависимого сигнального пути так или иначе вовлечены в процессы клеточной адгезии и миграции, что может свидетельствовать об их участии в инвазивном росте и метастазировании.
Регуляция эстрогенами и прогестероном экспрессии инсулиноподобных факторов роста и связывающих их белков в эндометрии.
У женщин с нормальным менструальным циклом уровень циркулирующих в сыворотке крови ИФР-I и ИФР-II не имеет различий в пролиферативную и лютеиновую фазы цикла. Концентрация ИФР-II, но не ИФР-I в яичниковой вене была значительно выше, чем в локтевой вене, что свидетельствует о том, что источником этого пептида являются яичники [1].
Показано, что в эндометрии пролиферативный эффект ИФР специфически контролируется прогестероном через регуляцию образования IGFBP-1, который синтезируется в эндометриальных стромальных клетках, достигая наивысшего уровня в лютеиновой фазе [18]. Прогестерон повышает экспрессию IGFBP-1 в строме эндометрия как в исследованиях in vitro, так и in vivo [7]. По мнению Frost et al. [15], прогестерон и IGFBP-1 в эндометрии формируют аутокринную петлю, контролирующую пролиферацию стромальных клеток и окончание лютеиновой фазы.
В нормальном эндометрии ИФР-I и ИФР-II синтезируются в стромальных клетках, и их образование ассоциируется с дифференцировкой эндометрия. Экспрессия ИФР-I в эндометриальных стромальных клетках стимулируется эстрогенами. IGF-IR экспрессируется в эндометрии в обоих типах клеток, но в большей степени в эпителиальных. В эпителиальных эндометриальных клетках выявлена коэкспрессия ИФР-II и IGFBP-2 [6].
Таким образом, компоненты ИФР-опосре-дованного сигнального пути вовлечены в регуляцию нормального менструального цикла (рис. 2). Нарастание уровня эстрадиола в сыворотке крови в пролиферативную фазу цикла ведет к стимуляции экспрессии ИФР-I и
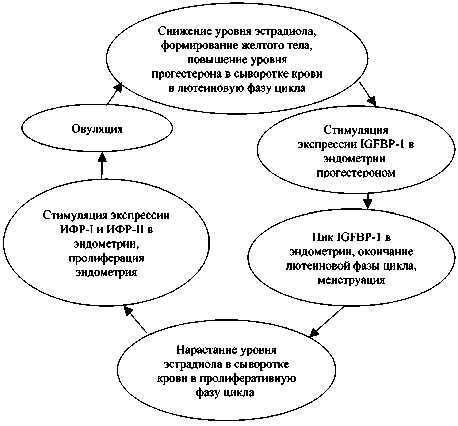
Рис. 2. Роль ИФР-опосредованного сигнального пути в регуляции менструального цикла
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2008. №3 (27)
ИФР-II в эндометрии с последующей его пролиферацией. После овуляции и формирования в яичнике желтого тела на фоне снижения уровня эстрадиола и повышения уровня прогестерона в сыворотке крови происходит стимуляция экспрессии IGFBP-1 в эндометрии. Таким образом, значительно нивелируется пролиферативный эффект ИФР на эндометрий. Максимальные значения экспрессии IGFBP-1 в эндометрии ассоциируются с окончанием лютеиновой фазы, отторжением эндометрия и началом нового менструального цикла.
В культуре эндометриальных стромальных клеток изучена регуляция содержания IGFBP-4. Данный белок секретируется этими клетками, и при инкубации клеток или с ИФР-I, или с ИФР-II его уровень дозозависимо снижается. В то же время выявлено, что повышение уровня экспрессии IGFBP-4 связано с активацией (связыванием, фосфорилированием) IGF-IR, так как высокие концентрации инсулина (100 нг/мл) (в этих условиях инсулин взаимодействует с IGF-IR, не связываясь с IGFBPs) индуцируют повышение уровня IGFBP-4 в инкубационной среде. Таким образом, в эндометриальных стромальных клетках выявлен лиганд-индуцируемый синтез и протеолиз IGFBP-4, причем в данных клетках протеолиз преобладал [21]. ИФР-зависимая IGFBP-4 и IGFBP-5-протеазная активность была выявлена в различных типах клеток (фибробласты, остеобласты, децидуальные клетки, клетки гранулезы яичника), в том числе и в эндометриальных стромальных клетках [12]. Данная протеаза была идентифицирована как ассоциированный с беременностью протеин (pregnancy-associated plasma protein-A (PAPP-A)) [26, 28].
Интересно отметить, что в гормонозависимых тканях существует определенный перекрест эстрогензависимого и ИФР-опосредованного сигнальных путей. При связывании рецептора эстрогенов-α с эстрогеном происходит его активация и отщепление белков теплового шока с последующим переносом эстроген-рецепторного комплекса в ядро, где он связывается со специфическими сайтами ДНК (estrogen responce element) и инициирует транскрипцию различных генов, что приводит к формированию эстрогенового фона – специфической белковой характеристике эстрогенной стимуляции. К числу эстроген-индуцируемых генов относят гены IGF-IR, ИФР-I, ИФР-II, IGFBP-4 и IGFBP-5 [2, 37].
Значение инсулиноподобных факторов роста, их рецептора и белков, связывающих инсулиноподобные факторы роста в патогенезе рака эндометрия.
Экспрессия мРНК IGF-IR и самого рецептора была выявлена в большинстве образцов опухолей эндометрия. Также было показано, что как ИФР-I, так и ИФР-II повышают пролиферацию в клеточной линии рака эндометрия ECC-1 [22, 39]. В 2006 г. впервые была описана высокая экспрессия и активация IGF-IR и фосфатидилинозитол-3 фосфат киназного/Akt пути в образцах атипичного гиперплазированного эндометрия и аденокарциномах эндометрия [10]. Однако большинство аденокарцином эндометрия не экспрессируют ИФР-I, но экспрессируют ИФР-II и ряд IGFBPs [12]. На примере эстрогензависимой клеточной линии рака эндометрия ECC-1 и прогестеронзависимой линии PRAB-36 было выявлено, что в линии ECC-1 эстроген-индуцируемая пролиферация в значительной степени обусловлена стимуляцией ИФР-опосредованного сигнального пути, в то же время ИФР-I-индуцированная пролиферация не затрагивает эстрогенные рецепторы. В обоих типах клеток экспрессия IGFBPs регулировалась эстрогенами и прогестероном (экспрессия IGFBP-4 стимулировалась эстрадиолом в ECC-1, а экспрессия IGFBP-3 и -6 подавлялась прогестероном в PRAB-36) [17].
Показано, что эстрадиол в клеточной линии рака молочной железы MCF-7 и клеточной линии высокодифференцированного рака эндометрия Ishikawa индуцировал экспрессию генов с-Myc и ИФР-I. Интересно, что только в клеточной линии Ishikawa тамоксифен, но не ралоксифен индуцировал экспрессию этих же генов [35].
Проведен ряд эпидемиологических исследований, где изучались ИФР и IGFBPs как возможные факторы риска развития рака эндометрия. При изучении взаимосвязи уровня сывороточного инсулина, глюкозы, ИФР-I и ИФР-II, а также IGFBP-1, -2 и -3 с возникнове- нием рака эндометрия у постменопаузальных больных, не страдающих сахарным диабетом, был выявлен более высокий уровень глюкозы и инсулина натощак у больных раком эндометрия по сравнению со здоровыми женщинами, в то же время для ИФР-I, ИФР-II и IGFBP-3 выявлена обратная зависимость [32]. При исследовании уровня циркулирующих ИФР и IGFBPs у постменопаузальных женщин было выявлено, что высокий сывороточный уровень ИФР-I, ИФР-II и IGFBP-3, но не IGFBP-1 ассоциирован со снижением риска развития рака эндометрия [25]. В более раннем американском когортном исследовании было показано, что сывороточные уровни ИФР-I, IGFBP-1,-2 и -3 не ассоциированы с риском развития рака эндометрия. В то же время хроническая гиперинсулинемия, о которой свидетельствует повышенный уровень циркулирующего С-пептида, является показателем повышенного риска развития рака эндометрия [29]. Таким образом, в отношении рака эндометрия в отличие от ряда других злокачественных опухолей (рака легкого, рака молочной железы, колоректального рака) не доказано, что ИФР и связывающие их белки являются факторами риска развития рака эндометрия (по данным эпидемиологических исследований) [33]. В то же время уровень инсулина и ряд инсулинзависимых параметров углеводного обмена являются важными факторами риска развития рака этой локализации, по-видимому, вследствие присущих только инсулину (и гораздо в меньшей степени ИФР) метаболических эффектов, затрагивающих углеводный и липидный обмен в организме.
Гиперинсулинемия – известный метаболический сдвиг, присущий как больным раком эндометрия, так и значительной части больных с гиперпластическими процессами эндометрия [4]. При сопоставлении митогенного эффекта инсулина, ИФР-I и ИФР-II было выяснено, что митогенная активность ИФР-I более чем в 3 раза превышает митогенную активность ИФР-II и более чем в 30 раз – инсулина [24]. Известно, что митогенная активность инсулина варьирует в различных типах клеток и зависит от количества инсулиновых рецепторов. В эстроген-рецепторнегативных клеточных линиях рака эндометрия HEC-1-A и HEC-1-B (выделенной от высокодифференцированной эндометриоидной карциномы) уровень рецепторов инсулина был наивысшим, а в эстрогенрецепторпозитивной клеточной линии RL95-2 (выделенной от высокодифференцированной аденосквамозной карциномы) – самым низким. В клеточных эстрогенрецепторнегативных клеточных линиях, выделенных из низкодифференцированной и недифференцированной карцином эндометрия, уровень рецепторов к инсулину имел средние значения. Во всех клеточных линиях инсулин стимулировал клеточную пролиферацию [30].
Таким образом, роль инсулина, ИФР, их рецептора и IGFBPs в патогенезе предрака и рака эндометрия представляется многоплановой (рис. 3). Автономная или индуцированная эстрадиолом и тамоксифеном продукция ИФР-I и/или ИФР-II гиперплазированным эндометрием или опухолью при наличии IGF-IR в тканях может приводить к избыточной пролиферации клеток, их пониженной чувствительности к проапоптотическим стимулам и повышенной клеточной подвижности. В опухолевых клетках такие события могут привести к значительной инвазии в нормальные ткани и отдаленному метастазированию. Существенную роль в регуляции биодоступности ИФР отводят IGFBPs, экспрессия которых, в свою очередь, регулируется эстрогенами, прогестероном, специфическими протеазами и самими ИФР.
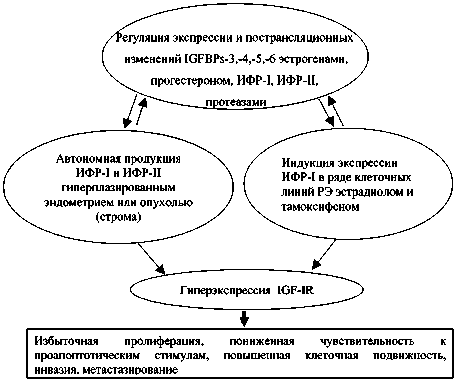
Рис. 3. Роль ИФР-опосредованного сигнального пути при гиперпластических процессах и раке эндометрия
Необходимо отметить, что многие моменты, касающиеся роли ИФР-опосредованного сигнального пути в патогенезе предрака и рака эндометрия, остаются неизученными. Большинство результатов получены на клеточных опухолевых линиях и их нельзя прямо экстраполировать на реальные опухоли и ткани. По-видимому, в реализации эффектов ИФР в опухолях эндометрия большое значение имеет строма опухолей. В то же время остаются практически не изученными клинические ассоциации компонентов ИФР-опосредованного сигнального пути при раке эндометрия. Исследования в этом направлении представляются достаточно актуальными как в плане разработки фундаментальных аспектов патогенеза рака эндометрия, так и в свете создания новых препаратов таргетной терапии, направленных на компоненты этого сигнального пути [33].


