Инсулиноподобные факторы роста в патогенезе и прогнозе рака яичников
Автор: Бочкарева Наталья Валерьевна, Кондакова Ирина Викторовна, Коломиец Лариса Александровна, Мунтян Алиса Борисовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 (45), 2011 года.
Бесплатный доступ
Обсуждается роль системы инсулиноподобных факторов роста в нормальном фолликулогенезе и отдельных аспектах патогенеза эпителиального рака яичников. Дальнейшая комплесная оценка уровня экспрессии показателей системы инсулиноподобных факторов роста и параметров, ассоциированных с клеточной подвижностью, при эпителиальном раке яичников представляет определенный интерес как в плане углубленного изучения патогенеза этой гетерогенной группы опухолей, так и в плане поиска новых молекулярных прогностических и предикторных факторов.
Система инсулиноподобных факторов роста, эпителиальный рак яичников, клеточная подвижность, прогноз
Короткий адрес: https://sciup.org/14055917
IDR: 14055917 | УДК: 618.11-006.6-092-037
Текст обзорной статьи Инсулиноподобные факторы роста в патогенезе и прогнозе рака яичников
От рака яичников (РЯ) ежегодно умирают больше женщин, чем от рака шейки матки и рака эндометрия вместе взятых. Несмотря на это, многие патогенетические аспекты данной патологии остаются малоизученными, в частности роль ростовых факторов [1, 4, 5]. В большинстве экспериментальных исследований показано, что инсулиноподобные факторы роста являются мощными митогенами, мотогенами (индукторами локомоторной активности клеток), снижают чувствительность клеток к апоптотическим стимулам и, таким образом, повышают выживаемость клеток. Опухоли яичников эпителиального происхождения составляют около 90 % всех злокачественных новообразований яичника, поэтому в данном обзоре система инсулиноподобных факторов роста при эпителиальном РЯ будет рассмотрена в плане изучения некоторых патогенетических аспектов и поиска возможных предикторных и прогностических показателей.
Характеристика инсулиноподобных факторов роста, их клеточных эффектов и путей регуляции биодоступности
В настоящее время сформировано понятие о сигнальном пути, в который входят инсулиноподобные факторы роста (ИФР) – ИФР-I, ИФР-II и рецептор ИФР I типа. Регуляция этой системы на клеточном и тканевом уровне осуществляется 6 белками, связывающими инсулиноподобные факторы роста (IGFBPs) и расщепляющими их протеиназами [13]. Основным источником ИФР в организме человека является печень, но эти пептиды также синтезируются в большинстве тканей организма [2]. Показана возможность продукции ИФР злокачественными опухолями [24].
Рецептор ИФР I типа (IGF-1R) – член семейства рецепторных тирозинкиназ, состоит из двух α-субъединиц и двух β-субъединиц. При активации IGF-1R путем связывания с ИФР с экстрацеллюлярной α-субъединицей происходит активация киназного домена, что, в свою очередь, ведет к рекрутированию в область β-субъединиц адапторных молекул, таких как субстраты инсулинового рецептора 1 и 2. В результате активируются множественные сигнальные пути, включающие путь с вовлечением митоген-активируемой протеинкиназы и фосфатидилинозитол-3-киназный путь, которые ведут к стимуляции клеточной пролиферации, подавлению апоптоза в клетках, клеточной подвижности и другим эффектам (рис. 1) [35].
В дополнение к связыванию с IGF-1R на клеточной мембране, ИФР с высокой аффи-ностью связываются с 6 специфическими протеинами – белками, связывающими инсулиноподобные факторы роста (IGFBPs). IGFBPs обнаружены в широком спектре биологических жидкостей: в сыворотке крови, в амниотической, цереброспинальной, семенной, фолликулярной жидкостях, а также в культуральных клеточных линиях [2, 13]. Важнейшей функцией всех IGFBPs является ограничение эффектов ИФР путем связывания с ними вблизи мембраны в экстраклеточном матриксе. Некоторые посттрансляционные модификации IGFBPs, такие как фосфорилирование, протеолиз и полимеризация, существенно изменяют их функции и, в первую очередь, влияют на способность связывать ИФР [25].
В физиологических концентрациях ИФР-I и ИФР-II защищают многие типы клеток в экспериментах in vitro от различных проапоптотиче-ских стимулов, включая экспозицию этопозида, сверхэкспрессию c-myc, полное удаление факторов роста из инкубационной среды, ультрафиолетовое облучение, активацию Fas-рецептора. В экспериментах in vivo сниженная экспрессия как ИФР-I, так и ИФР-II ассоциировалась с активацией апоптоза. Например, использование антисмысловой олигонуклеотидной последовательности к мРНК ИФР-II значительно редуцирует пролиферацию клеток панкреатической карциномы и индуцирует апоптоз [10]. В ряде исследований было показано, что при
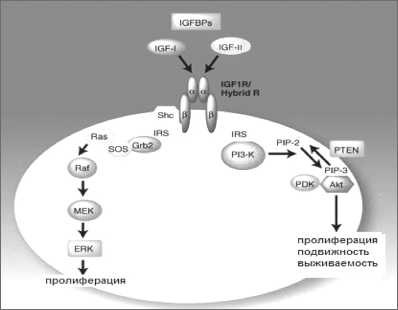
Рис. 1. ИФР-опосредованный сигнальный путь. Примечание: IGF-1R – ИФР-рецептор I типа, IGF-I и IGF-II – инсулиноподобные факторы роста – лиганды IGF-1R, IGFPs – протеины, связывающие ИФР и регулирующие их биодоступность, IRS – внутриклеточные cубстраты инсулинового рецептора, Ras, Raf, MEK и ERK – компоненты митоген-активируемого протеинкиназного сигнального пути, PI3-K – фосфатидилинозитол-3 киназа, PIP-2 – фосфатидилинозитолдифосфат, PIP-3 – фосфатидилинозитолтрифосфат, PDK – фосфонозитидзави-симая киназа, Akt – компонент PI3-K/Akt сигнального пути, PTEN – внутриклеточная фосфатаза, продукт гена-супрессора, регулирует активность PI3-K/Akt сигнального пути связывании ИФР со своим рецептором в клетках ингибируются эффекторные каспазы-3 и -7 на этапе их процессирования [28]. Кроме того, выявлена активация экспрессии мРНК IGFBP-3 при экспозиции ДНК-повреждающих факторов в клетках рака молочной железы, экспрессирующих дикий, но не мутантный р53 [10]. В исследованиях F. Garouste et al. [14] было выявлено, что ИФР-I и ИФР-II защищают клетки колоректальной карциномы человека HT29-D4 от апоптоза, индуцированного фактором некроза опухолей альфа.
Следует отметить, что большинство данных о роли ИФР-опосредованного сигнального пути в процессах пролиферации, апоптоза и выживаемости получены на клеточных культурах и некоторых клеточных опухолевых линиях. В то же время отсутствуют аналогичные данные в отношении нетрансформированных и трансформированных тканей, что представляет значительный интерес.
Внутриклеточная деградация компонентов IGF-1R/IGF комплекса
Регуляция ИФР-зависимого сигнального пути осуществляется также посредством эн- доцитоза и транспортировки внутрь клетки самого рецептора или рецептор-лигандного комплекса. Детальные механизмы интернализации IGF-1R не выяснены, но выявлено, что митогенный эффект от связывания IGF-1R со своими лигандами регулируется специфической молекулой – эндоцитоз-зависимым адаптерным протеином-2. Документировано лиганд-индуцированное рекрутирование рецептора внутрь кальвеолы при эндоцитозе [26]. Протеолитическая деградация интернализированных ИФР-I и ИФР-II охарактеризована не полностью, но в этом процессе важную роль отводят катепсину L и E-64-зависимой цистеиновой протеиназе [23]. Основную роль в деградации самого рецептора играет внутриклеточная убик-витинзависимая протеасомная система деградации. Показано, что связывание протеина MDM2 с β-субъединицей IGF-1R через адаптерный белок β-аррестин приводит к рекрутированию убиквитина к рецептору, таким образом, инициируется его деградация [16].
Роль инсулиноподобных факторов роста и связывающих их белков в фолликулогенезе
В последнее время установлена роль системы ИФР в фолликулогенезе у женщин. Показано, что доминантный фолликул содержит ИФР-I в большей концентрации, чем недоминантные. Уровень ИФР-I в фолликулярной жидкости положительно коррелировал как с концентрацией эстрадиола и прогестерона, так и с объемом фолликулярной жидкости. При использовании метода гибридизации in situ транскрипты ИФР-I были обнаружены в теке малых (3–5 мм) развивающихся фолликулов, но не найдены в гранулезных клетках. Однако ИФР-II мРНК наиболее часто встречались в гранулезных клетках больших развивающихся фолликулов и в желтом теле. Низкий уровень ИФР-II мРНК и IGFBP-6 был обнаружен в текаклетках женщин с синдромом поликистозных яичников, так же как и в малых антральных фолликулах у женщин с нормальной функцией яичников [2].
ИФР-зависимая IGFBP-2, -4 и -5-протеаз-ная активность была выявлена в различных типах клеток (фибробласты, остеобласты, децидуальные клетки, клетки гранулезы яичника, эндометриальные стромальные клетки). Данная протеаза была идентифицирована как ассоциированный с беременностью протеин (pregnancy-associated plasma protein-A (PAPP-A) [18, 20]. Показано, что у млекопитающих рост доминантного фолликула в терминальной фазе сопровождается значительным снижением ин-трафолликулярного уровня IGFBP-2 и IGFBP-4. В исследовании N. Gerard et al. [15] высокий уровень PAPP-A выявлен в фолликулярной жидкости ранних и поздних доминантных фолликулов у лошадей, однако практически не определялся в антральных фолликулах, что свидетельствует о возможной роли PAPP-A в фолликулогенезе и овуляции.
Значение инсулиноподобных факторов роста, их рецептора и белков, связывающих инсулиноподобные факторы роста в патогенезе рака яичников. Связь параметров ИФР-системы с эффективностью химио- и гормонотерапии при раке яичников
В литературе имеются немногочисленные данные об уровне отдельных показателей ИФР-системы при РЯ эпителиального происхождения. Так, с использованием метода ПЦР в реальном времени был изучен уровень экспрессии IGF-I и IGF-1R в злокачественных и доброкачественных опухолях яичника, который оказался выше в злокачественных опухолях с максимальными значениями у больных с плохим прогнозом, после субоптимальных резекций и с большим объемом остаточной опухоли [7]. Уровень IGFBP-2 и IGFBP-5 был повышен в низкодифференцированных серозных карциномах яичников по сравнению с нормальными тканями яичников, серозными кистами, пограничными серозными опухолями и высокодифференцированными аденокарциномами яичников [33].
Ряд интересных данных получен на экспериментальных клеточных линиях. Так, гиперэкспрессия IGF-1R и фосфатидилинозитол-3-киназы (компонента ИФР-зависимого сигнального пути) ассоциирована с платиноре-зистентностью некоторых клеточных линий РЯ [12]. На примере экспериментальной клеточной линии эндометриоидного РЯ было показано, что IGFBP-3 действует как опухолевый супрессор, эффективно подавляющий клеточную миграцию, инвазию, метастазирование, но не влияющий на клеточную пролиферацию. Клинически, у 35 больных с эндометриоидным РЯ с низким уровнем IGFBP-3 рак ассоциировался с низкой степенью дифференцировки, запущенностью процесса и плохим прогнозом [31]. При исследовании влияния таксола на степень фосфорилирования Akt – компонента инозитолтрифосфат/ Akt-сигнального пути, активирующегося при связывании ИФР с IGF-1R, – было показано, что таксол-индуцированное фосфорилирование Akt происходит при участии тирозинкиназы IGF-1R (активирование рецептора). Клеточная линия РЯ, резистентная к таксанам, имела высокий уровень IGF-II, а снижение уровня IGF-II восстанавливало чувствительность клеток к таксанам. Также было показано, что высокий уровень IGF-II в опухоли коррелировал с запущенной стадией, низкой степенью дифференцировки и редуцированной безрецидивной выживаемостью [19].
В литературе имеются разноречивые данные о связи параметров ИФР-системы с эффективностью химио- и гормонотерапии РЯ. В исследованиях G. Walker et al. [32] на эстроген положительных клеточных линиях РЯ была показана позитивная регуляция 17β-эстрадиолом экспрессии гена IGFBP-4 и негативная – генов IGFBP-3 и IGFBP-5. Экспрессия генов IGFBP-1, -2 и -6 была эстроген независима. На основании полученных данных было высказано предположение о возможности использования данных по экспрессии генов или белков некоторых IGFBPs в качестве предикторных параметров в отношении эффективности гормонотерапии ингибиторами ароматазы у больных РЯ с рецидивами. Используя сывороточный уровень СА-125 как индикатор ответа на проводимую терапию, была выявлена статистическая разница между экспрессией некоторых IGFBPs в опухоли (иммуногистохимическое окрашивание) в группах больных со стабильным течением заболевания по сравнению с группой больных с прогрессированием на фоне гормонотерапии. Средний уровень экспрессии IGFBP-3 и-5 был значительно ниже, а IGFBP-4 – значительно выше в первичной опухоли у больных, демонстрирующих ответ на проводимую гормонотерапию, по сравнению с группой с прогрессированием. Необходимо также отметить высокую частоту экспрессии IGFBP-3, -4 и -5 в первичных злокачественных опухолях яичника, составившую
95, 30 и 44 % соответственно. При проведении математического анализа методом многофакторной логистической регрессии было показано, что наибольшей предсказательной силой в отношении отвечаемости на гормонтерапию было сочетание IGFBP-4, IGFBP-5 и ERα, однако использование одного IGFBP-3 было лишь незначительно хуже вышеупомянутой комбинации [32]. В то же время, в исследованиях L. Lu et al. (2006) не было выявлено никакой ассоциации между экспрессией гена IGF-II, IGFBP-3 в опухоли и ответом на платиносодержащую химиотерапию 1-й линии у больных РЯ [22].
Роль параметров ИФР-системы в инвазии и метастазировании опухолей: некоторые молекулярные механизмы
Метастазирование опухолей – многоступенчатый процесс, складывающийся из сложных взаимоотношений между диссеминирующими опухолевыми клетками и изменяющимся микроокружением. Среди основных этапов, лимитирующих этот процесс, выделяют опухоль-индуцированную неоваскуляризацию (ангиогенез и лимфоангиогенез), деградацию экстраклеточного матрикса, миграцию клеток через тканевые барьеры, включая вход и выход метастазирующих опухолевых клеток из кровеносных сосудов, пролиферацию и выживаемость клеток в новом, не свойственном им микроокружении. Ряд авторов считают, что опухолевая инвазия является по своей сути нерегулируемой клеточной подвижностью [21]. Суммируя данные, полученные в основном на клеточных линиях, можно сказать, что компоненты ИФР-системы играют регуляторную роль практически на всех этапах метастазирования (рис. 2) [26].
Относительно недавно получены данные о механизмах участия ИФР и IGF-1R в процессах клеточной адгезии и миграции. Хотя ингибирование IGF-1R сигнального пути существенно ограничивает рост клеток рака молочной железы in vitro и in vivo, однако очень низкий уровень IGF-1R в этих клетках ассоциировался с высоким риском метастазирования и неблагоприятным клиническим прогнозом. Показано, что сверхэкспрессия IGF-1R на клетках рака молочной железы сокращает их потребность в эстрогенах для пролиферации,

Роль ИФР-системы в выживаемости опухолевых клеток в новом микроокружении
- Экспериментальные данные о значительном уменьшении размеров метастазов в печень экспериментальной опухоли, экспрессирующей мутантную форму рецептора IGF-1R, по сравнению с размерами метастазов опухоли с нормальным вариантом IGF-1R у мышей.
- Экспериментальные данные о большем размере первичной опухоли и ее метастазах в печень у мышей с генетически детерминированным сниженным уровнем синтеза IGF-I в печени и сыворотке крови при дополнительных инъекциях IGF-I по сравнению с нелеченными.
Роль ИФР-системы в ангиогенезе и лимфоангиогенезе:
- ИФР-1 и II через HIF-la индуцируют синтез VEGF - ИФР-1 и II индуцируют миграцию эндотелиальных клеток - IGF-1R позитивный регулятор продукции VEGF-C - основного ангиогенного фактора, регулирующего лимфоангиогенез
Роль ИФР-системы в клеточной адгезии и подвижности:
- изменение клеточной адгезии и подвижности через регулирование стабильности кадгерин-катенинового комплекса IGF-1R
- ИФР-независимая стимуляция клеточной подвижности IGFBP-2 и -5
Деградация экстрацеллюлярного матрикса:
- Регуляция продукции и активации ММП-2 и ММ П-9 через экспрессию IGF-1R
- Регуляция экспрессии иРА и uPAR IGF-1R
Рис. 2. Предполагаемая роль ИФР-системы в инвазии и метастазировании опухолей.
Примечание: ММП-2 и -9 – матриксные металлопротеиназы-2 и -9; uPA и uPAR – урокиназный активатор плазминогена и его рецептор
повышает их выживаемость и тем не менее ограничивает их подвижность и рассеивание, способствуя E-кадгерин-опосредованной клеточной адгезии [17].
В исследовании A.P. Pennisi et al. [24] на клеточной линии MCF-7 (клетки высокодифференцированного рака молочной железы с низкометастатическим и низкоинвазивным фенотипом) была показана важная роль IGF-1R в клеточной адгезии и подвижности. Клетки MCF-7 трансфецировали антисмысловой олигонуклеотидной последовательностью к IGF-1R, что приводило к уменьшению экспрессии рецептора примерно на 50 %. Используя тесты для функциональной оценки подвижности, прилипания и агрегации, было выявлено 3-кратное повышение миграционной активности клеток, практически полная потеря способности к прилипанию и снижение клеточной агрегации. Функциональные изменения сопровождались снижением экспрессии E-кадгерина, повышением уровня р120 протеина в цитозоле опухолевых клеток и значительным снижением уровня р120 в Е-кадгерин-катенин-р120 комплексе. Эти изменения сопровождались существенными изменениями в соотношении белков семейства малых ГТФ-аз, ответственных за миграцию клеток [24]. Таким образом, доказано, что не связанный с лигандом IGF-1R необходим для формирования функционально активного и стабильного кадгерин-катенинового комплекса. Формирование данного комплекса приводит к полноценному межклеточному контакту, повышенной адгезии клеток и снижению миграционной активности. Снижение экспрессии
IGF-1R приводит к снижению количества кадгерин-катениновых комплексов и изменению их конформации. Далее происходит перераспределение β-катенина и р120 протеина в цитозоль опухолевых клеток, что ведет к дифференциальной активации белков – членов семейства Rho, повышению подвижности клеток и, как следствие, к метастазированию. Предполагают, что активация IGF-1R посредством связывания со своими лигандами (ИФР-I, ИФР-II) и дальнейшее повышение клеточной подвижности объясняются выходом IGF-1R из кадгеринового комплекса [24].
Сами ИФР являются для большинства клеток мощными факторами миграции и стимулируют клеточную подвижность [13]. В ряде исследований выявлена двойственная роль IGFBPs в отношении клеточной подвижности. Так, было показано, что IGFBP-1 в высокометастатической клеточной линии рака молочной железы MDA-231BO снижал клеточную подвижность, индуцированную ИФР-I [35]. Однако также было выявлено, что сами IGFBP-1 и IGFBP-2 благодаря наличию в своей структуре интегрин-связывающего мотива (интегрины участвуют в передаче внеклеточных сигналов до элементов цитоскелета) в отсутствие ИФР стимулируют клеточную подвижность [13]. IGFBP-5 также стимулирует ИФР-независимую миграцию мезангиальных клеток и формирование в них филоподий (морфогенетические изменения, присущие движущимся клеткам) [8]. Таким образом, все компоненты ИФР-зависимого сигнального пути, так или иначе, вовлечены в процессы клеточной адгезии и миграции, что может свидетельствовать об их участии в инвазивном росте и метастазировании.
Связь параметров ИФР-системы с прогрессированием рака яичников.
Молекулярные механизмы прогрессии РЯ в значительной степени не изучены. Это связано с тем, что для РЯ, как ни для какой другой опухоли, свойственны все возможные способы распространения – per continuitatem (по протяжению), лимфогенно и гематогенно [3]. На клиническом уровне прогрессирование РЯ обычно сопряжено с появлением новых «проявлений болезни» после достижения частичной или полной регрессии на фоне первой линии химиотерапии (рецидивирующий, резистентный и персистирующий РЯ), или отсутствием эффекта или прогрессированием на фоне первой линии химиотерапии (рефрактерный рак яичников) [4–6].
Несколько исследований посвящены изучению уровня показателей ИФР-системы во взаимосвязи с клинико-морфологическими параметрами, являющимися доказанными прогностическими факторами, и прогнозом в целом, при РЯ. Так, было показано, что женщины с эпителиальным РЯ и высоким уровнем мРНК ИФР-I и самого белка имеют худший прогноз по сравнению с женщинами с низкими показателями обоих маркеров. Высокий уровень свободного, но не общего ИФР-I в опухоли ассоциирован с высоким риском прогрессирования [9]. Высокий уровень ИФР-II, но не IGFBP-3, в злокачественных эпителиальных опухолях коррелировал с плохим прогнозом, а именно – с запущенной стадией, гистологическим типом опухоли – серозный рак, низкой степенью дифференцировки, размером остаточной опухоли более 2 см [22]. С использованием метода ПЦР в реальном времени была изучена экспрессия гена ИФР-II в 109 образцах РЯ. Показано, что экспрессия гена ИФР-II в опухолях более чем в 300 раз превышала экспрессию гена в нормальном эпителии яичника. Высокая экспрессия ИФР-II ассоциировалась с III–IV стадией заболевания, низкой степенью дифференцировки и субоптимальным объемом резекции. При построении логистической регрессионной модели экспрессия ИФР-II в опухоли явилась независимым прогностическим фактором только для серозных эпителиальных опухолей, но не для опухолей несерозного гистотипа [27]. В исследовании D. Spentzos et al. [30] изучались взаимосвязи экспрессии генов ИФР-системы и ИФР-зависимого сигнального пути с выживаемостью у больных РЯ. При проведении одно- и многофакторного анализа прогностической значимости изученных параметров выяснилось, что экспрессия гена IGFBP-4 и гена субстрата инсулинового рецептора, соответственно, негативно и позитивно ассоциировались с выживаемостью.
В связи с доступностью асцитической жид- кости для исследования, высоким уровнем экспрессии отдельных маркеров как в клеточной, так и во внеклеточной части асцитической жидкости ряд современных исследований сосредоточены на определении диагностической и прогностической роли белков экссудата [11, 34]. Что касается белков ИФР-системы, то опубликованы результаты исследования, в котором был изучен уровень ИФР-II и IGFBP-3 в опухоли и асцитической жидкости у больных РЯ. Высокий уровень IGFBP-3 до химиотерапии и высокий уровень IGF-II после химиотерапии в асцитической жидкости коррелировал с низкой общей выживаемостью. Последний фактор явился независимым прогностическим фактором по данным многофакторного регрессионного анализа [29].
Заключение. Таким образом, проведенный анализ данных литературы свидетельствует об определенном значении инсулиноподобных факторов роста, их рецептора и связывающих их белков как в фолликулогенезе, так и в отдельных звеньях патогенеза злокачественных опухолей яичников эпителиального происхождения. Дальнейшая комплексная оценка уровня экспрессии показателей ИФР-системы и параметров, ассоциированных с клеточной подвижностью, при раке яичников представляет определенный интерес как в плане углубленного изучения патогенеза этой гетерогенной группы опухолей, так и в плане поиска новых молекулярных прогностических и предиктор-ных факторов.


