Интегральный метод диагностики метаболических нарушений у коров
Автор: Степанова И.П., Власова И.В., Дмитриева Л.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Методика
Статья в выпуске: 4 т.38, 2003 года.
Бесплатный доступ
Проводили сравнительную оценку интегрального метода диагностики метаболических нарушений у коров, основанного на спектрофометрическом определении содержания в плазме и эритроцитах крови веществ низкой и средней молекулярной массы, и рутинных биохимических методов. Обсуждается возможность широкого использования на практике интегрального метода, что позволит корректировать кормовой рацион животных с целью профилактики нарушений обмена веществ.
Короткий адрес: https://sciup.org/142132893
IDR: 142132893 | УДК: 636.2:616-008.9:616-07
Текст научной статьи Интегральный метод диагностики метаболических нарушений у коров
Ранняя диагностика метаболических нарушений позволяет повышать продуктивность, снижать заболеваемость и падеж скота. В медицинской практике для выявления обменных нарушений широко используют показатель, основанный на спектрофотометрическом определении веществ низкой и средней молекулярной массы (ВНСММ) в биологических средах (1, 2). К этим соединениям относится более 200 веществ разной биологической активности с относительной молекулярной массой 500-5000, в частности, инсулин, брадикинин, серотонин, гистамин, ангиотензины, нейропептиды, нейромедиаторы, мочевина, креатинин, мочевая кислота и др. Концентрация этих соединений в норме невелика и строго контролируется. Предполагается, что незначительное увеличение концентрации соединений этой фракции является компенсаторной реакцией организма, так как некоторые ее компоненты оказывают позитивное воздействие на отдельные звенья гомеостаза, например, они способны стимулировать фагоцитарную активность, иммунитет в целом, а также влиять на сосудистый тонус с компенсацией развивающихся расстройств. Однако дальнейшее повышение содержания ВНСММ оказывает негативное действие, так как образуются полипептиды с низкой и средней молекулярной массой, которые могут ингибировать эритропоэз, фагоцитарную активность лейкоцитов, пролиферацию фибропластов, синтез гемоглобина, запускать ряд иммунологических реакций, вызывать вторичную иммунодепрессию, изменять проницаемость клеточных мембран, нарушать трансмембранный транспорт (в том числе, ингибируя Na+- и К+-зависимую АТФазу), нарушать микроциркуляцию (3). Кроме того, некоторые компоненты фракции ВНСММ угнетают тканевое дыхание, разобщают окисление и фосфорилирование, проявляют цитотоксическое действие, влияют на свертываемость крови и фибринолиз, перекисное окисление липидов и обмен моноаминов в головном мозге, ингибируют ряд ферментов (лактатдегидрогеназу, пируваткиназу, транскетолазу).
В результате биологического воздействия фракции ВНСММ наблюдаются следующие нарушения физиологических функций: пониженная толерантность к бактериальной и вирусной инфекции, недостаточность клеточного и гуморального иммунитета, анемия, ухудшение нервно-мышечной проводимости, гипертонус миокарда, гиперкатаболизм, дисметаболизм аминокислот, гипогликемия, нарушение липидного состава крови и т.д. (1-3). В животноводстве аналогичный показатель используют для оценки метаболического статуса коров (4-6). В то же время сравнение диагностических возможностей оценки азотистого обмена интегральным и рутинными биохимическими методами не проводили, что и явилось целью наших исследований.
Описание методики . Научно-хозяйственный опыт ставили на базе ЗАО им. Ф. Энгельса Любинского района Омской области. В опытную группу входило 130 коров красной степной породы в возрасте 2-3 лет с аналогичными показателями живой массы и молочной продуктивности, которых содержали в условиях поточноцеховой системы. Было сформировано четыре технологические группы здоровых коров (25 гол. в каждой) на основе следующих физиологических периодов: производство молока (I), сухостой (II), отел (III), раздой и осеменение (IV). Продолжитель-109
ность сухостойного периода и периода раздоя после отела составляла соответственно 60 и 100 сут; исследования проводили в стойловый период. Все животные получали одинаковый по структуре и питательности рацион, соответствующий детализированным нормам. Группа коров с клиническими признаками нарушений обмена веществ (отставание в росте, низкая живая масса, потеря шерстного покрова и т.д.) состояла из 30 гол.
Содержание ВНСММ определяли методом Малаховой, принцип которого состоит в осаждении крупномолекулярных частиц плазмы крови и эритроцитов раствором трихлоруксусной кислоты и спектральном анализе водного раствора супернатанта в диапазоне длин волн от 238 до 310 нм (1). Для оценки результатов исследований определяли площадь усредненных спектрограмм плазмы и эритроцитов крови с использованием программы Origin 41. Содержание общего белка, альбуминов, мочевины, креатинина, билирубина, сыворотки крови, активность ферментов аспартатаминотрансферазы (АСАТ), аланинаминотранферазы (АЛАТ) и γ -глутамилтранспептидазы (ГГТ) определяли унифицированными методами с помощью наборов реактивов фирмы «Lachema» (Чехия). Математическую обработку данных проводили по критерию Стьюдента, сравнение средних величин выборок — на основе критерия Фишера.
Профили спектрограмм плазмы и эритроцитов крови животных всех изучаемых групп имели приблизительно одинаковый вид. При λ = = 238-246 нм оптическая плотность была равна нулю. Начиная с λ = 250 нм, оптическая плотность возрастала; максимумы поглощения отмечены при λ = 274 ± 8 и λ = 286 ± 4 нм — соответственно для плазмы и эритроцитов крови (рис. 1). У коров I, II, III и IV групп средняя высота пиков спектрограммы плазмы составляла соответственно 0,144; 0,121; 0,074; 0,106 усл. ед., эритроцитов — 0,383; 0,301; 0,228; 0,209 усл. ед.
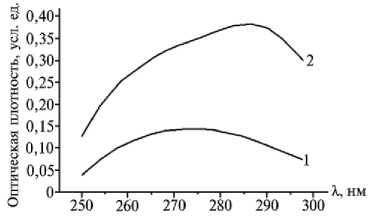
О содержании ВНСММ в биологических жидкостях позволяет судить площадь фигуры, ограниченная спектральной кривой и осью абсцисс. Этот показатель у животных I, II, III и IV групп составлял для плазмы крови соответственно 6,68 ± 3,81; 4,26 ± 2,23; 2,53 ± 0,63; 3,49 ± 1,39 усл. ед.2, для эритроцитов — 13,51 ± 6,64; 12,50 ± 6,61;
Рис. 1. Спектрограммы плазмы (1) и эритроци- 8,81 ± 4,05; 7,71 ± 2,80 усл. ед .
тов (2) крови коров красной степной породы в Содержание ВНСММ в плазме и период производства молока. эритроцитах крови в периоды производства молока и за 60 сут до отела не различалось, в периоды отела и раздоя наблюдалось достоверное снижение этого показателя (Р < 95), что, возможно, вызвано повышенной потребностью организма в таких важнейших соединениях, как НАД+, НАДФ ⋅ Н, рибозо-5-фосфат, глутатион, необходимых для синтеза и детоксикации. Это предположение основано на том, что вышеперечисленные соединения поглощают световое излучение в исследуемом диапазоне длин волн (1).
По данным статистической обработки, сравнение площадей спектрограмм плазмы и эритроцитов крови можно проводить только по трем парам сравниваемых групп коров (табл. 1).
1. Сравнительная оценка площадей спектрограмм плазмы и эритроцитов крови коров по физиологическим периодам
|
Критерий оценки |
Сравниваемые группы животных |
|||||
|
I—II |
I—III |
I—IV |
II—III |
II— IV |
III—IV |
|
|
П л о щ а д ь |
с п е к т р о г р |
а м м ы п л а з м ы к р о в и |
(S пл. ) |
|||
|
эксп. |
2,03 |
10,74 |
2,78 |
21,95 |
4,82 |
3,89 |
|
F табл. |
2,20 |
3,90 |
3,60 |
3,90 |
3,60 |
5,40 |
|
t э ксп. |
2,16 |
— |
1,80 |
– |
– |
3,41 |
|
t табл. |
2,75 |
– |
2,75 |
– |
– |
2,83 |
|
П л о щ а д ь |
с п е к т р о г р а м м ы |
э р и т р о ц и т о в |
(S эр. ) |
|||
|
эксп. |
1,78 |
2,46 |
4,20 |
4,37 |
7,48 |
1,71 |
|
F табл. |
2,20 |
3,90 |
3,40 |
3,90 |
3,40 |
4,80 |
|
t эксп . |
0,911 |
4,57 |
– |
– |
– |
1,29 |
|
t табл. |
2,75 |
2,75 |
– |
– |
– |
2,82 |
П р и м е ч а н и е. Прочерк в таблице означает, что площади спектрограмм сравнить невозможно. F и t — критерии соответственно Фишера и Стьюдента.
В связи с тем, что площади спектрограмм в пределах одной группы животных значительно различались, мы с целью повышения воспроизводимости метода использовали интегральные индексы для плазмы крови (ИИ пл. ) и эритроцитов (ИИ эр. ). По аналогии с площадью всей спектрограммы ИИ пл. и ИИ эр. представляют собой площадь спектральной фигуры, ограниченной длинами волн в диапазоне соответственно 266-282 и 282-294 нм, в котором находятся максимумы поглощения спектров плазмы и эритроцитов крови всех животных: ИИ пл. = 4 ⋅∑ D (266-282) , ИИ эр. = = 4 ⋅∑ D (282- 294 ) , где D — оптическая плотность (усл. ед.) (табл. 2).
2. Интегральные индексы (ИИ) и относительный показатель (ИПотн.) плазмы и эритроцитов крови коров по физиологическим периодам
|
Индекс |
Группа животных |
|
I 1 II 1 III 1 IV |
|
|
ИИ пл. , усл. ед.2 ИИ эр. , усл. ед.2 ИИ отн. ИП отн. |
1,23-4,37 1,08-3,44 1,80-2,24 1,29-1,53 3,48-11,24 3,23-8,17 3,45-4,35 3,77-4,95 2,40-4,06 2,43-3,13 2,36-2,92 1,73-2,31 1,92-2,39 2,91-2,94 2,50-4,08 2,16-2,32 |
Введение ИИпл. и ИИэр. позволяет сравнивать большее число групп животных (во втором случае почти все) и повышает воспроизводимость метода (табл. 3).
3. Сравнительная оценка интегральных индексов плазмы и эритроцитов крови коров по физиологическим периодам (усл. ед.2)
|
Критерий оценки |
Сравниваемые группы животных |
|||||
|
I—II 1 |
I—III |
1 I—IV 1 |
II—III |
1 II— IV 1 |
III—IV |
|
|
И н т е г р а л ь н ы й |
и н д е к с п л а з м ы |
к р о в и |
(ИИ пл. ) |
|||
|
F эксп. |
1,82 |
4,89 |
2,09 |
8,89 |
3,31 |
2,33 |
|
F табл. |
2,20 |
3,90 |
3,60 |
3,90 |
3,60 |
5,40 |
|
t э ксп. |
2,28 |
– |
1,15 |
– |
2,63 |
3,48 |
|
t табл. |
2,75 |
– |
2,75 |
– |
2,75 |
2,83 |
|
И н т е г р а л |
ь н ы й |
и н д е к с э р и т р о ц и т о в |
(ИИ эр. ) |
|||
|
F эксп. |
1,96 |
1,95 |
2,87 |
3,82 |
5,64 |
1,47 |
|
F табл. |
2,20 |
3,90 |
3,14 |
3,90 |
3,40 |
4,80 |
|
t э ксп. |
1,79 |
2,92 |
4,13 |
3,56 |
– |
1,01 |
|
t табл. |
2,75 |
2,75 |
2,75 |
2,75 |
– |
2,82 |
|
П р и м е ч а н и е. |
Прочерк в таблице означает, |
что сравнить индексы невозможно |
. F и t — критерии соответственно |
|||
|
Фишера и Стьюдента. |
||||||
Биохимические показатели азотистого обмена здоровых животных, оцениваемые рутинными методами, находились в пределах нормы, соответствующей каждому физиологическому периоду. Так, для группы коров в период производства молока, сухостоя, отела и раздоя концентрация в сыворотке крови общего белка составляла соответственно 85,3 ± 4,5; 84,7 ± 6,0; 80,8 ± 2,3; 78,6 ± 5 г/л; альбуминов — 26,4 ± 2,1; 27,6 ± 3,2; 24,5 ± 2,7; 25,4 ± 2,2 г/л; мочевины — 5,4 ± 0,8; 5,2 ± 0,6; 4,0 ± 0,7; 4,2 ± 0,6 ммоль/л; креатинина —0,174 ± 0,052; 0,142 ± 0,048; 0,135 ± 0,071; 0,138 ± 0,063 ммоль/л; билирубина — 2,1 ± 0,2; 4,1 ± 0,4; 3,8 ± 0,03; 2,3 ± 0,2 мкмоль/л; активность АСАТ — 1,70 ± 0,14; 1,68 ± 0,15; 1,73 ± 0,14; 1,75 ± 0,15; АЛАТ — 1,37 ± 0,15; 1,38 ± 0,14; 1,42 ± 0,15; 1,41 ± 0,14 нмоль/(с ⋅ л); ГГТ — 1,02 ± 0,11; 1,03 ± 0,12; 1,05 ± 0,11 1,05 ± 0,12 мкмоль/(с ⋅ л).
При нарушении обмена веществ характер спектрограмм изменялся, так как повышалась концентрация ВНСММ в крови. На начальной стадии нарушений обмена веществ повышалась оптическая плотность спектрограмм при длинах волн, соответствующих максимуму, при глубоких нарушениях изменялось расположение спектрограмм в целом. Кроме того, при глубоких нарушениях метаболизма смещались полосы максимумов спектрограмм и появлялись отличные от нуля показатели оптической плотности при длинах волн в диапазоне 238-246 нм, когда регистрируются вещества катаболического происхождения, ксенобиотики, продукты распада клеток микробной природы и т.д. У здоровых животных эти вещества в норме имеются в незначительных концентрациях, ниже порога чувствительности метода (D = 0).
Установить степень нарушения обмена веществ позволяет относительный интегральный индекс (ИИ отн. ), который рассчитывают по формуле: ИИ отн. = ИИ-эр . /ИИпл . ; в норме ИИотн . = 1,73 + 4,06 (см. табл. 2). На ранних стадиях метаболических нарушений увеличивалась сорбционная емкость эритроцитов, так как последние за счет белка гликофорина адсорбируют на поверхности вещества разных классов, в том числе, и средней молекулярной массы. В то же время концентрация ВНСММ в плазме крови практически не изменялась, в результате чего значения ИИ отн. были выше, чем в норме. На спектрограммах, соответствующих второй стадии нарушений метаболизма, наблюдалось умеренное увеличение содержания ВНСММ как в плазме крови, так и в эритроцитах, причем значения ИИотн. начинали снижаться. На третьей стадии нарушений обменных процессов увеличивалось содержание ВНСММ как в плазме крови, так и в эритроцитах, причем больше в плазме. Следовательно, при патологии ИИотн. резко снижается, что позволяет судить о степени нарушения обмена веществ и повышает информативность и значимость этого показателя (рис. 2).
Высокой информативностью обладает также относительный интегральный показатель (ИП отн. ), который рассчитывают по формуле ИП отн. = S 2 / S2 , где S 2 и
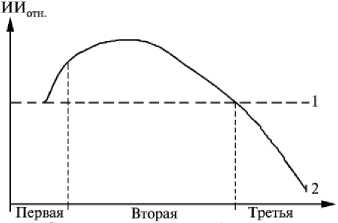
Стадии нарушения метаболизма
Рис. 2. Зависимость относительного интегрального индекса (ИИ отн. ) от стадии нарушения обмена веществ у коров красной пестрой породы: 1 — норма, 2 — патология.
эр. п л. эр.
S — площадь спектрограммы соответст- п л.
венно эритроцитов и плазмы крови; в норме ИП отн. = 2,05 + 3,47 (см. табл. 2). Характер зависимости ИП отн. от стадий метаболических нарушений аналогичен таковому ИИ отн. (см. рис. 2).
В то же время биохимические показатели рутинных методов не всегда позволяют выявлять нарушения обмена веществ на ранней стадии. Так, у животных с клини- ческими признаками нарушений обмена веществ концентрация общего белка в сыворотке крови составляла 63,4±2,2; альбуминов — 23,75±3,8 г/л; мочевины — 5,8±0,9 ммоль/л; креатинина —0,182±0,067 ммоль/л; билирубина — 3,90±0,4 мкмоль/л; активность АСАТ — 1,76±0,16 нмоль/(с-л); АЛАТ — 0,43±0,15 нмоль/(с-л); ГГТ — 1,04±0,12 мкмоль/(с-л).
Таким образом, интегральный метод оценки метаболического статуса коров, основанный на спектрофотометрическом определении содержания веществ низкой и средней молекулярной массы, является хорошо воспроизводимым, простым и сохраняет информативность по биохимическим показателям при сокращении числа общепринятых анализов крови. Следовательно, этот метод может быть широко использован на практике для диагностики метаболических нарушений, что дает возможность корректировать кормовой рацион животных и проводить профилактические меро- приятия.
Л И Т Е Р А Т У Р А
-
1. М а л а х о в а М.Я. Метод регистрации эндогенной интоксикации. СПб, 1995.
-
2. О б о л е н с к и й С.В., М а л а х о в а М.Я. Лабораторная диагностика интоксикаций в практике
интенсивной терапии. СПб, 1991.
-
3. С и м б и р ц е в С.А., Б е л я к о в Н.А. Патофизиологические аспекты эндогенных интоксикаций. Тез. докл. междунар. симп. «Эндогенные интоксикации». СПб, 1994: 5-9.
-
4. С т е п а н о в а И.П. Диагностическая ценность определения ВНСММ в плазме крови и эритроцитах коров. Зоотехния, 2001, 12: 14-15.
-
5. С т е п а н о в а И.П. Интегральная оценка метаболического статуса крупного рогатого скота. В сб.: Достижения ветеринарной медицины — XXI веку. Мат. междунар. науч. конф., посвященной 40-летию Института ветеринарной медицины АГАУ. Барнаул, 2002: 179-180.
-
6. С т е п а н о в а И.П. Сравнительный анализ методов оценки метаболического статуса коров в разные физиологические периоды. Тез. докл. 4-го съезда физиологов Сибири. Новосибирск, 2002: 269.
Институт ветеринарной медицины Омского 112


