Интенсификация процесса подготовки трутовика fomitopsis pinicola в технологии крашения текстильных материалов
Автор: Скобова Н.В., Кириллова М.Д., Шитикова А.А.
Журнал: Вестник Витебского государственного технологического университета @vestnik-vstu
Рубрика: Химическая технология
Статья в выпуске: 3 (53), 2025 года.
Бесплатный доступ
Возвращение к натуральным красителям, характеризующимся биосовместимостью, биоразлагаемостью и нетоксичностью, дает возможность удовлетворить спрос потребителя к «зелёным» технологиям и изделиям. Грибы – это экологичный источник пигментов, поскольку они вырабатывают стабильные красители, безопасные для окружающей среды, содержат несколько антрахиноновых соединений и пигментов, таких как дельфинидин, меланин и летучие органические соединения, которые являются их вторичными метаболитами. Доступным источником получения меланиновых пигментов являются дереворазрушающие грибы, в частности, трутовик окаймленный, произрастающий в большом количестве на территории Витебской области. Меланиновые пигменты обуславливают коричневую окраску плодового тела, находятся в клеточной стенке гриба, плохо растворимы в воде. Для их извлечения требуется выбрать обоснованный подход к вопросу подготовки сырья к экстрагированию меланиновых пигментов в рабочий раствор красильной ванны, чтобы придать окрашиваемому материалу яркие цвета, устойчивые к мокрым обработкам. Целью работы является выбор рациональных параметров подготовки плодовых частей Fomitopsis pinicola (трутовика окаймленного) к экстрагированию, обеспечивающих максимальный выход пигмента в рабочий раствор красильной ванны. Установлено, что предварительное замачивание частей плодового тела гриба и их дробление на мелкие фракции не позволяет повысить выход пигментов в рабочий раствор красильной ванны. Такой же результат получен после длительного экстрагирования частей гриба методом водной экстракции без предварительной ультразвуковой обработки сырья. Выявлено, что кавитационное воздействие на плодовую часть трутовика, приводящее к изменению структурно-функциональных свойств гриба и способствующее высвобождению внутриклеточных веществ (пигментов), оказывает существенное влияние на конечный цвет текстильного материала. Получены теоретико-экспериментальные зависимости оптической плотности рабочего раствора красильной ванны и индекса светлоты окрашенной пряжи от технологических режимов ультразвуковой обработки частей плодового тела трутовика окаймленного, позволяющие установить рациональные параметры озвучивания: мощность генератора не менее 60 Вт, продолжительность обработки не более 30 минут.
Плодовое тело гриба, трутовик, экстрагирование, спектрограмма, меланиновые пигменты, ультразвуковая обработка
Короткий адрес: https://sciup.org/142246495
IDR: 142246495 | УДК: 677.027.4 | DOI: 10.24412/2079-7958-2025-3-89-99
Текст научной статьи Интенсификация процесса подготовки трутовика fomitopsis pinicola в технологии крашения текстильных материалов
DOI:
Основной проблемой, стоящей перед современной наукой, является поиск устойчивых альтернатив синтетическим красителям. Это обусловлено тем, что текстильная промышленность производит более 2 миллиардов тонн сточных вод, большая часть которых попадает в водные экосистемы после процессов окрашивания. Согласно данным Всемирного банка, на её долю приходится более 20 % загрязнения всей воды, используемой в этом секторе (Carvalho et al., 2023). Химическая структура синтетических красителей, в основе которой лежат азогруппы, обуславливает их токсичность и канцерогенность. Этим объясняется растущий интерес к натуральным красителям растительного и животного происхождения, которые являются биоразлагаемыми, нетоксичными и возобновляемыми (Ballard, 2007). Для решения обозначенной проблемы наука вынуждена работать на стыке химии, материаловедения и экологии. Одним из наиболее перспективных направлений является разработка биокрасителей, получаемых из растений, штаммов микроорганизмов, продуцирующих пигменты, грибов (Haider, 2023; Naz, 2022; Ерниязова и Курагина, 2021).
Грибы представляют собой ценный источник пигментов (плодовое тело, питательная среда и мицелий), поскольку они способны давать высокие выходы вещества в дешевой питательной среде, что делает биопроцесс экономически выгодным в промышленном масштабе (Lagashetti et al., 2019; Shrikant and Sandeep, 2020; Wagh, 2021). Грибные пигменты – это внеклеточные метаболиты, которые можно использовать во многих продуктах (Diaz and Gerardo, 2022). На рисунке 1 можно увидеть некоторые оттенки, вырабатываемые различными классами метаболитов и их основными химическими структурами (меланины, антрахиноны, гидроксиантрахиноны, азафилоны, каротиноиды, оксополиены, хиноны и нафтохинон) (Özdemir, 2020).
Пигмент Arpink red (Натуральный красный), который является первым коммерческим красным цветом гриба, был получен из штамма Penicillium oxalicum var. armeniaca CCM 8242, выделенного из почвы. Биосинтетически многие из этих пигментов являются производными поликетидов, которые в изобилии вырабатываются большинством аскомицетных грибов g Neurospora spp. и Monascus spp. Кроме того, молекулы на основе поликетидов; другие классы пигментированных метаболитов, присутствующие в различных нитчатых грибах, – это терпеноиды, полифенолы и каротиноиды (Kalra, Conlan and Goel, 2020).
Для извлечения гидрофобных и внутриклеточных соединений предпочтительны методы «зелёной» экстракции, поскольку они либо не требуют использования органических растворителей, либо требуют меньшего их количества, а потому считаются более безопасными
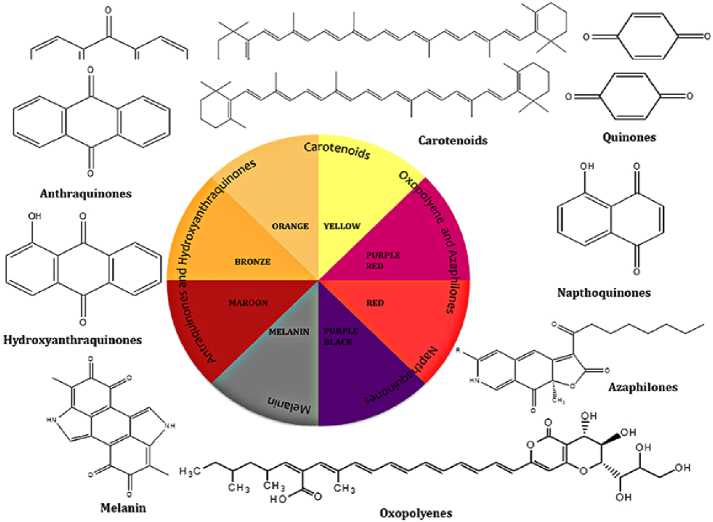
Рисунок 1 – Оттенки цветов, получаемые с помощью соединений разных классов метаболитов
Figure 1 – Color shades obtained using compounds of different classes of metabolites -------------------------------------------------------------------------------------------------------------•
и экологичными. Некоторые из этих методов работают при низких температурах, что также способствует извлечению термолабильных пигментов без их деградации. Эти методы экстракции включают ультразвуковую экстракцию, экстракцию с помощью импульсного электрического поля, экстракцию жидкостью под давлением, микроволновую экстракцию, экстракцию с помощью ионной жидкости и сверхкритическую экстракцию CO 2 (Kalra, Conlan and Goel, 2020).
Экстракция с помощью ультразвука зарекомендовала себя как эффективный и экологически безопасный метод в ряде фитофармацевтических отраслей (Chemat et al., 2017). Из-за термолабильности большинства природных метаболитов вероятность их разрушения при термической экстракции очень высока. В отличие от этого, применение ультразвука обеспечивает более высокую эффективность экстракции при низкой температуре. Этот метод основан на использовании высокоинтенсивных ультразвуковых волн для ускорения экстракции твёрдого вещества в жидком растворителе, волны создают локальное давление, которое в конечном счёте приводит к разрыву клетки и способствует высво- бождению внутриклеточных веществ в растворитель. В основном используется акустическая энергия, которая не поглощается молекулами, а передаётся через среду. (Kalra, Conlan and Goel, 2020).
Применение новых методов экстракции для извлечения пигментов на основе грибов является интересным направлением для дальнейшего изучения.
Целью работы является выбор рациональных параметров подготовки плодовых частей Fomitopsis pinicola (трутовика окаймленного) к экстрагированию, обеспечивающих максимальный выход пигмента в рабочий раствор красильной ванны.
Объекты и методы исследований
Из существующего множества представителей трутовиков объектом исследований выбран трутовик окаймленный (лат. Fomitopsis pinicola). Данный вид произрастает на валежнике, пнях, сухостое хвойных и лиственных деревьев, является сапрофитом, вызывающим бурую гниль, распространён на всей территории Республики Беларусь, а также России и Европы. Гриб отличается характерной окраской: полукруглая шляпка с концентрическими зонами разного цвета – от жёлтого и оранжевого до коричневого и чёрного, нижняя поверхность представляет собой трубчатый слой1 (рисунок 2). Плодовые тела Fomitopsis pinicola содержат множество уникальных биологически активных соединений. В последние годы из гриба получают множество химических экстрактов, содержащих большое число полезных ферментов: эндоглюканазу, ксиланазу, лаказу, целло-биогидролазу, β-1,4-глюкозидазу, а также питательные компоненты, такие как хитан и хитозан, тритерпены, производные тритерпенов, включая тритерпеновый спирт, тритерпеноиды ланостанова, тритерпеновые гликозиды, стероиды, биологически активные полисахариды (эндополисахариды и экзополисахариды) (Idrees, 2020).
Выбор представителя данного вида для изучения в контексте натурального красителя обусловлен:
– доступностью в больших количествах в лесах Республике Беларусь;
– высокой устойчивостью к внешним воздействиям, что делает его перспективным для получения натуральных красителей;
– не токсичен, так как используется в народной медицине для лечения многих заболеваний (диабет, гнойная инфекция и т. д.);
По предварительным данным гриб по биологическому составу имеет большое количество хитина, меланинов, глюканов, тритерпеноидных соединений: люпиол, бетулин; и других биологически активных веществ (Во- робьева, 2023; Sava, et al., 2001; Курченко и Сушинская, 2020). Некоторые из данных веществ являются красящими пигментами (например: меланин дает желтую, коричневую окраску).
Грибы собирали в лесах Витебской области, разрезали на части и высушивали в естественных условиях без доступа солнечного света.
В исследованиях использована лабораторная ультразвуковая ванна «Сапфир» УЗВ-1,3/2 (ЗАО НПО «Техноком»). Регулируемыми параметрами обработки являются время озвучивания раствора (от 1 до 99 мин), мощность генератора (до 100 Вт) и температура раствора (до 70 оС), нерегулируемым – рабочая частота колебаний (35 кГц).
Для оценки интенсивности выхода красящего пигмента в водный раствор применялся спектрофотометрический метод анализа полученных растворов, реализованный на спектрофотометре Solar 2201PB, работающем в ультрафиолетовой, видимой и ближней инфракрасной областях спектра. Использование спектрофотометра позволит качественно оценивать состав веществ, содержащихся в анализируемой пробе. Исследования проводились в режиме поглощения на длине волн от 230 нм до 600 нм (Скобова, Ясинская и Горохова, 2024).
Этапы подготовки растительного сырья к экстрагированию представлен на рисунке 3.
По схеме 1 сырье использовалось в сухом виде без предварительного замачивания. В исследованиях использовали крупные части грибов – 50–80 мм и дробленые с размером фракций 5–10 мм. По схеме 2 подготовка велась по всем этапам с использованием дробленых частей грибов.

Рисунок 2 – Трутовик окаймленный
Figure 2 – Fomitopsis pinicola
92 м
ВЕСТНИК Витебского государственного технологического университета, 2025, № 3 (53)
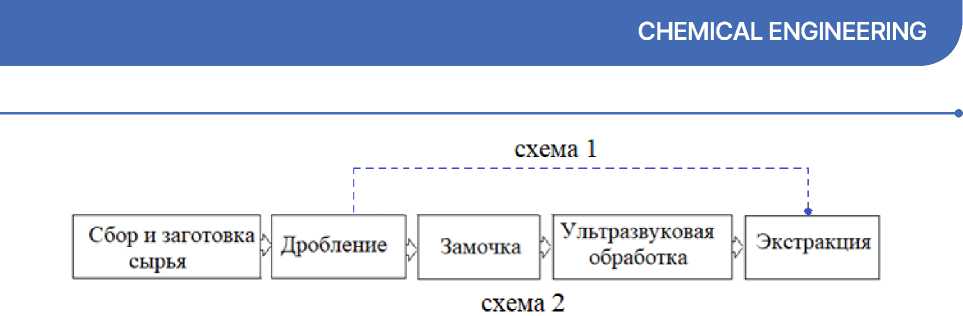
Рисунок 3 – Схема подготовки Fomitopsis pinicola к экстрагированию Figure 3 – Schemes of preparation Fomitopsis pinicola for extraction
Структура мякоти трутовика окаймленного упругая, войлочная, напоминающая пробку, верхняя лицевая часть – деревянистая. Поэтому были поставлены следующие задачи, решение которых позволит обеспечить максимальный выход пигментов в красильный раствор: установить необходимость этапа замачивания плодового тела, выбрать оптимальное время экстрагирования, оценить возможность интенсификации этапа экстрагирования путем ультразвуковой обработки сырья.
Замачивание сырья в дробленом виде проводили в дистиллированной воде на 1, 4 и 8 часов при температуре 20 оС. Эффективность многочасового замачивания оценивали по цветовой гамме полученных окрашенных образцов шерстяной пряжи.
Выбор продолжительности экстрагирования грибов в дробленом и недробленом виде варьировалась от 1 часа до 4 часов, температура ванны составляла 85–90 оС, модуль ванны 1:10, экстрагент – дистиллированная вода.
Для выбора оптимальных режимов ультразвуковой обработки частей трутовика окаймленного проведен двухфакторный эксперимент по матрице Коно с двумя повторностями в каждой серии опытов. Входными факторами выбраны мощность генератора и время озвучивания (таблица 1).
Выходными параметрами выбраны:
– оптическая плотность красильного раствора после экстрагирования;
– индекс светлоты (Пчелова и др., 2020). По отсканированным фотографиям окрашенных образцов пряжи определены усредненные условные цветовые координаты для каждого из образцов (RGB). После чего рассчитывали индекс светлоты ( Õ , %, от чисто белого):
Х =
R + G + B
• 100 % .
Крашение пряжи проводили при модуле ванны 1:5, температура красильной ванны 95 оС, продолжительность окрашивания 50 минут.
Результаты исследований
Исследования оптической плотности экстракта водного раствора Fomitopsis pinicola, полученного после восьмичасовой предварительной замочки сырья представлены на рисунке 4, а. Спектрограмма водного раствора имеет одноволновой спектр, максимум поглощения наблюдается при длине волны 350 нм, это выход темных меланинов. Имеется небольшой экстремум на длине 280 нм и 370 нм, с увеличением длины волны значения оптической плотности снижаются. Образцы пряжи, окрашенные в полученных растворах, по цветовой гамме мало отличимые, причем не наблюдается суще-
Таблица 1 – Уровни варьирования входных факторов
Table 1 – Levels of variation of input factors
|
Факторы |
Натуральные значения |
Кодированные значения |
||||
|
ниж. |
основ. |
верх. |
ниж. |
основ. |
верх. |
|
|
Мощность генератора, Вт ( W ) |
40 |
70 |
100 |
-1 |
0 |
+1 |
|
Время озвучивания, мин ( T ) |
20 |
30 |
40 |
-1 |
0 |
+1 |
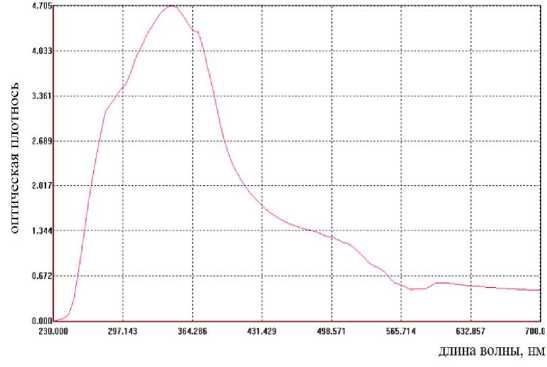
Рисунок 4 – Электронный спектр экстракта трутовика после 8 ч замачивания (а), результат окрашивания шерстяной пряжи (б)
Figure 4 – Electronic spectrum of tinder fungus extract after 8 hours of soaking (a), the result of dyeing wool yarn (b)

б (b)
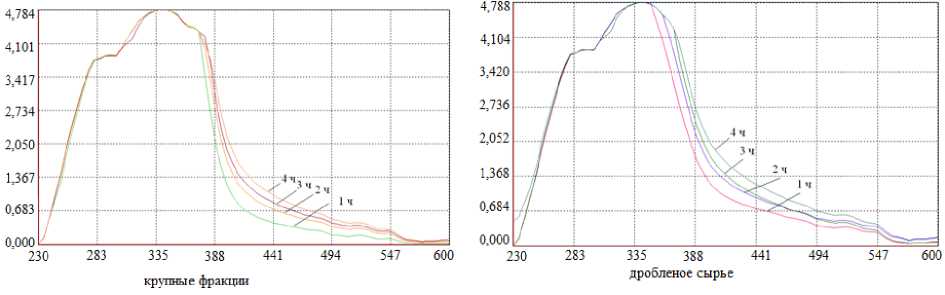
Рисунок 5 – Электронный спектр растворов после экстрагирования Figure 5 – Electronic spectrum of solutions after extraction
ственной разницы в насыщенности оттенка при сравнении с образцом, окрашенным экстрактом грибов без предварительного замачивания (рисунок 4, б).
Cогласно данным литературных источников, для экстрагирования в рабочий раствор различных веществ из трутовиков требуется от 1 до 6 часов (Воробьева, 2023; Ооржак, 2020), поэтому в проводимых исследованиях для извлечения пигмента в раствор для последующего крашения шерстяной пряжи выбран временной интервал от 1 до 4 часов. На рисунке 5 представлен электронный спектр красильных растворов после каждого часа экстракции плодового тела крупных и дробленых фракций. Подготовка сырья проводились по схеме 1.
Анализ спектров показал, что использование сырья в виде больших фракций наиболее предпочтительно, в электронном спектре экстракта наблюдаются три полосы поглощения с экстремумами на длине волны 280 нм, 340 и 355 нм, предположительно это выход темных меланинов (при идентификации меланина его максимальное поглощение в УФ-видимом спектре приходится на диапазон 200–400 нм (Suthar et al., 2023). Спектр раствора дробленого сырья имеет двухволновой вид с экстре- мумом на длине волны 280 и 340 нм. В обоих случаях экстрагирование более 2 часов не целесообразно, существенной разницы в спектрах не наблюдается, кроме того длительная обработка при высоких температурах приводит к термическому разложению плодового тела.
Проведены исследования по интенсификации процесса экстрагирования пигмента в рабочий раствор путем ультразвуковой обработки крупных фракций грибов по схеме 2 (условия эксперимента описаны ранее).
В результате обработки экспериментальных данных получены теоретико-экспериментальные зависимости оптической плотности красильного раствора от режимов озвучивания:
D 340 = 4,788 - 0,003 • T - 0,008 • W • T - 0,0087 • W 2 -
– зависимость индекса светлоты от режимов озвучивания:
X = 40,87 - 7,82 • W + 6,86 • T - 2,42 •T •W + 3,46 • W:
Анализ уравнений показывает, что на интенсивность окрашивания раствора красильной ванны оказывают влияние оба фактора: мощность генератора и время озвучивания.
Для оценки статистической значимости разработанных моделей проведен дисперсионный анализ. В таблице 2 для разработанных уравнений представлена сумма квадратов отклонений регрессии, критерий Фишера (F-value), значение которого для всех рассмотренных моделей значительно больше критического ( Ft = 5,05), при уровне значимости p < 0,05, что указывает на достоверность разработанных моделей.
0,0067 • T2 (R 2 = 0,976) (2)
( R 2 = 0,991 ) (3)
Таблица 2 – Оценка значимости разработанных моделей
Table 2 – Assessment of the significance of the developed models
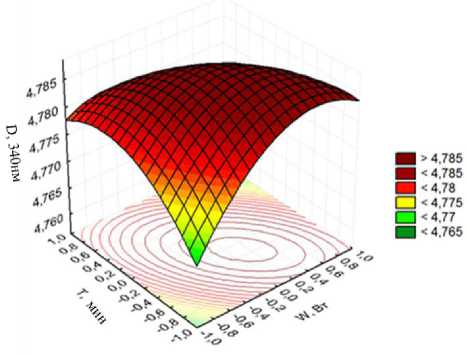
Рисунок 6 – Зависимость оптической плотности красильного раствора (слева)
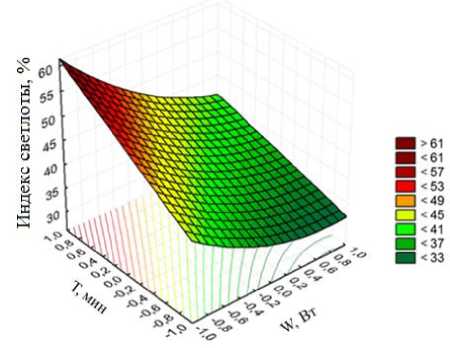
По моделям (2) и (3) построены 3D образы полученных зависимостей (рисунок 6).
Полученные зависимости позволяют оценить степень влияния режимов озвучивания сырья на последующий процесс крашения: максимальный выход пигмента в рабочую ванну происходит при мощности генератора 60 Вт и более, продолжительность обработки не более 30 минут.
Анализ результатов
Грибы представляют собой ценный источник пигментов, в частности трутовик окаймленный вырабатывает темно-коричневый пигмент, известный как меланин, путем окислительной полимеризации фенольных соединений, таких как глутаминил-3,4-дигидрокси-бензол (GDHB), или катехол, или 1,8-дигидроксинафталин (DHN), или 3,4-дигидроксифенилаланин (DOPA) (Pombeiro-Sponchiado et al. 2017; Suthar et al., 2023). Меланин обуславливает коричневую окраску верхнего слоя плодового тела гриба. Меланин проявляет акцепторную активность и другие биологические свойства, включая терморегуляторную, радио- и фотозащитную, антимикробную.
Меланины классифицируются как эумеланины, фео-меланины, алломеланины (DHN-меланины) и пиоме-ланины. Эти классификации основаны на химическом составе мономерных субъединиц пигмента и являются общепринятыми И эумеланины, и феомеланины образуются из общего предшественника – дофахинона, который получается в результате окисления тирозина или L-дофы (Suthar et al, 2023).
Предположительно, трутовик включает эумеланины – это тёмно-коричневые или чёрные пигменты, содержащие 6–9 % азота и 0–1 % серы. Их предшественник, дофахинон, подвергается циклизации, в результате чего образуется циклодопа, которая быстро окисляется до допахромы. Затем допахрома преобразуется в единицы 5,6-дигидроксииндола (DHI) и 5,6-дигидроксиин-дол-2-карбоновой кислоты (DHICA), образуя эумеланины (Suthar et al, 2023; Воробьева, 2023).
На поверхности меланинов содержится большое количество полярных групп, в среднем их количество: 6,50 % – карбонильных; 5,81 % – метоксильных; 4,5 % – карбоксильных (Воробьева, 2023). Наличие последних способствует лучшему растворению пигмента в воде, увеличению сродства пигмента к волокну и повышению устойчивости окрасок к мокрым обработкам. За счет комплексообразования и содержания большого количе- ства неспаренных электронов в меланинах могут содержаться минеральные компоненты, в том числе и ионы металлов. Все это делает выделяемый пигмент схожим с кислотными металлокомплексными синтетическими красителями, активно применямыми для окрашивания шерсти.
Эумеланины имеют низкую растворимость в воде, поэтому предварительное замачивание сырья не способствует максимальному выходу пигмента в рабочий раствор. Установлено, что влияющими факторами на процесс подготовки сырья являются длительность экстрагирования при высокой температуре и примененный метод интенсификации подготовки сырья к экстрагированию. За счёт высокой температуры процесса достигаются значительные скорость массообмена и выход экстрактивных веществ за короткое время.
Меланиновые пигменты прочно связаны со структурными компонентами клеток грибов, что делает невозможным их полное извлечение без изменения структурно-функциональных свойств. Воздействие ультразвуковых волн повышает эффективность экстракции меланина. В ходе этого процесса в клеточной стенке гриба происходит массообмен, вызванный кавитацией. Когда образуются и схлопываются кавитационные пузырьки, высвобождаемая энергия способствует проникновению растворителя в клеточную стенку, благодаря чему клеточная стенка легко разрушается и клеточный матрикс может быть отделён.
Выводы
В результате проведенных исследований установлено:
– гриб Fomitopsis pinicola можно рекомендовать к использованию в технологиях крашения шерстяной пряжи для получения окрасок, устойчивых к мокрым обработкам;
– дробление трутовика окаймленного до размера мелких фракций (5–10 мм) и его предварительное замачивание не целесообразно, т. к. не приводит к увеличению процента выхода пигмента в красильный раствор;
– для интенсификации процесса экстрагирования пигмента в рабочий раствор рекомендуется проводить ультразвуковую обработку плодовых тел грибов при мощности генератора 70 Вт, длительности озвучивания 30 минут.


