Интерстициальная лучевая терапия (брахитерапия) рака предстательной железы - 10 лет в России
Автор: Сивков А.В., Ощепков В.Н., Жернов А.А., Корякин А.В.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Рак предстательной железы, рак почки
Статья в выпуске: 2-3, 2011 года.
Бесплатный доступ
Рак предстательной железы, брахитерапия, пса
Короткий адрес: https://sciup.org/142187831
IDR: 142187831
Текст статьи Интерстициальная лучевая терапия (брахитерапия) рака предстательной железы - 10 лет в России
Б рахитерапия имеет более чем 100-летнюю историю. В 1914 г. были опубликованы первые результаты внедрения радиевой иглы в предстательную железу больному раком предстательной железы (РПЖ). В 30-х годах XX века Хью Грант провел более 5 тысяч имплантаций источников радиоактивного излучения в предстательную железу с достаточно хорошими результатами. Главным сдерживающим фактором развития метода стали отсутствие стандартизированных источников излучения, дозиметрического контроля и визуализации.
В 70-х годах прошлого века были разработаны источники, конструкция которых применяется до настоящего времени. В 1983 г. появилась методика введения источников в предстательную железу под ультразвуковым контролем. В 1995 г. была решена проблема миграции источ-
Рисунок 1. Контроль положения зерен с помощью КТ и постоперационная дозиметрия ников после имплантации путем их размещения на полимерной нити или в оплетке. Первые результаты десятилетнего наблюдения за больными РПЖ, перенесшими брахитерапию, опубликованы в 1998 г. Продемонстрировано, что отдаленные результаты брахитерапии приближаются к таковым после радикальной простатэктомии и дистанционной лучевой терапии.
ОПЫТ НИИ УРОЛОГИИ
1 марта 2000 г. в НИИ урологии была выполнена первая брахитера-
Таблица 1. Пятилетние результаты применения брахитерапии в НИИ урологии
|
N = 56 |
Безрецидивная выживаемость (%) |
Специфическая выживаемость (%) |
|
Пациенты низкого риска |
89 |
100 |
|
Пациенты промежуточного риска |
81 |
100 |
|
Пациенты высокого риска |
56 |
88 |
|
Таблица 2. Безрецидивная выживаемость |
||
|
Автор |
% |
лет |
|
Beyer & Brachman |
71 |
5 |
|
Ragde et al. |
66 |
10 |
|
Grado et al. |
79 |
5 |
|
Stock & Stone |
75 |
5 |
|
Zelefsky et al. |
71 |
5 |
|
Gritz et al. |
88 |
5 |
|
Blasko et al. |
85 |
10 |
|
ESTRO |
71-93 (65-85) |
5-10 |
|
НИИ урологии |
78 |
5 |
Interstitial radiation therapy (brachytherapy) for prostate cancer – 10 years experience in Russia
A. Sivkov, V. Oschepkov, A. Zhernov, A. Koryakin пия в России. За годы применения в стенах нашего института метод подвергся эволюции:
-
• усовершенствовалась техника имплантации радиоактивных зерен;
-
• внедрено планирование брахитерапии в режиме реального времени, что позволило выполнять ее более прецизионно и умень-
- Рисунок 2. Частота рецидивов в зависимости от стадии по Глисону
шить нагрузку на критические органы;
-
• достигнуто снижение продолжительности операции, которая составляет от пятнадцати минут до получаса;
-
• немаловажным фактором является проведение послеоперационного контрольного планирования, позволяющего оценить качество проведенного лечения (рисунок 1).
В 2008 г. на Пленуме российских онкоурологов были доложены 5-летние результаты применения брахитерапии в нашей клинике, которые соответствуют мировым данным: специфическая выживаемость составила 96%, безрецидивная – 78%. Проанализированы результаты 56 больных, их которых 18% были низкого риска, 46% – промежуточного, а 36% – высокого риска (таблицы 1, 2).
В настоящее время под наблюдением в НИИ урологии состоят более 230 пациентов с РПЖ в возрасте от 42 до 81 года и сроком наблюдения до 11 лет.
Необходимо подчеркнуть важность отбора больных. В частности, при разделении пациентов на группы наихудшие результаты были получены у пациентов, имевших индекс Глисона 7 и выше (рисунок 2). Такая же тенденция наблюдается для уровня простатического антигена (ПСА) более 10 нг/мл (рисунок 3). В своей практике мы используем следующие критерии отбора:
-
• клиническая стадия T1c-T2b;
-
• уровень ПСА менее 10 нг/мл;
-
• объем ПЖ до 50 см3 (по данным
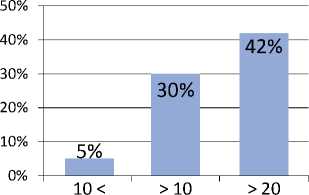
Рисунок 3. Частота рецидивов в зависимости от исходного уровня ПСА
ТРУЗИ) при отсутствии выраженной инфравезикальной обструкции;
-
• показатель Глисона менее 7 баллов;
-
• низкий риск экстракапсулярного распространения опухоли, поражения семенных пузырьков и лимфатических узлов по данным МРТ и номограмм.
При бóльших размерах ПЖ рекомендовано назначение гормональной терапии сроком до 3-х месяцев.
Пациентам стадий T2b-T3a целесообразно комбинированное лечение с применением дистанционной лучевой терапии (40 Гр).
В систематическом обзоре No-ederhaug, представленном в 2003 г., только работа Stokies и соавторов (2000) удовлетворяла всем принципам доказательной медицины. Это рандомизированное исследование не показало различий в безрецидив-ной 5-летней выживаемости для пациентов низкого и промежуточного риска, которая составила 70%.
Нами были разработаны ряд приемов, улучшающих результативность и безопасность лечения. Изменения техники имплантации позволили снизить частоту миграции источников (рисунок 4).
Эффективность и безопасность лечения прямо зависят от дозы подведенного излучения (рисунок 5). Поэтому важной задачей является достижение необходимого баланса между этими критериями (рисунок 6).
Мы используем для имплантации «зерна» разной активности, помещая в боковые доли предстательной же-
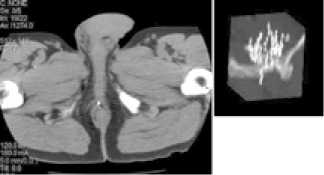
Рисунок 4. Миграция имплантов
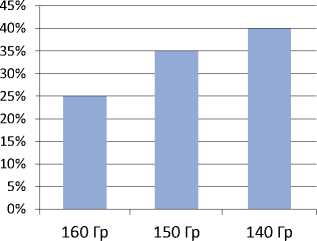
Рисунок 5. Частота биохимического рецидива в зависимости от дозы лезы источники более высокой активности, а вблизи уретры и прямой кишки, для уменьшения нагрузки на эти органы, – низкой.
Дизурия – это основная проблема, с которой приходится сталкиваться при ведении пациентов, перенесших брахитерапию. В этой связи, при отборе больных мы особое внимание уделяем качеству их мочеиспускания. Наличие выраженной инфравезикальной обструкции, скорее всего, создаст серьезные проблемы после брахитерапии у данной категории больных.
Брахитерапия – это частный случай лучевой терапии, и развитие лучевых реакций неизбежно. В первую очередь, тяжелые осложнения связаны с превышением дозы облучения в области уретры, то есть превышением 150%-до-зного порога, а также наличием инфравезикальной обструкции до лечения. В большом исследовании Gutman (2000), представленного в BJU, было показано, что после брахитерапии происходит уменьшение качества мочеиспускания, при оценке симптомов по шкале IPSS оно составляет примерно 5 баллов. Чем более выражены исходные
|| БЕБИГ
Внедрение и продвижение метода брахитерапии для лечения рака предстательной железы в России и странах СНГ


Мuwpoi/cmm^w С podtWPMTnweHWM ЙйО-125 fІГЭДЛЮП 05ХІ Т.Г
В России уже 17 медицинских учреждений выполняют брахитерапию рака предстательной железы
РЕКЛАМА

ООО «БЕБИГ»
123458, г. Москва,
Сайт:

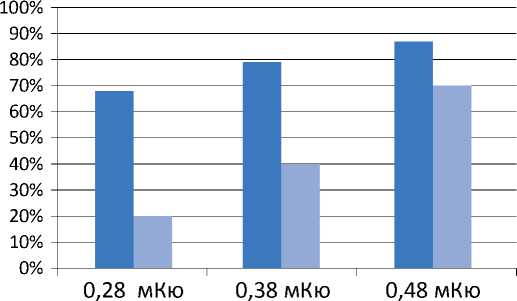
Рисунок 6. Использование источников низкой активности обеспечивает лучший результат
СОД 160 Гр
■ > 100%
■ > 200%
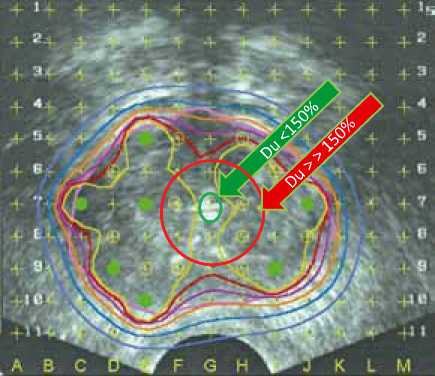
Контур уретры до ТУРП
Контур уретры после ТУРП
Увеличение просвета уретры во время ТУРП «перемещает» слизистую уретры в зону высоких доз
Рисунок 7. Поверхностный уретральный некроз и трансуретральная резекция
RTOG
НИИУ
симптомы ИВО, тем значительней они станут после лечения.
Для коррекции данного состояния мы стандартно используем аль-фа1-адреноблокаторы. Нами было проведено пилотное исследование по неоадъювантному применению альфа1-АБ, в котором было получено почти двукратное уменьшение частоты развития обструктивных осложнений в послеоперационном периоде.
У пациентов с бóльшим объемом предстательной железы мы проводим неоадъювантную гормональную терапию, цель которой – уменьшить размеры органа.
Вопрос применения превентивной трансуретральной резекции (ТУР) остается открытым. Тем не менее, если больному предстоит выполнить брахитерапию и имеется выраженная ИВО, то ТУР лучше выполнить до брахитерапии за 6-12 месяцев, чем после. Это связано с достаточно высоким риском развития серьезных осложнений – стриктуры уретры и недержания мочи. Основной причиной этих осложнений является развитие поверхностного уретрального некроза (рисунок 7). Долгое время считалось, что брахитерапия противопоказана пациентам, перенесшим ТУРП, в связи с высоким риском развития недержания мочи. Наш опыт свидетельствует, что брахитерапия выполнима с высокой степенью безопасности в отдаленном периоде после ТУРП, тщательной дозиметрии и прецизионной установки источников.
ЗАКЛЮЧЕНИЕ
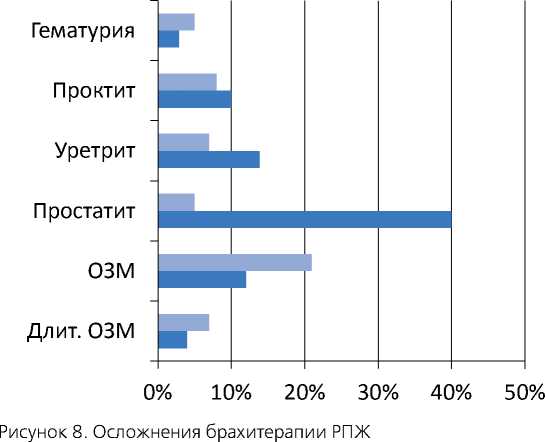
Брахитерапия – современный и безопасный метод лечения локализованного РПЖ у пациентов низкого и умеренного риска. Достигнутые нами результаты лечения соответствуют таковым в ведущих специализированных клиниках мира (рисунок 8). □


