Интрааортальное окутывание против окутывания дакроновым протезом при выполнении модифицированной операции росса у взрослых: ретроспективное одноцентровое исследование
Автор: Чернов И. И., Энгиноев С. Т., Зеньков A. А., Екимов С. С., Гамзаев А. Б.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
В исследованиях было показано, что процедура Росса дает отличные отдаленные результаты. Тем не менее, легочные аутотрансплантаты остаются подверженными риску дилатации в долгосрочной перспективе, поэтому были разработаны методики: внутриаортальная имплантация (ВАИ) и внутридакроновая имплантация (ВДИ). В настоящее время в литературе нет прямого сравнения этих двух методик.Цель исследования: сравнение непосредственных и среднесрочных результатов при выполнении различных модифицированных методик операции Росса.Материал и методы. В ретроспективное одноцентровое исследование были включены 43 пациента (ВАИ: 22; ВДИ: 21) в возрасте 18 лет и старше с патологией аортального клапана (АК), перенесших модифицированные операции Росса с января 2014 по декабрь 2019 гг., выполненные одним хирургом. Основными конечными точками были: госпитальная летальность, послеоперационные градиенты давления на АК, время ишемии миокарда и искусственного кровообращения, послеоперационные осложнения (рестернотомия по поводу кровотечения, периоперационный инфаркт миокарда, инсульт, стернальная инфекция, нарушение проводимости, потребовавшее имплантации постоянного электрокардиостимулятора (ЭКС), острая почечная недостаточность, потребовавшая гемодиализа) и среднесрочные результаты (общая выживаемость, отсутствие повторных операций, отсутствие дилатации аорты более 5 см). Медиана периода наблюдения составила 23 (12-68) мес.Результаты. Основным показанием к операции была аортальная недостаточность у 32 пациентов (74,4%). Двустворчатый АК диагностирован у 29 (67,4%) больных. Мужчин было 33 (76,7%), средний возраст больных составил 40 ± 11,7 лет. Летальных исходов в обеих группах не было. Пиковый и средний градиенты на АК были значительно ниже в группе ВАИ, чем в группе ВДИ (6 [4-8] и 4 [3-5] против 8 [7-11] и 7 [5-9] мм рт. ст., р = 0,04). Не было статистически значимой разницы и в частоте послеоперационных осложнений. Также не было статистически значимой разницы между группами в пятилетней общей выживаемости, отсутствии повторных операций и дилатации восходящей аорты ≥ 5 см.Выводы. Обе методики, включая интраоартальное окутывание и окутывание дакроновым протезом, обеспечивают отличные непосредственные и среднесрочные результаты с точки зрения общей выживаемости, свободы от повторной операции и отсутствия дилатации аорты.
Модифицированная операция росса, процедура росса, аортальный стеноз, аортальная регургитация
Короткий адрес: https://sciup.org/149144431
IDR: 149144431 | УДК: 616.132-007.271-032-089.819.843:616.126.56-031-77 | DOI: 10.29001/2073-8552-2023-38-4-222-230
Текст научной статьи Интрааортальное окутывание против окутывания дакроновым протезом при выполнении модифицированной операции росса у взрослых: ретроспективное одноцентровое исследование
Протезирование аортального клапана (ПАК) у симптоматических больных с тяжелым поражением клапана является «золотым стандартом» [1]. Тем не менее, варианты ПАК, доступные для пациентов молодого и среднего возраста, остаются ограниченными, поскольку биопротезы и механические клапаны имеют свои ограничения, особенно с точки зрения выживаемости. Впервые протезирование аортального (АК) и митрального клапана легочным аутографтом было предложено в 1967 г. D. Ross [2].
За последние десятилетия процедура Росса зарекомендовала себя как оптимальная альтернатива, способная обеспечить отличные результаты с точки зрения выживаемости и гемодинамические показатели, сравнимые с таковыми у пациентов с нормальным АК [3, 4]. Процедура Росса имеет лучшую выживаемость, чем гомографты, механические и биологические протезы [5, 6]. Тем не менее, одним из признанных осложнений и проблем, связанных с этой процедурой, остается дилатация легочного аллотрансплантата в отдаленном периоде, что является одним из основных показаний к повторной операции [7– 10]. Для решения данной проблемы за последние десятилетия было предложено множество технических модификаций операции Росса. Среди них есть внутриаортальная имплантация легочного аутотрансплантата (ВАИ) [11, 12], а также внутридакроновая имплантация (ВДИ) [13]. Однако, насколько нам известно, в литературе отсутствуют результаты сравнения этих двух методик.
Цель исследования: сравнить непосредственные и среднесрочные результаты ВАИ и ВДИ при выполнении модифицированной операции Росса у взрослых пациентов.
Материал и методы
Популяция и дизайн исследования
В ретроспективное исследование были включены 43 пациента в возрасте 18 лет и старше с патологией АК, которым в период с января 2014 по декабрь 2019 гг. были выполнены модифицированные методики операции Росса (ВАИ и ВДИ) одним хирургом в ФГБУ «Федеральный центр сердечно-сосудистой хирургии» Министерства здравоохранения Российской Федерации (Астрахань). Всем пациентам осуществлялась эхокардиографическая оценка АК в нашем учреждении до, во время и после операции, а также перед выпиской из стационара. Кроме того, пациентам старше 35 лет перед операцией проводилась коронароангиография. Данные были собраны ретроспективно как часть нашей базы данных, включая подробную информацию о демографических данных пациентов; исходные клинические характеристики, эхокардиографические и гемодинамические параметры, интраоперационные переменные и послеоперационные исходы. Это исследование было проведено в соответствии с Хельсинкской декларацией (в редакции 2013 г.).
Исследуемые группы
Все больные были разделены на 2 группы: I группа ( n = 22) – больные, перенесшие ВАИ, II группа ( n = 21) – больные, перенесшие ВДИ. Выбор методики осуществлялся оперирующим хирургом интраоперационно.
Конечные точки
Основными конечными точками были: госпитальная летальность и среднесрочные результаты (общая выживаемость, свобода от реоперации, свобода от дилатации аорты 5 см и более). Вторичными конечными точками были: послеоперационные градиенты давления на АК, время ишемии миокарда и искусственного кровообращения, послеоперационные осложнения (рестернотомия по поводу кровотечения, периоперационный инфаркт миокарда, инсульт, стернальная инфекция, нарушение проводимости, потребовавшее имплантации постоянного электрокардиостимулятора (ЭКС), острая почечная недостаточность, потребовавшая гемодиализа).
Хирургическая техника
Основным доступом при выполнении модифицированной операции Росса была срединная стернотомия в условиях искусственного кровообращения и фармакохолодовой кристаллоидной кардиоплегии. Подключали аппарат искусственного кровообращения по схеме «восходящая аорта – полые вены». В качестве кардиоплегического раствора во всех случаях использовали раствор «Кустодиол», доставляемый антеградно через корень аорты, а при аортальной регургитации (АР) – через устья коронарных артерий однократно в объеме 2000–3000 мл. Во всех случаях выполняли полное замещение корня аорты.
Имлантация легочного аутографта осуществлялась при дилатации аорты в собственную аорту, в других случаях в дакроновый протез. Для реконструкции выводного тракта правого желудочка использовали свежеприготовленный легочный гомографт (Санкт-Петербургский банк гомографтов, Санкт-Петербург, Россия). После окончания искусственного кровообращения проводили контрольное чреспищеводное ультразвуковое исследование для оценки функции миокарда и клапанов, гемодинамики на аутографте в аортальной позиции и гомографте в выводном отделе правого желудочка. Более подробно данные методики были описаны в нашей предыдущей статье [12].
Статистический анализ
Статистическую обработку полученных данных проводили с использованием пакетов программ IBM SPSS STATISTICS 26 (Чикаго, Иллинойс, США) и Jamovi (версия 1.6.9).
Проверка нормальности распределения количественных показателей проводилась с помощью критерия Шапиро – Уилка. Количественные показатели с близким к нормальному распределением описывали средним значением и стандартным отклонением (М ± SD ), при
Таблица 1. Дооперационная характеристика пациентов
Table 1. Preoperative characteristics of patients
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
||
|
Возраст, лет ( M ± SD ) Age, years |
40 ± 11,7 |
42,0 ± 13,3 |
38,0 ± 9,6 |
0,3 |
||
|
Мужчины, n ( %) Males |
33 (76,7) |
17 (77,3) |
16 (76,2) |
0,9 |
||
|
Индекс массы тела, кг/м2(М ± SD ) Body mass index, kg/m2 |
26,8 ± 4,7 |
26,0 ± 4,5 |
27,7 ± 4,8 |
0,2 |
||
|
Площадь поверхности тела, м2 ( М ± SD ) Body surface area, m2 |
1,9 ± 0,2 |
1,9 ± 0,2 |
1,9 ± 0,2 |
0,4 |
||
|
NYHA III–IV ФК, n ( %) NYHA III–IV class |
7 (16,3) |
3 (13,6) |
4 (19) |
0,7 |
||
|
Сопутствующие заболевания, n ( %) Comorbidities, n ( %) |
||||||
|
ИБС CAD |
2 (4,7) |
2 (9,1) |
0 |
0,4 |
||
|
ХОБЛ COPD |
1 (2,3) |
0 |
1 (4,8) |
0,5 |
||
|
ФП AF |
2 (4,7) |
0 |
1 (4,8) |
0,2 |
||
|
Периферические заболевания артерий Peripheral vascular disease |
2 (4,7) |
1 (4,8) |
1 (4,8) |
1 |
||
|
Показания к хирургии, n ( %) Surgery indication, n ( %) |
||||||
|
Тяжелый аортальный стеноз Severe aortic stenosis |
11 (25,6) |
6(27,6) |
5(23,8) |
0,8 |
||
|
Тяжелая аортальная регургитация Severe aortic regurgitation |
32 (74,4) |
16 (72,4) |
16 (76,2) |
0,8 |
||
|
Инфекционный эндокардит Infective endocarditis |
13 (30,2) |
5 (22,7) |
8 (38,1) |
0,3 |
||
|
Эхокардиографические параметры Echocardiographic data |
||||||
|
ФВ ЛЖ, % (М ± SD ) LVEF, % |
57,6 ± 7,5 |
56,6 ± 7,7 |
58,5 ± 7,4 |
0,4 |
||
|
Систолическое давление в легочной артерии, мм рт. ст. ( Me [ Q 1 –Q 3]) Pulmonary systolic pressure, mmHg |
30 (25–35) |
32 (26–34) |
33 (24–40) |
0.9 |
||
|
Давление в легочной артерии ≥ 25 мм рт. ст., n ( %) Pulmonary systolic pressure ≥25 mmHg |
33 (76,7) |
19 (86,4) |
14 (66,7) |
0,1 |
||
|
Размер синусов Вальсальвы ( М ± SD ) Sinus of Valsalva, mm |
36 ± 4,3 |
37,8 ± 3,5 |
34,8 ± 4,5 |
0,02 |
||
Окончание табл. 1
End of table 1
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
|
Размер проксимальной части восходящей аорты, mm ( Me [ Q 1 –Q 3]) Proximal ascending aorta, mm |
38 (34–44) |
40 (36–45) |
35 (33–43) |
0,1 |
|
Диаметр фиброзного кольца АК, мм ( Me [ Q 1 –Q 3]) Average annulus diameter, mm |
24 (23–25) |
24 (23–26) |
24 (23–24) |
0,2 |
|
Двухстворчатый АК, n ( %) Bicuspid AV |
29 (67,4) |
16 (72,7) |
13 (61,9) |
0,5 |
Примечание: ИБС – ишемическая болезнь сердца, ФВ ЛЖ – фракция выброса левого желудочка, ФК –функциональный класс, ФП – фибрилляция предсердий, ХОБЛ – хроническая обструктивная болезнь легких.
Note : AF – atrial fibrillation, AV – aortic valve, CAD – coronary artery disease, COPD – chronic obstructive pulmonary disease, NYHA – New York Heart Association, LVEF – left ventricle ejection fraction .
Интраоперационные характеристики
В группе ВАИ протезирование восходящей аорты чаще выполнялось по сравнению с группой ВДИ (22,7 против 0%, p = 0,004). Частота других сопутствующих кардиохирургических вмешательств достоверно не различалась между двумя группами, за исключением частоты протезирования восходящей аорты (табл. 2). Более того, время искусственного кровообращения статистически значимо не различалось между обеими группами (133 против 152 мин, p = 0,1). Однако время ишемии миокарда было значительно короче в группе ВАИ, чем в группе ВДИ (113 против 121 мин, p = 0,04). Медиана размера имплантированного легочного гомотрансплантата составляла 29 [28–29] мм в обеих группах (см. табл. 2).
Послеоперационные результаты
Данные по послеоперационным исходам представлены в таблице 3. Летальных исходов в обеих группах не было. Также не было статистически значимой разницы в частоте послеоперационных осложнений, таких как рестернотомия по поводу кровотечения, периоперационный инфаркт миокарда, инсульт, острая почечная недоста-
точность, стернальная инфекция и частота имплантации кардиостимулятора. Продолжительность пребывания в реанимации была статистически значимо больше в группе ВАИ, чем в группе ВДИ (30 против 24 ч, p = 0,006) (см. табл. 3).
Послеоперационные и среднесрочные эхокардиографические параметры
Пиковый и средний градиенты на АК в раннем послеоперационном периоде были статистически значимо ниже в группе ВАИ, чем в группе ВДИ (6 [4–8] и 4 [3–5] против 8 [7–11] и 7 [5–9] мм рт. ст., p = 0,04) (рис. 1). Но не было статистически значимой разницы в градиентах давления и в размерах аорты в среднесрочном периоде (табл. 4).
Среднесрочные результаты
Не было статистически значимой разницы в пятилетней общей выживаемости, свободе от реоперации и свободе от дилатации восходящей аорты ≥ 5 см после модифицированной операции Росса (97,4; 100 и 100% соответственно) (рис. 2, табл. 5). После выписки из клиники через 4 мес. от неизвестной причины умер один пациент из группы с ВДИ.
Таблица 2. Интраоперационные данные
Table 2. Intraoperative data
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
|
Продолжительность, мин ( Me [ Q1–Q3 ]) Durations, min |
||||
|
Время операции Procedure time |
240 (213–263) |
240 (240–275) |
230 (230–260) |
0,7 |
|
Искусственного кровообращения Cardiopulmonary bypass |
143 (129–160) |
133 (123–152) |
152 (136–163) |
0,1 |
|
Ишемии миокарда Aortic cross clamp |
116 (109–131) |
113 (103–119) |
121 (112–137) |
0,04 |
|
Срединная стернотомия, n ( %) Conventional sternotomy |
41 (95,3) |
22 (100) |
19 (90,5) |
0,2 |
|
Изолированное вмешательство, n ( %) Isolated procedure |
31 (76,7) |
16 (72,7) |
17 (81) |
0,7 |
|
Комбинированные вмешательства, n ( %) Concomitant procedures, n ( %) |
||||
|
Коронарное шунтирование Coronary artery bypass graft |
3 (7) |
2 (9,1) |
1 (4,8) |
0,9 |
Окончание табл. 2
End of table 2
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
|
Протезирование восходящей аорты Replacement of ascending aorta |
5 (11,6) |
5 (22,7) |
0 |
0,04 |
|
Хирургия митрального клапана Mitral valve surgery |
3 (7) |
0 |
3 (14,3) |
0,1 |
|
Хирургия трикуспидального клапана Tricuspid valve surgery |
2 (4,7) |
0 |
2 (9,5) |
0,2 |
|
Размер легочного гомографта, мм ( Me [ Q 1 –Q 3]) Size of the pulmonary homograft, mm |
29 (28–29) |
29 (28–29) |
29 (27–29) |
0,8 |
Таблица 3. Постоперационные осложнения
Table 3. Postoperative complications
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
|
Госпитальная летальность, % Operative mortality, % |
0 |
0 |
0 |
|
|
Реоперации по поводу кровотечения, n (%) Reoperation for bleeding, n (%) |
0 |
0 |
0 |
|
|
Периоперационный инфаркт миокарда, n ( %) Myocardial infarction, n ( %) |
2 (4,7) |
2 (9,1) |
0 |
0,2 |
|
Имплантация ЭКС, n ( %) Permanent pacemaker implantation, n ( %) |
2 (4,7) |
0 |
2 (9,5) |
0,2 |
|
Инсульт, n ( %) Stroke, n ( %) |
1 (2,3) |
1 (4,5) |
0 |
0,9 |
|
Стернальная инфекция, n ( %) Sternal wound infection, n ( %) |
0 |
0 |
0 |
|
|
Острое почечное повреждение, n ( %) Acute renal failure, n ( %) |
3 (7) |
0 |
3 (14,3) |
0,1 |
|
Время нахождения в реанимации, ч ( Me [ Q 1 –Q 3]) Intensive care unit stay, hours ( Me [ Q 1 –Q 3]) |
21 (17–43) |
30 (17–23) |
24 (20–87) |
0,006 |
|
Период госпитализации, дни, ( Me [ Q 1 –Q 3]) Hospital stay, days, ( Me [ Q 1 –Q 3]) |
13 (10–15) |
13 (9–14) |
14 (11–15) |
0,3 |
Таблица 4. Среднесрочные эхокардиографические параметры Table 4. Mid-term echocardiographic parameters
|
Параметры Parameters |
Все пациенты, n = 43 All study patients, n = 43 |
Интрааортальное окутывание (ВАИ), n = 22 Autologous inclusion technique (AIT), n = 22 |
Окутывание дакроновым протезом (ВДИ), n = 21 Dacron inclusion technique (DIT), n = 21 |
p |
|
Размер синусов Вальсальвы, мм ( М ± SD ) Sinus of Valsalva, mm ( М ± SD ) |
36,6 ± 3,2 |
36,6 ± 2,9 |
36,4 ± 3,7 |
0,8 |
|
Размер проксимальной части восходящей аорты, мм ( Me [ Q 1 –Q 3]) Proximal ascending aorta, mm ( Me [ Q 1 –Q 3]) |
36 (33–40) |
37 (32–40) |
35 (32–40) |
0,8 |
|
ФВ ЛЖ, % ( М ± SD ) LVEF, % ( М ± SD ) |
59,4 ± 6,2 |
58,1 ± 4,7 |
60,9 ± 7,4 |
0,2 |
|
Пиковый градиент на АК, мм рт. ст. ( Me [ Q 1 –Q 3]) Average peak pressure gradient, mmHg ( Me [ Q 1 –Q 3]) |
6 (4–7) |
5 (4–6) |
7 (6–9) |
0,058 |
|
AР ≥ 2-й степени, n ( %) AR ≥ 2 stage, n ( %) |
2 (4,6) |
2 (9) |
0 |
0,4 |
Примечание: ФВ ЛЖ – фракция выброса левого желудочка, АР – аортальная регургитация.
Note: LVEF – left ventricle ejection fraction, AR – aortic regurgitation.
Таблица 5. Оставшиеся под наблюдением пациенты
Table 5. Number at risk
|
Месяцы Months |
0 |
12 |
24 |
36 |
48 |
60 |
|
Внутриаортальная имплантация Autologous inclusion technique |
22 |
20 |
14 |
11 |
8 |
7 |
|
Внутридакроновая имплантация Dacron inclusion technique |
21 |
14 |
7 |
7 |
6 |
5 |
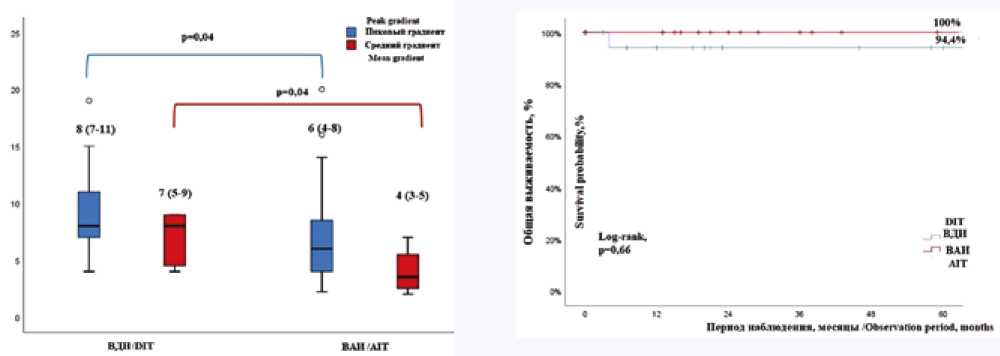
Рис. 2. Кривая Каплана – Мейера общей выживаемости
Примечание: ВДИ – внутридакроновая имплантация, ВАИ – внутриа ортальная имплантация.
Fig. 2. Kaplan – Meier curves of clinical outcomes
Note: DIT – dacron inclusion technique, AIT – autologous inclusion technique.
Рис. 1. Пиковый и средний градиенты на аортальном клапане после модифицированной операции Росса
Примечание: ВДИ – внутридакроновая имплантация, ВАИ – внутриаортальная имплантация.
Fig. 1. Peak and mean gradients on AV after modified Ross operation Note: DIT – dacron inclusion technique, AIT – autologous inclusion technique, AV – aortic valve.
отсутствии нормального распределения – медианой и межквартильным диапазоном ( Me [ Q 1 –Q 3]). При сравнении связанных количественных показателей (градиенты давления до и после операции Росса) с распределением, отличным от нормального, использовался критерий Уилкоксона. Нормально распределенные количественные показатели в двух независимых группах сравнивали с помощью t -критерия Стьюдента, при отсутствии нормального распределения для сравнения использовали критерий Манна – Уитни. Для сравнения категориальных показателей (частот встречаемости) в двух независимых группах использовались χ2 критерий Пирсона или точный критерий Фишера.
Динамику наступления неблагоприятных клинических событий (дилатация аорты ≥ 5 см, повторная операция) оценивали по методу Каплана – Мейера, а статистическая значимость межгрупповых различий в динамике наступления неблагоприятных клинических событий проверялась по лог-ранговому критерию. Пороговый уровень статистической значимости при проверке гипотез составлял p = 0,05.
Результаты
Базовая характеристика
В общей сложности 43 пациентам была выполнена модифицированная процедура Росса. Среди больных было 33 (76,7%) мужчины. Средний возраст пациентов составил 40 ± 11,7 лет, минимальный возраст – 18 лет, максимальный – 62 года. Наиболее частой причиной дисфункции АК была АР – 32 (74,4%) случая. Инфекционный эндокардит как причина патологии АК диагностирован у 13 (30,2%) больных. Хроническая сердечная недостаточность (ХСН) 3–4 функционального класса (ФК) по NYHA имела место у 7 (16,3%) больных. Двустворчатый АК диагностирован у 29 (67,4%) пациентов. Медиана периода наблюдения составила 23 (12–68) мес. Демографические и дооперационные клинические характеристики статистически значимо не различались в обеих группах, за исключением размеров синусов Вальсальвы, которые были значительно шире в I группе (ВАИ), чем во II группе (ВДИ) (37,8 ± 3,5 против 34,8 ± 4,5 мм, р = 0,02), таблица 1.
Обсуждение
Процедура Росса представляет собой альтернативу замене АК механическим или биопротезным протезами. Было показано, что операция Росса обеспечивает превосходные отдаленные результаты с выживаемостью до 93–97% в опытных центрах [14, 15].
Недавно Б. Цароев и соавт. в своей статье показали, что 12-летняя выживаемость у взрослых пациентов после операции Росса составила 94,7% и была сопоставима с общей популяцией того же возраста и пола. А частота свободы от реоперации в течение 10 лет составила 89,1% [4], тем самым подтвердив долговечность данной операции.
Тем не менее, у взрослой популяции было обнаружено, что расширение легочного аутотрансплантата (в кольце, синусе и синусно-тубулярном соединении) является одной из основных причин повторной операции в отдаленном периоде [7–10]. Эти наблюдения привели к снижению использования процедуры Росса у взрослых. В предыдущих исследованиях сообщалось, что отсутствие дилатации аутотрансплантата составляет 43–48% в наблюдении от 5 до 10 лет [16].
Для устранения этого отдаленного осложнения в течение последних десятилетий были предложены многочисленные модификации процедуры Росса [11–13] . Все модификации были направлены на поддержку фиброзного кольца аутотрансплантата и синотубулярного соединения, для предотвращения дальнейшего расширения. F. Juthier и соавт. сообщили об исходах у 322 пациентов, перенесших операцию Росса с ВДИ, при этом не было ни периоперационной смертности, ни расширения легочного аутотрансплантата при среднем периоде наблюдения 4 ± 1,4 года. Средний размер кольца аорты при выписке составил 23,3 ± 2,6 мм по сравнению с 24,0 ± 1,9 мм при последнем осмотре (p = 0,08) [17].
Аналогичные результаты были также получены F. Al Rashidi и соавт., которые сравнили результаты между традиционной процедурой Росса и модифицированной процедурой Росса с ВДИ [18]. За 4,5 года у больных, кому выполнялась ВДИ, достоверного увеличения аортального кольца не отмечено. Однако в традиционной группе Росса был отмечен значительно больший диаметр корня аорты по сравнению с ВДИ. В целом, несмотря на отсутствие долгосрочных данных, было показано, что ВДИ обеспечивает отличные непосредственные и среднесрочные результаты, предотвращая расширение нового корня и фиброзного кольца аорты. Тем не менее, были высказаны опасения по поводу ВДИ и цилиндрической формы дакроновой трубки. Действительно, синусовая часть аутотрансплантата необходима для обеспечения правильного функционирования створки. Таким образом, ВДИ потенциально может нарушать правильное функционирование створок АК в долгосрочной перспективе.
ВАИ – еще одна методика модифицированной процедуры Росса, разработанная для минимизации рецидивов регургитации в отдаленном периоде, предотвращения использования протезного материала в корне аорты. Как ВДИ, так и ВАИ показали отличные долгосрочные результаты. P.D. Skillington и соавт. сообщили об отдаленных результатах 201 пациента, перенесших ВАИ. Они обнаружили, что 20-летняя выживаемость составляет 97%, а свобода от повторной операции — 96% в течение 18 лет [11]. Кроме того, было показано, что изменение диаметра корня аорты было минимальным на протяжении всего периода исследования с максимальным размером 34,3 мм в течение 15 лет. Авторы рекомендуют укреплять фиброзное кольцо диаметром ≥ 25 мм.
Несмотря на отличные результаты, этот метод не получил широкого распространения в основном из-за его технической сложности. Кроме того, у пациентов с большими различиями между размером корня аорты и легочного аутотрансплантата может наблюдаться деформация легочного трансплантата во время операции [19].
Ограничения и новизна исследования
Насколько нам известно, в литературе еще не сообщалось о сравнении двух различных методик модифи- цированной процедуры Росса. Это исследование представляет собой ретроспективный нерандомизированный анализ, выполненный одним опытным хирургом с более чем 200 операциями Росса, поэтому результаты могут быть трудно воспроизводимыми и обобщаемыми.
Выводы
Обе методики модифицированной процедуры Росса обеспечивают отличные непосредственные и среднесрочные результаты с точки зрения общей выживаемости, отсутствия повторных операций и отсутствия дилатации аорты. В группе с ВАИ пиковый и средний градиент на АК в раннем послеоперационном периоде оказались несколько меньше, чем в группе с ВДИ, однако в среднесрочном периоде не было статистически значимой разницы.
Список литературы Интрааортальное окутывание против окутывания дакроновым протезом при выполнении модифицированной операции росса у взрослых: ретроспективное одноцентровое исследование
- Baumgartner H., Falk V, Bax J.J., De Bonis M., Hamm C., Holm P.J. et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur. Heart J. 2017;38(36):2739-2791. https://doi.org/10.1093/eurheartj/ehx391.
- Ross D.N. Replacement of aortic and mitral valves with a pulmonary autograft. Lancet (London, England). 1967;2(7523):956-958. https://doi.org/10.1016/s0140-6736(67)90794-5.
- El-Hamamsy I., Eryigit Z., Stevens L.-M., Sarang Z., George R., Clark L. et al. Long-term outcomes after autograft versus homograft aortic root replacement in adults with aortic valve disease: a randomised controlled trial. Lancet (London, England). 2010;376(9740):524-531. https://doi.org/10.1016/S0140-6736(10)60828-8.
- Tsaroev B., Chernov I., Enginoev S., Mustaev M. Survival and freedom from reoperation after the Ross procedure in a Russian adult population: A single-center experience. JTCVS Open. 2022;10:140-147. https://doi.org/10.1016/j.xjon.2022.04.026.
- Gofus J., Fila P., Drabkova S., Zacek P., Ondrasek J., Nemec P. et al. Ross procedure provides survival benefit over mechanical valve in adults: a propensity-matched nationwide analysis. Eur. J. Cardio-Thoracic. Surg. 2022;61:1357-1365. https://doi.org/10.1093/ejcts/ezac013.
- El-Hamamsy I., Toyoda N., Itagaki S., Stelzer P., Varghese R., Williams E.E. et al. Propensity-matched comparison of the Ross procedure and prosthetic aortic valve replacement in adults. J. Am. Coll. Cardiol. 2022;79:805-815. https://doi.org/10.1016/j.jacc.2021.11.057.
- Brown J.W., Ruzmetov M., Rodefeld M.D., Mahomed Y., Turrentine M.W. Incidence of and risk factors for pulmonary autograft dilation after Ross aortic valve replacement. Ann. Thorac. Surg. 2007;83(5):1781-1789. https://doi.org/10.1016/j.athoracsur.2006.12.066.
- Kouchoukos N.T., Masetti P., Nickerson N.J., Castner C.F., Shannon W.D., Dávila-Román V.G. The Ross procedure: long-term clinical and echocardiographic follow-up. Ann. Thorac. Surg. 2004;78(3):773-781. https://doi.org/10.1016/j.athoracsur.2004.02.033.
- David T.E., Omran A., Ivanov J., Armstrong S., de Sa M.P., Sonnenberg B. et al. Dilation of the pulmonary autograft after the Ross procedure. J. Thorac. Cardiovasc. Surg. 2000;119(2):210-220. https://doi.org/10.1016/S00225223(00)70175-9.
- Чернов И.И., Энгиноев С.Т., Кондратьев Д.А., Зеньков А.А., Абдурахманов А.А., Тарасов Д.Г. Операция Дэвида после Росса: серия клинических случаев. Российский кардиологический журнал. 2021;26(S4):4767. https://doi.org/10.15829/1560-4071-2021-4767.
- Skillington P.D., Mokhles M.M., Takkenberg J.J.M., Larobina M., O’Keefe M., Wynne R. et al. The Ross procedure using autologous support of the pulmonary autograft: Techniques and late results. J. Thorac. Cardiovasc. Surg. 2015;149(2 Suppl.):S46-S52. https://doi.org/10.1016/j.jtcvs.2014.08.068.
- Чернов И.И., Энгиноев С.Т., Кондратьев Д.А.,Козьмин Д.Ю., Демецкая В.В., Алиев Э.Р. и др. Пятилетние результаты модифицированной операции Росса у взрослых: опыт одного центра. Патология кровообращения и кардиохирургия. 2021;25(3):43-50. https://doi.org/10.21688/16813472-2021-3-43-50.
- Carrel T., Kadner A. Long-term clinical and imaging follow-up after reinforced pulmonary autograft Ross procedure. Semin. Thorac. Cardiovasc. Surg. Pediatr. Card. Surg. Annu. 2016;19(1):59-62. https://doi.org/10.1053/j.pcsu.2015.11.005.
- Mazine A., El-Hamamsy I., Verma S., Peterson M.D., Bonow R.O., Yacoub M.H. et al. Ross procedure in adults for cardiologists and cardiac surgeons: JACC state-of-the-art review. J. Am. Coll. Cardiol. 2018;72(22):2761-2777. https://doi.org/10.1016/j.jacc.2018.08.2200.
- Flynn C.D., Bono J.H. De, Muston B., Rattan N., Tian D.H., Larobina M. et al. Systematic review and meta-analysis of long-term outcomes in adults undergoing the Ross procedure. Ann. Cardiothorac. Surgery. 2021;10(4):411-419. https://doi.org/10.21037/acs-2021-rp-30.
- Luciani G.B., Mazzucco A. Aortic root disease after the Ross procedure. Curr. Opin. Cardiol. 2006;21(5):555-560. https://doi.org/10.1097/01.hco.0000245742.93453.1d.
- Juthier F., Banfi C., Vincentelli A., Ennezat P.-V., Le Tourneau T., Pinçon C. et al. Modified Ross operation with reinforcement of the pulmonary autograft: Six-year results. J. Thorac. Cardiovasc. Surg. 2010;139:1420-1423. https://doi.org/10.1016/j.jtcvs.2010.01.032.
- Al Rashidi F., Bhat M., Höglund P., Meurling C., Roijer A., Koul B. The modified Ross operation using a Dacron prosthetic vascular jacket does prevent pulmonary autograft dilatation at 4.5-year follow-up. Eur. J. Cardio-Thoracic. Surg. 2010;37(4):928-933. https://doi.org/10.1016/j.ejcts.2009.11.008.
- Chauvette V., Chamberland M.-È., El-Hamamsy I. A review of pulmonary autograft external support in the Ross procedure. Expert Rev. Med. Devices. 2019;16(11):981-988. https://doi.org/10.1080/17434440.2019.1685380.


