Интраоперационные изменения предсердного ритма при катетерной аблации фибрилляции предсердий у пациентов с артериальной гипертензией и ишемической болезнью сердца
Автор: Горев М. В., Уразовская И. Л., Сайганов С. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Фибрилляция предсердий (ФП) - нарушение ритма с обширной этиологией и не до конца изученным патогенезом. Катетерная аблация является эффективным способом контроля ритма при ФП. Результаты катетерной аблации отличаются у пациентов с различной сопутствующей патологией сердечно-сосудистой системы. Интраоперационные изменения предсердного ритма могут быть критерием долгосрочной эффективности операции или определять необходимость в дополнительных воздействиях.Цель исследования: оценка интраоперационных изменений предсердного ритма при катетерной аблации ФП у пациентов с артериальной гипертензией (АГ) и ишемической болезнью сердца (ИБС).Материал и методы. Ретроспективно за период с 2016 по 2017 гг. проанализированы результаты катетерной аблации 451 пациента с пароксизмальной и персистирующей ФП. После анализа клинико-анамнестических данных отобран 151 пациент с первичной изоляцией легочных вен. В зависимости от наличия сопутствующей патологии сердечнососудистой системы пациенты были распределены в 3 группы: 1-я группа - с идиопатической ФП, 2-я группа - ФП в сочетании с изолированной эссенциальной АГ, 3-я группа - ФП в сочетании с ИБС.Результаты. У пациентов с идиопатической ФП чаще происходило купирование ФП и сохранение синусового ритма (СР) до конца операции, чем у пациентов с ИБС (22 против 10,6%, р = 0,021). У пациентов с ИБС значительно чаще встречалось типичное трепетание предсердий (ТП) (47,9 против 18,8% в 1-й группе, р = 0,005; 24,7% во 2-й группе, р = 0,01), возникала необходимость в выполнении радиочастотной аблации (РЧА) кавотрикуспидального перешейка (истмуса) (КТИ) помимо изоляции легочных вен.Заключение. Наличие у пациентов сопутствующей патологии сердечно-сосудистой системы влияет на динамику предсердного ритма в процессе катетерного лечения ФП и должно учитываться при определении интраоперационной тактики.
Фибрилляция предсердий, катетерная аблация, ишемическая болезнь сердца, артериальная гипертензия
Короткий адрес: https://sciup.org/149144424
IDR: 149144424 | УДК: 616.12-008.313.2-089.819.1-089.168.1:616.12-008.331.1-005.4 | DOI: 10.29001/2073-8552-2023-38-4-167-175
Текст научной статьи Интраоперационные изменения предсердного ритма при катетерной аблации фибрилляции предсердий у пациентов с артериальной гипертензией и ишемической болезнью сердца
Фибрилляция предсердий (ФП) относится к сложным нарушениям ритма с обширной этиологией и не до конца изученным патогенезом [1]. Разница в клинической значимости «клапанной» и «неклапанной», идиопатической ФП и ФП, осложняющей течение структурной патологии сердца, хорошо известна [1]. Современная классификация, подразделяющая ФП по длительности течения заболевания на пароксизмальную, персистирующую, длительно персистирующую и постоянную формы, является основополагающей при выборе тактики лечения пациента [1]. Безусловно, временной фактор позволяет учесть такой важный аспект патогенеза, как прогрессирование ФП, однако известно, что патогенез ФП более многогранен [1, 2].
Многочисленные исследования продемонстрировали зависимость результатов катетерного лечения ФП от различных клинических и морфологических факторов, например, размеров и сократимости левого предсердия (ЛП), наличия и выраженности фиброза в предсердном миокарде, возраста, сопутствующей патологии [3–5]. Для одновременного учета этих факторов и прогнозирования эффективности аблации (перспективности восстановления и удержания синусового ритма (СР) у каждого пациента) разработаны шкалы оценки риска, эффективность которых не позволяет внедрить их в повседневную клиническую практику [2]. При составлении таких шкал факторы риска, как правило, выбираются по степени статистической значимости и корреляции с результатом в рамках регрессионного анализа, а не по их естественному сочетанию в тех или иных клинических ситуациях.
Мы предположили, что оценка результатов лечения у пациентов с различной коморбидной патологией может объединить отдельные факторы риска в их естественном сочетании и взаимном влиянии. Правомерность данного подхода ранее была подтверждена различной эффективностью катетерного лечения ФП у пациентов разных клинических групп [3].
Цель работы: сравнение интраоперационных изменений предсердного ритма при катетерной аблации ФП при идиопатической ФП с ФП на фоне АГ и ИБС.
Материал и методы
Дизайн исследования
Данная работа проведена как ретроспективное одноцентровое исследование.
Исследуемая группа пациентов
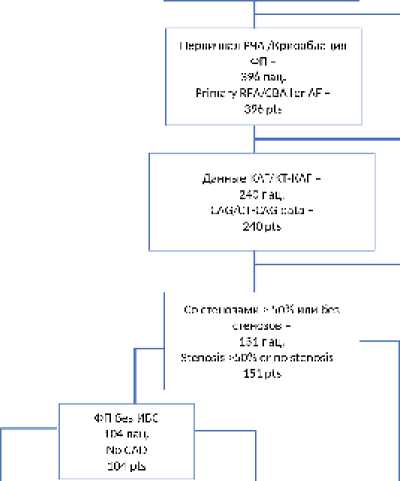
В 2016–2017 гг. выполнена 451 операция катетерной аблации по поводу ФП. Для последующего анализа были отобраны 396 пациентов с первичной изоляцией легочных вен. Затем были проанализированы основные клинико-демографические, а также лабораторно-инструментальные характеристики пациентов, полученные при изучении историй болезни и протоколов оперативного вмешательства. В исследование не включали пациентов с гемодинамически незначимым (стенозы менее 50%) атеросклеротическим поражением коронарного русла, наличием в анамнезе перенесенной ранее катетерной аблации по поводу ФП, заболеванием микрососудистой, вазоспастической стенокардией, гипертрофической кардиомиопатией, клапанными пороками, сердечной недостаточностью. Алгоритм отбора пациентов представлен на рисунке 1.
В исследование включен 151 пациент в возрасте от 18 до 80 лет, с первичной катетерной аблацией по поводу ФП, а также возможностью изучения анатомии коронарных артерий (результат коронароангиографии или КТ-ко-ронароангиографии, проведенной не ранее чем за 6 мес. до выполнения катетерной аблации). Отобранные пациенты были разделены на три группы: 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с артериальной гипертензией (АГ), 3-я группа – ФП в сочетании с ишемической болезнью сердца (ИБС).
Клинико-демографическая характеристика пациентов, включенных в исследование, представлена в таблице 1. Как видно, исследуемые группы в статистически значимо отличались друг от друга по большому количеству параметров, что является естественным для выбранных клинических групп.
^ЧА/крмляК.'л шя ФН ч 7D1f> 2С17н.-
1Д in УП1й 7П1 / H51ph
I Я"руППА J^ I ill.. GrCUF 1 47 pM
Пик ирмех Р1 •VKpMwGiiaun»i ФП
Repeal РГЛ-СЬЛ iui ЛГ -55 ptE
154 гац.
Чп ГАГ^'С I ГАС Г At А 15£pU
М .llipunx? дии1 и> стенокардия- 5 пэц. Li “I k::im <:зра ikpi н«я а 1ерий х 5386-И нац. гкмг 2пац. lk:poiMK-1 шн.
I Ie । д^ммьл 2ФИ - 2 iau. MlcrcwKCUl#' а ieina 3 рт$ CDXinurv urteriei irjenuHS *й(15е - 31 pb HCM ? pr* h/ibr V3^ Jserse - Ip.
№ Ф5 JdLi - 2 ph
Рис. 1. Алгоритм отбора пациентов для исследования
Примечание: РЧА – радиочастотная аблация, ФП – фибрилляция предсердий, КАГ – коронарная артериография, КТ-КАГ – компьютерная томографическая КАГ, МК – митральный клапан, ГКМП – гипертрофическая кардиомиопатия, ЭФИ – электрофизиологическое исследование, ИБС – ишемическая болезнь сердца. 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с артериальной гипертензией, 3-я группа – ФП в сочетании с ишемической болезнью сердца.
Fig. 1. Patients selection workflow Note: RFA – radiofrequency ablation, CBA – cryoballoon ablation, AF – atrial fibrillation, CAG – Coronary angiography, CT-CAG – computed tomography coronary angiography, HCM – hypertrophic cardiomyopathy, EPS – electrophysiology study, CAD – coronary artery disease. Group 1 – idiopathic AF, Group 2 – AF concomitant to AH, Group 3 – AF concomitant to coronary artery disease.
Таблица 1. Демографические, эхокардиографические и интраоперационные данные
Table 1. Demographic, Echo and intraoperative data
|
Параметры Parameters |
1-я г руппа , n = 32 Group 1, n = 32 |
2-я г руппа , n = 72 Group 2, n = 72 |
3-я г руппа , n = 48 Group 3, n = 48 |
p |
||
|
Мужской пол , n (%) Male sex, n (%) |
22 (68,8) |
28 (38,4) |
30 (62,5) |
p 1–2= 0,004 p 2–3 = 0,009 |
||
|
Возраст, лет Age, yrs |
48,6 ± 11,9 |
59,6 ± 9,2 |
66 ± 6,9 |
< 0,001 |
||
|
АГ , n (%) AH, n (%) |
0 |
72 (100) |
48 (100) |
– |
||
|
СД , n (%) DM, n (%) |
1 (3,1) |
5 (6,8) |
11 (22,9) |
p 1–3= 0,005 p 2–3= 0,021 |
||
|
ПИКС , n (%) MI, n (%) |
– |
– |
19 (39,6) |
– |
||
|
Реваскуляризация в анамнезе , n (%) Revascularization , n (%) |
– |
– |
20 (42) |
– |
||
|
CHA2DS2-VASc score |
0,3 ± 0,7 |
2,3 ± 1,2 |
3,7 ± 1,3 |
p < 0,001 |
||
|
Анти - коагулянт Oral anticoagulant |
Ривароксабан , n (%) Rivaroxaban, n (%) |
9 (45) |
26 (60) |
18 (69) |
– |
|
|
Апиксабан , n (%) Apixaban, n (%) |
3 (15) |
7 (16) |
0 (0) |
|||
|
Дабигатран , n (%) Dabigatran, n (%) |
6 (30) |
10 (23) |
5 (19) |
|||
|
Варфарин , n (%) Warfarin, n (%) |
2 (10) |
0 (0) |
3 (12) |
|||
|
Инсульт в анамнезе , n (%) Stroke, n (%) |
0 |
4 (7,1) |
9 (22,5) |
p = 0,044 |
||
|
Пароксизмальная ФП , n (%) Paroxysmal AF, n (%) |
25 (78,1) |
62 (84,9) |
44 (91,7) |
Ns |
||
|
ФВ ЛЖ , % LV EF, % |
64,4 ± 2,3 |
62,3 ± 4,5 |
61,2 ± 7,4 |
p 1–2= 0,002 p 1–3= 0,008 |
||
|
Размер ЛП, мм LA size, mm |
39,4 ± 4,0 |
42 ± 4,4 |
44,3 ± 4,8 |
p 1–2= 0,004 p 1–3 = 0,001 p 2–3= 0,011 |
||
|
Степень митральной регургитации Mitral regurgitation stage |
0,8 ± 0,6 |
1,1 ± 0,6 |
1,2 ± 0,6 |
p 1–2= 0,013 p 1–3= 0,003 |
||
|
Аблация КТИ , n (%) CTI ablation, n (%) |
6 (18,8) |
18 (25) |
23 (47,9) |
p 1–3= 0,005 p 2–3 = 0,01 |
||
|
Источник энергии для ИЛВ, n (%) Energy source for PVI, n (%) КБА CBA |
РЧА RFA |
19 (59,4) |
55 (76,4) |
38 (79,2) |
Ns |
|
|
13 (40,6) |
17 (23,6) |
10 (20,8) |
||||
Примечание: ФП – фибрилляция предсердий, АГ – артериальная гипертензия, СД – сахарный диабет, ПИКС – постинфарктный кардиосклероз, ФВ ЛЖ – фракция выброса левого желудочка, ЛП – левое предсердие, КТИ – кавотрикуспидальный перешеек (истмус), РЧА – радиочастотная аблация, КБА – криобаллонная аблация, ИЛВ – изоляция легочных вен. 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с АГ, 3-я группа – ФП в сочетании с ИБС.
Note: AF – atrial fibrillation, AH – arterial hypertension, DM - diabetes mellitus, MI – myocardial infarction, LV EF – left ventricular ejection fraction, LA – left atrium, CTI – cavotricuspid isthmus, RFA – radiofrequency ablation, CBA – cryoballoon ablation, PVI – pulmonary vein isolation. Group 1 – idiopathic AF, Group 2 – AF concomitant to AH, Group 3 – AF concomitant to coronary artery disease.
Диагностика ишемической болезни сердца
Заключение о наличии атеросклероза коронарных артерий делалось на основании данных коронарографии (КАГ) или КТ-коронарографии (КТ-КАГ) (с определением индекса коронарного кальция). У 59 пациентов была проведена плановая ангиография коронарных артерий, у 89 пациентов выполнена КТ-ангиография. ИБС диагностировалась согласно действующим рекомендациям [4]. В исследование были включены только пациенты без признаков коронарного атеросклероза (отсутствие признаков атеросклероза коронарных сосудов при КАГ/КТ-КАГ и/или индекс коронарного кальция, равный 0) и пациенты с диагностированной ИБС. Пациенты с нестенозирующим (стенозы < 50%) атеросклерозом коронарных артерий, не подходящие под критерии ИБС, исключались из исследования.
Медикаментозная терапия ФП в периоперационном периоде
Все пациенты, включенные в исследование, получали терапию в соответствии с существующими рекомендациями по каждой нозологии. Выбор препаратов и их сочетаний, а также режимы дозирования оставлялись на усмотрение лечащего врача и отдельно в данном исследовании не изучались. Для снижения риска кате-тер-ассоциированного тромбоза во время процедуры катетерной аблации и риска образования тромбов в местах радиочастотных или криоповреждений в полости ЛП все пациенты не менее 4 нед. до и не менее 3 мес. после операции получали антикоагулянтную терапию новыми оральными антикоагулянтами (НОАК) или вар-фарином.
Антиаритмическая терапия
Антиаритмическая терапия проводилась без перерыва до и после операции. Всем пациентам для профилактики ранних (в первые 3 мес. после аблации) рецидивов ФП назначалась антиаритмическая терапия. Чаще всего для этого использовался тот же препарат, который пациент принимал непосредственно перед операцией. В таблице 2 представлены антиаритмические препараты, которые использовались в периоперационном периоде. Некоторым пациентам антиаритмическая терапия не назначалась в связи с наличием абсолютных и относительных противопоказаний для всех препаратов (например, сочетание постинфарктного кардиосклероза, атриовентрикулярной блокады 2-й степени и компенсированного кордарон-индуцированного гипертиреоза).
Перед операцией почти все пациенты получали анти-аритмическую терапию препаратами 1-го или 3-го класса. Причем вне зависимости от отношения к той или иной клинической группе почти каждый четвертый пациент принимал амиодарон. У пациентов с преимущественно пароксизмальной ФП, готовящихся к первой катетерной аблации, этот факт является отражением агрессивности антиаритмической терапии на фоне отсутствия эффекта от препаратов с более выгодным профилем безопасности. Доля пациентов без антиаритмической терапии во всех клинических группах не превышала 10% и объяснялась существованием пациентов с противопоказаниями ко всем группам антиаритмиков и пациентов, не настроенных на консервативную антиаритмическую терапию.
Таблица 2. Антиаритмическая терапия в периоперационном периоде
Table 2. Periprocedural antiarrhythmic therapy
|
Препараты Antiarrhythmic agents |
1-я группа Group 1 |
2-я группа Group 2 |
3-я группа Group 3 |
|
Нет None |
7,7% |
6,5% |
10,9% |
|
Пропафенон Propaphenone |
7,7% |
8,1% |
6,5% |
|
Аллапинин Allapinin |
11,5% |
12,9% |
4,3% |
|
Соталол + аллапинин Sotalol + Allapinin |
3,8% |
8,1% |
2,2% |
|
Соталол Sotalol |
46,2% |
40,3% |
52,2% |
|
Амиодарон Amiodarone |
23,1% |
24,2% |
23,9% |
Примечание: общие отличия между группами отсутствуют (p-value – ns). 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с АГ, 3-я группа – ФП в сочетании с ИБС.
Note: difference between groups are absent (p-value – ns). Group 1 – idiopathic AF, Group 2 – AF concomitant to AH, Group 3 – AF concomitant to coronary artery disease.
Катетерная аблация
Изоляция устьев легочных вен выполнялась с помощью радиочастотной (РЧА) или криобаллонной аблации под внутривенной седацией и анальгезией растворами пропофола и фентанила или эндотрахеальным наркозом.
Конечной целью аблации являлось достижение двунаправленной блокады проведения электрических импульсов между мышечными муфтами всех легочных вен и миокардом ЛП при СР. Блокада входа в легочную вену определялась как отсутствие электрической активности на циркулярном многополюсном диагностическом катетере Lasso 2515 (Biosense Webster, США) или Achieve (Medtronic, США), помещенном внутрь легочной вены за линией аблации. Блокада выхода импульсов из легочной вены определялась при нанесении электрических стимулов (амплитуда – 10 В, длительность – 1 мс, частота – 100 в мин) через диагностический интраоперационный электрокардиостимулятор EPS320 (MicroPace EP Inc, США) на мышечные муфты каждой легочной вены через циркулярный катетер, помещенный внутри легочной вены за линией аблации.
Радиочастотная изоляция устьев легочных вен выполнялась под рентгеноскопическим контролем с помощью орошаемого электрода Thermocool EZsteer DF-curve (Biosense-Webster, USA) последовательно в правой верхней, правой нижней, левой верхней, левой нижней легочных венах. При использовании системы нефлюроскопи-ческой магнитной навигации Carto 3 (Biosense-Webster, USA) перед началом воздействий выполнялось построение трехмерной модели ЛП и проксимальных отделов легочных вен с обозначением предполагаемой линии между легочными венами и предсердием. В этих случаях антральная изоляция выполнялась последовательно в правых, затем в левых легочных венах с помощью орошаемых катетеров Thermocool SF Nav (Biosense-Webster, США) и Thermocool SmartTouch (Biosense-Webster, США).
При криобаллонной изоляции устьев легочных вен использовались криобаллонные катетеры Arctic Front Advance (Medtronic, США). Воздействия выполнялись последовательно в левой верхней, левой нижней, правой нижней, правой верхней легочных венах. В каждой вене выполнялось одно воздействие длительностью 240 с. При отсутствии признаков блокады входа в вену в течение первых 60 с криовоздействие прекращалось, положение баллонного катетера в легочной вене менялось, и попытка криовоздействия повторялась. Контроль за сохранностью проведения по правому диафрагмальному нерву во время криовоздействий в правых легочных венах осуществлялся с помощью его электрической стимуляции с амплитудой 15В и циклом 1000–2000 мс через электрофизиологический электрод, установленный в верхней полой вене.
Оценка изменения предсердного ритма во время изоляции легочных вен
Сочетание предсердного ритма до и после операции характеризовалось как один из 4 вариантов:
-
1 – сохранение СР в течение всей процедуры (СР-СР);
-
2 – начало операции с СР и развитие устойчивого пароксизма ФП, сохранявшегося до конца операции (СР-ФП);
-
3 – начало операции с ФП и ее купирование с восстановлением СР или сохранением трепетания предсердий (ТП) к концу операции (ФП-СР);
-
4 – сохранение в течение всей операции пароксизма ФП, на фоне которого операция начиналась (ФП-ФП).
Индуцируемость ФП после изоляции легочных вен
Если после изоляции легочных вен у пациента регистрировался СР, выполнялась попытка искусственной индукции ФП с помощью программной или учащающей стимуляции предсердий. При программной стимуляции базовая частота составляла 150 уд./мин, задержка экстрастимула последовательно укорачивалась с длительности 380 мс на 20 мс в каждой следующей серии стимулов до достижения эффективного рефрактерного периода предсердного миокарда. При учащающей стимуляции предсердий производилось несколько серий стимулов с постепенным увеличением частоты: со 100 до 200 имп./мин, затем с 200 до 250 имп./мин, затем с 200 до 270 имп./мин, затем с 200 до 300 имп./мин.
Распространенность типичного трепетания предсердий и техника выполнения РЧА кавотрикуспидального перешейка
Пациентам с типичным ТП, зарегистрированным по ЭКГ или индуцированным во время операции, выполнялось линейное радиочастотное воздействие орошаемым аблационным электродом Thermocool EZsteer DF-curve (Biosense-Webster, USA) в области кавотрикуспидального перешейка (истмуса) (КТИ) до достижения признаков двунаправленной блокады проведения по нему. Воздействие выполнялось с контролем по мощности c параметрами 37–39 Вт, 38–45 °С.
Статистический анализ
Статистическая обработка результатов произведена с использованием лицензионного программного обеспечения SPSS STATISTICS 26.0 (IBM, США).
Был выполнен тест Колмогорова Смирнова на нормальность распределения количественных и порядковых данных. Количественные переменные представлены средним значением и стандартным отклонением. Номинальные показатели описаны абсолютными (n) и относительными (в %) частотами встречаемости. Сравнительный анализ показателей с нормальным распределением в двух независимых группах (апостериорные парные сравнения) выполнен с помощью t-теста Стьюдента. Сравнение номинальных показателей в независимых группах осуществлено с помощью критерия χ2 или критерия Фишера в зависимости от минимального значения в ячейке таблицы сопряженности. В качестве порогового уровня статистической значимости было принято значение р = 0,05.
Результаты
Ритм в предсердиях до и после операции
Распределение пациентов по типу предсердного ритма (СР или ФП) до и после изоляции легочных вен у пациентов различных клинических групп представлено на рисунке 2.
В 1-й группе количество пациентов с СР и ФП в начале операции было одинаковым (табл. 3). В 3-й группе пациентов с ФП до операции было существенно больше, чем в 1-й группе ( р = 0,008).
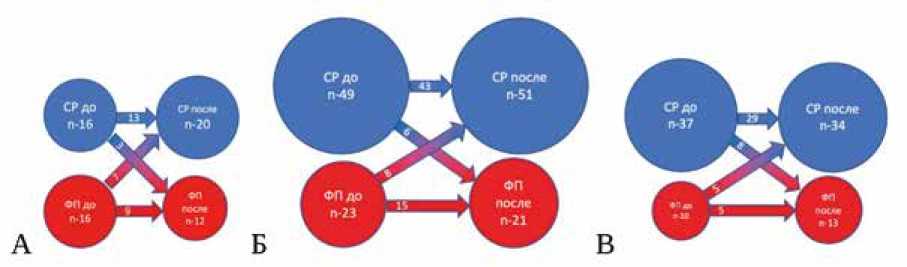
Рис. 2. Диаграмма изменений ритма у пациентов разных групп до и после катетерной изоляции легочных вен. А – в 1-й группе, Б – во 2-й группе, В – в 3-й группе
Примечание: СР – синусовый ритм, ФП – фибрилляция предсердий.
В процессе изоляции легочных вен у части пациентов произошло купирование ФП с восстановлением СР. У других пациентов, наоборот, механические манипуляции в ЛП или отек, вызванный радиочастотными или криовоздействиями, индуцировали ФП. Пациенты в 1-й группе с большей вероятностью к концу операции демонстрировали переход из ФП в СР, чем пациенты 3-й группы (22 против 10,6%, р = 0,021) (см. табл. 3).
Если после завершения всех воздействий у пациента сохранялась предсердная тахиаритмия, выполнялась синхронизированная электрическая кардиоверсия бифазным разрядом 200 Дж. Выполнение кардиоверсии потребовалось 11 (34,4%) пациентам в 1-й группе, 21 (30%) пациенту во 2-й группе и 10 (21,3%) пациентам в 3-й группе (р > 0,1 при всех попарных сравнениях). После окончания операции у всех пациентов по ЭКГ регистрировался СР. Одному пациенту в 1-й группе и трем паци- ентам в 3-й группе, у которых после изоляции легочных вен отмечалась ФП, были выполнены дополнительные радиочастотные или криовоздействия в ЛП, в результате которых отмечено восстановление СР без электрической кардиоверсии.
Индуцируемость ФП после аблации
Попытки индуцировать ФП программной или учащающей стимуляцией в конце операции для оценки арит-могенности предсердного миокарда проводились у пациентов, имевших СР после изоляции легочных вен и не требовавших выполнения кардиоверсии. Количество этих пациентов в исследуемых группах составило 21 (65,6%) в 1-й группе, 47 (64,4%) – во 2-й группе, 32 (66,7%) пациента в 3-й группе. Из них индуцировать ФП удалось в 1-й группе у 7 (33,3%), во 2-й группе – у 18 (38,3%), в 3-й группе – у 12 (37,5%) пациентов ( р = 0,925).
Таблица 3. Количество пациентов с фибрилляцией предсердий и синусовым ритмом до и после изоляции легочных вен в разных группах Table 3. Quantity of patients with AF and SR before and after pulmonary vein isolation in different groups
|
Параметры Parameters |
1-я группа, n = 32 Group 1, n = 32 |
2-я группа, n = 72 Group 2, n = 72 |
3-я группа, n = 47 Group 3, n = 47 |
p |
|||
|
1–2 |
1–3 |
2–3 |
|||||
|
Ритм до ИЛВ Rhythm before PVI |
СР, n (%) SR , n (%) |
16 (50) |
49 (68,1) |
37 (78,7) |
0,081 |
0,008 |
0,206 |
|
ФП, n (%) AF , n (%) |
16 (50) |
23 (31,9) |
10 (21,3) |
||||
|
Ритм после ИЛВ Rhythm after PVI |
СР, n (%) SR , n (%) |
20 (62,5) |
51 (70,8) |
34 (72,3) |
0,402 |
0,359 |
0,859 |
|
ФП, n (%) AF , n (%) |
12 (37,5) |
21 (29,2) |
13 (37,7) |
||||
Примечание: СР – синусовый ритм, ФП – фибрилляция предсердий, ИЛВ – изоляция легочных вен. 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с АГ, 3-я группа – ФП в сочетании с ИБС.
Note: SR – sinus rhythm, AF – atrial fibrillation, PVI – pulmonary vein isolation. Group 1 – idiopathic AF, Group 2 – AF concomitant to AH, Group 3 – AF concomitant to coronary artery disease.
Частота выполнения аблации кавотрикуспидального перешейка
У 47,9% пациентов в 3-й группе до или во время аблации было зарегистрировано типичное ТП, в связи с чем кроме изоляции легочных вен было выполнено линейное воздействие в области КТИ с помощью РЧА. Количество пациентов с ТП в 3-й группе было значимо выше, чем в двух других группах: 18,8% ( р = 0,005) в 1-й группе и 24,7% ( р = 0,01) во 2-й группе (рис. 3).
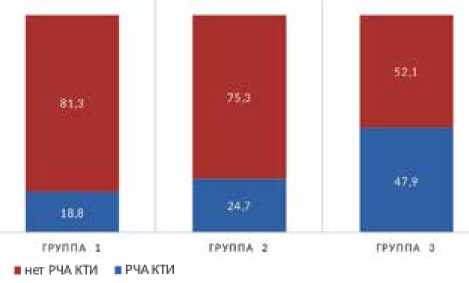
Рис. 3. Доли пациентов с трепетанием предсердий в разных группах Примечание: РЧА КТИ – радиочастотная аблация кавотрикуспидального истмуса по поводу трепетания предсердий. 1-я группа – идиопатическая ФП, 2-я группа – ФП в сочетании с АГ, 3-я группа – ФП в сочетании с ИБС.
Обсуждение
Ритм в предсердиях до и после изоляции легочных вен
В 1-й группе доля пациентов с СР в начале процедуры (50%) была ниже, чем в 3-й (79%, р = 0,008) и 2-й группах (68%, р = 0,081). Корреляция наличия СР в начале операции с эффективностью аблации была показана S. Koshhauser и соавт. [5]. Оценка долгосрочной эффективности процедуры не входила в задачи нашей работы, а представленная разница в распределении пациентов разных клинических групп по ритму в начале операции скорее отражает особенности отбора пациентов для катетерной аблации. Наличие сопутствующей патологии, снижающей эффективность аблации, вынуждает более тщательно отбирать пациентов для оперативного лечения.
В то же время взгляды на купирование ФП как на цель процедуры катетерной аблации разнятся. Так, купирование ФП во время аблации используется некоторыми авторами в качестве конечной точки операции при лечении персистирующей и длительно персистирующей форм [6, 7]. В других работах опровергается взаимосвязь острого «спонтанного» восстановления ритма с отдаленными результатами [5, 8]. В нашей работе после операции доли пациентов с СР на момент окончания операции в исследуемых группах не отличались.
Характер изменения или сохранения ритма в процессе изоляции легочных вен может отражать выраженность аритмогенного субстрата в миокарде ЛП. Стойкое сохранение СР (СР-СР), несмотря на манипуляции и нанесение повреждений в предсердии, могло свидетельствовать о том, что у таких пациентов для развития ФП были необходимы особые условия. Купирование ФП в процессе изоляции легочных вен (ФП-СР) говорит о блокировании проведения импульсов из эктопического очага в предсердный миокард (изоляции аритмогенной зоны) или уменьшении объема миокарда, способного к фибрилляции. Восстановление СР при этом свидетельствует об отсутствии в миокарде субстрата, поддерживающего аритмию, и, следовательно, о более благоприятном прогнозе в долгосрочной перспективе.
Развитие пароксизма ФП (СР-ФП) при манипуляциях во время операции или непосредственно в процессе создания повреждений для изоляции легочных вен говорит о наличии в миокарде предсердий субстрата, который может самостоятельно индуцировать ФП и поддерживать ее существование в течение длительного времени. Сохранение ФП, начавшейся до операции и продолжающейся в течение всей процедуры (ФП-ФП), свидетельствует об отсутствии зависимости аритмии от муфт легочных вен, следовательно, – о наличии поддерживающего субстрата в миокарде предсердий.
Вероятность купирования аритмии во время аблации может зависеть от большого количества факто- ров: методики операции, длительности текущего пароксизма ФП [9]. В настоящем исследовании нами показано, что коморбидный фон также может влиять на вероятность купирования ФП в процессе катетерной аблации.
Индуцируемость фибрилляции предсердий после аблации
Данные разных исследователей относительно прогностической значимости ФП, индуцируемой в конце операции, разнятся [10, 11]. Наиболее распространенным является мнение, что возможность запуска ФП коррелирует с рецидивом ФП в отдаленном послеоперационном периоде, но не может использоваться в качестве конечной точки операции из-за низкой специфичности и повышения вероятности осложнений [11]. В то же время существуют исследования, опровергающие взаимосвязь интраоперационной индуцируемости ФП с отдаленной эффективностью аблации [12, 13].
В нашем исследовании индуцировать устойчивый (более 30 с) пароксизм ФП удалось у одинакового (33–38%) количества пациентов в разных группах, что говорит о том, что данный показатель не зависит от клинической группы.
Частота выполнения аблации кавотрикуспидального перешейка
Доля пациентов, у которых было выявлено типичное ТП и потребовалась дополнительная линейная РЧА в области КТИ в правом предсердии, составила в 3-й группе около 50%. Эта пропорция существенно превышала аналогичные показатели в 1-й (18,8%) и 2-й группах (24,7%). Повышенный риск развития ТП у пациентов с ИБС также ранее был продемонстрирован J. De Bono и соавт. [14]. Возможным выводом из этого может быть рутинное выполнение аблации КТИ у всех пациентов, поступающих для катетерного лечения ФП, при наличии у них диагностированной ИБС.
Заключение
У пациентов с ФП, возникающей на фоне АГ и ИБС, существуют отличия в динамике предсердного ритма во время катетерной аблации. Пациенты с ИБС в большей степени подвержены развитию типичного ТП, чем пациенты с идиопатической ФП и ФП, сочетающейся с АГ. Это подтверждает обоснованность и необходимость разработки и применения персонифицированного подхода в лечении ФП у пациентов в зависимости от наличия сопутствующей патологии сердечно-сосудистой системы.
Список литературы Интраоперационные изменения предсердного ритма при катетерной аблации фибрилляции предсердий у пациентов с артериальной гипертензией и ишемической болезнью сердца
- Аракелян М.Г., Бокерия Л.А., Васильева Е.Ю., Голицын С.П., Голухова Е.З., Горев М.В. и др. Фибрилляция и трепетание предсердий. Клинические рекомендации 2020. Российский кардиологический журнал. 2021;26(7):4594. https://doi.org/10.15829/1560-4071-2021-4594.
- Winkle R.A., Jarman J.W.E., Mead R.H., Engel G., Kong M.H., Fleming W. et al. Predicting atrial fibrillation ablation outcome: The CAAPAF score. Hear. Rhythm. 2016;13(11):2119-2125. https://doi.org/10.1016/j.hrthm.2016.07.018.
- Горев М.В., Уразовская И.Л. Эффективность катетерной аблации фибрилляции предсердий в различных клинических группах: влияние ишемической болезни сердца и возраста. Cardiac Arrhythmias. 2023;3(1):31-40.. https://doi.org/10.17816/cardar305725.
- Стабильная ишемическая болезнь сердца. Клинические рекомендации 2020. Российское кардиологическое общество. Российский кардиологический журнал. 2020;25(11):4076. https://doi.org/10.15829/29/1560-4071-2020-4076.
- Kochhäuser S., Jiang C.Y., Betts T.R., Chen J., Deisenhofer I., Mantovan R. et al.; STAR AF II Investigators. Impact of acute atrial fibrillation termination and prolongation of atrial fibrillation cycle length on the outcome of ablation of persistent atrial fibrillation: A substudy of the STAR AF II trial. Heart Rhythm. 2017;14(4):476-483. https://doi.org/10.1016/j.hrthm.2016.12.033.
- Scherr D., Khairy P., Miyazaki S., Aurillac-Lavignolle V., Pascale P., Wilton S.B. et al. Five-year outcome of catheter ablation of persistent atrial fibrillation using termination of atrial fibrillation as a procedural endpoint. Circ. Arrhythmia Electrophysiol. 2015;8(1):18-24. https://doi.org/10.1161/CIRCEP.114.001943.
- Fiala M., Bulková V., Škňouřil L., Nevřalová R., Toman O., Januška J. et al. Sinus rhythm restoration and arrhythmia noninducibility are major predictors of arrhythmia-free outcome after ablation for long-standing persistent atrial fibrillation: A prospective study. Heart Rhythm. 2015;12(4):687-698. https://doi.org/10.1016/j.hrthm.2015.01.004.
- Li F., Tu X., Li D., Jiang Y., Cheng Y., Jia Y. et al. Is ablation to atrial fibrillation termination of persistent atrial fibrillation the end point? Medicine (Baltimore). 2019;98(47):e18045. https://doi.org/10.1097/ MD.0000000000018045.
- Покушалов Е.А., Туров А.Н., Шугаев П.Л., Артеменко С.Н., Романов А.Б., Абаскалова А.В. Феномен купирования фибрилляции предсердий во время катетерной аблации. Вестник Аритмологии. 2007;48:5-14. URL: https://vestar.elpub.ru/jour/article/view/304 (01.12.2023).
- Baker M., Kumar P., Hummel J.P., Gehi A.K. Non-Inducibility or termination as endpoints of atrial fibrillation ablation: What is their role? J. Atr. Fibrillation. 2014;7(3):54-60. https://doi.org/10.4022/jafib.1125.
- Oral H., Chugh A., Lemola K., Cheung P., Hall B., Good E. et al. Noninducibility of atrial fibrillation as an end point of left atrial circumferential ablation for paroxysmal atrial fibrillation: A randomized study. Circulation. 2004;110(18):2797-2801. https://doi.org/10.1046/j.1540-8167.2004.03432.x.
- Leong-Sit P.S.M., Robinson M., Zado E.S., Callans D.J., Garcia F. et al. Inducibility of atrial fibrillation and flutter following pulmonary vein ablation. J Cardiovasc. Electrophysiol. 2013;24(6):617-623. https://doi.org/10.1111/jce.12088.
- Satomi K., Tilz R., Takatsuki S., Chun J., Schmidt B., Bänsch D. et al. Inducibility of atrial tachyarrhythmias after circumferential pulmonary vein isolation in patients with paroxysmal atrial fibrillation: Clinical predictor and outcome during follow-up. Europace. 2008;10(8):949-954. https://doi.org/10.1093/europace/eun131.
- De Bono J.P., Stoll V.M., Joshi A., Rajappan K., Bashir Y., Betts T.R. Cavotricuspid isthmus dependent flutter is associated with an increased incidence of occult coronary artery disease. Europace. 2010;12(12):1774- 1777. https://doi.org/10.1093/europace/euq334


