Интраоперационный мониторинг температуры внутри пищевода во время радиочастотной аблации задней стенки левого предсердия при фибрилляции предсердий (обзор литературы)
Автор: Яшков М. В., Артюхина Е. А., Таймасова И. А., Дедух Е. В., Васковский В. А., Кузнецов Н. М., Ревишвили А. Ш., Попов А. Ю., Васин В. А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
На сегодняшний день катетерная радиочастотная аблация (РЧА) стала стандартным методом лечения пациентов с фибрилляцией предсердий (ФП). В ходе РЧА выполняются дополнительные линейные воздействия по задней стенке левого предсердия, что может вызвать повреждение пищевода. В статье рассматриваются внедренные в практику методы предотвращения повреждения пищевода в ходе радиочастотной аблации, выделены плюсы и минусы методик.
Внутрипищеводный датчик, внутрипищеводная температура, радиочастотная аблация, пищеводная фистула, фибрилляция предсердий
Короткий адрес: https://sciup.org/149142858
IDR: 149142858 | УДК: 616.12-008.313.2:616.125.2-089:615.846.7]-06:616.329-007 | DOI: 10.29001/2073-8552-2023-38-2-44-50
Текст обзорной статьи Интраоперационный мониторинг температуры внутри пищевода во время радиочастотной аблации задней стенки левого предсердия при фибрилляции предсердий (обзор литературы)
На сегодняшний день катетерная радиочастотная аблация (РЧА) стала стандартным методом лечения пациентов с фибрилляцией предсердий (ФП) [1]. Стратегии аблации при ФП направлены в первую очередь на электрическую изоляцию предполагаемого источника аритмии – муфты легочных вен (ЛВ) [2]. С течением времени стратегия катетерного лечения ФП претерпевала ряд изменений, от изначальной остиальной изоляции до широкой антральной аблации, что позволило уменьшить риск развития стеноза ЛВ [3]. За последние годы было показано, что в поддержании и инициации ФП могут участвовать также участки, расположенные вне устьев ЛВ. В таких случаях в ходе РЧА выполняются дополнительные линейные воздействия по задней стенке левого предсердия (ЛП) под контролем систем электроанатомического картирования [4].
Методы предотвращения повреждения пищевода в ходе радиочастотной аблации задней стенки левого предсердия
Низкая частота возникновения ППС (1%) была впервые описана во время операции на открытом сердце [7]. У пациентов, перенесших катетерную РЧА ФП, зарегистрированная частота этого осложнения составляет около 0,01% [8]. Однако этот процент может быть недооценен. C. Pappone и соавт. сообщили о 2 случаях ППС [9]. Один из пациентов умер, второй выжил после операции. M.I. Scanavacca и соавт. описали случай ППС после аблации 8-мм катетером с максимальной мощностью 60 Вт и максимальной температурой 55 °C [10, 11]. Как правило, клиническая картина фистулы проявляется поздно после процедуры (в течение 2 нед.), а симптомы обычно неспецифичны, включают лихорадку, неврологические нарушения, желудочно-кишечное кровотечение и сепсис [12].
Бессимптомный ранее существовавший или недавно развившийся кислотный рефлюкс часто встречается у пациентов, перенесших РЧА по поводу лечения ФП. По- вреждение нейронов блуждающего нерва нижнего отдела пищевода путем кондуктивного нагревания является возможным механизмом, приводящим к развитию гастроэзофагеального рефлюкса. Возможно, что такие факторы, как кислотный рефлюкс в процессе заживления поражения, приводят к прогрессированию язвы пищевода в ППС [13].
Механизм повреждения пищевода до конца не известен. Термическое повреждение, по-видимому, является наиболее вероятной причиной (с образованием области некроза, окруженной воспалительными клетками), хотя также рассматривается ишемический механизм [14].
Одним из возможных механизмом термического поражения пищевода в ходе РЧА является сниженная моторика и недостаточное глотание во время общей анестезии. Это может привести к аблации в одном и том же месте в проекции пищевода на протяжении всего периода операции. С другой стороны, при седации боль, вызванная РЧА, может вызвать активную перистальтику и глотание, что приводит к охлаждению и прерыванию передачи термического воздействия на стенку пищевода [15].
Исходя из изложенного выше, перед исследователями встал вопрос о способах предотвращения термического повреждения пищевода.
На сегодняшний день существует несколько стратегий, помогающих предотвратить или уменьшить повреждение пищевода во время аблации ФП.
Анатомический визуализация пищевода в ходе аблации
Так, ряд авторов для снижения осложнений, связанных с повреждением пищевода в ходе РЧА задней стенки ЛП, определяли анатомическое отношение пищевода к задней части ЛП с помощью бариевой взвеси, которая вводилась в ходе РЧА (рис. 1) [16].
Другие исследователи для понимания анатомического расположения пищевода применяли метод визуализации электрода системами инвазивного электроанатомическо-го картирования (рис. 2) [17]. Для этого внутрь пищевода вводился диагностический электрод. В области расположения пищевода авторы уменьшали мощность и температуру в ходе аблации.
Получил большое распространение метод компьютерно-томографического (КТ) исследования для оценки положения и степени прилегания пищевода к задней стенке ЛП. Перед КТ для лучшей визуализации в пищевод через нос вводили желудочный зонд. Далее данные КТ загружали в трехмерную электроанатомическую систему, оснащенную модулем интеграции изображений [18].
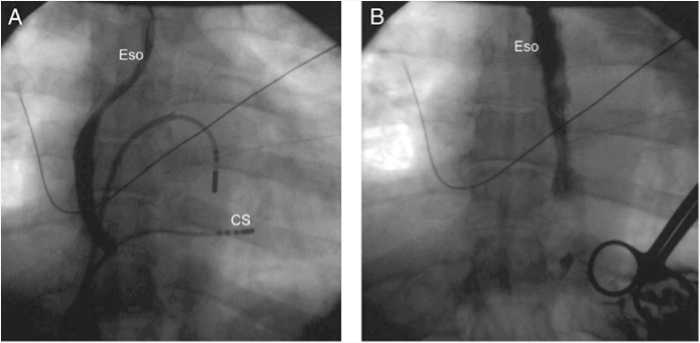
Рис. 1. Флюороскопическая визуализация пищевода посредством введения бариевой взвеси. Положение пищевода (Eso) до (A) и после (B) аблации в переднезадней проекции. CS – электрод в коронарном синусе (переведено согласно E. Good и соавт. [16]).
Fig. 1. Fluoroscopic visualization of the esophagus by administration of a barium suspension. The position of the esophagus (Eso) before (A) and after (B) ablation in the anteroposterior view. CS – electrode in the coronary sinus (E. Good et al. [16]).
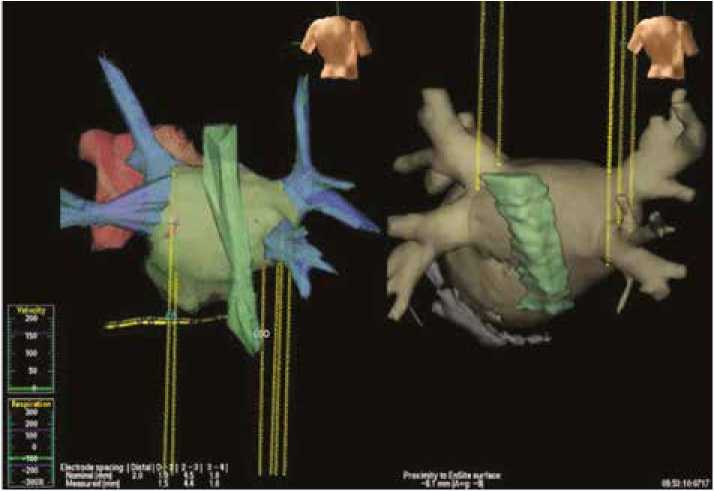
Рис. 2. Изображение трехмерной реконструкции (вид сзади), созданное с помощью системы электроанатомического картирования (слева) и компьютерной томографии (справа). Пищевод окрашен в зеленый цвет, желтые линии обозначают опорные точки, используемые в качестве референта для выполнения слияния изображения электроанатомической модели и компьютерно-томографического изображения (переведено согласно F.A. Scazzuso и соавт. [17]).
Fig. 2. Image of a 3D reconstruction (posterior view) created with an electroanatomical mapping system (left) and computed tomography (right). The esophagus is colored green, the yellow lines indicate the reference points used as a reference to perform the fusion of the electroanatomical model image and the CT image (F.A. Scazzuso et al. [17]).
Однако КТ не позволяет измерять толщину стенки менее 0,5 мм. Кроме того, КТ, как и применение в ходе интервенционного вмешательства бариевой взвеси, дает статическую картину пищевода и не позволяет оценить возможность движения пищевода во время процедуры.
Другими исследователями были предложены техники отклонения пищевода в сторону в ходе РЧА.
Изменение положения пищевода в ходе аблации
Так, J.S. Koruth и соавт. интраоперационно вводили в пищевод орогастральный зонд и 20–30 мл перорального контрастного вещества сульфата бария. Далее устанав- ливался гибкий торакальный катетер из ПВХ, а за ним вводился алюминиевый интубационный стилет в пластиковом корпусе, которым и производились манипуляции с целью отклонения пищевода в ходе РЧА (рис 3.) [19].
J.C.P. Mateos и соавт. для смещения пищевода и предотвращения повышения температуры внутри просвета пищевода применяли датчик чреспищеводной эхокардиографии. Авторы показали, что в большинстве случаев смещения пищевода было достаточно для безопасного выполнения РЧА на задней стенке ЛП. Данный метод стал удобной альтернативой для снижения риска атриоэ-зофагеальной фистулы [20].
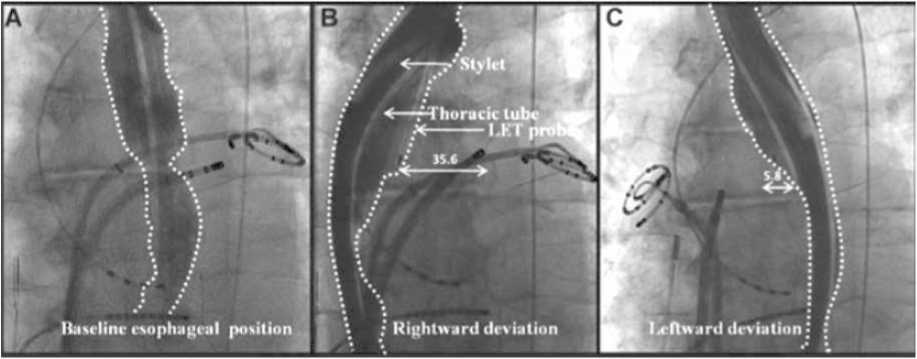
Рис. 3. A – визуализация пищевода посредством введения бариевой взвеси, используемая для определения изначального положения. B и C демонстрируют степень бокового отклонения вправо и влево (35,6 и 5,8 мм соответственно). B – циркулярный диагностический катетер и аблацион-ный катетер в левой верхней вене. C – циркулярный диагностический катетер и аблационный катетер в правой верхней вене. Baseline esophageal position исходное положение пищевода. rightward deviation – отклонение пищевода вправо, leftward deviation отклонение пищевода влево, stylet стилет, для механического перемещения пищевода; Thoracic tube – торакальный катетер, LET probe люминальный пищеводный температурный зонд (переведено согласно J.S. Koruth и соавт. [19]).
Fig. 3. A – Esophagus visualization by injection of barium suspension used to determine the initial position. B and C show the degree of lateral deflection to the right and left (35.6 and 5.8 mm), respectively. B – circular diagnostic catheter and ablation catheter in the left upper vein. C – circular diagnostic catheter and ablation catheter in the right upper vein. Baseline esophageal position – the initial position of the esophagus. Rightward deviation – deviation of the esophagus to the right; Leftward deviation – deviation of the esophagus to the left, stylet – stylet, for mechanical movement of the esophagus. Thoracic tube – thoracic catheter, LET probe – luminal esophageal temperature probe (J.S. Koruth et al. [19]).
Другие исследователи с целью профилактики развития возможных предсердно-пищеводных фистул рекомендуют применять альтернативные источники энергии, уменьшать и контролировать время длительности аблации при выполнении воздействий на задней стенке ЛП [21, 22].
В ряде случаев для определения положения пищевода применялся метод внутрисердечной эхокардиографии [23].
Охлаждение пищевода в ходе аблации
Группой исследователей был предложен метод, основанный на введении водно-солевой охлажденного раствора, который подавался болюсно во время РЧА задней стенки ЛП, с целью охлаждения пищевода. Охлаждение пищевода происходило тогда и только тогда, когда люминальная температура пищевода превышала 0,5 °C [24].
В другом пилотном исследовании с целью предотвращения термического поражения пищевода ряду пациентов вводился эзофагальный катетер для охлаждения EnsoETM, а в группе контроля данный датчик не применялся. Данное устройство обеспечивает замкнутый поток воды через многоканальную цилиндрическую силиконовую трубку, размещенную в пищеводе. Устройство было подключено к блоку теплообмена, который обеспечивает большой объем потока дистиллированной воды с регулируемой температурой со скоростью 136 л/ч. Непосредственно перед аблацией охлаждающую жидкость устанавливали на 4 °C, и эта температура поддерживалась в ходе аблации задней стенки ЛП. Температуру тела пациента контролировали с помощью ректального датчика температуры. Авторы пришли к выводу, что степень повреждения пищевода была менее серьезной при использовании устройства для охлаждения пищевода, чем при периодическом ручном закапывании ледяной воды, снижения эффективности аблации не наблюдалось [25].
Оценка температуры внутри пищевода в ходе аблации
Измерение люминальной температуры пищевода во время аблации ЛП является наиболее распространенным способом избегания термического повреждения.
Так, в практике для защиты пищевода от возможных повреждений ряд авторов применяли стационарный датчик температуры пищевода с одной термопарой, что вызвало задержку в обнаружении повышения температуры и ограничивало обнаружение повышения температуры в местах, удаленных от термопары (рис. 4) [26]. Другие исследователи говорят о необходимости применения многоканального температурного пищеводного катетера (ТПК) при выполнении линейных воздействий по задней стенке ЛП [27].
В крупном метаанализе были оценены данные 411 пациентов ( n = 235 в группе мониторинга ТПК; n = 176 в группе мониторинга без ТПК). В группе мониторинга ТПК был 21 (8,9%) пациент с термическим повреждением пищевода, 12 (6,8%) пациентов в группе наблюдения без ТПК. Объединенное отношение шансов составило 0,66 (0,23–1,89), что указывает на отсутствие статистически значимых различий между двумя группами в отношении повреждения пищевода. Однако авторы отмечают, что из-за небольшого размера выборки и нерандомизированного характера испытаний наблюдалась неоднородность результатов среди испытаний. Роль мониторинга температуры пищевода в снижении риска термических поражений пищевода во время изоляции ЛВ по поводу ФП не установлена. Необходимы дополнительные исследования, включая рандомизированные контролируемые испытания, чтобы оценить его истинное влияние [29]. Ряд других авторов продемонстрировали, что применение ТПК не уменьшает количество ППС и подчеркнули необходимость поиска предикторов и индикаторов возникновения ППС [30].
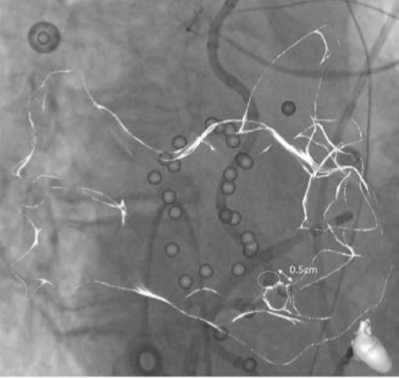
Рис. 4. Интеграция электроанатомической карты левого предсердия, включая маркеры поражения и маркеры внутрипищеводного датчика температуры (переведено согласно C.R. Barbhaiya и соавт. [28])
Fig. 4. Integration of the electroanatomical map of the left atrium, including markers of lesion and the intraesophageal temperature sensor (C.R.
Barbhaiya et al. [28])
Однако авторы приходят к общему мнению, что нагревание стенки пищевода во время РЧА может быть косвенно выявлено путем мониторинга температуры в просвете пищевода, Флюороскопическая оценка бли- зости кончика катетера к пищеводу может ввести в заблуждение, а мониторинг в режиме реального времени температуры в просвете пищевода в сочетании с рентгеноскопической визуализацией может повысить способность хирурга в определении потенциального РЧ-ин-дуцированного нагревания пищевода. Пока нет данных о взаимосвязи между внутрипросветной температурой пищевода, пристеночной температурой пищевода и повреждением пищевода у пациентов в ходе лечения ФП. У пациентов, перенесших катетерную аблацию по поводу ФП, мониторинг температуры в просвете пищевода потенциально может дать полезную информацию для выбора стратегии аблации [31]. Также авторы отмечают, что расстояние между активным ТПК и пищеводом является наиболее важным анатомическим фактором в прогнозировании повышения температуры пищевода. Мониторинг температуры пищевода с помощью ТПК может быть альтернативным подходом для безопасной РЧА, однако результаты показывают, что при малых расстояниях между электродом и пищеводом существует риск недооценки повышения температуры [32].
Заключение
По данным мировой литературы, применение температурного пищеводного катетера в ходе РЧА задней стенки ЛП потенциально может дать полезную информацию для выбора стратегии и параметров аблации. Однако требуется дальнейшее исследование в данном направлении.
Список литературы Интраоперационный мониторинг температуры внутри пищевода во время радиочастотной аблации задней стенки левого предсердия при фибрилляции предсердий (обзор литературы)
- Calkins H., Hindricks G., Cappato R., Kim Y.H., Saad E.B., Aguinaga L. et al. 2017 HRS/EHRA/ECAS/APHRS/SOLAECE expert consensus statement on catheter and surgical ablation of atrial fibrillation. Europace. 2018;20(1):e1-e160. https://doi.org/10.1093/europace/eux274.
- Haissaguerre M., Jais P., Shah D. C., Takahashi A., Hocini M., Quiniou, G. et al. 1998 Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins. New England Journal of Medicine. 1998;339(10): 659-666. https://doi.org/10.1056/NEJM199809033391003.
- Oral H., Scharf C., Chugh A., Hall B., Cheung P., Good E. et al. Catheter ablation for paroxysmal atrial fibrillation: segmental pulmonary vein ostial ablation versus left atrial ablation. Circulation. 2003; 108(19):2355-60. https://doi.org/10.1161/01.CIR.0000095796.45180.88.
- Ernst S., Ouyang F., Lober F., Antz M., Kuck K. H. Catheter-induced linear lesions in the left atrium in patients with atrial fibrillation: An electroanatomic study. Journal of the American College of Cardiology. 2003;42(7):1271-1282. https://doi.org/10.1016/S0735-1097(03)00940-9.
- Cappato R., Calkins H., Chen S. A., Davies W., Iesaka, Y., Kalman J. et al. Updated worldwide survey on the methods, efficacy, and safety of catheter ablation for human atrial fibrillation. Circulation: Arrhythmia and Electrophysiology. 2010;3(1):32-38. https://doi.org/10.1161/CIRCEP.109.859116.
- Koruth J. S., Reddy V. Y., Miller M. A., Patel K. K., Coffey J. O., Fischer A. et al. Mechanical esophageal displacement during catheter ablation for atrial fibrillation. Journal of Cardiovascular Electrophysiology. 2012;23(2):147-154. https://doi.org/10.1111/j.1540-8167.2011.02162.x.
- Gillinov A. M., Pettersson G., Rice T. W. Esophageal injury during radiofrequency ablation for atrial fibrillation. The Journal of Thoracic and Cardiovascular Surgery. 2001;122(6):1239-1240. https://doi.org/10.1067/mtc.2001.118041.
- Doll N., Borger M.A., Fabricius A., Stephan S., Gummert J., Mohr F.W. et al. Esophageal perforation during left atrial radiofrequency ablation: is the risk too high? The Journal of Thoracic and Cardiovascular Surgery. 2003;125(4):836-842. https://doi.org/10.1067/mtc.2003.165
- Pappone C., Oral H., Santinelli V., Vicedomini G., Lang C.C., Manguso F.et al. Atrio-esophageal fistula as a complication of percutaneous transcatheter ablation of atrial fibrillation. Circulation. 2004;109(22): 2724-2726. https://doi.org/10.1161/01.CIR.0000131866.44650.46.
- Scanavacca M.I., D'avila A., Parga J., Sosa E. Left atrial-esophageal fistula following radiofrequency catheter ablation of atrial fibrillation. Journal of Cardiovascular Electrophysiology. 2004;15(8):960-962. https://doi.org/10.1046/j.1540-8167.2004.04083.x.
- Cummings J.E., Schweikert R.A., Saliba W.I., Burkhardt J.D., Kilikaslan F., Saad E. et al. Brief communication: atrial-esophageal fistulas after radiofrequency ablation. Annals of Internal Medicine. 2006;144(8):572-574. https://doi.org/10.7326/0003-4819-144-8-200604180-00007.
- Nakagawa H., Yokohama K., Seres K.A. Improving the safety of catheter ablation of atrial fibrillation: prevention of left atrial-esophageal fistula (abstr.) Atrial Fibrillation: Mechanisms and New Directions in Therapy. 13th Annual Boston Symposium on Atrial Fibrillation; 2008; January 17-19. URL: https://a-fib.com/boston-af-symposium-2008 (06.06.2022).
- Gillinov A.M., Pettersson G., Rice T.W. Esophageal injury during radiofrequency ablation for atrial fibrillation. The Journal of Thoracic and Cardiovascular Surgery. 2001;122(6):1239-1240. https://doi.org/doi.org/10.1067/mtc.2001.118041.
- Di Biase L., Saenz L.C., Burkhardt D.J., Vacca M., Elayi C.S., Barrett C.D. et al. Esophageal capsule endoscopy after radiofrequency catheter ablation for atrial fibrillation: documented higher risk of luminal esophageal damage with general anesthesia as compared with conscious sedation. Circulation: Arrhythmia and Electrophysiology. 2009;2(2):108-112. https://doi.org/10.1161/CIRCEP.108.815266.
- Kennedy R., Good E., Oral H., Huether E., Bogun F., Pelosi F. et al. Temporal stability of the location of the esophagus in patients undergoing a repeat left atrial ablation procedure for atrial fibrillation or flutter. Journal of Cardiovascular Electrophysiology. 2008;19(4):351-355. https://doi.org/10.1111/j.1540-8167.2007.01051.x.
- Good E., Oral H., Lemola K., Han J., Tamirisa K., Igic P. et al. Movement of the esophagus during left atrial catheter ablation for atrial fibrillation. Journal of the American College of Cardiology. 2005;46(11):2107-2110. https://doi.org/10.1016/j.jacc.2005.08.042.
- Scazzuso F.A., Rivera S.H., Albina G., de la Paz Ricapito M., Gomez L.A., Sanmartino V. et al. Three-dimensional esophagus reconstruction and monitoring during ablation of atrial fibrillation: combination of two imaging techniques. International Journal of Cardiology. 2013;168(3):2364-2368. https://doi.org/10.1016/j.ijcard.2013.01.026.
- Kobza R., Schoenenberger A. W., Erne P. Esophagus imaging for catheter ablation of atrial fibrillation: comparison of two methods with showing of esophageal movement. Journal of Interventional Cardiac Electrophysiology. 2009;26(3):159-164. https://doi.org/10.1007/s10840-009-9434-3.
- Koruth J.S., Reddy V.Y., Miller M.A., Patel K.K., Coffey J.O., Fischer A. et al. Mechanical esophageal displacement during catheter ablation for atrial fibrillation. Journal of Cardiovascular Electrophysiology. 2012;23(2): 147-154. https://doi.org/10.1111/j.1540-8167.2011.02162.x.
- Mateos J.C.P., Mateos E.I.P., Pena T.G.S., Lobo T.J., Mateos J.C.P., Vargas R.N.A. et al. Simplified method for esophagus protection during radiofrequency catheter ablation of atrial fibrillation-prospective study of 704 cases. Brazilian Journal of Cardiovascular Surgery. 2015;30:139-147. https://doi.org/10.5935/1678-9741.20150009.
- Bahnson T. D. Strategies to minimize the risk of esophageal injury durings catheter ablation for atrial fibrillation. Pacing and Clinical Electrophysiology. 2009:32(2): 248-260. https://doi.org/10.1111/j.1540-8159.2008.02210.x.
- Martinek M., Bencsik G., Aichinger J., Hassanein S., Schoefl R., Kuchinka P. et al. Esophageal damage during radiofrequency ablation of atrial fibrillation: impact of energy settings, lesion sets, and esophageal visualization. Journal of Cardiovascular Electrophysiology. 2009;20(7):726-733. https://doi.org/10.1111/j.1540-8167.2008.01426.x.
- Di Biase L., Saenz L. C., Burkhardt D. J., Vacca M., Elayi C. S., Barrett C. D. et al. Esophageal capsule endoscopy after radiofrequency catheter ablation for atrial fibrillation: documented higher risk of luminal esophageal damage with general anesthesia as compared with conscious sedation. Circulation: Arrhythmia and Electrophysiology. 2009;2(2):108-112. https://doi.org/10.1161/CIRCEP.108.815266.
- John J., Garg L., Orosey M., Desai T., Haines D. E. et al. The effect of esophageal cooling on esophageal injury during radiofrequency catheter ablation of atrial fibrillation. Journal of Interventional Cardiac Electrophysiology. 2020;58(1):43-50. https://doi.org/10.1007/s10840-019-00566-3.
- Clark B., Alvi N., Hanks J., Suprenant B. A pilot study of an esophageal cooling device during radiofrequency ablation for atrial fibrillation. medRxiv. 2020. https://doi.org/10.1101/2020.01.27.20019026.
- Khoshknab M., Kuo L., Zghaib T., Arkles J., Santangeli P., Marchlinski F. E. et al. Esophageal luminal temperature rise during atrial fibrillation ablation is associated with lower radiofrequency electrode distance and baseline impedance. Journal of Cardiovascular Electrophysiology. 2021;32(7):1857-1864. https://doi.org/10.1111/jce.15097.
- Meininghaus D.G., Blembel K., Waniek C., Kruells-Muench J., Ernst H., Kleemann T. et al. Temperature monitoring and temperature-driven irrigated radiofrequency energy titration do not prevent thermally induced esophageal lesions in pulmonary vein isolation: A randomized study controlled by esophagoscopy before and after catheter ablation. Heart Rhythm. 2021;18(6): 926-934. https://doi.org/10.1016/j.hrthm.2021.02.003.
- Barbhaiya C.R., Kogan E.V., Jankelson L., Knotts R.J., Spinelli M., Bernstein S. et al. Esophageal temperature dynamics during high-power short-duration posterior wall ablation. Heart Rhythm. 2020;17(5):721-727. https://doi.org/10.1016/j.hrthm.2020.01.014.
- Ha F.J., Han H.C., Sanders P., Teh A.W., O'Donnell D., Farouque O. et al. Prevalence and prevention of oesophageal injury during atrial fibrillation ablation: a systematic review and meta-analysis. EP Europace. 2019;21(1):80-90. https://doi.org/10.1093/europace/euy121.
- Meininghaus D.G., Blembel K., Waniek C., Kruells-Muench J., Ernst H., Kleemann T. et al. Temperature monitoring and temperature-driven irrigated radiofrequency energy titration do not prevent thermally induced esophageal lesions in pulmonary vein isolation: A randomized study controlled by esophagoscopy before and after catheter ablation. Heart Rhythm. 2021;18(6):926-934. https://doi.org/10.1016/j.hrthm.2021.02.003.
- Leung L.W., Akhtar Z., Sheppard M.N., Louis-Auguste J., Hayat J., Gallagher M.M. Preventing esophageal complications from atrial fibrillation ablation: A review. Heart Rhythm O2. 2021;2(6 Part A):651-664. https://doi.org/10.1016/j.hroo.2021.09.004.
- Hornero F., Berjano E.J. Esophageal temperature during radiofrequency‐catheter ablation of left atrium: A three‐dimensional computer modeling study. Journal of Cardiovascular Electrophysiology. 2006;17(4):405-410. https://doi.org/10.1111/j.1540-8167.2006.00404.x.


