Ирисин как посредник и маркер позитивных эффектов физической активности: физиологические основы методов реабилитации
Автор: Глазачев О.С., Крыжановская С.Ю., Запара М.А., Ледень А.С.
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Физиология
Статья в выпуске: 3 т.24, 2024 года.
Бесплатный доступ
Цель: проанализировать данные литературы о механизмах действия ирисина, регуляции и возможных методах стимуляции секреции. Методы исследования. Анализ публикаций за последние 5 лет баз данных PubMed и eLibrary.ru. Результаты. Показаны аутокринные и паракринные эффекты ирисина на мышцы и эндокринные эффекты на другие органы. В целом ирисин поддерживает баланс между мышечной, костной и жировой тканями, оказывает противодиабетическое действие и препятствует ожирению, когнитивным и сосудистым нарушениям, сопровождающим уменьшение мышечной массы при недостатке физической активности (ФА). Продемонстрированы возможности детекции ирисина как маркера саркопении. Учитывая данные о регуляции секреции ирисина, разрабатываются технологии стимуляции его синтеза, доступные при вынужденном дефиците ФА. Среди них – сбалансированное питание, альтернативные виды тренировок, электроакупунктура, температурные воздействия. Большой интерес вызывают методы прогревания ввиду достаточной теоретической базы их применения. Заключение. Ирисин оказывает множественные долгосрочные положительные эффекты у здоровых людей и при патологии. Физиологически обосновано использование методов реабилитации для стимуляции секреции ирисина, причем тепловые воздействия эффективны как в сочетании с ФА, так и без нее.
Миокины, ирисин, физическая активность, саркопения, методы реабилитации
Короткий адрес: https://sciup.org/147247667
IDR: 147247667 | УДК: 612.744.24 | DOI: 10.14529/hsm240308
Текст научной статьи Ирисин как посредник и маркер позитивных эффектов физической активности: физиологические основы методов реабилитации
O.S. Glazachev, ,
S.Yu. Kryzhanovskaya, ,
M.А. Zapara, ,
A.S. Leden, ,
Введение. Понимание физиологических основ позитивных эффектов физической активности (ФА) позволяет разрабатывать технологии спортивной и восстановительной медицины и критерии их оценки. Скелетные мышцы, составляющие до 40 % массы тела и являющиеся главными потребителями энергии при ФА, оказывают влияние на метаболические процессы с помощью как нервной, так и гуморальной регуляции – за счет секреции сигнальных молекул [3]. 20 лет назад для описания цитокинов, продуцируемых скелетными мышцами в ответ на сокращение, введен термин «миокины» [7]. В настоящее время мио-кинами называют большое число веществ, в том числе интерлейкинов, факторов роста, основным источником которых являются мышцы, а концентрация в крови изменяется в ответ на ФА [3, 7]. При недостатке ФА у пациентов с метаболическими заболеваниями, у пожилых людей происходит уменьшение мышечной массы (саркопения), которое имеет такие последствия, как ожирение, инсулино-резистентность, сосудистая дисфункция и когнитивные нарушения [13]. Миокины оказывают непосредственное влияние на патофизиологию саркопении и могут выступать её маркерами [20, 32].
Один из наиболее изучаемых миокинов – ирисин, открыт в 2012 г., назван в честь Ирис – посланницы богов в греческой мифологии [2]. После высокоинтенсивной тренировки уровень ирисина повышается не только в крови, но и в слюне [28]. Показана тесная связь между уровнем ирисина в крови и выраженностью саркопении, плотностью костной ткани у пожилых [14, 20, 32]. Проводятся исследования рекомбинантного ирисина [10, 37]. Изучаются возможности использования доступных мето- дов реабилитации для повышения синтеза ирисина [8, 22].
Цель: проанализировать данные литературы о механизмах действия ирисина, регуляции и возможных методах стимуляции секреции.
Результаты. Механизмы действия ириси-на на ткани-мишени. Ирисин оказывает множественные эффекты: аутокринно и паракрин-но – на скелетные мышцы, эндокринно (через кровь) – на другие ткани, участвуя в их системном взаимодействии (см. рисунок). Открыты рецепторы ирисина – молекулы мембранных белков интегринов класса αV [15, 38], предполагается существование и других рецепторов [23, 37]. Описано несколько внутриклеточных сигнальных путей, через которые ирисин изменяет активность ферментов и геномного аппарата клеток, а значит, скорость синтеза белков, пролиферацию и дифференцировку [35].
В целом эти изменения направлены на стимуляцию энергообмена, защиту от оксида-тивного стресса и воспаления, однако имеют тканевую специфику [35]. Например, ирисин индуцирует поглощение глюкозы мышцами и снижение резистентности к инсулину [36], подавляет синтез провоспалительных цитокинов, а также миостатина и атрогина-1, способствующих атрофии мышц [10]. У животных с дефицитом ирисина наблюдается ускоренная атрофия мышц, а введение ирисина стареющим мышам уменьшает саркопению [10].
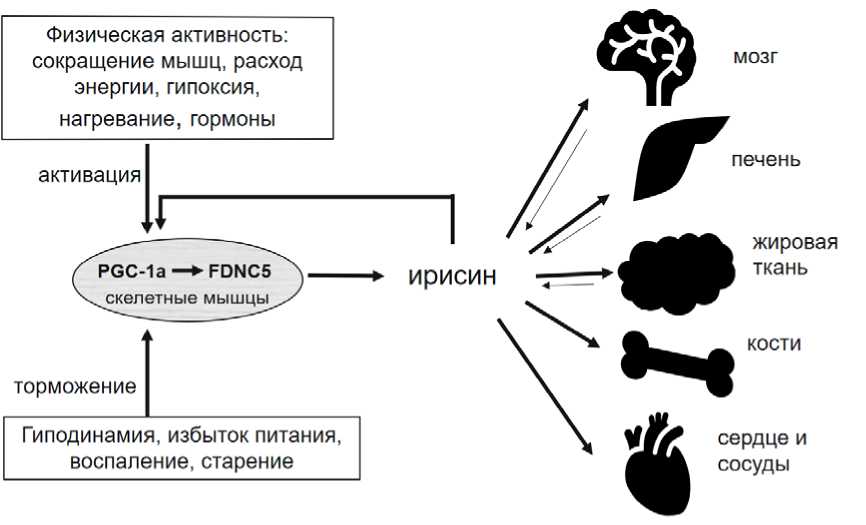
Регуляция секреции и органы-мишени ирисина (пояснения в тексте)
Mechanism of irisin secretion and its effects on target organs (explanations are provided in the text)
При отсутствии нагрузки на нижние конечности снижается уровень ирисина и происходит атрофия мышц, а лечение ирисином её ингибирует [33]. В жировой ткани ирисин ингибирует дифференцировку адипоцитов [24] и накопление в них липидов путем усиления регуляции экспрессии генов, участвующих в липолизе, повышая расход энергии [14]. Через те же сигнальные пути ирисин активирует деление и дифференцировку остеобластов, что может обеспечить новую терапию для предотвращения остеопороза и других нарушений опорно-двигательного аппарата в условиях микрогравитации [4]. Пребывание культуры костных клеток на борту космической станции привело к подавлению генов, отвечающих за рост костей, и активации генов, способствующих эрозии костей. Ирисин в значительной степени устранял эти эффекты [5]. Таким образом ирисин поддерживает баланс между мышечной, костной и жировой тканями, оказывает противодиабетическое действие и препятствует ожирению [24].
Ирисин способен оказывать не только профилактические, но и терапевтические эффекты. Так, он стимулирует остеогенез у крыс с сахарным диабетом, когда регенерация кости затруднена [19]. Ирисин защищает клетки сердца при гипоксии, препятствует развитию атеросклероза, ингибирует апоптоз, секрецию провоспалительных цитокинов и выработку активных форм кислорода (АФК) в клетках эндотелия, стимулирует выработку NO [23]. Лечение ирисином уменьшает размер инфаркта миокарда и улучшает функцию сердца в эксперименте за счет снижения выработки АФК и стимуляции ангиогенеза [21].
Ирисин оказывает влияние на мозг: повышает синтез мозгового нейротрофического фактора (BDNF), который активирует нейрогенез и синаптическую пластичность, предотвращая ухудшение памяти [25, 31]. Ирисин подавляет гибель нейронов головного мозга после нарушения кровообращения, поэтому может служить потенциальным лекарственным средством для лечения пациентов с ишемическим инсультом [37]. Кроме того, ирисин препятствует отложению амилоидных белков, тем самым замедляя развитие болезни Альцгеймера [35].
Регуляция секреции ирисина. Известно, что ирисин образуется в результате протеолиза мембранного белка FNDC5, но регуляция этого процесса пока неясна [25]. Синтез FNDC5 активируется фактором PGC-1α, который описан как главный регулятор энергетического метаболизма митохондрий [1]. Образование и активация PGC-1α происходит под влиянием не только мышечного сокращения, но и других стрессовых факторов: температурных, дефицита питательных веществ, накопления АФК, а также регулируется гормонами, в том числе ирисином (положительная обратная связь). Напротив, избыточное питание, воспаление, старение снижают активность PGC-1α [1]. Это дает теоретическую основу методам стимуляции секреции ирисина (см. рисунок).
Важно, что влияния долгосрочны, поскольку происходят на геномном уровне. Это согласуется с изменением секреции ирисина у тренированных людей и нарушением этого процесса у пожилых пациентов с сахарным диабетом и ожирением [17], у которых снижена концентрация ирисина в крови [14]. Влияние ФА на секрецию миокинов при сахарном диабете существенно отличается от здоровых [27]. Подобная ситуация наблюдается у пожилых пациентов с хроническими обструктивными заболеваниями легких, у которых уровень ирисина был связан не только с саркопенией, но и показателями внешнего дыхания, маркерами воспаления [18].
Секрецию ирисина ингибирует его антагонист миостатин, воздействуя на ядро клетки. У пациентов с ожирением снижен уровень ирисина и повышен миостатина, что способствует потере мышечной массы и увеличению жировой, а также развитию инсулинорези-стентности [17, 32].
Уровень ирисина в крови вариабелен и зависит не только от ФА, наличия сопутствующих заболеваний, но и от пола, возраста, массы и состава тела [20, 26, 34]. Иногда данные литературы противоречивы. Так, после острой ФА повышается уровень ирисина, а после 18 недель тренировок снижается [29]. У здоровых добровольцев после 2 недель постельного режима уровень ирисина повысился в соответствии с исходной мышечной силой [6]. Это, вероятно, связано с тем, что ири-син могут выделять другие ткани, хотя существенно меньше, чем скелетные мышцы, а также может изменяться чувствительность клеток к нему [6, 38].
Методики стимуляции секреции ирисина. Поскольку интенсивная ФА недоступна для большого числа людей, разрабатываются методы реабилитации, способные дополнительно стимулировать образование ирисина. Например, повысить эффективность упражнений у пожилых предлагают с помощью питания, сбалансированного по содержанию белка [32], или применения манжеток, ограничивающих кровоток в конечностях, что способствует гипоксии и увеличивает синтез миокинов [30].
Вибрационные тренировки тела привели к повышению уровня ирисина у женщин с фибромиалгией и ожирением [8]. Электроакупунктура повышала уровень ирисина в крови у животных с экспериментальным инсультом [22].
Учитывая стимулирующее влияние ири-сина в отношении энергообмена, исследовалось влияние холода на его секрецию. Исследования показали, что охлаждение во время тренировок дополнительно индуцирует экспрессию ирисина [29], но только через стимуляцию дрожи [12]. Оказалось, что в условиях высокой температуры окружающей среды (+ 32 °С) при ФА у здоровых молодых людей уровень ирисина повышается сильнее, чем при +16 °С [27]. В тех же условиях у пожилых людей эффект был, но менее выраженный [26], а при сахарном диабете отсутствовал [27]. Влияние нагревания кажется логичным, так как при ФА температура в мышцах растет. В статье [16] собраны доказательства прямого активирующего влияния нагревания на митохондриальное окисление и экспрессию PGC-1α в мышцах. Это означает, что воздействия высокой температурой могут быть эффективны не только в сочетании с ФА, но и как самостоятельный метод. По данным [11] ежедневное воздействие теплового стресса в течение 10 дней иммобилизации нижних конечностей у человека поддерживает дыхательную способность митохондрий, а также содержание PGC-1α и ослабляет атрофию скелетных мышц. В нашей лаборатории выявлено повышение концентрации в крови ирисина и мозгового нейротрофического фактора после курса процедур пассивного (без ФА) прогревания всего тела [9].
Заключение. Взаимные влияния органов осуществляются не только через нервную и эндокринную системы, но и прямо, путем выделения миокинов, главным источником которых являются скелетные мышцы. Секреция известного миокина ирисина повышается после ФА, снижается при недостатке ФА, саркопе-нии и метаболических нарушениях, благодаря чему ирисин может служить их маркером. Ирисин оказывает долгосрочные позитивные эффекты через геномный аппарат клеток, повышая энергетический обмен, способствуя трофике мышц, костей, сосудов, мозга, препятствуя старению, ожирению, резистентности к инсулину, сосудистым и когнитивным нарушениям. Данные о механизмах регуляции подтверждают, что усилить секрецию ирисина можно с помощью дополнительных методов реабилитации, среди которых наиболее обос- нованным является прогревание. Показана эффективность этого метода как в сочетании с ФА, так и без нее.
Список литературы Ирисин как посредник и маркер позитивных эффектов физической активности: физиологические основы методов реабилитации
- Abu Shelbayeh O., Arroum T., Morris S., Busch K.B. PGC-1α Is a Master Regulator of Mitochondrial Lifecycle and ROS Stress Response. Antioxidants (Basel), 2023, vol. 12 (5), p. 1075. DOI: 10.3390/antiox12051075
- Boström P., Wu J., Jedrychowski M.P. et al. A PGC1-α-dependent Myokine that Drives Brown-fat-like Development of White Fat and Thermogenesis. Nature, 2012, vol. 481, no. 7382, pp. 463–468. DOI: 10.1038/nature10777
- Chen W., Wang L., You W., Shan T. Myokines Mediate the Cross Talk between Skeletal Muscle and Other Organs. Journal of Cellular Physiology, 2021, vol. 236, no. 4, pp. 2393–2412. DOI: 10.1002/jcp.30033
- Chen Z., Zhang Y., Zhao F. et al. Recombinant Irisin Prevents the Reduction of Osteoblast Differentiation Induced by Stimulated Microgravity through Increasing β-Catenin Expression. International Journal of Molecular Sciences, 2020, vol. 21 (4), p. 1259. DOI: 10.3390/ijms21041259
- Colucci S., Colaianni G., Brunetti G. et al. Irisin Prevents Microgravity-induced Impairment of Osteoblast Differentiation in Vitro During the Space Flight CRS-14 Mission. FASEB Journal: Official Publication of the Federation of American Societies for Experimental Biology, 2020, vol. 34, no. 8, pp. 10096–10106. DOI: 10.1096/fj.202000216R
- D'Amuri A., Sanz J.M., Lazzer S. et al. Irisin Attenuates Muscle Impairment during Bed Rest through Muscle-Adipose Tissue Crosstalk. Biology (Basel), 2022, vol. 11 (7), p. 999. DOI: 10.3390/ biology11070999
- Domin R., Dadej D., Pytka M. et al. Effect of Various Exercise Regimens on Selected Exercise-Induced Cytokines in Healthy People. International Journal of Environmental Research and Public Health, 2021, vol. 18 (3), p. 1261. DOI: 10.3390/ijerph18031261
- Dos Santos J.M., Taiar R., Ribeiro V.G.C. et al. Whole-Body Vibration Training on Oxidative Stress Markers, Irisin Levels, and Body Composition in Women with Fibromyalgia: A Randomized Controlled Trial. Bioengineering (Basel), 2023, vol. 10 (2), p. 260. DOI: 10.3390/bioengineering10020260
- Glazachev O.S., Zapara M.A., Kryzhanovskaya S.Y. et al. Whole-body Repeated Hyper-thermia Increases Irisin and Brain-derived Neurotrophic Factor: A Randomized Controlled Trial. Journal of Thermal Biology, 2021, vol. 101, p. 103067. DOI: 10.1016/j.jtherbio.2021.103067
- Guo M., Yao J., Li J. et al. Irisin Ameliorates Age-associated Sarcopenia and Metabolic Dysfunction. Journal of Cachexia, Sarcopenia and Muscle, 2023, vol. 14, no. 1, pp. 391–405. DOI: 10.1002/jcsm.13141
- Hafen P.S., Abbott K., Bowden J. et al. Daily Heat Treatment Maintains Mitochondrial Function and Attenuates Atrophy in Human Skeletal Muscle Subjected to Immobilization. Journal of Applied Physiology, 2019, vol. 127, no. 1, pp. 47–57. DOI: 10.1152/japplphysiol.01098.2018
- Jiang S., Bae J.H., Wang Y., Song W. The Potential Roles of Myokines in Adipose Tissue Metabolism with Exercise and Cold Exposure. International Journal of Molecular Sciences, 2022, vol. 23 (19), p. 11523. DOI: 10.3390/ijms231911523
- Jo D., Yoon G., Kim O.Y., Song J. A New Paradigm in Sarcopenia: Cognitive Impairment Caused by Imbalanced Myokine Secretion and Vascular Dysfunction. Biomedicine & Pharma-cotherapy, 2022, vol. 147, p. 112636. DOI: 10.1016/j.biopha.2022.112636
- Khajebishak Y., Faghfouri A.H., Soleimani A. et al. The Potential Relationship between Serum Irisin Concentration with Inflammatory Cytokines, Oxidative Stress Biomarkers, Glycemic Indices and Lipid Profiles in Obese Patients with Type 2 Diabetes Mellitus: A Pilot Study. Journal of the ASEAN Federation of Endocrine Societies, 2023, vol. 38, no. 1, pp. 45–51. DOI: 10.15605/jafes.038.01.13
- Kim H., Wrann C.D., Jedrychowski M. et al. Irisin Mediates Effects on Bone and Fat via αV Integrin Receptors. Cell, 2018, vol. 175, no. 7, pp. 1756–1768. DOI: 10.1016/j.cell.2018.10.025
- Kim K., Monroe J.C., Gavin T. P., Roseguini B.T. Skeletal Muscle Adaptations to Heat Therapy. Journal of Applied Physiology, 2020, vol. 128, no. 6, pp. 1635–1642. DOI: 10.1152/ japplphysiol.00061.2020
- Krämer A.I., Handschin C. How Epigenetic Modifications Drive the Expression and Mediate the Action of PGC-1α in the Regulation of Metabolism. Molecular Sciences, 2019, vol. 20, p. 5449. DOI: 10.3390/ijms20215449
- Lage V.K.D.S., de Paula F.A., Lima L.P. et al. Plasma Levels of Myokines and Inflammatory Markers are Related with Functional and Respiratory Performance in Older Adults with COPD and Sarcopenia. Experimental Gerontology, 2022, vol. 164, p. 111834. DOI: 10.1016/j.exger.2022.111834
- Li G., Jian Z., Wang H. et al. Irisin Promotes Osteogenesis by Modulating Oxidative Stress and Mitophagy through SIRT3 Signaling under Diabetic Conditions. Oxidative Medicine and Cellular Longevity, 2022, vol. 10, 3319056. DOI: 10.1155/2022/3319056
- Liang H., Qi W., Jiajue R. et al. Serum Irisin Level is Associated with Fall Risk, Uscle Strength, and Cortical Porosity in Postmenopausal Women. Frontiers in Endocrinology, 2023, vol. 14, 1096950. DOI: 10.3389/fendo.2023.1096950
- Liao Q., Qu S., Tang L.X. et al. Irisin Exerts a Therapeutic Effect Against Myocardial Infarction via Promoting Angiogenesis. Acta Pharmacologica Sinica, 2019, vol. 40, no. 10, pp. 1314–1321. DOI: 10.1038/s41401-019-0230-z
- Liu L., Zhang Q., Li M. et al. Early Post-Stroke Electroacupuncture Promotes Motor Function Recovery in Post-Ischemic Rats by Increasing the Blood and Brain Irisin. Neuropsychiatric Disease and Treatment, 2021, vol. 17, pp. 695–702. DOI: 10.2147/NDT.S290148
- Ma C., Ding H., Deng Y. et al. Irisin: A New Code Uncover the Relationship of Skeletal Muscle and Cardiovascular Health During Exercise. Frontiers in Physiology, 2021, vol. 12, p. 620608. DOI: 10.3389/fphys.2021.620608
- Ma E.B., Sahar N.E., Jeon g M., Huh J.Y. Irisin Exerts Inhibitory Effect on Adipogenesis Through Regulation of Wnt Signaling. Frontiers in Physiology, 2019, vol. 10, p. 1085. DOI: 10.3389/fphys.2019.01085
- Maak S., Norheim F., Drevon C.A., Erickson H.P. Progress and Challenges in the Biology of FNDC5 and Irisin. Endocrine Reviews, 2021, vol. 42, no. 4, pp. 436–456. DOI: 10.1210/endrev/bnab003
- McCormick J.J., King K.E., Notley S.R. et al. Exercise in the Heat Induces Similar Elevations in Serum Irisin in Young and Older Men Despite Lower Resting Irisin Concentrations in Older Adults. Journal of Thermal Biology, 2022, vol. 104, p. 103189. DOI: 10.1016/j.jtherbio.2022.103189
- McCormick J.J., Notley S.R., Yardley J.E. et al. Blunted Circulating Irisin in Adults with Type 1 Diabetes During Aerobic Exercise in a hot Environment: a Pilot Study. Applied Physiology, Nutrition, and Metabolism = Physiologie Appliquee, Nutrition et Metabolism, 2020, vol. 45, no. 6, pp. 679–682. DOI: 10.1139/apnm-2019-0624
- Missaglia S., Tommasini E., Vago P. et al. Salivary and Serum Irisin in Healthy Adults before and After Exercise. European Journal of Translational Myology, 2023, vol. 33 (1), p. 11093. DOI: 10.4081/ejtm.2023.11093
- Ozbay S., Ulupınar S., Şebin E., Altınkaynak K. Acute and Chronic Effects of Aerobic Exercise on Serum Irisin, Adropin, and Cholesterol Levels in the Winter Season: Indoor Training Versus Outdoor Training. The Chinese Journal of Physiology, 2020, vol. 63, no. 1, pp. 21–26. DOI: 10.4103/CJP.CJP_84_19
- Pazokian F., Amani-Shalamzari S., Rajabi H. Effects of Functional Training with Blood Occlusion on the Irisin, Follistatin, and Myostatin Myokines in Elderly Men. European Review of Aging and Physical Activity, 2022, vol. 19, p. 22. DOI: 10.1186/s11556-022-00303-2
- Pesce M., Fratta I.L., Paolucci T. et al. From Exercise to Cognitive Performance: Role of Irisin. Applied Sciences, 2021, vol. 11, p. 7120. DOI: 10.3390/app11157120
- Planella-Farrugia C., Comas F., Sabater-Masdeu M. et al. Circulating Irisin and Myostatin as Markers of Muscle Strength and Physical Condition in Elderly Subjects. Frontiers in Physiology, 2019, vol. 10, p. 871. DOI: 10.3389/fphys.2019.00871
- Sanesi L., Storlino G., Dicarlo M. et al. Time-dependent Unloading Effects on Muscle and Bone and Involvement of FNDC5/irisin Axis. NPJ Microgravity, 2023, vol. 9 (1), p. 4. DOI: 10.1038/s41526-023-00251-w
- Velez L.M., Van C., Moore T. et al. Genetic Variation of Putative Myokine Signaling is Dominated by Biological Sex and Sex Hormones. Elife, 2022, vol. 11, e76887. DOI: 10.7554/eLife.76887
- Waseem R., Shamsi A., Mohammad T. et al. FNDC5/Irisin: Physiology and Pathophysiology. Molecules, 2022, vol. 27 (3), p. 1118. DOI: 10.3390/molecules27031118
- Ye X., Shen Y., Ni C. et al. Irisin Reverses Insulin Resistance in C2C12 Cells via the p38-MAPK-PGC-1α Pathway. Peptides, 2019, vol. 11, 170120. DOI: 10.1016/j.peptides.2019.170120
- Yu Q., Li G., Li J. et al. Irisin Protects Cerebral Neurons from Hypoxia/Reoxygenation via Suppression of Apoptosis and Expression of Pro-Inflammatory Cytokines. Neuroimmunomodulation, 2022, vol. 29, no. 4, pp. 425–432. DOI: 10.1159/000524273
- Zhu J., Li J., Yao T. et al. Analysis of the Role of Irisin Receptor Signaling in Regulating Osteogenic/adipogenic Differentiation of Bone Marrow Mesenchymal Stem Cells. Biotechnology & Genetic Engineering Reviews, 2023, vol. 1–24. DOI: 10.1080/02648725.2023.2197713


